Method Article
Использование каспазы мультиплексирования Пробирной для определения апоптоза в гипоталамуса Cell Model
В этой статье
Резюме
Мультиплекс анализы могут обеспечить полезной информацией для основных клеточных механизмов и ликвидации отходов реагентов и ненужных повторяющихся экспериментов. Мы описываем здесь многозальный каспазы-3/7 анализа активности, используя флуоресцентные и люминесцентные методы, основанные на, чтобы определить жизнеспособность клеток в гипоталамо модели в пробирке следующей окислительного заражения пальмитиновой кислоты.
Аннотация
Возможность мультиплексирования анализов при исследовании сложных клеточных механизмов исключает необходимость в повторных экспериментах, обеспечивает внутренний контроль, и уменьшает отходы в затратах и реагентов. Здесь мы опишем оптимизацию многозальный анализа для оценки апоптоза после пальмитиновой кислоты (ПА) вызов в гипоталамо модели в пробирке, используя как флуоресцентные и люминесцентные основе анализов для измерения жизнеспособных количество клеток и каспазы-3/7 деятельность в 96-а Формат микротитрационный планшет. После PA вызов, жизнеспособные клетки определяется резазурин основе флуоресцентного анализа. Каспазы-3/7 активность была затем определена с использованием люминогенных подложку, DevD и нормализованы к числу клеток. Это мультиплексирование анализ является полезным методом для определения изменения в активности каспазы следующее апоптоза стимулом, таким как вызов насыщенной жирной кислоты. Насыщенной жирной кислоты PA может увеличить гипоталамуса окислительного стресса и апоптоза, что указывает на потенциальную ImportaNCE анализов, таких как описаны здесь, что в изучения связи между насыщенных жирных кислот и функции нейронов.
Введение
Диета, богатая насыщенными жирными кислотами, такими как пальмитиновая кислота (PA) были связаны с ожирением и другими сопутствующими заболеваниями, в том числе сердечно-сосудистых заболеваний и диабета 1, 2. Жирная диета также было показано увеличение окислительного стресса, апоптоз и дегенерации нейронов в гипоталамусе, важным регулятором аппетита и энергии расходов 3-7. Понимание механизма, через который экспозиции высоким содержанием жиров индуцирует гипоталамуса нарушение регуляции Таким образом, важно для развития фармакологических методов лечения ожирения. Тем не менее, клеточные механизмы, через которые диетического жира влияет функции нейронов остаются неясными. Более глубокое понимание того, как жиры, такие как ПА может вызвать начало гипоталамуса апоптоза является необходимым первым шагом на пути к этой цели. Цель этой статьи заключается в описании многозальный анализа для тестирования в пробирке нейронов ответ на воздействие Звуковая, разработанный для использования в исследованиях чypothalamic нейродегенерация. Мы предоставляем подробное описание в пробирке 96-а формате мультиплекса анализа для измерения каспазы 3/7 активность на общее количество клеток в дифференцированного увековечена взрослых мышей гипоталамо клеточной линии (назначенного A12) после окислительного заражения PA 8.
Вкратце, жизнеспособность клеток определяется следующее PA вызов через резазурин основе анализа. Ресазурин является проницаемой соединение клеток, который подвергается ферментативной снижение метаболически активных клеток, процесс полагают, происходит через митохондрии 9. Жизнеспособные клетки непрерывно преобразовывать резазурин в резоруфином, производя флуоресцентный сигнал, пропорциональный количеству жизнеспособных клеток. Каспазы-3/7 активность затем анализировали с использованием DEVD основе lumogenic анализа. DEVD является аминокислотная последовательность (Asp-Glu-Val-Asp) расщепляется каспазы-3. Когда эта последовательность соединен с lumogenic вещества, при активации внутриклеточного каспазы-3/7 и последующим расщеплениемиз DEVD подложки, люминесцентный продукт выпущен. Эта реакция пропорциональна активности каспаз и, таким образом, к индукции апоптоза. Как мертвые клетки не могут производить каспазы, каспазы-3/7 деятельность по своей природе переходного; Поэтому анализ должен быть завершен в период с 30 мин до 4 ч после заражения, в зависимости от эффективности клеточной стресс. Жизнеспособность клеток обратно пропорциональна каспазы-3/7 активностью и могут быть использованы для определения механизмов гибели клеток. Например, этот метод ранее был использован, чтобы показать, что предварительная обработка с пептидного гормона орексина уменьшает апоптоз в клетках гипоталамуса, зараженных перекиси водорода, предполагая, что механизмы страдают от этого лечения играют важную роль в защите против окислительного повреждения 10. Важно отметить, эти анализы клеточной линии и ткани зависит, как они опираются на митохондриальной активности уменьшить реагентов для анализа. Этот протокол был оптимизирован для взрослых мышей гипоталамо (A12) клеток; ОднакоСпособы, описанные может быть изменена, чтобы соответствовать в пределах подобного исследования.
Мультиплексирования анализы от одного культуры и обеспечивает преимущество по сравнению с традиционным методом выполнения отдельных анализов по нескольким причинам. В дополнение к экономии времени, образцы клеток и культуры реагенты, мультиплексирования анализы также могут предоставить знания выживания и гибели клеток, обеспечить внутренний контроль, и устранить необходимость в повторных экспериментах 11, 12.
Альтернативные методы полагались на Вестерн-блоттинга или ИФА, которые надежные анализы, но это дорого и отнимает много времени (1-2 дней), особенно при использовании формата 96-луночного. Без учета времени, необходимого для культуры клеток для мультиплексирования анализа, общее время составляет менее 3 ч. Хотя этот протокол был оптимизирован для использования с A12 клеток, он может быть изменен для использования в других моделях, сохраняя при этом в виду факторы, которые могут повлиять на целостность клеток. Удерживатьдобыча если этот протокол будет работать на серии экспериментов зависит от от количества образцов или экспериментальных условиях и о планируемых последующих экспериментах.
протокол
1. Покрытие и обслуживание культуре клеток
- Теплый Игла в модификации Дульбекко (DMEM), питательные среды (DMEM + 10% FBS + 1% пенициллина / стрептомицина / Неомицин) до 37 ° C.
- Получить запас замороженных A12 клеток от -80 ° С.
- Быстро разморозить клетки в 37 ° С водяной бане; После оттаивания мягко пипеток клетки перенести на 75 см 2 вентилируемой колбу культуры и добавить 10 мл культуральной среды.
- Выдержите колбу на ночь в 5% CO 2 инкубаторе при 37 ° С Аспирируйте СМИ после 24 часов и заменить свежей средой. Продолжить выращивания клеток до 70-80% слияния не будет получено (рост 2-3 дня).
2. Подсчет и Покрытие Клетки
- Теплый DMEM и 1x-трипсин-ЭДТА до 37 ° C.
- Аспирируйте средств массовой информации из клеток и мыть два раза стерильной фосфатным буферным раствором (PBS).
- Добавить 500 мкл раствора трипсина и инкубировали при 37 ° С в течение 2-5 мин.
- ОтделятьКлетки из колбы с помощью скребка и приостановить клеток в 5 мл среды. Pass клетки через сито и пройти через ячейки фильтра в чистый 50 мл трубки. Возможно, потребуется пройти клетки через ситечко более одного раза, но не повторять более трех раз.
- Граф клеток с помощью гемоцитометра, чтобы определить количество клеток в культуре на семена 6000 клеток / лунку в 96-луночный прозрачным дном черной или белой стеной пластины в конечном объеме 100 мкл среды. Инкубируйте пластины в 5% CO 2 при 37 ° С в течение 24 часов.
3. Определение жизнеспособность клеток и каспазы-3/7 активность
- Передача PA в стерильную стекл нную пробирку емкостью 5 мл и растворить в 100% диметилсульфоксиде (ДМСО). Развести маточного раствора PA 1:10 в ДМСО и добавить его в предварительно нагретой DMEM, чтобы получить конечную рабочую концентрации 0,1 мМ ПА. Для контроля СМИ, добавить такую же концентрацию ДМСО, которое добавляется к среде, содержащей PA.
- Извлеките носитель в каждую лунку и заменить 50 мкл СМИ + / -ПА. Инкубировать в течение 2 часов в 5% CO 2 при 37 ° С Затем добавляют 5 мкл резазурин реагента и инкубировали в течение 10 мин при комнатной температуре.
- Использование многомодовых планшетного, запись флуоресценции (560 ЕХ / 590 EM) для измерения жизнеспособности клеток. Результаты представлены в виде относительных единицах флуоресценции (РФС).
- С этой же пластине, добавляют 55 мкл реагента каспазы и инкубируют при комнатной температуре в течение 2 часов.
- Снова используя планшетного, запись свечение для измерения каспазы-3/7 деятельность. Результаты представлены в виде относительных единицах люминесценции (RLU), с люминесценции прямо пропорциональной каспазы-3/7 деятельности.
- Для нормализации каспазы-3/7 деятельность по количеству клеток, разделите клеток жизнеспособность (РФС) по каспазы-3/7 деятельности (RLU).
Результаты
Протокол выше описывает результаты в мультиплексирования двух отдельных анализов, чтобы определить механизмы клеточной гибели. Рисунок 1 показывает обзор протокола для определения жизнеспособности клеток и каспазы-3/7 деятельность. Каспазы активность была значительно увеличена в клетках, зараженных ПА после 2 часов инкубации (рис. 2а и табл. 1). Потеря целостности клеточных мембран является морфологическое изменение, связанное с индукции апоптоза, который проявляется в клетках после 2 ч воздействия ПА (рис. 2В). Рисунок 3 излагается один из возможных путей, в котором ПА индуцирует апоптоз и демонстрирует важность оптимизации инкубации Время в DEVD реагента.

Рисунок 1. Экспериментальная дизайн для мультиплекса анализачтобы определить активность каспазы-3/7 активность. Клетки высевают в 96-луночный планшет в течение 24 ч и затем инкубировали в присутствии или в отсутствие PA. Время инкубации в присутствии каждого реагента может варьироваться в зависимости от модели. Кликните здесь, чтобы посмотреть увеличенное изображение.
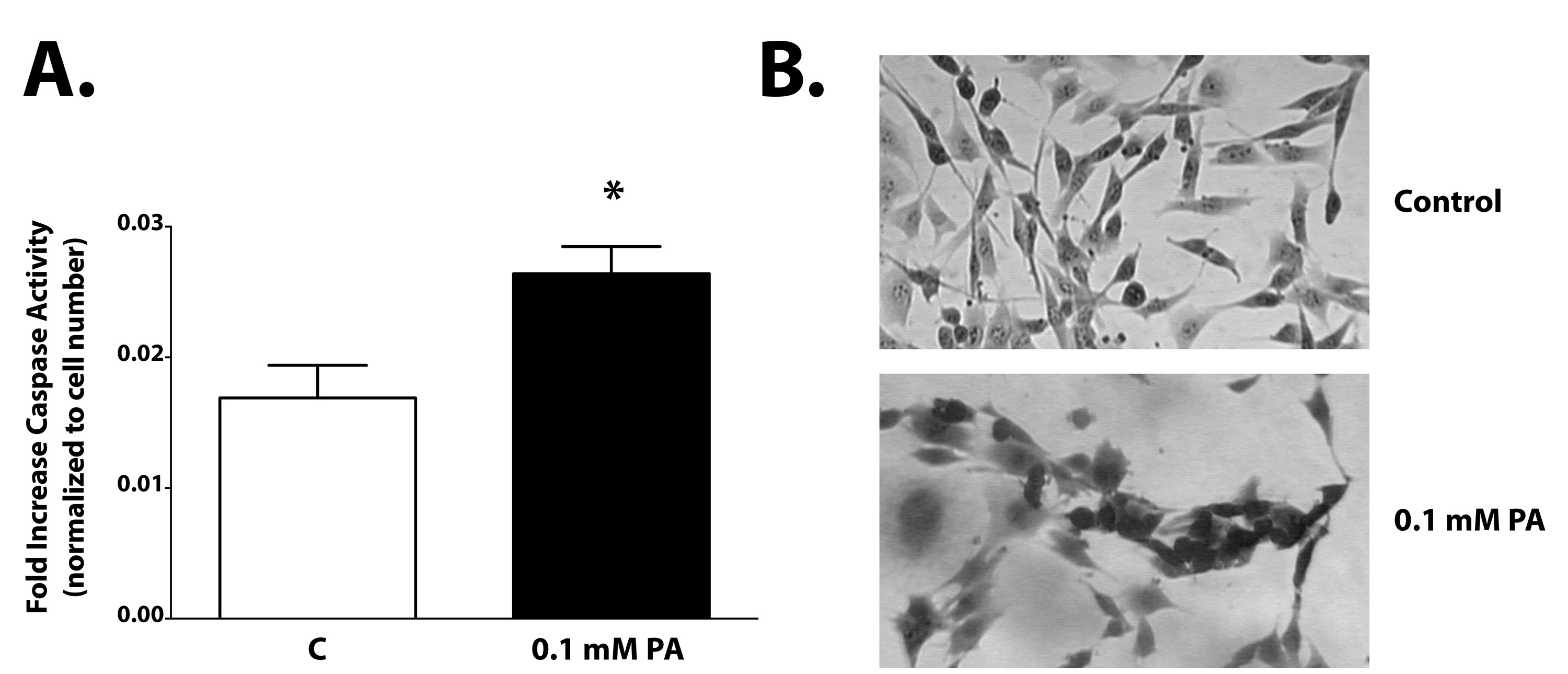
Рисунок 2. Каспазы-3/7 активность повышается следующие два часа PA вызов. Гипоталамуса A12 клетки обрабатывали в присутствии или в отсутствие 0,1 мМ ПА в течение 2 часов. Каспазы-3/7 активность была значительно увеличена в клетках, обработанных PA (р <0,01). Сотовый целостность мембран заметно потерял в присутствии ПА. Кликните здесь, чтобы посмотреть увеличенное изображение.

Рисунок 3. Потенциал путь ПА гибели клеток. Кликните здесь, чтобы посмотреть увеличенное изображение.
| Контроль | 0,1 ммоль ПА | ||||
| Жизнеспособных клеток | Каспазы 3/7 | соотношение | Жизнеспособных клеток | Каспазы 3/7 | соотношение |
| Флуоресценции (560 ЕХ / 590 EM) | Люминесценции 650 нм пик | Каспазы / жизнеспособных клеток | Флуоресценции (560 ЕХ / 590 EM) | Люминесценции 650 нм пик | Каспазы / жизнеспособных Слоктей |
| 1951,8 | 45,488 | 0,023305667 | 808,78 | 16,731 | 0,020686713 |
| 1647,0 | 46,011 | 0,027936248 | 788,84 | 22,080 | 0,027990467 |
| 1911,0 | 34,508 | 0,018057561 | 777,68 | 28,234 | 0,036305421 |
| 1792,5 | 14,183 | 0,007912413 | 807,45 | 20,457 | 0,025335315 |
| 1965,7 | 19,868 | 0,010107341 | 829,14 | 17.777 | 0,021440288 |
| 1803,0 | 20,229 | 0,011219634 | 742,35 | 29,280 | 0,039442312 |
| 1804,8 | 27,188 | 0,015064273 | 761,77 | 17.777 | 0,023336440 |
| 1890,1 | 40,7825 | 0,021576901 | 756,66 | 20,914 | 0,027639891 |
Таблица 1. Пример собранных данных и расчетных отношений.
Обсуждение
Мультиплексный анализ является широко признанным методом, который был использован учеными во многих приложениях, таких как ПЦР, микрочипов иммунологического и других белковых основе методов обнаружения 13, 14. В последнее время мультиплексирования анализы становятся все более используется в в пробирке эксперименты пластинчатых основе и были утверждены в качестве точного метода оценки цитотоксичности и жизнеспособности 12. В приведенном выше протоколе, мы продемонстрировать эффективность мультиплексирования люминесцентных и люминесцентных анализов, чтобы определить каспазы-3/7 активность и жизнеспособность клеток в A12 клеток следующих Звуковая вызов. Жизнеспособность клеток определяли в течение 10 мин первоначального Звуковая оскорбление, что позволяет быстро и надежно представления жизнеспособных клеток. Следует отметить, что rezasurin-реагент на основе живой анализ клетки, который позволяет для дальнейших конечными точками, чтобы быть измерены; Однако оптимизации времени инкубации, чтобы определить каспазы-3/7 активностью, эссенциял для получения приемлемых результатов 15.
Апоптоз может быть активирован внешних раздражений, сигналов внутренних клеток и поверхностных рецепторов приводит к различных морфологических и биохимических событий. Увеличение каспазы 3 деятельность, фрагментацию ДНК, потеря целостности клеточных мембран, конденсации хроматина и поли (АДФ-рибоза) полимеразы (PARP) расщепление некоторые специфические маркеры апоптоза, которые могут быть исследованы 16. Активация каспазы 3 и 7 являются основными модуляторами апоптоза, что делает их эфирные маркеры для оценки в фармакологических манипуляций, направленных на снижение апоптоза ущерб 17. Клетки, проходящие длительное апоптоз в конечном итоге пройти вторичный некроз, наблюдаемую на лизиса клеток, что подчеркивает важность выбора соответствующего сроки определить каспазы-3/7 деятельность 11. Как упоминалось ранее, каспазы-3/7 активность является временным; Поэтому, в зависимости от эффективности клеточной стресс, определения йэ соответствующий график для анализа активности каспазы может занять некоторое усилие. Кроме того, основные ограничения для нашего протокола мультиплексирования в том, что каспазы-3/7 активность может быть определена, но не количественно, а полученный лизат не может быть использована для последующих анализов (например, Вестерн-блоты или экспрессии генов).
Понимание характеристики клеточного цикла выбранной модели и как она может ответить на назначенных стресса при применении этого метода имеет решающее значение для получения достоверных результатов. Дополнительные соображения при планировании исследования, которые будут оценивать апоптоза являются: 1) определение соответствующей плотности клеток, которые высевают в каждую лунку; 2) концентрация и инкубация стрессора или используемого препарата; и 3) соответствующего времени инкубации в течение реагентов, используемых в анализе. Отсутствие стандартизации или предварительных исследований, направленных эти соображения обычно приводит к ошибочных данных. Время и усилия для стандартизации тыс.э мультиплексирования анализа мы описываем здесь представляет собой ценный, надежный и экономии времени технику для апоптоза исследований 10.
Раскрытие информации
Авторы не имеют никаких конфликтов раскрывать.
Благодарности
Работа, описанная здесь финансировалась американским Министерством по делам ветеранов биомедицинских лабораторных исследований и развития BX001686-1А1 и В. А. реабилитации исследований и разработок.
Материалы
| Name | Company | Catalog Number | Comments |
| Adult Mouse Hypothalamus Cell Line mHypoA-1/2 | Cellutions Biosystems Inc. | CLU172 | |
| Dulbecco’s Modified Eagle’s Medium | Invitrogen | 10313-039 | |
| Fetal Bovine Serum | PAA Labs | A15-751 | |
| Penicillin/Streptomycin | Invitrogen | 15070-063 | |
| Palmitic Acid | Sigma-Aldrich | P0500 | |
| Dimethy Sulfoxide | Sigma-Aldrich | D2650 | |
PrestoBlue Cell Viability Reagent | Invitrogen | A13262 | |
| Caspase-Glo 3/7 Assay Systems | Promega | G8091 | |
| 96 W Optical Bottom Plate, Black Polystyrene, Cell Culture Treated, with lid, Sterile | Thermo Fisher Scientific | 165305 | |
| SpectraMax M5 Multi-Mode Microplate | Molecular Devices |
Ссылки
- Akil, L., Ahmad, H. A. Relationships between obesity and cardiovascular diseases in four southern states and Colorado. J. Health Care Poor Underserved. 22, 61-72 (2011).
- Posey, K. A., et al. Hypothalamic proinflammatory lipid accumulation, inflammation, and insulin resistance in rats fed a high-fat diet. Am. J. Physiol. Endocrinol. Metab. 296, 1003-1012 (2009).
- Moraes, J. C., et al. High-fat diet induces apoptosis of hypothalamic neurons. PloS one. 4, (2009).
- Mayer, C. M., Belsham, D. D. Palmitate attenuates insulin signaling and induces endoplasmic reticulum stress and apoptosis in hypothalamic neurons: rescue of resistance and apoptosis through adenosine 5' monophosphate-activated protein kinase activation. Endocrinology. 151, 576-585 (2010).
- Benoit, S. C., et al. Palmitic acid mediates hypothalamic insulin resistance by altering PKC-theta subcellular localization in rodents. J. Clin. Invest. 119, 2577-2589 (2009).
- Thaler, J. P., et al. Obesity is associated with hypothalamic injury in rodents and humans. J. Clin. Invest. 122, 153-162 (2012).
- Williams, L. M. Hypothalamic dysfunction in obesity. Proc. Nutr. Soc. 71, 521-533 (2012).
- Belsham, D. D., et al. Generation of a phenotypic array of hypothalamic neuronal cell models to study complex neuroendocrine disorders. Endocrinology. 145, 393-400 (2004).
- Xiao, J., et al. Monitoring of cell viability and proliferation in hydrogel-encapsulated system by resazurin assay. Appl. Biochem. Biotechnol. 162, 1996-2007 (2010).
- Butterick, T. A., Nixon, J. P., Billington, C. J., Kotz, C. M. Orexin A decreases lipid peroxidation and apoptosis in a novel hypothalamic cell model. Neurosci. Lett. 524, 30-34 (2012).
- Riss, T. L., Moravec, R. A. Use of multiple assay endpoints to investigate the effects of incubation time, dose of toxin, and plating density in cell-based cytotoxicity assays. Assay Drug Dev. Technol. 2, 51-62 (2004).
- Niles, A. L., Moravec, R. A., Riss, T. L. In vitro viability and cytotoxicity testing and same-well multi-parametric combinations for high throughput screening. Curr. Chem. Genomics. 3, 33-41 (2009).
- Steffen, W., Linck, R. W. Multiple immunoblot: a sensitive technique to stain proteins and detect multiple antigens on a single two-dimensional replica. Electrophoresis. 10, 714-718 (1989).
- Gingrich, J. C., Davis, D. R., Nguyen, Q. Multiplex detection and quantitation of proteins on western blots using fluorescent probes. Biotechniques. 29, 636-642 (2000).
- Riss, T. L., Moravec, R. A. Use of multiple assay endpoints to investigate the effects of incubation time, dose of toxin, and plating density in cell-based cytotoxicity assays. Assay Drug Dev. Technol. 2, 51-62 (2004).
- Smyth, P. G., Berman, S. A. Markers of apoptosis: methods for elucidating the mechanism of apoptotic cell death from the nervous system. Biotechniques. 32, 648-650 (2002).
- Lavrik, I. N., Golks, A., Krammer, P. H. Caspases: pharmacological manipulation of cell death. J. Clin. Invest. 115, 2665-2672 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены