Method Article
視床下部細胞モデルでアポトーシスを決定するために、カスパーゼの多重化アッセイの使用
要約
マルチプレックスアッセイは、基本的な細胞メカニズムのための有益な情報を提供し、試薬および不必要な反復実験の無駄をなくすことができます。我々は、パルミチン酸との酸化的チャレンジ後のin vitroモデルの視床下部での細胞生存率を決定するために、蛍光及び発光に基づく方法を用いて、ここに多重化カスパーゼ3/7活性アッセイを記載する。
要約
複雑な細胞メカニズムの研究においてアッセイを多重化する能力は、反復的な実験の必要性を排除する内部コントロールを提供し、コストおよび試薬の無駄を減少させる。ここでは、96ウェル中の生存細胞数およびカスパーゼ3/7活性を測定するために、蛍光及び発光ベースのアッセイの両方を使用して、 インビトロ視床モデルにおけるパルミチン酸(PA)チャレンジ後のアポトーシスを評価するために、多重アッセイの最適化を記載マイクロタイタープレートフォーマット。 PAチャレンジ後、生存細胞を、レサズリン系蛍光アッセイにより決定した。カスパーゼ3/7活性次に発光基質、DEVD、そして細胞数に対して正規化を使用して決定した。この多重アッセイは、例えば、飽和脂肪酸チャレンジとしてアポトーシス刺激、次のカスパーゼ活性の変化を決定するために有用な技術である。飽和脂肪酸は、潜在的なPA importaですを示し、視床下部酸化ストレスおよびアポトーシスを増加させることができる例えば、そのようなアッセイのNCEは、飽和脂肪酸および神経機能の関係を研究する中で、ここで説明。
概要
パルミチン酸(PA)などの飽和脂肪酸が豊富な食事は、心血管疾患および糖尿病1、2を含む、肥満および他の併存疾患に関連している。高脂肪食はまた、酸化ストレス、アポトーシス、および視床下部の神経変性、食欲及びエネルギー消費3-7の重要な調節因子を増加させることが示されている。高脂肪食の露出が視床下部調節不全を誘導するメカニズムを理解することは、肥満のための薬理学的治療の開発のためのが重要である。しかし、食事の脂肪が神経機能に影響を与えるそれを通して細胞メカニズムは不明である。このようなPAとして脂肪が視床下部アポトーシス経路の発症を誘発するかもしれない方法をよりよく理解するには、この目的に向けて必要な最初のステップです。この記事の目的は、Hの研究に使用するために開発されたPA暴露に対する神経細胞応答のin vitro試験のためのマルチプレックスアッセイを、説明することであるypothalamic神経変性。我々は、PA 8との酸化的攻撃後(A12と称する)に分化する不死化成体マウスの視床下部細胞株における細胞の総数あたりの3月7日の活動カスパーゼを測定するためのin vitroでの 96ウェルフォーマットの多重検定の詳細な説明を提供する。
簡潔には、細胞生存率をレサズリン基づくアッセイを介してPAチャレンジを下記判定される。レサズリンは、代謝的に活性な細胞中の酵素の減少、ミトコンドリア9を介して起こると考えプロセスを受ける細胞透過性化合物である。生存細胞は、連続的に生細胞数に比例する蛍光シグナルを生成するレゾルフィンレサズリン変換する。カスパーゼ3/7活性を、次いで、DEVD-lumogenicベースのアッセイを用いて分析する。 DEVDはカスパーゼ3により切断されるアミノ酸配列(のAspのGlu-Aspで、ヴァル)である。この配列は、細胞内カスパーゼ3/7の活性化およびその後の切断の際に、lumogenic物質に結合されるとDEVD基板から、発光生成物が放出される。この反応は、カスパーゼ活性を、したがってアポトーシスの誘導に比例する。死んだ細胞は、カスパーゼを生産することができないように、カスパーゼ3/7活性を、自然の過渡的である。したがって、解析は細胞ストレッサーの効果によって、4時間後にチャレンジに30分の間に完了する必要があります。細胞生存率は、カスパーゼ3/7活性に反比例し、細胞死のメカニズムを決定するために用いることができる。例えば、この方法は、以前にオレキシンが、この処置によって影響メカニズムは酸化的損傷10に対する保護において重要であることを示唆し、過酸化水素でチャレンジ視床下部の細胞においてアポトーシスを減少させるペプチドホルモンとその前処理を示すために使用されている。それは、それらがアッセイ試薬を減少させるためにミトコンドリア活性に依存して、これらのアッセイは、細胞株および組織に依存する注意することが重要である。このプロトコルは、成体マウスの視床下部(A12)細胞用に最適化されています。しかし、記載された方法は、類似の研究の範囲内に収まるように変更することができる。
単一培養ウェルからの多重化アッセイは、いくつかの理由で個別のアッセイを行う従来の方法に勝る利点を提供する。時間、細胞試料、および培養試薬を保存することに加えて、多重化アッセイは、細胞生存と死の知識を提供内部対照を提供し、反復的な実験11,12の必要性を排除することができる。
代替法は、96ウェルフォーマットを使用している場合は特に、信頼性の高いアッセイであるウェスタンブロットまたはELISAを、依拠するが、費用と時間がかかる(1〜2日)であるている。それは、多重化アッセイのために細胞を培養するのに要する時間を除くと、合計時間は3時間未満である。このプロトコルはA12細胞との使用に最適化されたが、細胞の完全性に影響を及ぼし得る要因を念頭に保ちながら、それは他のモデルで使用するために変更されてもよい。抑止するこのプロトコルは、一連の実験のために働くかどうマイニングは、サンプルや実験条件の数にして計画されたダウンストリーム実験に依存します。
プロトコル
細胞培養物の1。メッキとメンテナンス
- 暖かいダルベッコ改変イーグル培地(DMEM)の培養培地(DMEM + 10%FBS + 1%ペニシリン/ストレプトマイシン/ネオマイシン)を37℃まで
- -80℃から凍結されたA12細胞の株式を取得
- 急速に37℃の水浴中で細胞を解凍する;一度解凍した、優しくピペット細胞が75cm 2の通気培養フラスコに移し、培養液の10ミリリットルを追加します。
- 37℃で5%CO2インキュベーター内でフラスコ一晩インキュベート培地を吸引し、24時間後に、新鮮な培地と交換します。 70〜80%のコンフルエンスが得られるまで細胞を増殖させるコンティニュ(2-3日間増殖)。
2。計数及びめっきセル
- 暖かいDMEMおよび37℃に1X-トリプシン-EDTA溶液
- 細胞から培地を吸引し、滅菌リン酸緩衝生理食塩水(PBS)で2回洗浄する。
- トリプシン溶液500μlを加え、2〜5分間37℃でインキュベートする。
- 切り離すスクレーパーを使用し、5mlの培地中で細胞を懸濁フラスコからの細胞。ストレーナーを通して細胞をパスし、きれいな50ミリリットルチューブにセルストレーナーを通過する。複数回ストレーナーを通して細胞を渡す必要があるかもしれませんが、以上の3回を繰り返さないでください。
- メディアの最終容量100μl、96ウェル透明底黒または白の壁のプレートに6000細胞/ウェルに播種するために培養するための細胞の量を測定する血球計数器を用いて細胞を数える。 24時間、37℃、5%CO 2でプレートをインキュベートする。
3。細胞生存率およびカスパーゼ3/7活性測定
- 無菌の5mlガラスバイアルに移し、PA、100%ジメチルスルホキシド(DMSO)に可溶化する。 DMSOにストックPAソリューション1:10に希釈し、0.1 mMのPAの最終作業濃度を得るために、DMEMを予め温めに追加します。制御メディアの場合、PAを含む培地に添加されている同じ濃度のDMSOを加える。
- 各ウェルに培地を除去し、50μlのメディア+ /で置き換える -ペンシルバニア州。 37℃、5%CO 2中で2時間、プレートをインキュベート次いで、5μlのレサズリン試薬を追加し、室温で10分間インキュベートする。
- 細胞生存率を測定するためのマルチモードマイクロプレートリーダー、蛍光レコード(560 EX / 590 EM)を用いて。結果は相対蛍光単位(RFU)として提示される。
- 同じプレートに、カスパーゼ試薬55μLを加え、2時間室温でインキュベートする。
- 再度カスパーゼ3/7活性を測定するためにマイクロプレートリーダー、レコード発光を用いて。結果は、カスパーゼ3/7活性に直接比例して発光、相対発光単位(RLU)として提示される。
- 細胞数にカスパーゼ3/7活性が正常化するには、カスパーゼ3/7活性(RLU)での細胞生存率(RFU)を分割します。
結果
上記のプロトコルは、細胞死のメカニズムを決定するために、多重つの別々のアッセイ結果を記載する。 図1は、細胞生存率とカスパーゼ3/7活性を測定するためのプロトコルの概要を示している。カスパーゼ活性は、有意に2時間インキュベートした( 図2Aおよび表1)の後にPAでチャレンジ細胞において増加した。細胞膜の完全性の喪失は、PA( 図2B)に2時間曝露した後に細胞において明らかであるアポトーシスの誘導に関連する形態学的変化である。 図3は、PAがアポトーシスを誘導し、インキュベーションを最適化することの重要性を実証している潜在的な経路を概説DEVD試薬中の時間。

図1。多重アッセイのための実験デザインカスパーゼ3/7活性を決定する。細胞を、24時間、96ウェルプレートに播種し、次いでPAの存在下又は非存在下でインキュベートする。各試薬の存在下でのインキュベーション時間は、モデルによって異なる場合があります。 拡大画像を表示するにはここをクリックしてください。
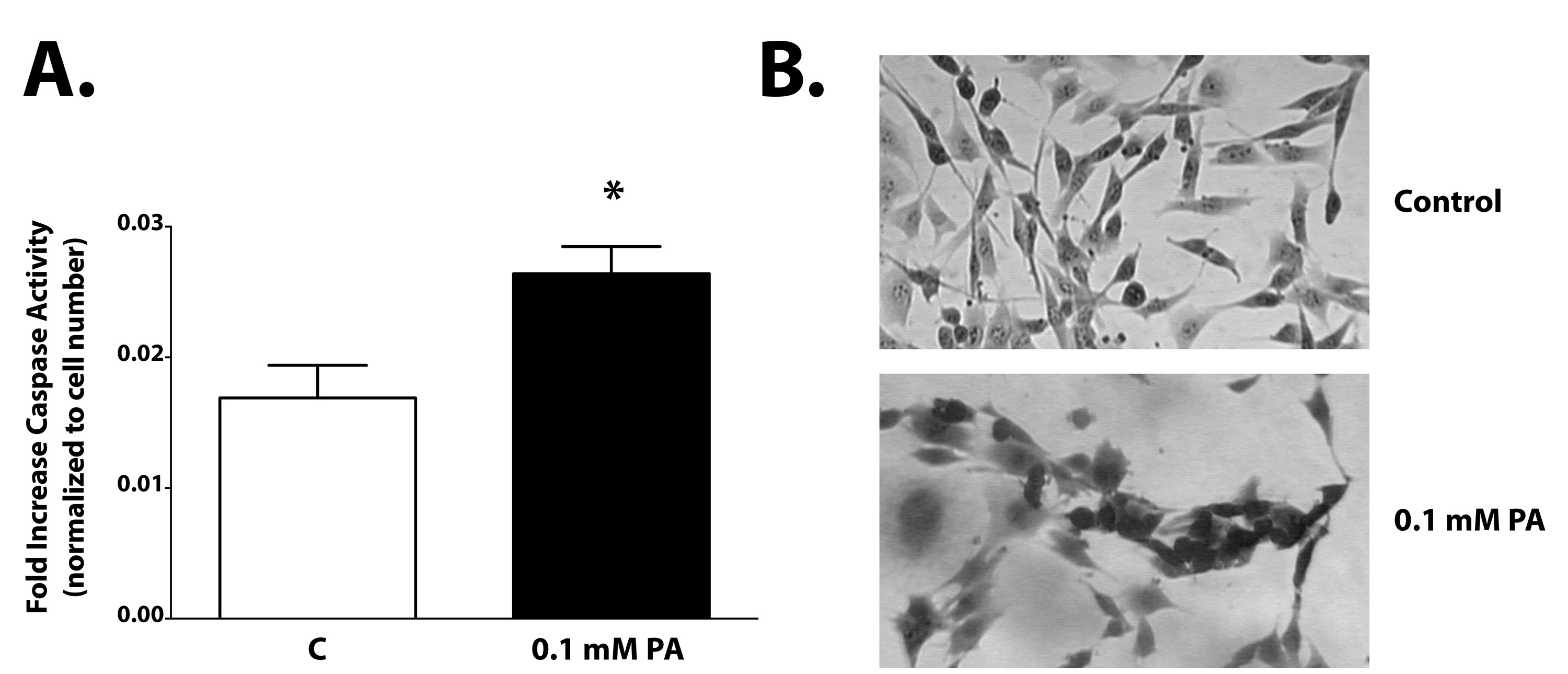
図2:カスパーゼ3/7活性は2時間のPA攻撃後増加する。視床下部A12細胞を、2時間0.1mMのPAの存在下又は非存在下で処理した。カスパーゼ3/7活性が有意にPAた(p <0.01)で処理した細胞で増加した。細胞膜の完全性は目に見えて、PAの存在下で失われます。 拡大画像を表示するにはここをクリックしてください。

図3。のPA誘導される細胞死の潜在的な経路。 拡大画像を表示するにはここをクリックしてください。
| コントロール | 0.1 mMのPA | ||||
| 生細胞 | カスパーゼ3/7 | 比 | 生細胞 | カスパーゼ3/7 | 比 |
| 蛍光(560 EX / 590 EM) | 650nmのピークルミネセンス | カスパーゼ/生細胞 | 蛍光(560 EX / 590 EM) | 650nmのピークルミネセンス | カスパーゼ/生存Cのエル |
| 1951.8 | 45.488 | 0.023305667 | 808.78 | 16.731 | 0.020686713 |
| 1647.0 | 46.011 | 0.027936248 | 788.84 | 22.080 | 0.027990467 |
| 1911.0 | 34.508 | 0.018057561 | 777.68 | 28.234 | 0.036305421 |
| 1792.5 | 14.183 | 0.007912413 | 807.45 | 20.457 | 0.025335315 |
| 1965.7 | 19.868 | 0.010107341 | 829.14 | 17.777 | 0.021440288 |
| 1803.0 | 20.229 | 0.011219634 | 742.35 | 29.280 | 0.039442312 |
| 1804.8 | 27.188 | 0.015064273 | 761.77 | 17.777 | 0.023336440 |
| 1890.1 | 40.7825 | 0.021576901 | 756.66 | 20.914 | 0.027639891 |
収集したデータと計算された比率の表1例。
ディスカッション
多重アッセイ、例えばPCRマイクロアレイ、免疫検出、および他のタンパク質に基づく検出法13、14のような多数の用途に科学者によって使用されている広く受け入れられた技術である。最近では、多重アッセイは、ますますin vitroのプレートベースの実験に利用され、細胞毒性を評価する正確な方法として、検証され、12の実行可能性されたとなっている。上記のプロトコルでは、PA攻撃後のA12細胞におけるカスパーゼ3/7活性及び細胞生存率を決定するために、多重蛍光および発光アッセイの有効性を実証する。細胞生存率は、生存細胞の迅速かつ信頼性の表現を可能にする、初期PA傷害の10分以内に測定した。それはrezasurin系試薬が測定されるエンドポイントをさらに可能にする生細胞アッセイであることに留意すべきである。しかし、カスパーゼ3/7活性を決定するために、インキュベーション時間を最適化することであるessentia使用可能な結果15を得るためのL。
アポトーシスは、外部刺激、細胞内部のシグナル、および別個の形態学的および生化学的事象を生じる表面受容体によって活性化することができる。増加したカスパーゼ3活性、DNAの断片化、細胞膜の完全性の喪失、クロマチン凝縮、およびポリ(ADP-リボース)ポリメラーゼ(PARP)切断が16を調査することができるいくつかのアポトーシス特異的マーカーである。カスパーゼ3および7の活性化は、アポトーシスのダメージ17を減らすことを目的とした薬理学的な操作に評価するために、彼らに不可欠なマーカーを作り、アポトーシスの主要な調節因子である。長期のアポトーシスを受ける細胞は、最終的にはカスパーゼ3/7活性の11を決定するために、適切なタイムフレームを選択することの重要性を強調し、細胞溶解によって観察、二次的壊死を受ける。前述したように、カスパーゼ3/7活性は、一過性であり;従って、細胞ストレッサの効果によって、目を決定するカスパーゼ活性を測定する電子の適切なタイミングは、いくつかの努力を取ることができます。さらに、我々の多重化プロトコルのための主な制限は、カスパーゼ3/7活性を測定して定量限定はないが、得られた溶解物を下流のアッセイ( すなわち、ウェスタンブロットまたは遺伝子発現)のために使用することができないことができることである。
選択されたモデルの細胞周期の特性を理解し、どのようにこの技術を適用すると、有効な結果を得るために重要であるときに、指定されたストレス因子に応答することがあります。その他の考慮事項アポトーシス経路を評価する研究を計画している:1)ウェル当たり播種する細胞の適切な密度を決定すること; 2)濃度、使用ストレスまたは薬物のインキュベーション; 3)アッセイに使用される試薬のための適切なインキュベーション時間。標準化や、これらの考慮事項に対処する予備的研究の欠如は、一般的に誤ったデータになります。目を標準化するために使用される時間と労力我々はここで説明するE多重アッセイは、アポトーシスの研究10のため、貴重な信頼性があり、時間節約の技術を提供する。
開示事項
著者らは、開示する競合がない。
謝辞
ここで説明する作業は、退役軍人の米国農務生物医学研究所研究開発BX001686-1A1およびVAリハビリテーション研究開発によって資金を供給された。
資料
| Name | Company | Catalog Number | Comments |
| Adult Mouse Hypothalamus Cell Line mHypoA-1/2 | Cellutions Biosystems Inc. | CLU172 | |
| Dulbecco’s Modified Eagle’s Medium | Invitrogen | 10313-039 | |
| Fetal Bovine Serum | PAA Labs | A15-751 | |
| Penicillin/Streptomycin | Invitrogen | 15070-063 | |
| Palmitic Acid | Sigma-Aldrich | P0500 | |
| Dimethy Sulfoxide | Sigma-Aldrich | D2650 | |
PrestoBlue Cell Viability Reagent | Invitrogen | A13262 | |
| Caspase-Glo 3/7 Assay Systems | Promega | G8091 | |
| 96 W Optical Bottom Plate, Black Polystyrene, Cell Culture Treated, with lid, Sterile | Thermo Fisher Scientific | 165305 | |
| SpectraMax M5 Multi-Mode Microplate | Molecular Devices |
参考文献
- Akil, L., Ahmad, H. A. Relationships between obesity and cardiovascular diseases in four southern states and Colorado. J. Health Care Poor Underserved. 22, 61-72 (2011).
- Posey, K. A., et al. Hypothalamic proinflammatory lipid accumulation, inflammation, and insulin resistance in rats fed a high-fat diet. Am. J. Physiol. Endocrinol. Metab. 296, 1003-1012 (2009).
- Moraes, J. C., et al. High-fat diet induces apoptosis of hypothalamic neurons. PloS one. 4, (2009).
- Mayer, C. M., Belsham, D. D. Palmitate attenuates insulin signaling and induces endoplasmic reticulum stress and apoptosis in hypothalamic neurons: rescue of resistance and apoptosis through adenosine 5' monophosphate-activated protein kinase activation. Endocrinology. 151, 576-585 (2010).
- Benoit, S. C., et al. Palmitic acid mediates hypothalamic insulin resistance by altering PKC-theta subcellular localization in rodents. J. Clin. Invest. 119, 2577-2589 (2009).
- Thaler, J. P., et al. Obesity is associated with hypothalamic injury in rodents and humans. J. Clin. Invest. 122, 153-162 (2012).
- Williams, L. M. Hypothalamic dysfunction in obesity. Proc. Nutr. Soc. 71, 521-533 (2012).
- Belsham, D. D., et al. Generation of a phenotypic array of hypothalamic neuronal cell models to study complex neuroendocrine disorders. Endocrinology. 145, 393-400 (2004).
- Xiao, J., et al. Monitoring of cell viability and proliferation in hydrogel-encapsulated system by resazurin assay. Appl. Biochem. Biotechnol. 162, 1996-2007 (2010).
- Butterick, T. A., Nixon, J. P., Billington, C. J., Kotz, C. M. Orexin A decreases lipid peroxidation and apoptosis in a novel hypothalamic cell model. Neurosci. Lett. 524, 30-34 (2012).
- Riss, T. L., Moravec, R. A. Use of multiple assay endpoints to investigate the effects of incubation time, dose of toxin, and plating density in cell-based cytotoxicity assays. Assay Drug Dev. Technol. 2, 51-62 (2004).
- Niles, A. L., Moravec, R. A., Riss, T. L. In vitro viability and cytotoxicity testing and same-well multi-parametric combinations for high throughput screening. Curr. Chem. Genomics. 3, 33-41 (2009).
- Steffen, W., Linck, R. W. Multiple immunoblot: a sensitive technique to stain proteins and detect multiple antigens on a single two-dimensional replica. Electrophoresis. 10, 714-718 (1989).
- Gingrich, J. C., Davis, D. R., Nguyen, Q. Multiplex detection and quantitation of proteins on western blots using fluorescent probes. Biotechniques. 29, 636-642 (2000).
- Riss, T. L., Moravec, R. A. Use of multiple assay endpoints to investigate the effects of incubation time, dose of toxin, and plating density in cell-based cytotoxicity assays. Assay Drug Dev. Technol. 2, 51-62 (2004).
- Smyth, P. G., Berman, S. A. Markers of apoptosis: methods for elucidating the mechanism of apoptotic cell death from the nervous system. Biotechniques. 32, 648-650 (2002).
- Lavrik, I. N., Golks, A., Krammer, P. H. Caspases: pharmacological manipulation of cell death. J. Clin. Invest. 115, 2665-2672 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved