Method Article
Эффективное производство и очистка рекомбинантного мышиного Kindlin-3 от клетках насекомых биофизической исследований
В этой статье
Резюме
Kindlins имеют основополагающее значение для клеточной адгезии через интегринам но исследования них были затруднены трудности встречаются в выражении их рекомбинантно в бактериальных хозяевах. Мы описываем здесь методы их эффективного производства в бакуловирусом-инфицированных клетках насекомых.
Аннотация
Kindlins являются важнейшими коактиваторы, с Талин, из рецепторов клеточной поверхности интегринов, а также участвовать в интегриновые снаружи внутрь сигнализации, и контроля транскрипции генов в ядре клетки. В kindlins являются ~ 75 кДа многодоменные белки и привязку к мотивом NPxY и вверх по течению Т / S кластера интегрину β-субъединицы цитоплазматического хвоста. Hematopoietically-важно kindlin изоформы, kindlin-3, имеет решающее значение для агрегации тромбоцитов в процессе формирования тромбов, лейкоцитов прокатки в ответ на инфекцию и воспаление и формирование остеокластов подоцитов в костной резорбции. Роль Kindlin-3 в этих процессах привело к обширным клеточных и физиологических исследований. Тем не менее, существует необходимость в эффективном способе получения высококачественных миллиграмм количества белка для дальнейших исследований. Мы разработали протокол, описанный здесь, для эффективной экспрессии и очистки рекомбинантного мышиного kindlin-3 с использованием бакуловируса-Dраздираемой системы экспрессии в клетках Sf9, дающих достаточное количество высокой чистоты полноразмерного белка, чтобы его биофизический характеристику. Такой же подход можно было бы принять в изучении других млекопитающих kindlin изоформ.
Введение
Белки семейства kindlin являются одним из важнейших компонентов координационного узла сцепления, и поэтому важное значение для сложных форм жизни. Kindlins, из которых 3 изоформы у млекопитающих (kindlin-1, kindlin-2, и kindlin-3), считаются коактиваторы из внеклеточных рецепторов интегринов наряду талина 1. Интегрин-опосредованную клеточную адгезию соединяет поверхности клеток с внеклеточным матриксом (ECM) в высших эукариот. Это является одним из важнейших и общий процесс в многочисленных физиологических явлений, к которым относятся целостность тканей, эмбриогенеза, костный метаболизм, гемостаз, и иммунитет. Интегрин-опосредованной клеточной адгезии активируется через наизнанку передаче сигнала через связывание талина и kindlin к интегриновых β-субъединицы цитоплазматических хвостов (CTS) на своих консервативных NPxY мотивами. Биомедицинская важность kindlin белков расширяет однако, насколько в ядро, где kindlin-2, как было показано в ряде недавних докладов, которые будут вовлечены в транскрипцииаль контролировать 2,3.
Kindlins являются многодоменные белки приблизительно 75 кДа, пронизанной представляет владение двудольного С-концевой FERM (4,1 полосы, эзрина, radixin, moesin) домена, который прерывается pleckstrin гомологии домена (PH) в центре ее F2 поддомен 4,5. Исследования kindlin-2 и kindlin-3 PH доменов показало, что он связывается с липидные вторичных мессенджеров фосфатидилинозитол-(3,4,5)-трифосфата и фосфатидилинозита-(4,5)-бифосфаткарбоксилазы 6-8. Однако исследования области kindlin-1 PH показывают, что он связывается с PtdIns (3,4,5) P 3 с гораздо более низким сродством, который может быть раскрыт в kindlin-1 с помощью изоформы конкретных солевого мостика, предотвращая липиды от связывания 9. Кроме того, существует цикл ~ 100 аминокислота вставлена в домене F1 из kindlins что, по прогнозам, быть развернута но связывается с фосфатидилсерина во внутреннем листке плазматической мембраны 10,11. Kindlin FERMдомена считается гомологичной области талин FERM, хотя домен талин FERM не обладает домен pleckstrin гомологии. Оба kindlins и талин взаимодействовать с NPxY мотивов на интегриновых β хвостов через F3 области их области FERM, но kindlin связывается с мембраной дистальной мотива, а талин цели мембраны проксимальных один 12-16. Kindlins и талин как в дополнение обладают N-концевой F0 область с убиквитин-как раз, что не встречается в других белков Ferm 11,17. Исследования по F0 области kindlin-2 показали, что независимо связывается с фосфатидилинозитол-(4,5)-бисфосфат обогащенных мембран 17.
В kindlins проявляют ткани узоры паралога конкретных выражений и неизбыточных физиологические функции. Kindlin-1 в первую очередь выражается в эпидермисе, но и в меньшей степени толстой кишки, желудка и почек; kindlin-2 экспрессируется повсеместно, но сосредоточена в поперечно-полосатой и гладкоймышцы и является единственным kindlin выражается в эмбриональном развитии 4 и kindlin-3 выражается в кроветворных тканей с высокой концентрацией kindlin-3, найденного в мегакариоцитов 18. Однако более поздние исследования показали, что функциональный белок экспрессируется в эндотелиальных тканях, а 19.
Kindlin-3 острого медицинского интерес из-за его важную физиологическую роль в крови. Это имеет решающее значение для агрегации тромбоцитов и распространения во время формирования тромба 20 лейкоцитов прокатки в ответ на инфекцию и воспаление 21,22 и формирования остеокластов подоцитов в резорбции кости 23. Кроме того, истощение kindlin-3 в организме человека приводит к адгезии лейкоцитов дефицита типа III - это заболевание характеризуется угрожающими жизни нарушениями свертываемости крови и рецидивирующих бактериальных инфекций 20,24,25. Kindlin-3 нокаут-исследования на мышах показали решающую функцию белка вклеточной адгезии KIND3 -. / - мыши обладают ярко выраженными фенотипы, такие как сильное кровотечение из-за неактивных интегринам тромбоцитов, тяжелой остеопетроза и нарушенной адгезии лейкоцитов 20,22, напоминающие симптомы у людей не хватает kindlin-3.
Структурные данные с высоким разрешением на kindlins, на сегодняшний день, было ограничено отдельными поддоменов, таких как pleckstrin гомологии (PH) домена из kindlin-1 9 и kindlin-2 26,27 и F0 домена из kindlin-1 11 и kindlin -2 17. Большинство из поддоменов каждого kindlin полипептида были однако сопротивлялся клонирование и структурный анализ (Yates и Гилберт, неопубликованные данные), и исследования полнометражных белков было затруднено из-за сложности выражения и очистки достаточных количеств использованием E. палочка (неопубликованные наблюдения и Harburger др.. 14). Существует значительный медицинский интерес к kindlin-3 и его фуnction, наряду с двумя другими членами семьи, а в последнее время мы получили миллиграмм количествах рекомбинантной экспрессией в Spodoptera frugiperda клеток, управляемых бакуловирусной инфекции 12. Поэтому мы здесь описаны способы производства миллиграмм количества рекомбинантного мыши kindlin-3 в культуре клеток насекомых, пригодных для обширных структурных исследований и биохимического анализа.
В этом протоколе мы используем сконструированного нокаутом Бакмидную (BAC10 KO: 1629) то есть, в одиночку, не в состоянии производить жизнеспособные вирионы 28. Вирусной ДНК, таким образом, спасены рекомбинации с вектором переноса что в этом случае также включает ген kindlin-3 (FERMT3) и результаты в гене FERMT3 замену вирус очень поздно ген, который экспрессируется на высоком уровне, но излишним, в результате рекомбинантной вирус, который выражает мыши kindlin-3 в рамках жизненного цикла вируса 28. Мы определили этоМетод для производства kindlin-3 после попытки выразить и очистить его у других хозяев экспрессии оказалось чрезвычайно сложно (неопубликованные наблюдения), но и в связи с универсальностью вектора набор POPIN, который мы использовали для клонирования и что может развернуты во многих выражения хостов 29.
протокол
Этот протокол предполагает, что мышь kindlin-3 гена (FERMT3) успешно клонировали в вектор вниз по течению от очень поздней p10 промоутер и что вектор обладает фланговые бакуловирусных последовательности, чтобы обеспечить рекомбинации с Бакмидную BAC10 KO: 1629, разработанной И.М. Джонс и коллеги 28. Для этого протокола, ген kindlin-3 клонировали в pOPINE 29 и праймеры и стратегия клонирования, используемые можно найти описано в другом месте 12. Плазмида спроектирована таким образом, что ген FERMT3 (kindlin-3) находится под контролем промотора бакуловирусной p10 и вектор содержит 5 'UTR/ORF603 и ORF 1629 и кодирует С-концевой His 6-тег для последующей очистки 29.
1. Насекомое Культура клеток и ремонт
- До рекомбинантного усиления бакуловирусной, Spodoptera frugiperda клетки приспособлены к суспензионной культуре (Sf9 клеток) должнывыращивать и поддерживать. Клетки насекомых всегда должны быть обработаны с использованием асептических методов в выделенном культуры ткани вытяжной шкаф.
- Суспензионные культуры клеток насекомых инкубируют в SF-900 II (ССМ) бессывороточной жидкой среде с добавлением 100 мкг / мл пенициллина и 100 мкг / мл стрептомицина в колбах при 27 ° С при встряхивании при 100 оборотах в минуту.
- Поддерживать диапазон плотности культуры клеток насекомых, между 1 х 10 6 - 1 х 10 7 клеток / мл по расщеплению и разбавления культуры клеток со свежими Sf-900 II СМИ.
Примечание: здоровым Клетки должны выглядеть однородными по размеру и должны быть сферическими по форме. - Подсчет клеток в объеме образца с помощью гемоцитометра и световой микроскопии для расчета плотности культуры клеток.
2. Генерация рекомбинантного бакуловируса
- Культура и поддерживать Sf9 клеток в суспензии с использованием Sf-900 II среде с 100 мкг / мл penicilliн и 100 мкг / мл стрептомицина. Для бакуловирусной поколения, клетки насекомых следует культивировать до плотности диапазоне от 5 × 10 5 - 1 × 10 6 клеток / мл.
- Семя примерно 1 × 10 6 Sf9 клеток на лунку стерильного планшета для культуры ткани в 2 мл Sf-900 II среде с 100 мкг / мл пенициллина и 100 мкг / мл стрептомицина 6-луночный. Оставьте клетки Sf9 при комнатной температуре в вытяжном шкафу прилипать к базе пластиковых скважин и, следовательно, образуют монослой.
- Выполните рекомбинантный бакуловирусной поколения по cotransfecting Бакмидную ДНК и ДНК плазмиды на монослоя культуры.
- Для каждой трансфекции, смешать 1-2 мкг очищенной pOPINE-mFERMT3, который обладает ORF1629 бакуловируса элементы, с 0,5 мкг очищенного BAC10 Ko: 1629 в 100 мкл Sf-900 II SFM без антибиотиков (раствор А).
- В отдельную пробирку, развести 6 мкл Cellfectin II реагента 100 мкл Sf-900 II SFM без антиантибиотики для каждой реакции трансфекции (раствор B). "Мастер микс" могут быть созданы здесь, для уменьшения обработки жидкой, если требуются многие трансфекции.
- Смешайте два решения (А и В, приблизительно 200 мкл) и инкубируют при комнатной температуре в течение 20 мин с образованием комплекса липид-ДНК.
- Развести комплексы липидов ДНК с 800 мкл Sf-900 II SFM без антибиотиков. Тщательно аспирата клеточный монослой носитель Sf9 и осторожно пипеткой раствора A / B и средств массовой информации в верхней части монослоя Sf9.
- Инкубируйте трансфицированных клеток в увлажненном инкубаторе при 27 ° CO / N и добавить еще 1 мл Sf-900 II SFM без антибиотиков в каждой монослойной культуре на следующий день. Инкубируйте клетки при 27 ° С в течение еще 5 дней.
- Урожай рекомбинантного бакуловируса непосредственно из культуральной среды (около 2 мл в сумме) и передать в чистую центрифужную пробирку (например, 15 мл трубки сокола).
- Уточнить любую SF9 клеток Дебреэто центрифугированием при 1000 х г в течение 5 мин при комнатной температуре. Передача не вирус, который в полученной надосадочной жидкости и обозначенный P1, в чистую пробирку и хранить при температуре 4 ° С в темноте до использования. На этом этапе оставшаяся Sf9 монослой могут быть использованы для оценки рекомбинантный вирус поколения путем оценки присутствии рекомбинантного kindlin-3 в клетках насекомых.
- Ресуспендируют монослой с 0,5 мл PBS и разбавленной пробы 10 мкл равными объемами 2x SDS-PAGE загрузочного буфера. Тепло образцов при> 95 ° С в течение по крайней мере 10 мин.
- Обрабатывают ультразвуком образца в течение 1 сек при 10% амплитуды с использованием наконечника микро-обработки ультразвуком, если она слишком вязкой для правильной нагрузки геля.
3. Усиление рекомбинантный бакуловирус
- Для амплификации вируса в суспензии с помощью плотности клеток 1,4 × 10 6 клеток / мл, и это должно занимать 1/20 от общего объема колбы (т.е. 50 мл культуры в2-литровую колбу).
- Достижение амплификации рекомбинантного вируса путем заражения культуры клеток насекомых с вирусным P1 при множественности инфекции (MOI) 0,1, используя следующую формулу;

Примечание: вирус поколение P1 можно предположить иметь ожидаемый вирусный титр 1 × 10 7 PFU / мл. Тем не менее, доска анализ может быть выполнена до этой стадии. - Инкубируйте P1-насекомых, инфицированных культуру при 27 ° С при встряхивании при 100 оборотах в минуту в течение 3 дней (72 час).
- Урожай вирус путем разделения клеток из средств массовой информации центрифугированием при 1000 х г в течение 5 мин при комнатной температуре. Сохранить полученный осадок клеток на этом этапе подтверждения рекомбинантной продукции вируса путем оценки kindlin-3 экспрессии белка в ДСН-ПААГ и вестерн-блоттинга.
- Перенесите уточнены вирусов обогащенный СМИ в чистую пробирку и хранить при температуре 4 ° С втемно до использования. Это вирусный штамм обозначается как Р2.
Примечание: вирусный титр 2 х 10 8 БОЕ / мл (или величины прироста 100 КОЕ / клетку) могут быть спрогнозированы.
4. Выражение kindlin-3 в инфицированных бакуловирусом Sf9
- Grow адекватный объем клеток Sf9 культур в суспензии в Sf-900 II SFM с добавлением 100 мкг / мл пенициллина и 100 мкг / мл стрептомицина, до крупномасштабного рекомбинантного kindlin-3 выражения для очистки. Инкубируйте суспензионных культур при 27 ° С при встряхивании при 100 оборотах в минуту и с общим объемом культуральной: колбе объемное соотношение 1:5.
- Infect суспензионные культуры Sf9 при плотности 2 × 10 6 клеток / мл.
- Дополнение Sf9 культуры с конечной концентрацией 1% (об / об) фетальной сыворотки теленка (FBS), а затем с усиленным рекомбинантного вируса (P2-вирусный штамм) с получением МВД 1. Инкубируйте инфицированных культур при 27 ° С при встряхивании при 100 оборотах в минуту.
- Урожай рекомбинациинт kindlin-3-CHIS 6-экспрессирующих клеток Sf9 72 ч после инфекции центрифугированием при 1000 х г и полученную в результате клеточный осадок хранили при -20 ° С до использования или -80 ° C для длительного хранения.
5. Очистка рекомбинантного Kindlin-3
- Оттепель замороженных бакуловирусом-инфицированных клеток насекомых (Sf9) гранулы экспрессирующие рекомбинантный kindlin-3 на льду.
- Ресуспендируют осадок клеток талой буфером для лизиса (50 мМ Трис-HCl, рН 7,5, 500 мМ NaCl, 1% (объем / объем) Твин-20) с добавлением ЭДТА свободной коктейль ингибиторов протеаз и 1000-2000 U из DNase1.
Примечание: В качестве альтернативы, модифицированный забуференный фосфатом физиологический раствор (PBS) также может быть использован, когда концентрация NaCl доводили до 500 мм для предотвращения неспецифических взаимодействий между эндогенных клеточных белков Sf9 и колонну с иммобилизованными металла, используемого для аффинной очистки ниже по потоку (см. ниже). - Лизиса клеток путем инкубации клеток ресуспендировали с моющим средством и VOrtexing. Разрушать ультразвуком (амплитуда 40%, 10 циклов: 10 сек с последующим импульсом 10 сек охлаждения) образец для дальнейшего разрушения клеток на бане со льдом или в качестве альтернативы использовать гомогенизаторе Даунса.
- Уточнение лизата центрифугированием при 48000 х г в течение 1 часа при 4 ° С. Загрузить полученного супернатанта на колонку HisTrap (5 мл объема колонки), предварительно уравновешенную буфером для лизиса, при 4 ° С со скоростью 1 мл / мин.
Примечание: В качестве альтернативы, осветленный лизат можно инкубировать с объемом в 1-5 мл слоем, предварительно уравновешенную никелевых сефарозы (например, Ni Sepharose 6 Fast Flow) при 4 ° С в течение 1-2 часов. Колонна Ni сефарозе могут быть сформированы после стадии связывания, используя колонку самотеком. - Колонку промывают 10 объемами колонки промывочным буфером (50 мМ Трис-HCl, рН 7,5, 500 мМ NaCl, 10 мМ имидазол) для удаления несвязанных белков.
- С помощью линейного градиента имидазола от 10-500 мм при скорости 10 мм / мл (или в 10 объемах колонки) с использованием FPLC AKTA для элюированияграница рекомбинантный kindlin-3-CHIS 6.
- Фракционирования элюированием в 0,5-1 мл фракций с использованием AKTA FPLC, с тех фракций, содержащих kindlin-3-Chis 6 обычно элюированием при концентрации имидазола 300 мм.
- Оценка белковый состав элюента в ДСН-ПААГ и впервые очисток подтвердить вестерн-блоттингом с использованием анти-His 6 антитело или анти-мыши kindlin-3 антитела.
- Объединяют фракции, содержащие kindlin-3 и замены буфера в 20 мМ Трис-HCl, рН 7,5, 200 мМ NaCl через серию разведений в буфере и концентрации примера с использованием центробежного концентратора белка с 50 кДа молекулярная масса отсечки (MWCO) при 4 ° С.
Примечание: В качестве альтернативы, диализировать белкового раствора с использованием Slide-A-тестера диализа кассеты с MWCO 30 кДа при 4 ° С в течение 4 часов, чтобы O / N в 20 мМ Трис-HCl, рН 7,5, 200 мМ NaCl.
Примечание: для ионного обмена (см. ниже) низкая концентрация NaCl, т.е. 50 мм, может быть и была использована для этого шага. - Применение белкового раствора буфера обмену на предварительно уравновешенную колонку HiTrap гепарин HP (5 мл объема колонки) с использованием FPLC AKTA со скоростью 0,5 мл / мин.
Примечание: граница kindlin-3 элюировали с использованием линейного градиента NaCl (0,2 М NaCl в 1 М NaCl) в том же буфере, увеличивается со скоростью 10 мм / мл. Kindlin-3-CHIS6 ожидается для элюирования при ~ 0,6 М NaCl. - Фракционирования элюированием в 0,5-1 мл фракций и оценить белковой композиции в ДСН-ПААГ и вестерн-блоттинга, в случае необходимости.
Примечание: можно ожидать чистоту белка около 95%, как определено SDS-PAGE. - Бассейн Фракции, содержащие kindlin-3 и концентрировать с помощью центрифуги белка концентратор с 50 кДа MWCO до конечного объема 0,5-2 мл.
- На конечной стадии, полировать концентрированный белок и буфер обмена белка с помощью эксклюзионной хроматографии (SEC).
- Примените очищенный белок на Суperdex S200 (16/60) или (10/30), предварительно уравновешенную в 20 мМ Трис-HCl, рН 7,5, 200 мМ NaCl, 1 мМ DTT со скоростью 1 мл / мин или 0,5 мл / мин в зависимости от размера колонны используется.
Примечание: гель-хроматографии может быть также выполнена в фосфатно-солевом буфере (PBS), если требуется. - Очищают белки согласно размеру с применением буфера на колонку со скоростью 1 мл / мин или 0,5 мл / мин, в зависимости от размера используемой колонки.
Примечание: белок, элюируемой из колонки фракционируют и контролируется с использованием оптической плотности при 280 нм. - Единственный пик поглощение следует ожидать от сек, что на фракции и оценивали электрофорезом в ДСН-ПААГ для определения однородности и обычно> 95% чистоты после этого шага.
- Примените очищенный белок на Суperdex S200 (16/60) или (10/30), предварительно уравновешенную в 20 мМ Трис-HCl, рН 7,5, 200 мМ NaCl, 1 мМ DTT со скоростью 1 мл / мин или 0,5 мл / мин в зависимости от размера колонны используется.
- Концентрат очищали kindlin-3-CHIS 6 с использованием центрифуги белка концентратор с 50 кДа MWCO до ~ 15 мг / мл, как определено спектрофотометрически с использованием вычисленного коэффициента экстинкции (ε) из 109 320 М -1 см -1 </ SUP> (предполагая, что все остатки цистеина снижаются).
- Для хранения при -20 ° С и длительного хранения при -80 ° С, Аликвота белок в ПЦР пробирок и флэш-заморозить образцы в жидком азоте. Альтернативно, белок может быть использован непосредственно для исследования с использованием ряда биохимических и биофизических методов.
Результаты
Крупномасштабное экспрессии рекомбинантных мыши kindlin-3 с использованием бакуловирус-инфицированных Sf9 клеток может принимать менее чем за две недели, чтобы достичь количества миллиграмм, как показано на схематическом рисунке 1А и требует лишь небольшого количества плазмидной ДНК из набора QIAprep Miniprep, для пример. Генерирование рекомбинантного бакуловируса достигается cotransfecting клеток Sf9 с мышь kindlin-3 (FERMT3)-содержащей плазмиды вместе с линеаризованной инженерии Бакмидную (BAC10: KO 1629) и заготовка вновь образованных вирионов после 5-7 дней, как показано на рисунке 1А. Этот метод результатов бакуловирусом поколения в 100% рекомбинантных вирусов и существенно обходится необходимость очистки доска 28,30. Представитель мелкомасштабные (2 мл монослой) культура будет генерировать рекомбинантный вирус, содержащих решение с ожидаемым вирусного титра 1 х 10 7 бляшкообразующих единиц (БОЕ) на млкультура. Можно выполнить бляшек для определения фактической титр вируса, но это, пожалуй, слишком трудоемким, когда большое количество конструкций проверяются на структурных исследований. Успех этапе генерации, вирус может быть оценена с помощью EGFP-содержащей плазмиды параллельно или, по этой kindlin-3 конструкции, монослой Sf9 может быть ресуспендировали в PBS и оценивали электрофорезом в ДСН-ПААГ и Вестерн-блоттингом, который обычно демонстрирует ясно полоса, соответствующая белку His-меченого 75 кДа, как показано на фиг.1В. Вирус затем усиливается генерировать достаточное количество для крупномасштабных (объемы литровые) инфекции клеток насекомых и изоляции рекомбинантного белка. Второй вирус проход (Р2) порождается заражения суспензионных культур по оценкам МВД 0,1 (см. протокол). Очень важно, что усиление Sf9 подвеска культура занимает лишь двадцатую часть от общего объема колбы. Этот дополнительный аэрации гарантирует, что приводит Virнам содержащих СМИ, собирают через 3 дня (72 часа) после заражения, будет генерировать достаточное количество kindlin-3 в последующем культуры экспрессии. Усиленный вирус складе (Р2) предполагается обладают ожидаемый вирусный титр 2 х 10 8 БОЕ / мл на основе консервативной оценке 100 БОЕ / клетку с помощью плотности клеток 2 х 10 6 клеток / мл в течение усиления 31. Как правило, для оптимальной амплификации бакуловирус и белка производства, клетки Sf9 должны быть однородными по размеру и сферической, как показано на рисунке 1С. Кроме того, вирусная усиление и белка выражение максимальна при 72 ч после заражения, и оба они значительно снижается при 96 ч после заражения.
После того, как вирус был усилен и использовали для инфицирования клеток Sf9 в крупномасштабных экспериментов рекомбинантный kindlin-3 частично очищают в силу своей инженерии С-концевой His 6-тега с использованием иммобилизованной металл аффинной хромахроматография, как показано на рисунке 2. Важно провести очистку при 4 ° С и достаточных ингибиторы протеазы, которые были добавлены, чтобы предотвратить протеолиз. Частично очищенный kindlin-3 дополнительно очищают на ближайшем гомогенности с помощью ионообменной хроматографии (IEC) с использованием колонки гепарин, как показано на рисунке 3. Мы использовали использование колонку с гепарином вместо обычного ионного обменной колонны, как предсказано, что большое количество основных остатков, в том числе поли-лизин участке в домене kindlin-3 F1, будет сильно взаимодействуют с отрицательно заряженными сульфатных групп столбца. Эта стратегия особенно полезна для ДНК-и РНК-связывающих белков с основными кислотными участками связывания нуклеиновых, например РНК-связывающий терминал uridylyltransferase CID1 32. Наконец kindlin-3 чистота "полированный" с помощью эксклюзионной хроматографии для удаления агрегатов и достижения однородности, как показано наРисунок 4. Буферы указанные в протоколах стандартные буферы часто используемые при очистке белков для структурного анализа. Как правило, на основе фосфата буферы избегать очистки белков для структурных исследований, особенно скрининг кристаллизации в связи с образованием фосфатных кристаллов в каплях кристаллизации (особенно для экспериментов на 4 ° С). Тем не менее, мы провели Thermofluor основе анализа теплового сдвига чтобы определить, какие буферы стабилизации для kindlin-3, как показано на рисунке 5. Вкратце, очищенный белковый раствор разбавляют в буферах, которые охватывают диапазон концентраций хлорида натрия рН и, следовательно, образуя 2-мерный экран. Плавление белка измеряется путем наблюдения флуоресценции от Sypro оранжевой краски (Molecular Probes), который связывается с гидрофобных остатков в сложенном белка ядра, в интервале температур 20-95 ° С (293-368 К). Температура в середине точка, в которой йе белок разворачивается (температура перехода, Т м) рассчитывали с помощью программного обеспечения Opticon монитора и описано в другом месте 33. Kindlin-3 наблюдалась, чтобы быть стабильной при высоких концентрациях хлорида натрия (500 мм) в диапазоне рН 7,0-9,0, с последовательным температуры перехода (Т м) 55 ° С. Было также отмечено, что Т м Kindlin-3 составляла примерно 55 ° C в диапазоне рН 7,0-7,5, независимо от концентрации хлорида натрия.
Мы обнаружили, что существует ограниченный протеолиз kindlin-3 в течение очистки, но анализ SDS-PAGE из высококонцентрированной белка (~ 15 мг / мл) показали ограниченную загрязнения с двумя дополнительными полипептидами равной интенсивности. Как ни странно, однако нет никаких признаков того, дополнительных видов с помощью гель-хроматографии, как показано на рисунке 4. Таким образом, считалось, что белок рваные протеазами но остается сложить и hydrodynamically неотличимы от полноразмерного белка. Интересно, Кальпаин является известным протеазы, которая расщепляет kindlin-3 в Tyrosine373, что в β1-β2 петле pleckstrin гомологии (PH) домена 34 и может объяснить наши наблюдения. Кроме того, вестерн-блоттинг показывает, что одна из полипептидных дублетов обладает С-концевую His-метку и кажущуюся молекулярную массу дублета, когда суммируются, равна 75 кДа, та же молекулярная масса, как нативного белка. Выход очищенного рекомбинантного kindlin-3 на литр клеток Sf9 (~ 2 г веса клеток), в лучшем случае, 5 мг.

Рисунок 1. Обзор бакуловирусом-инфицированной выражения клеток насекомых гетерологического белка. (А) схематически обзор бакуловирусной Generatioн и выражение kindlin-3 в клетках Sf9. В векторной ДНК схемы, 5'UTR / ORF603 окрашена в красный, ORF1629 окрашена в зеленый и, ген белка интереса (POI) окрашен в синий цвет. (B) Вестерн-блот с использованием анти-His 6 антитела, из шести малых (2 мл) монослой культур (дорожки маркированы согласно культуры) Sf9 клеток, продуцирующих рекомбинантного бакуловируса и рекомбинантный мышиный kindlin-3. (C) Оптическое микроскопическое изображение здоровых клеток Sf9 выращивали в суспензии в Sf-900 II SFM с добавлением антибиотиков и переносили в 35 мм и тканевой культуральной чашке (см. протокол). Изображение 20-кратным увеличением.

Рисунок 2. Representative очистка kindlin-3 по иммобилизованным металлом аффинной хроматографии (IMAC). SDS-PAGE никеля сродством очищенный рекомбинантный мышиный kindlin-3 выражается в бакуловирус-инфицированных клеток Sf9 (~ 2 г клеточной массы). Адсорбированный белок элюируют с помощью градиента имидазола (см. выше геля). Дорожки обозначены следующим образом; МВт, маркер молекулярной массы, Lys, клеточный лизат; FT, течь через (несвязанного); WI, мыть 1; WII, мыть 2. Вестерн-блот анализ (см. ниже) также выполняется с использованием элюирования фракций, чтобы подтвердить наличие инженерного His-метки на рекомбинантного белка. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 3. Предтель очистка kindlin-3 гепарином аффинной хроматографии. (А) профиль элюирования наблюдается при 280 нм (синий), где отображаются один симметричный пик элюируя под градиентом хлорида натрия линейная (зеленый) с помощью диапазона концентраций NaCl 0,05-1,0 М. ( Б) анализ SDS-PAGE из фракционированного элюирования демонстрируя присутствие кДа белка 75, kindlin-3 (помечены К3). Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 4. Представитель гель-фильтрационную хроматографию и концентрировали kindlin-3. (A) Гель-фильтрация Профиль элюции очищенной kindlin-3 с использованиемSuperdex S200 (16/60) в трис-HCl, рН 7,5, 150 мМ NaCl и 1 мМ DTT при 20 ° С. На основании объема элюировани, kindlin-3 мигрирует как ожидалось для кДа-белка 75, предполагая, что это преимущественно мономерные. (В) SDS-ПААГ высококонцентрированный очищенный рекомбинантный kindlin-3 на 14,5 мг / мл. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
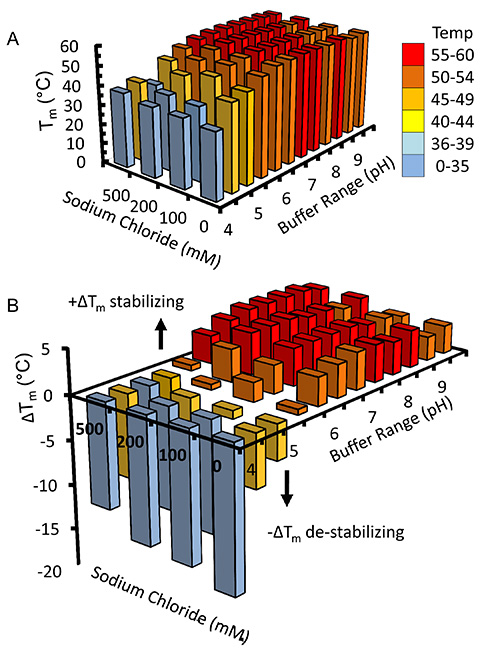
Рисунок 5. Thermofluor основе Thermal Assay Buffer сдвига для скрининга. Kindlin-3 разбавляют в различных буферах, содержащих двумерный экран рН от концентрации хлорида натрия. Температуры фазовых переходов (температура середины баллов) наблюдались флуоресценциигидрофобно связаны краситель, SYPRO оранжевый (молекулярные зонды) и рассчитывается с помощью программного обеспечения Opticon Monitor. (А) 3D гистограмма температур перехода строится вместе с (В) изменение температуры перехода от расчетного среднем 50,4 ° С. Для ясности бары окрашены в зависимости от диапазона температур, которым они соответствуют. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Бакуловирусные системы экспрессии становятся все более популярными и важным инструментом для производства миллиграмм количества рекомбинантного белка для белка характеристики с использованием биофизических исследований, в том числе рентгеновской кристаллографии. Несмотря на то, более экспериментально требуя бакуловирусный системы экспрессии предлагают несколько преимуществ над Е. палочка, один из которых является почти родным среда для белков эукариот происхождения, например, при наличии соответствующих сопровождающих и возможности для пост-трансляционной модификации. В наших собственных усилий, чтобы выразить kindlin-3, альтернативные хозяева выражения были использованы в том числе млекопитающих клеточных линий и штаммов бактериальных экспрессии (неопубликованные данные). Как правило, многие E. палочка штаммов производится очень небольшое количество рекомбинантного kindlin-3 (~ 0,5 мг / л культуры; неопубликованные наблюдения). Однако выражение бакуловирус приводом в клетках насекомых был особенно эффективным и, в сотрудничествеmparison к кратковременной экспрессии в клетках млекопитающих, более склонны к генерации большого биомассу, необходимую для выделения миллиграммов рекомбинантных цитоплазматических белков (неопубликованные данные). Мы полагаем, что присутствие эукариот шапероны может позволить эффективное производство kindlin-3.
В Baculoviridae инфицировать клетки насекомых и для экспрессии рекомбинантного белка бакуловируса используется в данной работе основывается на Autographa саЩогтса вирус ядерного полиэдроза (AcNPV). В природе AcNPV, который заражает Autographa саЩогтса (люцерна Lopper) личинки насекомых, требуется белок полиэдрина для формирования окклюзии в результате чего вирионов инкапсулированных в матрице кристаллического белка, таким образом, обеспечивая необходимую защиту их освобождения. В культивируемых клетках образование телец не требуется для репликации и, следовательно, необязательной. В случае экспрессии чужеродных белков ген полиэдрина белок может быть гeplaced в рекомбинантной AcNPV с геном белка, представляющего интерес. AcNPV может инфицировать другие биологические виды Lepidopteron и для целей рекомбинантный белок выражение армия червя Spodoptera frugiperda куколочные клетки яичника используются. В подходом, изложенным здесь, AcNPV Бакмидную (BAC10) спроектирована таким образом, что существенным вирусным геном, ORF1629, инактивируется вставки хлорамфеникол ацетилтрансферазы в результате чего нокаут-Бакмидную (BAC10: KO 1629), таким образом, что он является не в состоянии сформировать инфекционных baculovirions 28. Котрансфекция Sf9 клеток с линеаризованной BAC10: KO 1629 и FERMT3 содержащие вектор переноса ремонт неактивный ORF1629, через транспозиции, в результате чего жизнеспособной генома, которые также включены ген FERMT3 под контролем промотора полиэдрина 28.
Мы опишем протокол очистки для выделения высокочистого рекомбинантного мыши kindlin-3 через Автошоуэ шаг хроматографический подход. Методы, используемые здесь может быть легко применены к другим Его-меченных белков. Мы использовали в стадии ионного обмена для дальнейшей очистки kindlin-3, но мы считаем, что это является еще одним шагом псевдо-сродство как kindlin-3 обладает большое количество основных остатков, в том числе поли-лизин участке в своей области F1. Кроме того, kindlin-3 считается связывать и взаимодействовать с цитоплазматической поверхности плазматической мембраны, где он функционирует, и, следовательно, мы прогнозируем, что кластеризация основных остатков позволит белок, чтобы противостоять отрицательно заряженную мембрану.
Буферы, описанные в протоколах очистки считаются стандартными и часто используются в структурной биологии. Thermofluor анализ (рис. 5) показывает, что kindlin-3 стабилен в большинстве условий буферных выше рН 6,0. Это было особенно полезным и важным для информирования наших экспериментов при изучении kinldin-3: β1Хвост взаимодействие с помощью ЯМР, который показал прекрасные спектры при рН 6.1 с низкими концентрациями NaCl 12.
Перед любым биофизических исследование может быть предпринято, важно продемонстрировать, что очищенный белок, представляющий интерес, действительно, правильно свернутый, и функционально активным. В предыдущей публикации мы продемонстрировали, что рекомбинантный kindlin-3 экспрессировали и очищали, используя этот метод был мономер и монодисперсные в растворе, как определено гель-хроматографии, динамического светорассеяния, аналитической ультрацентрифугирования и малоуглового рассеяния рентгеновских лучей, и был также способны связывать и признавая мембраны-дистальной NPxY и вверх по течению Серин / треонин кластер β 1A цитоплазматических хвостов 14, подтвердив тем самым, что он ведет себя как нативного белка, который является в соответствии с предыдущими клеточных и физиологических исследований 14,20,22. Использование теплового анализа устойчивости является дополнительным способом предлагая тыс.е надлежащее сгибание интерес белка, как неправильно сложены белок приведет к высокой фоновой флуоресценции из-за подверженных гидрофобных остатков.
Kindlin семейство белков с был обнаружен их неожиданным роль в качестве основных коактиваторов интегринов в естественных условиях была в центре внимания большого внимания. Это вызвало много усилий, чтобы выразить их рекомбинантно и решать их структуры. На сегодняшний день ограниченный успех был отмечен в выражении миллиграмм количества длины полной рекомбинантного белка, но мы имеем здесь описано применение бакуловирусной системе, которая позволяет крупномасштабных выражение на уровнях, где структурные исследования стало возможным. Создавая большое количество рекомбинантного kindlin-3 мы ожидаем, что это будет способствовать дальнейшие исследования этого белка. Бакуловирус приводом способ очистки и рабочий процесс, описанный здесь для рекомбинантного мышиного kindlin-3 также может быть использован для экспрессии и очистки других изоформ kindlin, Которые также трудно выразить, а также обладают поли-лизин участки, и может быть дополнительно приспособлен для других цитоплазматических белков, таких как связывающих белков, нуклеиновых кислот, которые не выражают в бактериальных штаммов.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Мы благодарим Weixan Лу для оказания технической помощи в культуре и поддержания запасов Sf9 клеток. LAY поддержали Совет по медицинским исследованиям (MRC) выпускник студенчества. RJCG был Королевское общество университет научный сотрудник. Оксфордский Отдел структурной биологии является частью Центра Доверия Wellcome генетики человека, Wellcome Trust Основной Award номер гранта 090532/Z/09/Z.
Материалы
| Name | Company | Catalog Number | Comments |
| Sf-900 II serum free media (SFM) 1x liquid | Life Technologies | 10902-096 | store at 4 °C and warm to RT before use |
| Cellfectin II Reagent | Invitrogen | 10362-100 | Alternatively, GeneJuice transfection (EMD) reagent can be used |
| Streptomycin sulphate (solid) | Melford | S0148 | Sterilize filter (0.22 μm filter) before use |
| Penicillin G, potassium salt (solid) | Melford | P0580 | Sterilize filter (0.22 μm filter) before use |
| CELLSTAR Sterile 6-well Culture Plate | Greiner Bio-One | 657160 | |
| Fetal Bovine Serum (FBS) | Life Technologies | 10100-147 | |
| Protease Inhibitor Cocktail | Sigma | P8849 | Caution: Protease inhibitors are dissolved in DMSO |
| Bovine pancrease deoxyribonuclease (Dnase) I | Sigma | D5025 | |
| HisTrap FF (5 ml) | GE Heathcare | 17-5286-01 | Requires an Äkta FPLC machine |
| HiTrap Heparin (5 ml) | GE Heathcare | 17-0407-01 | Requires an Äkta FPLC machine |
| Amicon Ultra-15 Centrifugal Filter Units (with Ultracel-50 membrane) | Millipore | UFC905024 | 15 ml capacity and a MWCO of 50 kDa protein concentrator |
Ссылки
- Moser, M., Legate, K. R., Zent, R., Fassler, R. The tail of integrins, talin, and kindlins. Science. 895, 899 (2009).
- Yu, Y., et al. Kindlin 2 forms a transcriptional complex with β-catenin and TCF4 to enhance Wnt signalling. EMBO Rep. 13, 750-758 (2012).
- Yu, Y., et al. Kindlin 2 promotes breast cancer invasion via epigenetic silencing of the microRNA200 gene family. Int J Cancer. , (2013).
- Meves, A., Stremmel, C., Gottschalk, K., Fassler, R. The Kindlin protein family: new members to the club of focal adhesion proteins. Trends Cell Biol. 19, 504-513 (2009).
- Siegel, D. H., et al. Loss of kindlin-1, a human homolog of the Caenorhabditis elegans actin-extracellular-matrix linker protein UNC-112, causes Kindler syndrome. Am. J. Hum. Genet. 73, 174-187 (2003).
- Hart, R., Stanley, P., Chakravarty, P., Hogg, N. The kindlin 3 PH domain has an essential role in integrin LFA-1-mediated B cell adhesion and migration. J. Biol. Chem. , (2013).
- Liu, J., et al. Structural basis of phosphoinositide binding to Kindlin-2 pleckstrin homology domain in regulating integrin activation. J. Biol. Chem. 286, 43334-43342 (2011).
- Qu, H., et al. Kindlin-2 regulates podocyte adhesion and fibronectin matrix deposition through interactions with phosphoinositides and integrins. J. Cell Sci. 124, 879-891 (2011).
- Yates, L. A., et al. Structural and Functional Characterisation of the Kindlin-1 Pleckstrin Homology Domain. J. Biol. Chem. 287, 43246-43261 (2012).
- Bouaouina, M., et al. A conserved lipid-binding loop in the kindlin FERM F1 domain is required for kindlin-mediated αIIbβ3 integrin coactivation. J. Biol. Chem. 287, 6979-6990 (2012).
- Goult, B. T., et al. The structure of the N-terminus of kindlin-1: a domain important for AlphaIIbBeta3 integrin activation. J. Mol. Biol. 394, 944-956 (2009).
- Yates, L. A., Fuzery, A. K., Bonet, R., Campbell, I. D., Gilbert, R. J. Biophysical Analysis of Kindlin-3 Reveals an Elongated Conformation and Maps Integrin Binding to the Membrane-Distal β-Subunit NPXY motif. J. Biol. Chem. 287, 37715-37731 (2012).
- Anthis, N. J., Campbell, I. D. The tail of integrin activation. Trends Biochem. Sci. 36, 191-198 (2011).
- Harburger, D. S., Bouaouina, M., Calderwood, D. A. Kindlin-1 and -2 directly bind the C-terminal region of beta integrin cytoplasmic tails and exert integrin-specific activation effects. J. Biol. Chem. 284, 11485-11497 (2009).
- Tadokoro, S., et al. Talin binding to integrin beta tails: a final common step in integrin activation. Science. 302, 103-106 (2003).
- Garcia-Alvarez, , et al. Structural determinants of integrin recognition by talin. Mol. Cell. 11, 49-58 (2003).
- Perera, H. D., Ma, Y. Q., Yang, J., Hirbawi, J., Plow, E. F., Qin, J. Membrane binding of the N-terminal ubiquitin-like domain of kindlin-2 is crucial for its regulation of integrin activation. Structure. 19, 1664-1671 (2011).
- Ussar, S., Wang, H. V., Linder, S., Fassler, R., Moser, M. The Kindlins: subcellular localization and expression during murine development. Exp. Cell Res. 312, 3142-3151 (2006).
- Bialkowska, K., et al. The integrin co-activator Kindlin-3 is expressed and functional in a non-hematopoietic cell, the endothelial cell. J. Biol. Chem. 285, 18640-18649 (2010).
- Moser, M., Nieswandt, B., Ussar, S., Pozgajova, M., Fassler, R. Kindlin-3 is essential for integrin activation and platelet aggregation. Nat. Med. 14, 325-330 (2008).
- Lefort, C. T., et al. Distinct roles for talin-1 and kindlin-3 in LFA-1 extension and affinity regulation. Blood. 119, 4275-4282 (2012).
- Moser, M., et al. Kindlin-3 is required for beta2 integrin-mediated leukocyte adhesion to endothelial cells. Nat. Med. 15, 300-305 (2009).
- Schmidt, S., Nakchbandi, I., Ruppert, R., Kawelke, N., Hess, M. W., Pfaller, K., Jurdic, P., Fassler, R., Moser, M. Kindlin-3-mediated signaling from multiple integrin classes is required for osteoclast-mediated bone resorption. J. Cell Biol. 192, 883-897 (2011).
- Malinin, N. L., et al. A point mutation in KINDLIN3 ablates activation of three integrin subfamilies in humans. Nat. Med. 15, 313-318 (2009).
- Svensson, L., et al. Leukocyte adhesion deficiency-III is caused by mutations in KINDLIN3 affecting integrin activation. Nat. Med. 15, 306-312 (2009).
- Liu, Y., Zhu, Y., Ye, S., Zhang, R. Crystal structure of kindlin-2 PH domain reveals a conformational transition for its membrane anchoring and regulation of integrin activation. Protein Cell. 3, 434-440 (2013).
- Liu, J., et al. Structural basis of phosphoinositide binding to kindlin-2 protein pleckstrin homology domain in regulating integrin activation. J. Biol. Chem. 286, 43334-43342 (2011).
- Zhao, Y., Chapman, D. A., Jones, I. M. Improving baculovirus recombination. Nucleic Acids Res. 31, (2003).
- Berrow, N. S., et al. A versatile ligation-independent cloning method suitable for high-throughput expression screening applications. Nucleic Acids Res. 35, 45 (2007).
- Nettleship, J. E., Assenberg, R., Diprose, J. M., Rahman-Huq, N., Owens, R. J. Recent advances in the production of proteins in insect and mammalian cells for structural biology. J Struct. Biol. 172, 55-65 .
- Wasilko, D. J., et al. The titerless infected-cells preservation and scale-up (TIPS) method for large-scale production of NO-sensitive human soluble guanylate cyclase (sGC) from insect cells infected with recombinant baculovirus. Protein Expr. Purif. 65, 122-132 (2009).
- Yates, L. A., Fleurdépine, S., Rissland, O. S., De Colibus, L., Harlos, K., Norbury, C. J., Gilbert, R. J. Structural Basis for the activity of a cytoplasmic RNA terminal uridylyl transferase. Nat. Struct. Mol. Biol. 19, 782-787 (2012).
- Sainsbury, S., Ren, J., Saunders, N. J., Stuart, D. I., Owens, R. J. Crystallization and preliminary X-ray analysis of CrgA, a LysR-type transcriptional regulator from pathogenic Neisseria meningitidis MC58. Acta Crystallogr. Sect. F. Struct. Biol. Cryst. Commun. 64, 797-801 (2008).
- Zhao, Y., et al. Regulation of cell adhesion and migration by Kindlin-3 cleavage by calpain. J. Biol. Chem. 287, 40012-40020 .
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены