Method Article
Всего экстракции белка и 2-D электрофореза в геле Методы
В этой статье
Резюме
Члены рода Burkholderia являются возбудителями клиническое значение. Мы опишем метод для общего бактериального извлечения белка, с использованием механического разрушения и гель-электрофореза 2-D для последующего протеомного анализа.
Аннотация
Исследование внутриклеточных уровней белка из бактериальных видов имеет важное значение для понимания патогенетические механизмы заболеваний, вызванных этими микроорганизмами. Здесь мы опишем процедуру для извлечения белка из видов Burkholderia на основе механического лизиса с использованием стеклянных шариков в присутствии этилендиаминтетрауксусной кислоты и фенилметилсульфонилфторидом в забуференном фосфатом физиологическом растворе. Этот метод может быть использован для различных видов Burkholderia, для различных условий роста, и вполне вероятно, пригодны для использования в протеомических исследований других бактерий. После экстракции белка, двумерный (2-D) гель-электрофорез протеомный методика описана для изучения глобальных изменений в протеомов этих организмов. Этот метод состоит в разделении белков в соответствии с их изоэлектрической точке методом изоэлектрофокусировки в первом измерении с последующим разделением на основе молекулярной массыгель-электрофорезом акриламида во втором измерении. Визуализация белков, разделенных осуществляется путем окрашивания серебром.
Введение
Род Burkholderia содержит более 62 видов, грамотрицательных организмов, выделенные из широкого спектра ниши, и он разделен на две основные группы 1,2. Первый кластер включает в себя людей, животных и фитотрофных организмов, и большинство исследований были сосредоточены на патогенные видов этой группы в связи с их клиническое значение. Наиболее патогенные члены Б. pseudomallei и В. mallei (который вызывает Melioidosis и сапа соответственно) 3,4 и условно-патогенных микроорганизмов (в 17 определенных видов cepacia комплекса Burkholderia, BCC) 5, которые вызывают заболевания у Муковисцидоз (МВ) и ХГБ (КГД) 1. Второй кластер, с более чем 30 непатогенных видов, включает в себя бактерии, связанные с растениями или с окружающей средой, и считаются потенциально выгоден для хозяина 2.
Многочисленные осложнения возникают фром бактериальной инфекции с патогенными членов рода Burkholderia, таких как передача возбудителя между пациентами, распространением болезни и неудачи лечения из-за внутренней или приобретенной устойчивости к антибиотикам, делающих трудно искоренить в большинстве случаев 6-9. Поэтому, приобретая более ясное понимание основы для установления бактериальной инфекции является жизненно важным для лечения заболеваний, вызванных этими организмами. Для того чтобы получить представление о создании инфекции, обширные исследования по бактериальных компонентов, связанных с патогенезом необходимы. Исследования, посвященные протеомного анализа Burkholderia организмов с помощью протеомных подходов описаны белки, которые были вовлечены в бактериальной патогенеза, а также изменения в их протеома профилей 10-16.
Методы экстракции белка с использованием ультразвука и сублимационной талой циклов в буфере для лизиса, содержащего высокую концentration мочевины, тиомочевины в сочетании с моющим средством и амфолитов был применен в Burkholderia протеомных исследований 10-13. Хотя мочевина является достаточно эффективным для денатурации белка, он может установить равновесие в водном растворе с изоцианатом аммония, которые могут реагировать с аминогруппами кислота, образуя тем самым артефакты (карбамоилирование реакция) 17. Поэтому рекомендуется включать носителей амфолитов, которые действуют как цианатных мусорщиков и избежать температур выше 37 ° С 17. Кроме того, чтобы предотвратить любую химическую вмешательства лизирующего буфера с белком количественного, так же буфере для лизиса может быть использован для создания стандартной кривой так, что образцы и стандарты имеют одинаковую фона 10. Другие методологии предусматривают использование щелочных буферов и моющих средств с тепловыми инкубационного периода 17,18, однако эти условия могут вызвать изменения в протеома и некоторые моющие средства не совместимы с пр.oteomics приложение, если последующие шаги по удалению моющего средства не включены 17,18.
После надлежащей экстракции и количественное, глобальное экспрессии белка каждого отдельного белка могут быть изучены с помощью протеомических подходов, таких как гель-электрофореза двумерной (2-D). Этот метод был впервые описан O'Farell 19 и состоит в разделении белков в соответствии с их изоэлектрической точке методом изоэлектрофокусировки в первом измерении, а затем в соответствии с их молекулярной массы акриламида гель-электрофореза во втором измерении. Благодаря своей разрешением и чувствительностью, этот метод является мощным инструментом для анализа и выявления белков из сложных биологических источников 19,20. Этот метод разделения в настоящее время доступна в белково-ориентированных подходов с большим преимуществом разрешения изоформы белка, вызванные посттранскрипционных модификаций или протеолитической обработки. Количественные изменениямогут быть обнаружены путем сравнения интенсивности соответствующего месте после окрашивания геля 20. Однако этот способ не подходит для идентификации очень больших белков, мембранных белков, крайне основных и кислотных или гидрофобных белков, и несколько трудоемкий и требует много времени техника 20. Новые пептидные ориентированные подходы (не гель на основе), которые являются более прочными и цель становятся доступными и могут быть использованы для количественного сравнения по дифференциальных методов стабильных изотопов маркировки, таких как цистеин маркировки с помощью изотопов кодированием сродством мечения (ICAT) 21 и аминогруппы маркировка изотопом тегов для относительной и абсолютной количественного (iTRAQ) 22. Использование одного протеомики техники может дать достаточной информации, поэтому использование двух дополнительных протеомических подходов является необходимым для большинства полностью оценки изменений в протеоме. Тем не менее, гель-электрофорез 2-D широко используется и может быть обычно применяется для квантовойвенных экспрессию нескольких белков в разных организмов.
Здесь мы опишем экстрагирования белка цельноклеточная и 2-D процедуры гель-электрофореза для видов Burkholderia, которые были адаптированы и оптимизированы от GE Healthcare 2-D электрофореза Принципы и методы Руководство 80-6429-60AC 2004 ( www.amershambiosciences.com ). Экстракцию белка проводили с использованием шарик било со стеклянными шариками в присутствии PBS, содержащего 5 мМ ЭДТА (этилендиаминтетрауксусной кислоты) и 1 мМ ФМСФ (фенилметилсульфонилфторид). Эта процедура позволяет количественно оценить белков с минимальными искажениями и исправимо для протеомных подходов как сообщалось ранее 15,23,24. Гель-электрофорез 2-D проводили с использованием 24 см в длину, иммобилизованных рН 4-7 градиента и белки были разделены в соответствии с их изоэлектрической точке. Затем белки были разделены в соответствии с их Molecулар вес на SDS-полиакриламидном геле. Кроме того, мы описали метод окраски серебром для визуализации спот белков, и серебряным методом окраски, совместимый для масс-спектрометрического анализа. Вместе эти процедуры могут позволить идентификацию важных белков из видов Burkholderia, которые могут быть вовлечены в патогенез.
протокол
1. Рост культуры (Дни 1 +2)
- Вырастить закваски: 3 мл Лурия Bertani (LB) бульона в оснастку лучших 15 мл трубки, при 37 ° С ротатора в одночасье. Развести ночной рост к OD 600 0,6. Добавить 1 мл этого раствора до 100 мл LB бульона в колбе Эрленмейера на 250 мл. Инкубировать при 37 ° С с перемешиванием при 250 оборотах в минуту в течение 16 часов в стационарной фазе (SP), чтобы лучше приблизительный, в периодической культуре, условия инфекции и гарантировать, что бактериальные факторы вирулентности под контролем стационарных факторов фаза сигналов, таких как RPOS и кворума зондирования, выражаются. Кроме того, бактерии, выращенные в начале или в середине SP-или поздней логарифмической фазы могут быть использованы для получения информации о бактериальной фазы адаптации.
- После 16 часов измерить OD 600 и обеспечить культура достигла SP по сравнению с ранее построенной кривой роста в одинаковых условиях.
2. Белок Добыча (День 3)
- Холод все средства массовой информации и решения заранее холодильник на ночь. Все шаги должны осуществляться с трубками в ведерке со льдом. Prechill микроцентрифуге и Beckman Coulter High Performance центрифугу (или эквивалент) до 4 ° С и ротор (ротор внутри = JA-20, центрифуге = J2-HS).
- Подготовка свежий 0,1 М фенилметансульфонилфторида (PMSF, 174,19 г / моль) раствора в ацетоне растворением 0,0174 г (PMSF "ВНИМАНИЕ" PMSF является токсичным и коррозию, использовать защитные маски и перчатки) в 1 мл ацетона ("ВНИМАНИЕ 'ацетон токсичных и горючих, использовать защитные маски и перчатки).
- Приготовить PBS / EDTA / ФМСФ решение: 0,1 мл 0,1 M PMSF, 0,1 мл 0,5 М ЭДТА, и 9,8 мл PBS. Проверьте ОП ч культуры 16 примерно, где он должен находиться в SP.
- Возьмите 35 мл бактериальной культуры и передачи на Oakridge трубки центрифуги и центрифуги культуры на 4500 × г в течение 20 мин при 4 ° С.
- Удалить супернатант в контейнер для отходов идобавить 35 мл охлажденного PBS и ресуспендируют осадок. Центрифуга снова в 4500 х г в течение 20 мин при 4 ° С.
- Удалить супернатант и ресуспендируют в 1 мл холодного PBS. Переезд в стерильной 2 мл Eppendorf и центрифуги 1 мин на высоко в микроцентрифуге при 14000 × г при 4 ° С. Снимите и выбросьте супернатант.
- Добавить 1 мл PBS / ЭДТА / ФМСФ решения, ресуспендируют осадок и передача до 2 мл с завинчивающейся пробкой трубку (с уплотнительным кольцом), содержащий ~ 0,5 мл стеклянных шариков (presterilized). Добавьте ресуспендировали осадок в пробирке, содержащей стекл нные шарики и шарик колотить их при 4 ° С в течение 1 мин в холодной комнате. Делайте это в 3 раза, положив образец на льду после каждого Баш.
- Центрифуге при 14000 х г в течение 1 мин в микроцентрифуге. Удалить супернатант и положил его в стерильном 5 мл полистирола трубки.
- Для увеличения выхода добавить 1 мл PBS / EDTA / ФМСФ решение для одной пробирке содержать стеклянные бусы снова. Шарик удар трубка при 4 ° С в течение 1 мин. Сделайте это 2x положить образец на льду афтер Баш. Центрифуга при 14000 х г в течение одной минуты в центрифуге и удалить супернатант и добавить к надосадочной жидкости с этапа 2.8. С помощью шприца емкостью 1 мл и 0,20 мкм фильтр супернатант из полистирола трубки к новой стерильной 2 мл пробирку Эппендорфа.
- На данный момент образцы должны быть проанализированы на количество белка, используя Пирс MicroBCA белка набора для экстракции и аликвоты 200 мкг должны быть заморожены при температуре -80 ° С, пока не потребуется.
3. Подготовка образцов (День 4)
- Подготовка 25 мл исходного раствора регидратации (8 М мочевины, 2% CHAPS, 2% IPG Буфер, 0,002% бромфеноловый синий) и хранить в 2,5 мл аликвотах при -20 ° С. Добавить 7 мг дитиотреитола (DTT, 154,2 г / моль) непосредственно перед использованием к 2,5 мл аликвоты исходного раствора регидратации.
- Процесс разморозить образцы, начиная с шага 2,10 с использованием 2-D набор для дезактивации с окончательным ресуспендированием в 450 мкл регидратации маточного раствора, полученного на стадии 3.1.
4. Первый-Размер Изоэлектрическое фокусировки (МЭФ) (День 4)
Все шаги в этом разделе используете Ettan IGPhor IEF системы.
- Настройте IPG первое измерение полосы: чистые держатели полосы с очистки полосы раствора, а затем вымыть с Milli-Q воды, оставить с ног на голову, чтобы высохнуть. Связать каждый образец к гель полосы числа держателя.
- Загрузите образец из регидратации шаг во втором широкой области от (-) конец. Используйте чистые щипцы, чтобы вытащить гелевые полоски из упаковки. Выньте защитный слой с гелевых полосок. Линия полоски шероховатой стороной вниз в медленном, скользящим движением, чтобы получить полоски мокрые пути от (-) конец (+) конец.
- Положите влажную промокательную бумагу с стерилизованной воды на вершине электрода и под полосками геля для предотвращения выгорания. Промыть пинцет в-между раундами с очищенной водой и этанолом. Удалите все пузыри, накладывать тонким слоем минерального масла, чтобы предотвратить сухие аутов. Линия держателей полосы геля на машине.
- Запуск 12 ч при 20 ° С в течение rehydРацион, 1 час при 200 В, 1 час при 500 В, 1 час при 1000 В, 0,5 ч при 4000 В, 12 ч при 8000 В, 24 часа в сутки держать при 300 V и могут быть вывезены в это время.
- После МЭФ закончен, рекомендуется выполнить второй размерности электрофореза в SDS-полиакриламидном геле, если полоса IPG не были заморожены при температуре -80 ° С в Саран Wrap, покрытой минеральным маслом для последующего анализа. Кроме того, во избежание точку полос в связи с выходом DTT можно включать в себя второй этап уравновешивания IPG полосы до второго измерения с буфер, содержащий иодацетамид.
5. Второй аспект-SDS-электрофореза в полиакриламидном геле (день 5)
Все шаги в этом разделе с помощью электрофореза аппарат Ettan DALTsix.
- Чтобы собрать гель заклинателя аппарат, тщательно очистите все компоненты и убедиться, что гель заклинатель уровень и серый резиновый связывания смазывается силиконовым гелем. Положите черный рубBER треугольную пробку на дне. Затем поочередно место разделитель и стеклянные пластины с более коротким пластины стекла Облицовка фасада. Убедитесь, что сепараторы находятся на задней и передней. Заполните оставшееся место с наполнителями (около 5 листов) так, чтобы верхняя плоская. Поместите переднюю панель на с красным наконечником на внешней стороне. Использование зажимы затянуть каждую сторону и затянуть нижний винты.
- Подготовка геля: Добавить 297,3 мл Duracryl, ('ВНИМАНИЕ' Duracryl токсичен использование лицевые щитки и перчатки), 147 мл Трис-буфер 1,5 М рН 8,8, и 143,3 мл Milli-Q воды в колбу с вакуумными наконечник, содержащий мешалку. Положите крышку сверху и перемешать раствор с умеренной скоростью с вакуумом на в течение 20 мин. Вакуум используется для дегазации решение. Выполняет свежее 10% раствора персульфата аммония (APS, 218,8 г / моль): 0,2 г APS к 2 мл Milli-Q воды.
- Добавление смеси гель в геле МНЛЗ: Когда вакуум делается добавить 6 мл 10% додецилсульфата натрия (SDS, 228,38 г / моль)в сторону колбы, чтобы не подвергать более шариков в растворе. Добавить APS, перемешать, добавить 0,25 мл N, N, N ', N'-тетраметилэтилендиамина (TEMED, 116.20 г / моль) (' ВНИМАНИЕ 'TEMED легко воспламеняется использование лицевые щитки и перчатки) и перемешать.
- Налейте смесь в гель гель разливки через воронку, вставленной в задней части аппарата. Налейте до дюйма ниже короткой пластины. Добавить 1,5 мл насыщенного водой бутанола к верхней части геля и обернуть сверху с Саран обертывание чтобы избежать обезвоживания. Подождите в течение 1 часа для обеспечения полного полимеризации.
- Проверка гель: Когда гель делается (проверить колбу), разбирать гель заклинателя на раковину. Проверьте целостность гель во время промывания стеклянные пластины с теплой водой; не допускайте попадания воды в тарелку. Вылейте бутанол и промойте поверхность геля дважды водой, чтобы избавиться от бутанола. Заполните верхнюю часть с водой снова и пусть сидят, если гели не используются сразу же.
- Подготовка полосы: Приготовьте раствор уравновешивающим буфером отморозильник (6 М мочевины, 75 мМ Трис-HCl рН 8,8, 29,9% SDS, 0,002% бромфеноловый синий). Это может быть preprepared и хранится в 10 мл аликвотах при -20 ° С. Растворить 0,1 г DTT в 10 мл уравновешивающего буфера раствора. Один трубка может быть использован в течение двух полосок IPG. Поместите гели полосы лицевой стороной вниз на буфера и оставьте на 30 мин. Помните, какой конец есть что.
- Подготовка блок электрофореза (2-D) разделение аппарата: Добавить 4,5 л 1х буфер для электрофореза (25 мМ Трис-основание [121,1 г / моль], 192 мМ глицина [288,38 г / моль] и 0,1% вес / объем ДСН [288,38 г / моль]) к проточной бака. Этот буфер может быть использован до 3x. Поверните электрофореза устройство. Проверьте уровень воды в водяным охлаждением машины и заполнить его водой, если это низко. Включите машину на, пресс-режиме, чтобы проверить обозначенную температуру, которая должна быть 10 ° С.
- Сделать 1 л 2x работает буфера и 1 л 1x ведения буфер и хранить их при температуре 4 ° C. Сделать агарозы герметизации решение: вес 0,25 г agarosе и растворяют в 50 мл 1х работает буфера. Пульс на 15 сек каждый.
- Настройка устройства электрофореза: Используйте пинцет, чтобы вывезти каждую полоску и удалить избыток буфера с обеих сторон чистым бумажным полотенцем. НЕ прикасайтесь к полоски. Выливают в воду в верхней части геля и выравнивают верхнюю гель с 1х работает буфера. Используйте чистые пинцет и поместите полоски на верхней части длинной пластины, с боковой гель обращена к Вам. Добавить 1x буфер для полос для смазки его. Слайд полосы дальше с использованием пластиковых полосок. Удалить все пузырьки между полосой и геля.
- Добавить в агарозном герметизации раствор в верхней части полосы, чтобы запечатать его. Повторите для остальной части полос. Поместите стеклянные пластины, содержащие гели в гель колыбели и ниже в бак геля. Убедитесь, что уровень буфера 1x во внешней камере находится на указанном нижней строке перед вводом в верхнюю камеру.
- Поместите рамку для верхней палаты буфера поверх стеклянных пластин и убедиться, что он все вау вниз, нажав на дно вниз. Используйте воронку и добавьте работает буфер 2x в верхнюю камеру до средней линии. С помощью воронки и добавить 1x рабочего буфера в наружной камере, пока он не достигнет верхней линии. Поместите крышку сверху и включить устройство электрофореза и блока питания.
- Запустите в течение ночи при 52 V, 96 мА, 5 Вт Проверьте, если текущий собирается, глядя на пузыри на серебряной проволоки в верхней. Запустите гель, пока ведущий линия в 1 см от дна.
- Белки также могут быть проанализированы с использованием оборудования и реагентов от других компаний, таких Biorad или Hoefer, в соответствии с инструкциями производителя.
6. Серебро Окрашивание гелей для гель визуализации (День 5-6)
- Подготовьте решение Fix 1 (800 мл этанола, 200 мл уксусной кислоты и 1000 мл Milli-Q воды в вытяжной шкаф в пластиковое ведро). Решение это хорошо для 6 гелей. Включите все машины с и вывезти весь средней части блока электрофореза и пубудем его в раковину. И дело даже белый стенд в раковине. Вытяните верхний лоток, содержащий 2x бега буфер.
- Разберите аппарат и удалить гели из стеклянных пластин в решение Fix 1. Гели могут быть идентифицированы, отрезав углы, когда они будут удалены из стеклянных пластин, число углов сократить соответствующий того гель в разливки.
- Поместите контейнер с раствором исправить и гелей на рокера, по крайней мере 1 час, чтобы в течение ночи при 4 ° С.
- Передача гели исправить Решение 2 (20 мл 50% глутаральдегида, 600 мл этанола, 5 г тетратионата калия (302,46 г / моль), 136 г ацетата натрия (82,03 г / моль), и Milli-Q воды до 2000 мл) и место на качалку в течение 1 часа.
- Вымойте гели 4x в течение 15 мин каждого в Milli-Q воды.
- Пятно гели в раствором нитрата серебра (4 г нитрата серебра (169,87 г / моль), 500 мкл формальдегида и Milli-Q воды до 2000 мл) в течение 30 мин или до 48 часов.
- Вымойте гель для 1мин в Milli-Q воды.
- Передача не разработчику раствора (60 г карбоната натрия (105,99 г / моль), 300 мкл формальдегида, 15 мг тиосульфата натрия (158,11 г / моль) и Milli-Q воды до 2000 мл) в течение 5-30 мин, пока Гель окрашивают.
- Поместите гели в стоп-раствора (100 г Трис-основание (121,14 г / моль), 40 мл уксусной кислоты и Milli-Q воды до 2000 мл) в течение 10 мин.
- Для хранения, передачи гели в растворе глицерина (40 мл глицерина или 400 мл, если длительного хранения желательно, и 1600 мл Milli-Q воды) в течение 10 мин, а затем высушить их с помощью гель сушилка.
- Гели могут быть визуализированы после окрашивания с использованием системы визуализации, таких как сканер / денситометра, сфотографированного с использованием световой просвечивания или гель формирования изображения. Анализ изображений программное обеспечение, такое как PDQuest 2-D анализа от BioRad затем могут быть использованы для получения количественной и качественной информации от белков в образце.
7. Гель Серебряный Окрашивание для анализа масс-спектрометрии
- Закрепить гели в 50% метанола и 5% уксусной кислоты в течение 1 часа.
- Стирать в 50% метанола в течение не менее 10 мин до ночи.
- Промыть в дистиллированной водой 3 раза в течение 10 мин.
- Позволяют с 0,02% тиосульфата натрия (158,11 г / моль) 2x в течение 15 мин.
- Wash 3x в охлажденном дистиллированной воды 3 раза в течение 10 мин.
- Submerge гель в охлажденном 1% раствором нитрата серебра (169,87 г / моль) в течение по крайней мере 20 минут до 1 часа при 4 ° С
- Wash 2x в течение 1 мин с дистиллированной водой. Изменение лотка / ведро.
- Разработать в 0,04% формальдегида в 2% безводного карбоната натрия (105.99 г / моль) и отбросить, когда он становится желтым довольно быстро; имеют три партии и быть готовым изменить каждые 5 минут.
- Промыть в 5% уксусной кислоты затем хранить в 1% уксусной кислоты.
- Промыть 1,5 мл ампулах Эппендорфа (держать получить место вырезов) с USP класса этанола и сушка воздухом в перед использованием.
- Чистые щипцы, бритвенные лезвия и поверхности с 100%-ным метанолом.
- Спрей перчатки и поверхностей с этанолом.
- Акцизные пятна в капюшоном потока или чистой зоне воздуха. Пятна могут быть также вырезали с использованием автоматического резака пятна.
- Поместите их в пробирки Эппендорф и корабля на льду или держать в холодильнике.
Результаты
Сравнительный анализ белковых профилей, извлеченных из той же бактериальной культуры в двух различных случаях показали аналогичные модели полос указывает успешных белковые экстракции. Молекулярные белки вес извлеченные колебалась от 10-150 кДа. На рисунке 1 показана представительство Кумасси синий окрашивания гель белковых цельноклеточная извлечений из Burkholderia multivorans (член КСТР) клинических изолятов, выращенные в LB или Дрожжи / маннит (Ем) бульона и собирают из стационарной фазы.
Для 2-D анализа гель-электрофореза, 200 мкг общего белка из Burkholderia pseudomallei был использован (рис. 2). Поскольку этот возбудитель признается в качестве B-типа биологического оружия агента Центрами США по контролю и профилактике заболеваний 25, процедуры подготовки белковые проводились в Био Уровень безопасности 3 сдерживания лаборатории и, соответственно, со стандартными процедурами работы.Белки ресуспендировали в растворе регидратации и наносили на 24 см в длину, иммобилизованных рН 4-7 градиент и белки были разделены в соответствии с их изоэлектрической точки (PI). Затем полосы были размещены на SDS-полиакриламидном геле и белков были разделены в соответствии с их молекулярной массы (Mw). Впоследствии гель окрашивали серебром для точечной визуализации белка. Результаты показали, обилие более 500 точек белка, которые могут быть индивидуально идентифицированных методом масс-спектрометрии.
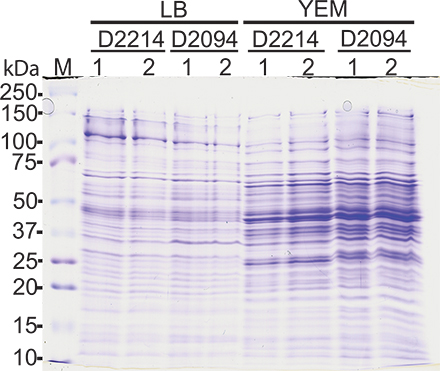
Рисунок 1. Общий белок профили Burkholderia multivorans изолятов. Анализ SDS-ПААГ белка, экстрагированного в стационарной фазе от D-2214 и D-2094 изолятов выращивают в LB или дрожжей / маннит (Ем) бульона в двух различных случаях (1 и 2). 4 мкг белка были загружены в каждой полосой 12,5% геля и окрашивали Wiй Кумасси синий. Лейн М, маркерный белок.

Рисунок 2. 2-D гель-электрофорез анализ Burkholderia pseudomallei 1234B изолировать. Представительство серебряную окрашенных 2-D гель демонстрационный разделение белка в изоэлектрической 4-7-диапазона полосы. Белковые Всего-клеточные экстракты (200 мкг) в стационарной фазе использовались и разделяли на 15% SDS-PAGE гель.
Обсуждение
Способ получения белков было описано, что можно извлечь большинство Burkholderia белков с хорошей воспроизводимостью. Это продемонстрировано получение такой же профиль белка из двух независимых препаратов, выполненных в разные дни, используя тот же бактериальной культуры, выращенные в LB бульоне или Ем, как показано на рисунке 1. Добыча была эффективной для бактерий, выращенных в жидкой среде, однако, мы не проверяли этот метод для бактерий, выращенных на пластинах. Этот метод был также использован для дальнейшей характеристики белка с помощью протеомных инструменты; наша группа успешно изучали изменения протеома использованием гель-электрофореза 2-D и изотопный тегов для относительной и абсолютной количественного (iTRAQ) протеомные методы 15,23,24. Что касается последнего, белки экстрагировали в буфере, содержащем 0,5 М ЭДТА в PBS, чтобы избежать интерференции с PMSF экспериментов iTRAQ 15.
Важно бэрковчег, что во время процесса экстракции белка и гель-электрофореза 2-D, все шаги должны быть выполнены при 4 ° С или в холодных условиях с использованием ведра со льдом, чтобы минимизировать деградацию белков, а также использовать подключены подсказки и носить нитриловые перчатки и охватывают все кожи, чтобы предотвратить кератина загрязнения любых пятен вырезал для последующей идентификации методом масс-спектрометрии. При выполнении белковые экстракции, важно также учитывать, что ФМСФ остается времени полураспада в водных растворах, в зависимости от производителя, поэтому 0,1 мМ исходный раствор в ацетоне следует непосредственно перед использованием. Кроме того, другие ингибиторы серин или ингибиторы протеазы, которые более растворимы и стабильны и менее токсичны, могут быть использованы, хотя мы не тестировали их в наших экспериментах.
Буфер для лизиса используются в этой процедуре не содержит мочевину, что очень важно для растворения, чтобы извлечь как водные (цитозольные) белков и меньше растворимого протEins, в том числе некоторых мембранных белков 17. Но, во время подготовки проб для первого размерности изоэлектрофокусировки (шаг 3 этого протокола), образцы ресуспендировали в регидратации буфер, который содержит мочевину. Другие протеомные методы также включать подобную обработку 26. Перед выполнением с стадии регидратации, кажется, что удаление мешающих материалов или низкомолекулярных примесей имеет решающее значение за большой размер, мы рекомендуем использовать 2-D очистка Kit в каждом белковых образцов, как результаты улучшились. Ранее загрузки образцов для разделения фокусировки первого измерение изоэлектрической, убедитесь, что подготовленные полосы промокательной бумаги нужного размера из держателей полосы, как это проблематично, чтобы сократить правильный размер в асептической моды на месте (для шага 3.4 это протокол).
Перед запуском гель-электрофореза в SDS-полиакриламидном 2-D, необходимо обеспечить, чтобы доля гель подходит ожидаемые размеры интереса (120,5% процент гель может решить белок в диапазоне 14-100 кДа). После электрофореза гель второе измерение будет завершено, визуализация белков может быть достигнуто путем Кумасси синим или окрашиванием серебром, последний окрашивание является более чувствительным с пределом обнаружения составляет всего лишь 0,1 нг / белок / 20 месте. Белковые пятна визуализированы с окрашиванием серебром пригодны для дальнейшего анализа методом масс-спектрометрии. Однако, важно отметить, что раствор серебра пятно не должны содержать глутаральдегид, так как это агент сшивки с белками, поэтому он не совместим с последующим анализом масс-спектрометрии 20. Кроме того, для выявления и количественной разному экспрессируются белки, другой подход гель на основе, например, двумерной-разница в гель-электрофореза (2D-ПГЛП) совместно с автоматизированного программного обеспечения могут быть использованы. Этот подход использует различные флуоресцентные метки (например, 2 Сая 3, 5 и), которые используются для образцов этикеток и универсального внутреннего стандарта пр.восходят второй аспект электрофореза преодоления, в некоторой степени, недостатки вариации и воспроизводимости 2-D электрофореза 27. Кроме того, гели могут быть окрашены после второго измерения с SyproRuby, что металлоорганическое рутений хелат предназначен для пятно протеомических приложений. Он может обнаружить белковые пятна с подобной чувствительностью к этому окрашиванием серебром, но с большей чувствительностью, чем Кумасси синим. После окрашивания гели могут сфотографироваться с лазерным сканером или трансиллюминаторе 28.
В заключение, это видео описывает бактериальную процедуры экстракции белка целой клетки и 2-D метод гель-электрофореза, которая может позволить изучение глобальных изменений в протеома в видов Burkholderia.
Раскрытие информации
Авторы заявляют, что они не имеют конкурирующие финансовые интересы.
Благодарности
Эта работа была поддержана студенчества из Университета Британской Колумбии (к BV) и грантов от муковисцидоза Канада и Канадского института исследований в области здравоохранения (ДПС). Мы благодарим Жаклин Chung для первоначальной подготовки протоколов.
Материалы
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Phenylmethanesulfonyl fluoride (PMSF) | Sigma | P7626 | Toxic, corrosive |
| Acetone | Fisher | A18-1 | Flammable |
| PBS Buffer | Bioscience | R028 | |
| Ethylenediaminetetraacetic acid (EDTA) | Fisher | BP118-500 | toxic |
| Glass beads (0.1 mm) | BioSpec Products | 11079101 | |
| Nalgene Oak Ridge Centrifuge tubes, polycarbonate (50 ml) | VWR | 21009-342 | |
| MicroBCA protein extraction kit | Pierce | 23235 | |
| Microcentrifuge Tubes 2.0 ml conical Screw cap Tubes with Cap and O-Ring | Fisher | 02-681-375 | |
| 2-D Clean-Up kit | GE Healthcare | 80-6484-51 | |
| Urea | Invitrogen | 15505-050 | Irritant |
| CHAPS | Amersham Biosciences | 17-1314-01 | |
| Dithiothreitol (DTT) | MPBiomedical, LCC | 856126 | Irritant |
| Immobiline DryStrips pH 4-7 24 cm | Amersham Biosciences | 176002-46 | |
| Duracryl | Proteomic Solutions | 80-0148 | Very toxic, carcinogen |
| Ammonium persulfate | Fisher | BP179-100 | Flammable, toxic, corrosive |
| N,N,N’,N’-tetramethylethylenediamine (TEMED) | Invitrogen | 15524-010 | Flammable |
| Sodium dodecyl sulfate (SDS) | Fisher | BP166-500 | Acute toxicity, flammable |
| Agarose | Invitrogen | 15510-027 | |
| Ethanol | Fisher | HC1100-1GL | Flammable, toxic |
| Acetic acid | Fisher | A491-212 | Flammable, corrosive |
| Glutaraldehyde | Fisher | G151-1 | Very toxic, corrosive, dangerous for the environment |
| Potassium tetrathionate | Sigma | P2926 | Irritant |
| Sodium acetate | EM Science | 7510 | |
| Silver nitrate | Sigma | 209139 | Corrosive, dangerous for the environment |
| Formaldehyde | Sigma | 252549 | Toxic |
| Sodium thiosulfate | Sigma | S7026 | |
| Tris Base | EMD | 9230 | |
| Glycine | MPBiomedical, LCC | 808831 | |
| Glycerol | MPBiomedical, LCC | 800688 | |
| Methanol | Fisher | A412-4 | Flammable, toxic, health hazard |
| Sodium carbonate anhydrous | EMD | SX0400-3 | Toxic |
| Mineral oil | ACROS | 415080010 | |
| Equipment | |||
| JA-20 ultracentrifuge rotor | Beckman Coulter | 334831 | |
| Mini Beadbeater | Biospec Products | 3110BX | |
| Ettan IPGphor II Isoelectric Focusing System and accessories | GE Healthcare | 80-6505-03 | www.amershambiosciences.com |
| Ettan DALT Large Vertical electrophoresis system | GE Healthcare | 80-6485-27 | www.amershambiosciences.com |
Ссылки
- Drevinek, P., Mahenthiralingam, E. Burkholderia cenocepacia in cystic fibrosis: epidemiology and molecular mechanisms of virulence. Clin. Microbiol. Infect. 16, 821-830 (2010).
- Suarez-Moreno, Z. R., et al. Common Features of Environmental and Potentially Beneficial Plant-Associated Burkholderia. Microb. Ecol. , (2011).
- Wiersinga, W. J., van der Poll, T., White, N. J., Day, N. P., Peacock, S. J. Melioidosis: insights into the pathogenicity of Burkholderia pseudomallei. Nat. Rev. Microbiol. 4, 272-282 (2006).
- White, N. J. Melioidosis. Lancet. 361, 1715-1722 (2003).
- Mahenthiralingam, E., Urban, T. A., Goldberg, J. B. The multifarious, multireplicon Burkholderia cepacia complex. Nat. Rev. Microbiol. 3, 144-156 (2005).
- Speert, D. P., Henry, D., Vandamme, P., Corey, M., Mahenthiralingam, E. Epidemiology of Burkholderia cepacia complex in patients with cystic fibrosis. Canada. Emerg. Infect. Dis. 8, 181-187 (2002).
- Dance, D. A., Wuthiekanun, V., Chaowagul, W., White, N. J. The antimicrobial susceptibility of Pseudomonas pseudomallei. Emergence of resistance in vitro and during treatment. J. Antimicrob. Chemother. 24, 295-309 (1989).
- Thibault, F. M., Hernandez, E., Vidal, D. R., Girardet, M., Cavallo, J. D. Antibiotic susceptibility of 65 isolates of Burkholderia pseudomallei and Burkholderia mallei to 35 antimicrobial agents. J. Antimicrob. Chemother. 54, 1134-1138 (2004).
- Govan, J. R. W., et al. Evidence for transmission of Pseudomonas cepacia by social contact in cystic fibrosis. Lancet. 342, 15-19 (1993).
- Thongboonkerd, V., et al. Altered proteome in Burkholderia pseudomallei rpoE operon knockout mutant: insights into mechanisms of rpoE operon in stress tolerance, survival, and virulence. J. Proteome. Res. 6, 1334-1341 (2007).
- Park, K. H., Lipuma, J. J., Lubman, D. M. Comparative proteomic analysis of B. cenocepacia using two-dimensional liquid separations coupled with mass spectrometry. Anal Chim. Acta. 592, 91-100 (2007).
- Wongtrakoongate, P., Mongkoldhumrongkul, N., Chaijan, S., Kamchonwongpaisan, S., Tungpradabkul, S. Comparative proteomic profiles and the potential markers between Burkholderia pseudomallei and Burkholderia thailandensis. Mol. Cell Probes. 21, 81-91 (2007).
- Harding, S. V., et al. The identification of surface proteins of Burkholderia pseudomallei. Vaccine. 25, 2664-2672 (2007).
- Madeira, A., Santos, P. M., Coutinho, C. P., Pinto-de-Oliveira, A., Sa-Correia, I. Quantitative proteomics (2-D DIGE) reveals molecular strategies employed by Burkholderia cenocepacia to adapt to the airways of cystic fibrosis patients under antimicrobial therapy. Proteomics. 11, 1313-1328 (2011).
- Zlosnik, J. E. A., Speert, D. P. The Role of Mucoidy in Virulence of Bacteria from the Burkholderia cepacia Complex: A Systematic Proteomic and Transcriptomic Analysis. J. Infect. Dis. 202, 770-781 (2010).
- Riedel, K., Carranza, P., Gehrig, P., Potthast, F., Eberl, L. Towards the proteome of Burkholderia cenocepacia H111: setting up a 2-DE reference map. Proteomics. 6, 207-216 (2006).
- Weiss, W., Gorg, A. Sample solublization buffers for two-dimensional electrophoresis. Methods Mol. Biol. 424, 35-42 (2008).
- von der Haar, T. Optimized protein extraction for quantitative proteomics of yeasts. PLoS One. 2, e1078(2007).
- O'Farrell, P. H. High resolution two-dimensional electrophoresis of proteins. J. Biol. Chem. 250, 4007-4021 (1975).
- Gorg, A., Weiss, W., Dunn, M. J. Current two-dimensional electrophoresis technology for proteomics. Proteomics. 4, 3665-3685 (2004).
- Gygi, S. P., Rist, B., Griffin, T. J., Eng, J., Aebersold, R. Proteome analysis of low-abundance proteins using multidimensional chromatography and isotope-coded affinity tags. J. Proteome Res. 1, 47-54 (2002).
- Ross, P. L., et al. Multiplexed protein quantitation in Saccharomyces cerevisiae using amine-reactive isobaric tagging reagents. Mol. Cell Proteomics. 3, 1154-1169 (2004).
- Velapatiño, B., Limmathurotsakul, D., Peacock, S. J., Speert, D. P. Identification of differentially expressed proteins from Burkholderia pseudomallei isolated during primary and relapsing melioidosis. Microbes. Infect. 14, 335-340 (2012).
- Chung, J. W., Speert, D. P. Proteomic identification and characterization of bacterial factors associated with Burkholderia cenocepacia survival in a murine host. Microbiology. 153, 206-214 (2007).
- Rotz, L. D., Khan, A. S., Lillibridge, S. R., Ostroff, S. M., Hughes, J. M. Public health assessment of potential biological terrorism agents. Emerg. Infect. Dis. 8, 225-230 (2002).
- Thon, J. N., et al. Comprehensive proteomic analysis of protein changes during platelet storage requires complementary proteomic approaches. Transfusion. 48, 425-435 (2008).
- Wu, T. In New and Emerging Proteomic Techniques. Methods Mol. Biol. 328, 71-95 (2006).
- Lopez, M. F., et al. A comparison of silver stain and SYPRO Ruby Protein Gel Stain with respect to protein detection in two-dimensional gels and identification by peptide mass profiling. Electrophoresis. 21, 3673-3683 (2000).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены