Method Article
Extração de proteínas e 2-D métodos Eletroforese em Gel de
Neste Artigo
Resumo
Membros do género Burkholderia são patógenos de importância clínica. Nós descrevemos um método para extração de proteínas bacterianas, usando ruptura mecânica, e eletroforese em gel 2-D para a análise proteômica subseqüente.
Resumo
A investigação dos níveis de proteínas intracelulares de espécies de bactérias é de grande importância para a compreensão dos mecanismos patogênicos de doenças causadas por estes organismos. Aqui, descrevemos um processo para a extracção de proteínas a partir de espécies de Burkholderia baseado em lise mecânica com esferas de vidro na presença de ácido tetra-acético de etilenodiamina e de fluoreto de fenilmetilsulfonilo em tampão fosfato salino. Este método pode ser usado para diferentes espécies de Burkholderia, para diferentes condições de crescimento, e é provavelmente apropriada para a utilização em estudos de proteomas de outras bactérias. Após a extracção de proteínas, uma (2-D) técnica de eletroforese em gel de proteômica bidimensional é descrito para estudar mudanças globais nos proteomas desses organismos. Este método consiste na separação de proteínas de acordo com o seu ponto isoeléctrico, por focagem isoeléctrica na primeira dimensão, seguido de separação com base no peso molecularpor electroforese em gel de acrilamida na segunda dimensão. A visualização das proteínas separadas é realizada por coloração com prata.
Introdução
A Burkholderia gênero compreende mais de 62 espécies, Gram-negativos isolados de uma ampla variedade de nichos, e é dividido em dois blocos principais 1,2. O primeiro grupo inclui humana, animal e organismos phytotrophic, ea maioria dos estudos têm-se centrado nas espécies patogênicas deste grupo devido à sua importância clínica. Os membros mais patogênicas são B. pseudomallei e B. mallei (que causa melioidosis e mormo respectivamente) 3,4 e patógenos oportunistas (17 espécies definidas do complexo Burkholderia cepacia, BCC) 5, que causam doença na fibrose cística (FC) e doença granulomatosa crônica (CGD) 1. O segundo grupo, com mais de 30 espécies não patogênicas, incluindo bactérias associadas a plantas ou com o meio ambiente, e são consideradas como potencialmente benéfica para o host 2.
Numerosos complicações surgem frinfecção bacteriana om com os membros patogénicos do género Burkholderia, tais como a transmissão do agente patogénico entre pacientes, a propagação da doença e tratamento de falha, devido à resistência intrínseca ou adquirida aos antibióticos tornando difícil de eliminar, na maioria dos casos 6-9. Por conseguinte, obter uma compreensão mais clara da base para o estabelecimento de infecção bacteriana é vital para o tratamento de doenças causadas por estes organismos. A fim de obter informações sobre o estabelecimento da infecção, são necessárias amplas investigações sobre os componentes bacterianos associados à patogênese. Os estudos sobre a análise proteômica de organismos Burkholderia usando abordagens proteômicas descrito proteínas que têm sido implicados na patogênese bacteriana, bem como mudanças em seu proteoma perfis 10-16.
Métodos de extração de proteínas utilizando sonicação e ciclos de congelamento e descongelamento em tampão de lise contendo alta concentration de ureia, tio-ureia em combinação com um detergente e anfólitos foi aplicado em Burkholderia estudos proteomic 10-13. Embora a ureia é bastante eficaz para a desnaturação da proteína, que pode estabelecer um equilíbrio em solução aquosa, com isocianato de amónio, que podem reagir com os grupos de aminoácidos, formando assim artefactos (reacção de carbamilação) 17. Portanto, recomenda-se a incluir anfólitos transportadores, que actuam como agentes de limpeza de cianato e evitar temperaturas superiores a 37 ° C 17. Além disso, para evitar qualquer interferência química de tampão de lise com a quantificação de proteínas, o mesmo tampão de lise pode ser usado para gerar a curva padrão, de modo que as amostras e os padrões têm a mesma base 10. Outras metodologias envolvem o uso de buffers alcalinas e detergentes com períodos de incubação de calor 17,18, no entanto estas condições podem induzir alterações no proteoma e alguns detergentes não são compatíveis com o proteomics aplicação a menos que medidas de remoção de detergente subsequentes são incluídos 17,18.
Após extracção e quantificação adequada, a expressão da proteína global de cada proteína individual pode ser estudada usando abordagens tais como a proteómica bidimensional (2-D) de electroforese em gel. Esta técnica foi descrita pela primeira vez por O'Farell 19 e consiste na separação de proteínas de acordo com o seu ponto isoeléctrico, por focagem isoeléctrica na primeira dimensão, e em seguida, de acordo com o seu peso molecular por electroforese em gel de acrilamida na segunda dimensão. Devido à sua resolução e sensibilidade, esta técnica é uma ferramenta poderosa para a análise e detecção de proteínas de fontes biológicas complexas 19,20. Esta técnica de separação está atualmente disponível em abordagens de proteína-centric com a grande vantagem de resolver isoformas da proteína causadas por modificações pós-transcricional ou processamento proteolítico. Alterações quantitativaspode ser detectada através da comparação da intensidade da mancha correspondente após a coloração do gel 20. No entanto, esta técnica não é adequada para a identificação de proteínas muito grandes, as proteínas de membrana, proteínas extremamente ácidas ou básicas e hidrofóbicos, e é uma técnica um tanto laboriosa e demorada 20. Novas abordagens peptídicos centrada (com base em gel não) que são mais robustas e objectivo tornar-se disponíveis e podem ser utilizados para a comparação quantitativa por diferenciais métodos de marcação de isótopos estáveis, tais como etiquetagem de cisteína por afinidade codificados por isótopos de marcação (ICAT) 21, e um grupo amino rotulagem por isótopo marcação de quantificação relativa e absoluta (iTRAQ) 22. A utilização de uma única técnica proteômica pode dar informações insuficientes, portanto é necessário o uso de duas abordagens proteômicas complementares para a maioria das alterações que avaliam totalmente em proteoma. Contudo, a electroforese em gel 2-D é amplamente utilizado e pode ser aplicado como rotina quantitativo expressão de várias proteínas em organismos diferentes.
Aqui nós descrevemos um extração de proteínas de células inteiras e 2-D procedimentos de eletroforese em gel de espécies de Burkholderia que foram adaptados e aperfeiçoados a partir das GE Healthcare 2-D Eletroforese princípios e métodos Handbook 80-6429-60AC 2004 ( www.amershambiosciences.com ). A extracção da proteína foi realizada utilizando um batedor de talão com contas de vidro na presença de PBS contendo EDTA 5 mM (ácido etilenodiaminotetracético) e 1 mM de PMSF (fluoreto de fenilmetilsulfonilo). Este procedimento permite a quantificação de proteínas com degradação mínima e pode ser alterada por abordagens proteômicas como relatado anteriormente 15,23,24. Electroforese em gel de 2-D foi realizada utilizando 24 centímetros de comprimento imobilizadas pH 4-7 gradiente e as proteínas foram separadas de acordo com o seu ponto isoeléctrico. Em seguida, as proteínas foram separadas segundo a sua Molecular peso por gel de SDS-poliacrilamida. Além disso, foi descrito um método de coloração com prata para visualização de proteínas no local, e um método de coloração de prata, que é compatível com a análise de espectrometria de massa. Juntos, estes procedimentos podem permitir a identificação de proteínas importantes de espécies de Burkholderia que poderiam estar envolvidos na patogénese.
Protocolo
1. Crescimento Cultura (dias 1 +2)
- Crescer uma cultura de partida: 3 ml de Luria Bertani (LB) caldo numa ml tubo de pressão top 15, a 37 ° C durante a noite rotador. Dilui-se o crescimento durante a noite a uma DO600 de 0,6. Adicionar 1 ml desta diluição para 100 ml de caldo LB num balão Erlenmeyer de 250 mL. Incubar a 37 ° C com agitação a 250 rpm durante 16 horas em fase estacionária (SP), a melhor aproximada, em cultura descontínua, condições de infecção e para assegurar que os factores de virulência bacteriana sob o controlo de factores de sinal de fase estacionária, tais como centros de investigação e de quorum detecção, são expressos. Alternativamente, as bactérias cresceram em SP cedo ou fase semi-logarítmica tardia ou pode ser usada para obter informação sobre a fase de adaptação bacteriana.
- Depois de 16 horas a medir DO600 e assegurar a cultura atingiu SP por comparação com uma curva de crescimento previamente construído sob condições idênticas.
2. Extração de proteínas (dia 3)
- Relaxe todos os meios de comunicação e soluções de antemão, a geladeira durante a noite. Todos os passos devem ser realizados com os tubos em um balde de gelo. Prechill uma microcentrífuga e uma centrifugadora Beckman Coulter Alto Desempenho (ou equivalente) a 4 ° C e o rotor interno (rotor JA-20 =, centrífuga = J2-HS).
- Preparar a solução (PMSF, 174,19 g / mol) em acetona pela dissolução de 0,0174 g de PMSF (PMSF 'CUIDADO' é tóxico e corrosivo, o uso de rosto escudos e luvas) em 1 ml de acetona (acetona 'CUIDADO' é fresco 0,1 M de fluoreto fenilmetanossulfonilo tóxico e inflamável, usar escudos face e luvas).
- Adicione-se uma solução de PBS / EDTA / PMSF: 0,1 ml de 0,1 M de PMSF, 0,1 ml de 0,5 M de EDTA, e 9,8 ml de PBS. Verifique o OD da cultura hr 16 é de aproximadamente onde deve estar em SP.
- Tomar 35 ml da cultura bacteriana e transferência para um tubo de centrífuga de Oakridge e centrifugar a cultura a 4.500 x g durante 20 min a 4 ° C.
- Remover o sobrenadante para um recipiente de resíduos eadição de 35 ml de PBS arrefecido e ressuspender o pellet. Centrifugar novamente a 4500 × g durante 20 min a 4 ° C.
- Remover o sobrenadante e ressuspender em 1 ml de PBS frio. Transferir para estéril 2 ml de Eppendorf e centrifuga-se 1 min a alta na microcentrífuga a 14000 × g a 4 ° C. Retire e elimine o sobrenadante.
- Adicione 1 ml de solução de PBS / EDTA / PMSF, ressuspender o sedimento e transferir para um tubo de 2 ml parafuso da tampa (com o-ring) contendo 0,5 ml ~ contas de vidro (esterilizado). Adicionar o pelete re-suspenso para o tubo contendo as esferas de vidro e talão bater-lhes a 4 ° C durante 1 min na sala fria. Faça isso 3x, colocando a amostra em gelo após cada bash.
- Centrifugar a 14000 xg durante 1 min na microcentrífuga. Remover o sobrenadante e colocá-lo em um tubo de poliestireno 5 ml estéril.
- Para aumentar o rendimento adicionar 1 ml de PBS / EDTA / PMSF ao mesmo tubo contêm grânulos de vidro novo. Grânulo bater o tubo a 4 ° C durante 1 min. Faça isso 2x colocando a amostra em gelo affesta de ter. Centrifugar a 14.000 x g durante um minuto sobre a centrífuga e remover o sobrenadante e adicionar ao sobrenadante a partir do passo 2.8. Usando uma seringa de 1 ml e um filtro de 0,20 mM do sobrenadante a partir do tubo de poliestireno estéril, para um novo tubo de Eppendorf de 2 ml.
- Neste ponto, as amostras devem ser ensaiadas para a quantidade de proteína, utilizando o kit de extracção de proteínas Pierce MicroBCA e aliquotas de 200 mg devem ser congeladas a -80 ° C até ser necessário.
3. Preparação de Amostras (dia 4)
- Prepare 25 ml de solução stock de reidratação (8 M uréia, 2% CHAPS, 2% IPG Buffer, 0,002% de azul de bromofenol) e armazenar em 2,5 mL alíquotas a -20 ° C. Adicionar 7 mg de ditiotreitol (DTT, 154,2 g / mol), imediatamente antes da utilização a uma alíquota de 2,5 ml da solução de re-hidratação.
- Processo descongelado amostras do passo 2.10 usando um 2-D Clean up kit com ressuspensão final em 450 ml de solução estoque de reidratação preparados no passo 3.1.
4. PrimeiroDimensão Isoelectric focagem (IEF) (Dia 4)
Todas as etapas desta seção estão usando o IEF Sistema Ettan IGPhor.
- Configure as primeiras tiras IPG dimensão: os titulares de strip limpos com solução de limpeza tira e depois lave com água Milli-Q, deixar de cabeça para baixo para secar. Atribua a cada amostra para um número compartimento de gel.
- Coloque a amostra a partir da etapa de reidratação na segunda área mais ampla do - end (). Use uma pinça limpa para puxar tiras de gel de embalagens. Retire camada protetora a partir de tiras de gel. Linha tiras lado áspero para baixo em um movimento lento, deslizando para conseguir as tiras molhadas ao longo do caminho de (-) ao final (+) final.
- Coloque papel absorvente úmido com água esterilizada em cima do eletrodo e sob as tiras de gel para evitar o cansaço. Enxágüe pinças em-entre os rounds com água purificada e etanol. Remova todas as bolhas, sobrepor levemente com óleo mineral para evitar saídas secos. Alinhe os detentores tira de gel na máquina.
- Executar 12 horas a 20 ° C durante rehydração, 1 hora a 200 V, 1 hora a 500 V, 1 hora a 1000 V, 0,5 horas a 4000 V, 12 horas a 8000 V, 24 hr espera a 300 V, e pode ser retirado no momento.
- Após IEF é terminado, é recomendável realizar a electroforese de segunda dimensão em gel de SDS-poliacrilamida, a menos que a tira de IPG são congeladas a -80 ° C em Saran Wrap revestida com óleo mineral para análise futura. Alternativamente, a fim de evitar a formação de estrias ponto, devido ao acesso de DTT é possível incluir um segundo passo de equilibração do IPG tiras antes da segunda dimensão com um tampão que contém a iodoacetamida.
5. Segunda-dimensão SDS-poliacrilamida Eletroforese em Gel (dia 5)
Todas as etapas desta seção estão utilizando o aparelho de eletroforese Ettan DALTsix.
- Para montar o aparelho de rodízio gel, limpar completamente todos os componentes e garantir que rodízio gel é o nível ea ligação de borracha cinza é lubrificado com gel de silicone. Coloque o busílis pretober rolha triangular na parte inferior. Em seguida, coloca alternadamente o separador e as placas de vidro com a placa de vidro mais curtos para a frente. Certifique-se que os separadores são na parte de trás e da frente. Preencha o espaço restante com as cargas (cerca de 5 folhas) de modo que o topo é plano. Coloque o painel frontal com a ponta vermelha do lado de fora. Use grampos para apertar cada lado e apertar os parafusos inferiores.
- Preparar o gel: Adicionar 297,3 ml de Duracryl, ('CUIDADO' Duracryl é usar tóxico rosto escudos e luvas), 147 ml de tampão Tris 1,5 M pH 8,8, e 143,3 ml de água Milli-Q para um balão com ponta de vácuo contendo um barra de agitação. Coloque a tampa em cima e misturar a solução a uma velocidade moderada, com o vácuo por 20 minutos. O vácuo é utilizada para de-gás da solução. Fazer uma nova 10% de solução de persulfato de amónio (APS, 218,8 g / mol): 0,2 g de APS a 2 ml de água Milli-Q.
- Adicionando-se a mistura de gel para o rodízio de gel: Quando o vácuo é realizado adicionar 6 mL de 10% de dodecilsulfato de sódio (SDS, 228,38 g / mol)para a parede lateral do balão para evitar colocar mais bolhas na solução. Adicionar APS, mexa, adicione 0,25 mL de N, N, N ', N'-tetrametiletilenodiamina (TEMED, 116,20 g / mol) (' CUIDADO 'Temed é usar inflamável rosto escudos e luvas) e agitar.
- Despeje a mistura em gel de rodízio em gel através de um funil inserido na parte traseira do aparelho. Deitar-se a um centímetro abaixo da placa curta. Adicionar 1,5 mL de butanol saturado com água para a parte superior do gel e embrulhar topo com saran wrap para evitar a desidratação. Aguarde 1 hora para garantir a polimerização completa.
- Verificando o gel: Quando o gel é feito (verifique o frasco), desmontar o rodízio gel por uma pia. Verifique se há integridade gel enquanto enxaguar as placas de vidro com água morna, não deixe a água entrar no prato. Despeje a butanol e lavar a parte superior do gel duas vezes com água para se livrar de butanol. Preencha o topo com água e deixe descansar novamente se os géis não são utilizados de imediato.
- Preparação das tiras: Preparar a solução tampão de equilíbrio docongelador (6 M ureia, 75 mM Tris-HCl pH 8,8, 29,9% de SDS, 0,002% de azul de bromofenol). Isto pode ser previamente preparada e armazenada em alíquotas de 10 ml a -20 ° C. Dissolve-se 0,1 g de DTT a 10 ml de uma solução tampão de equilíbrio. Um tubo pode ser utilizado para duas tiras de IPG. Colocar os géis de face para baixo sobre a tira de tampão e deixar repousar durante 30 minutos. Lembre-se que final é qual.
- Preparação da unidade de electroforese (aparelho de separação de 2-D): Adicionar 4,5 L de 1x tampão de electroforese (25 mM Tris Base de Dados [121,1 g / mol], de glicina 192 mM de [288,38 g / mol], e 0,1% w / v de SDS [288,38 g / mol]) para o tanque de funcionamento. Este tampão pode ser utilizada para um máximo de 3x. Vire a unidade de eletroforese em. Verifique o nível de água na máquina de refrigeração de água e encha-o com água, se ele é baixo. Ligue a máquina, o modo de imprensa para verificar a temperatura designado, que deve ser de 10 ° C.
- Adicione 1 L de tampão de corrida e 2x 1 L de 1x de tampão de corrida e armazená-los, a 4 ° C. Certifique-selagem agarose solução: peso de 0,25 g de agarose dissolve-se em 50 ml de tampão 1x execução. Pulso por 15 segundos cada.
- Configurando a unidade de Eletroforese: Use uma pinça para tirar cada faixa e remover o excesso de tampão em ambos os lados com papel toalha limpa. NÃO toque nas tiras. Deitar fora a água no topo do gel e alinhar o início de gel com tampão 1x execução. Use uma pinça limpa e coloque as tiras em cima da placa longa, com o lado do gel de frente para você. Adicionar tampão 1x às tiras para lubrificar. Tiras de slides ainda mais para baixo, usando tiras de plástico. Remova todas as bolhas entre a tira eo gel.
- Adicionar solução de selagem de agarose para o topo da tira para selar. Repetir para o resto das tiras. Colocar as placas de vidro e contendo os géis em gel de berço inferior e no tanque de gel. Verifique se o nível de 1x tampão na câmara exterior é na linha de fundo designado antes de colocar a câmara superior diante.
- Coloque a moldura para câmara de amortecimento superior em cima das placas de vidro e garantir que ele é tudo o way para baixo, pressionando a parte inferior para baixo. Utilizando um funil e adicionar o tampão de corrida 2x dentro da câmara superior para a linha do meio. Utilizando um funil e adicionar tampão de corrida 1x a câmara exterior, até atingir a linha de cima. Coloque a tampa em cima e ligar a unidade Eletroforese eo bloco de poder.
- Correr durante a noite em 52 V, 96 mA, 5 W. Verifique se a corrente está indo, procurando por bolhas no fio de prata perto do topo. Executar o gel até o fio condutor é de 1 cm a partir do fundo.
- As proteínas também podem ser analisados utilizando-se os equipamentos e reagentes de outras empresas tais BioRad ou Hoefer, de acordo com as instruções do fabricante.
6. Prata coloração dos géis para Gel Visualization (dia 5-6)
- Prepara-se uma solução da solução de 1 (800 ml de etanol, 200 ml de ácido acético, e 1000 ml de água Milli-Q da coifa em um balde de plástico). Solução é boa para 6 géis. Ligue todas as máquinas off e tirar toda a parte do meio da unidade de Eletroforese e puvai la em pia. Também colocou o carrinho branco na pia. Retire a bandeja superior contendo o tampão 2x execução.
- Desmontar o aparelho e remover os geles a partir de placas de vidro em solução da solução 1. Os géis podem ser identificados por cortar cantos quando são removidas das placas de vidro, o número de cantos cortados correspondente à ordem de gel no rodízio.
- Colocar o recipiente com a solução da solução e os géis em um balancim para, pelo menos, 1 hora a durante a noite a 4 ° C.
- Transferir o gel para corrigir a solução 2 (20 ml de 50% de glutaraldeído, 600 ml de etanol, 5 g de tetrationato de potássio (302,46 g / mol), 136 g de acetato de sódio (82,03 g / mol), e água Milli-Q para 2.000 ml) e coloque em uma cadeira de balanço para 1 hora.
- Lave os géis 4x durante 15 min cada em água Milli-Q.
- Manchar os géis em solução de nitrato de prata (4 g de nitrato de prata (169,87 g / mol), 500 mL de formaldeído e água Milli-Q para 2000 ml) durante 30 minutos ou até de 48 h.
- Lavar o gel para umamin em água Milli-Q.
- Transferir a solução de revelador (60 g de carbonato de sódio (105,99 g / mol), 300 ml de formaldeído, 15 mg de tiossulfato de sódio (158,11 g / mol), e água Milli-Q para 2000 ml) durante 5-30 min, até o gel é corado.
- Colocar o gel em solução de paragem (100 g de Tris-Base (121,14 g / mol), 40 ml de ácido acético, e água Milli-Q para 2000 ml) durante 10 min.
- Para o armazenamento, a transferência dos géis para solução de glicerol (40 ml de glicerol ou de 400 ml, se o armazenamento a longo termo é desejável, e 1600 ml de água Milli-Q), durante 10 min e em seguida secá-los utilizando um secador de gel.
- Gel pode ser visualizada após coloração usando sistemas de imagem, como um scanner / densitômetro, fotografada usando transiluminador de luz ou Gel imager. O software de análise de imagem, tal como PDQuest análise 2-D da BIORAD pode então ser utilizada para obter informação quantitativa e qualitativa de proteínas numa amostra.
7. Gel Prata Coloração para Análise Espectrometria de Massa
- Fixar os geles em metanol a 50%, e 5% de ácido acético durante 1 hora.
- Lavar com metanol a 50% durante pelo menos 10 minutos a durante a noite.
- Lavar 3x em água destilada durante 10 min.
- Sensibilizar com tiossulfato de sódio a 0,02% (158,11 g / mol) 2x durante 15 min.
- Lavar 3x em REFRIGERADA 3x água destilada durante 10 min.
- Submerge gel em REFRIGERADA solução de nitrato de prata a 1% (169,87 g / mol), durante pelo menos 20 minutos a 1 hora a 4 ° C
- Lavar 2x durante 1 min, com água destilada. Mude tabuleiro / balde.
- Desenvolver em 0,04% de formaldeído em 2% de carbonato de sódio anidro (105.99 g / mol) e descartar quando fica amarelo muito rápido, tem três lotes e estar pronto para mudar a cada 5 min.
- Lavar com ácido acético a 5%, em seguida, armazenar em ácido acético a 1%.
- Enxágüe 1,5 ml tubos Eppendorf (para segurar obter ponto cut-outs) com USP etanol grau e secar ao ar antes de usar.
- Fórceps limpos, lâminas de barbear e superfícies com 100% de metanol.
- Spray de luvas e superfícies com etanol.
- Pontos especiais de consumo em uma capela de fluxo ou área de ar limpo. As manchas podem também ser excisada utilizando um cortador de ponto automatizado.
- Coloque-as em tubos e navio Eppendorf no gelo ou manter em frigorífico.
Resultados
Análise comparativa dos perfis de proteínas extraídas da mesma cultura bacteriana em duas ocasiões diferentes mostraram padrões semelhantes de bandas indicando extração de proteínas de sucesso. Proteínas de peso molecular extraídos variou 10-150 kDa. Figura 1 mostra representativa coloração com Coomassie azul do gel as extracções de proteínas de células inteiras a partir de multivorans Burkholderia (um membro da BCC) isolados clínicos crescidos em LB ou levedura / Manitol (YEM) e caldo colhido de fase estacionária.
Para 2-D de análise de electroforese em gel, 200 mg de proteínas totais de Burkholderia pseudomallei foi usado (Figura 2). Uma vez que este patógeno é reconhecido como um do tipo B agente de guerra biológica pelos Centros dos EUA para Controle e Prevenção de Doenças 25, os procedimentos de preparação de proteína foram realizadas em laboratório Bio Segurança Nível 3 contenção e em conformidade com os procedimentos de operação padrão.As proteínas foram novamente suspensas em solução de re-hidratação e aplicado a uma 24 cm de comprimento imobilizadas pH 4-7 gradiente e as proteínas foram separadas de acordo com o seu ponto isoeléctrico (pi). Em seguida, as tiras foram colocadas num gel de SDS-poliacrilamida e as proteínas foram separadas de acordo com o seu peso molecular (MW). Subsequentemente, o gel foi corado com prata para a visualização da proteína local. Os resultados mostraram a abundância de mais de 500 manchas de proteínas que podem ser identificados individualmente por espectrometria de massa.
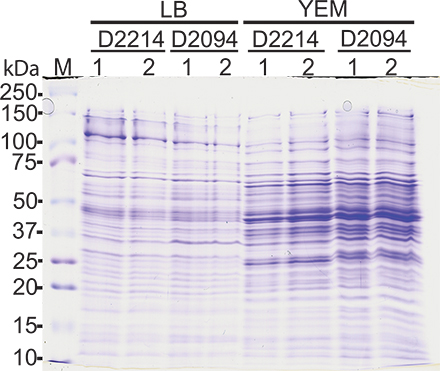
Figura 1. Perfis de proteínas totais de isolados de Burkholderia multivorans. Análise de SDS-PAGE da proteína extraída a partir da fase estacionária D-2214 e D-2094 isolados cresceram em LB ou levedura / Manitol (YEM) caldo em duas ocasiões diferentes (1 e 2). 4 ug de proteína foram carregadas em cada faixa de um gel a 12,5% e coradas wiª Coomassie azul. Pista M, marcador de proteína.

Figura 2. 2-D análise de eletroforese em gel de Burkholderia pseudomallei 1234B isolar. Gel separação Representante manchada de prata 2-D mostrando proteína no pI 4 a 7 tira-range. Extractos de proteína de célula total (200 ug) na fase estacionária foram utilizados e separados num gel de SDS-PAGE a 15%.
Discussão
Um método para a preparação de proteínas tem sido descrito que pode extrair a maioria das proteínas de Burkholderia com boa reprodutibilidade. Isto é demonstrado pela obtenção do mesmo perfil de proteína a partir de duas preparações independentes realizadas em dias diferentes, utilizando a mesma cultura bacteriana cresceu em LB ou caldo YEM como mostrado na Figura 1. Extração foi eficiente para as bactérias cultivadas em meio líquido, no entanto, não testei este método para as bactérias cultivadas em placas. Este método também foi usado para posterior caracterização de proteínas usando ferramentas de proteômica, o nosso grupo tem estudado com sucesso mudanças proteoma por eletroforese em gel 2-D e isótopo de marcação para a quantificação relativa e absoluta (iTRAQ) técnicas proteômicas 15,23,24. Relativamente a estes últimos, as proteínas foram extraídas para um tampão contendo 0,5 M de EDTA em PBS, para evitar qualquer interferência de PMSF com as experiências iTRAQ 15.
É importante remarca que, durante o processo de extracção de proteína e de electroforese em gel 2-D, todos os passos devem ser realizados a 4 ° C ou em condições de frio utilizando baldes de gelo para minimizar a degradação de proteínas, assim como para usar dicas ligados e usar luvas de borracha nitrílica e cobrir toda a pele para evitar a contaminação de queratina de quaisquer manchas cortado para posterior identificação por espectrometria de massa. Ao realizar extracções de proteínas, é também importante considerar que o PMSF tem um tempo de meia-vida curta em soluções aquosas, de acordo com o fabricante, pelo que a solução de reserva 0,1 mM em acetona deve ser feito imediatamente antes da utilização. Alternativamente, outros inibidores de serina ou inibidores de protease, que são mais solúvel e estável, e menos tóxico pode ser usado, embora não tenhamos testado-los em nossos experimentos.
O tampão de lise usado no presente processo não contém ureia, o que é importante para a solubilização para extrair ambas as proteínas citosólicas aquosas (prot) e menos solúveleins, incluindo algumas proteínas da membrana 17. Mas, durante a preparação da amostra para a primeira dimensão focalização isoelétrica (passo 3 do presente protocolo), as amostras são novamente suspensas em tampão de reidratação que contém uréia. Outras técnicas proteômicas também envolvem tratamento semelhante 26. Antes de seguir com a etapa de reidratação, parece que a remoção de materiais de interferência ou impurezas de baixo peso molecular é crucial para alta resolução, recomendamos usar o 2-D Kit Clean-up em cada um amostras de proteínas como os resultados melhoraram. Anteriormente carregar as amostras para primeira dimensão isoelétrico separação de focagem, certifique-se de ter tiras preparadas de papel mata-borrão do tamanho certo dos titulares de strip, como isso é problemático para cortar o tamanho certo de forma asséptica no local (para a etapa 3.4 deste protocol).
Antes de executar uma electroforese em gel de SDS-poliacrilamida a 2-D, que é necessária para assegurar que a porcentagem em gel encaixa os tamanhos esperados de interesse (um 120,5% de percentagem de gel é possível resolver de proteína na gama de 14-100 kDa). Após a electroforese em gel de segunda dimensão é concluída, a visualização de proteínas pode ser alcançada por coloração com azul de Coomassie ou prata, sendo esta última a coloração é mais sensível com um limite de detecção é tão baixa quanto 0,1 ng / proteína / local 20. Spots visualizadas com manchas de prata são adequados para posterior análise por espectrometria de massa. No entanto, é importante mencionar que a solução de coloração de prata não deve conter glutaraldeído uma vez que este agente de reticulação com as proteínas e por isso não é compatível com a análise de espectrometria de massa de mais de 20. Em alternativa, para detectar e quantificar as proteínas expressas diferencialmente, uma outra abordagem baseada em gel, tais como Bidimensional-Diferença Electroforese em Gel (2D-DIGE) em conjunto com o software automatizado pode ser utilizado. Esta abordagem emprega marcas fluorescentes distintas (por exemplo Cy 3, 5 e 2), que são usados para amostras de etiquetas e um pr padrão interno universalior a segunda dimensão de electroforese superação, em certa medida, as desvantagens de variação e reprodutibilidade da electroforese 2-D 27. Além disso, os geles podem ser coradas após a segunda dimensão com SyproRuby, que é um quelato de ruténio mancha organometálico concebidos para aplicações de proteomas. É possível detectar marcas de proteínas com uma sensibilidade semelhante à coloração de prata, mas com uma maior sensibilidade do que o azul de Coomassie. Depois de géis de coloração pode ser fotografado com scanner a laser ou transilluminator 28.
Em conclusão, este vídeo descreve um procedimento proteína bacteriana extração de células inteiras e 2-D método de eletroforese em gel que pode permitir o estudo das mudanças globais no proteoma de espécies de Burkholderia.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
Este trabalho foi apoiado por uma bolsa de estudo da Universidade de British Columbia (a BV) e doações de Fibrose Cística Canadá e Institutos Canadenses de Pesquisa em Saúde (DPS) para. Agradecemos Jacqueline Chung para a preparação inicial dos protocolos.
Materiais
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Phenylmethanesulfonyl fluoride (PMSF) | Sigma | P7626 | Toxic, corrosive |
| Acetone | Fisher | A18-1 | Flammable |
| PBS Buffer | Bioscience | R028 | |
| Ethylenediaminetetraacetic acid (EDTA) | Fisher | BP118-500 | toxic |
| Glass beads (0.1 mm) | BioSpec Products | 11079101 | |
| Nalgene Oak Ridge Centrifuge tubes, polycarbonate (50 ml) | VWR | 21009-342 | |
| MicroBCA protein extraction kit | Pierce | 23235 | |
| Microcentrifuge Tubes 2.0 ml conical Screw cap Tubes with Cap and O-Ring | Fisher | 02-681-375 | |
| 2-D Clean-Up kit | GE Healthcare | 80-6484-51 | |
| Urea | Invitrogen | 15505-050 | Irritant |
| CHAPS | Amersham Biosciences | 17-1314-01 | |
| Dithiothreitol (DTT) | MPBiomedical, LCC | 856126 | Irritant |
| Immobiline DryStrips pH 4-7 24 cm | Amersham Biosciences | 176002-46 | |
| Duracryl | Proteomic Solutions | 80-0148 | Very toxic, carcinogen |
| Ammonium persulfate | Fisher | BP179-100 | Flammable, toxic, corrosive |
| N,N,N’,N’-tetramethylethylenediamine (TEMED) | Invitrogen | 15524-010 | Flammable |
| Sodium dodecyl sulfate (SDS) | Fisher | BP166-500 | Acute toxicity, flammable |
| Agarose | Invitrogen | 15510-027 | |
| Ethanol | Fisher | HC1100-1GL | Flammable, toxic |
| Acetic acid | Fisher | A491-212 | Flammable, corrosive |
| Glutaraldehyde | Fisher | G151-1 | Very toxic, corrosive, dangerous for the environment |
| Potassium tetrathionate | Sigma | P2926 | Irritant |
| Sodium acetate | EM Science | 7510 | |
| Silver nitrate | Sigma | 209139 | Corrosive, dangerous for the environment |
| Formaldehyde | Sigma | 252549 | Toxic |
| Sodium thiosulfate | Sigma | S7026 | |
| Tris Base | EMD | 9230 | |
| Glycine | MPBiomedical, LCC | 808831 | |
| Glycerol | MPBiomedical, LCC | 800688 | |
| Methanol | Fisher | A412-4 | Flammable, toxic, health hazard |
| Sodium carbonate anhydrous | EMD | SX0400-3 | Toxic |
| Mineral oil | ACROS | 415080010 | |
| Equipment | |||
| JA-20 ultracentrifuge rotor | Beckman Coulter | 334831 | |
| Mini Beadbeater | Biospec Products | 3110BX | |
| Ettan IPGphor II Isoelectric Focusing System and accessories | GE Healthcare | 80-6505-03 | www.amershambiosciences.com |
| Ettan DALT Large Vertical electrophoresis system | GE Healthcare | 80-6485-27 | www.amershambiosciences.com |
Referências
- Drevinek, P., Mahenthiralingam, E. Burkholderia cenocepacia in cystic fibrosis: epidemiology and molecular mechanisms of virulence. Clin. Microbiol. Infect. 16, 821-830 (2010).
- Suarez-Moreno, Z. R., et al. Common Features of Environmental and Potentially Beneficial Plant-Associated Burkholderia. Microb. Ecol. , (2011).
- Wiersinga, W. J., van der Poll, T., White, N. J., Day, N. P., Peacock, S. J. Melioidosis: insights into the pathogenicity of Burkholderia pseudomallei. Nat. Rev. Microbiol. 4, 272-282 (2006).
- White, N. J. Melioidosis. Lancet. 361, 1715-1722 (2003).
- Mahenthiralingam, E., Urban, T. A., Goldberg, J. B. The multifarious, multireplicon Burkholderia cepacia complex. Nat. Rev. Microbiol. 3, 144-156 (2005).
- Speert, D. P., Henry, D., Vandamme, P., Corey, M., Mahenthiralingam, E. Epidemiology of Burkholderia cepacia complex in patients with cystic fibrosis. Canada. Emerg. Infect. Dis. 8, 181-187 (2002).
- Dance, D. A., Wuthiekanun, V., Chaowagul, W., White, N. J. The antimicrobial susceptibility of Pseudomonas pseudomallei. Emergence of resistance in vitro and during treatment. J. Antimicrob. Chemother. 24, 295-309 (1989).
- Thibault, F. M., Hernandez, E., Vidal, D. R., Girardet, M., Cavallo, J. D. Antibiotic susceptibility of 65 isolates of Burkholderia pseudomallei and Burkholderia mallei to 35 antimicrobial agents. J. Antimicrob. Chemother. 54, 1134-1138 (2004).
- Govan, J. R. W., et al. Evidence for transmission of Pseudomonas cepacia by social contact in cystic fibrosis. Lancet. 342, 15-19 (1993).
- Thongboonkerd, V., et al. Altered proteome in Burkholderia pseudomallei rpoE operon knockout mutant: insights into mechanisms of rpoE operon in stress tolerance, survival, and virulence. J. Proteome. Res. 6, 1334-1341 (2007).
- Park, K. H., Lipuma, J. J., Lubman, D. M. Comparative proteomic analysis of B. cenocepacia using two-dimensional liquid separations coupled with mass spectrometry. Anal Chim. Acta. 592, 91-100 (2007).
- Wongtrakoongate, P., Mongkoldhumrongkul, N., Chaijan, S., Kamchonwongpaisan, S., Tungpradabkul, S. Comparative proteomic profiles and the potential markers between Burkholderia pseudomallei and Burkholderia thailandensis. Mol. Cell Probes. 21, 81-91 (2007).
- Harding, S. V., et al. The identification of surface proteins of Burkholderia pseudomallei. Vaccine. 25, 2664-2672 (2007).
- Madeira, A., Santos, P. M., Coutinho, C. P., Pinto-de-Oliveira, A., Sa-Correia, I. Quantitative proteomics (2-D DIGE) reveals molecular strategies employed by Burkholderia cenocepacia to adapt to the airways of cystic fibrosis patients under antimicrobial therapy. Proteomics. 11, 1313-1328 (2011).
- Zlosnik, J. E. A., Speert, D. P. The Role of Mucoidy in Virulence of Bacteria from the Burkholderia cepacia Complex: A Systematic Proteomic and Transcriptomic Analysis. J. Infect. Dis. 202, 770-781 (2010).
- Riedel, K., Carranza, P., Gehrig, P., Potthast, F., Eberl, L. Towards the proteome of Burkholderia cenocepacia H111: setting up a 2-DE reference map. Proteomics. 6, 207-216 (2006).
- Weiss, W., Gorg, A. Sample solublization buffers for two-dimensional electrophoresis. Methods Mol. Biol. 424, 35-42 (2008).
- von der Haar, T. Optimized protein extraction for quantitative proteomics of yeasts. PLoS One. 2, e1078(2007).
- O'Farrell, P. H. High resolution two-dimensional electrophoresis of proteins. J. Biol. Chem. 250, 4007-4021 (1975).
- Gorg, A., Weiss, W., Dunn, M. J. Current two-dimensional electrophoresis technology for proteomics. Proteomics. 4, 3665-3685 (2004).
- Gygi, S. P., Rist, B., Griffin, T. J., Eng, J., Aebersold, R. Proteome analysis of low-abundance proteins using multidimensional chromatography and isotope-coded affinity tags. J. Proteome Res. 1, 47-54 (2002).
- Ross, P. L., et al. Multiplexed protein quantitation in Saccharomyces cerevisiae using amine-reactive isobaric tagging reagents. Mol. Cell Proteomics. 3, 1154-1169 (2004).
- Velapatiño, B., Limmathurotsakul, D., Peacock, S. J., Speert, D. P. Identification of differentially expressed proteins from Burkholderia pseudomallei isolated during primary and relapsing melioidosis. Microbes. Infect. 14, 335-340 (2012).
- Chung, J. W., Speert, D. P. Proteomic identification and characterization of bacterial factors associated with Burkholderia cenocepacia survival in a murine host. Microbiology. 153, 206-214 (2007).
- Rotz, L. D., Khan, A. S., Lillibridge, S. R., Ostroff, S. M., Hughes, J. M. Public health assessment of potential biological terrorism agents. Emerg. Infect. Dis. 8, 225-230 (2002).
- Thon, J. N., et al. Comprehensive proteomic analysis of protein changes during platelet storage requires complementary proteomic approaches. Transfusion. 48, 425-435 (2008).
- Wu, T. In New and Emerging Proteomic Techniques. Methods Mol. Biol. 328, 71-95 (2006).
- Lopez, M. F., et al. A comparison of silver stain and SYPRO Ruby Protein Gel Stain with respect to protein detection in two-dimensional gels and identification by peptide mass profiling. Electrophoresis. 21, 3673-3683 (2000).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados