Method Article
Прародитель полученные из олигодендроцитов системе культуры человека от мозга плода
В этой статье
Резюме
Первичные, человеческий мозг плода полученных, мультипотентных клеток-предшественников размножаться В пробирке, Сохраняя при этом способность дифференцироваться в нейроны и астроциты. Эта работа показывает, что нейронная предшественников можно индуцировать дифференцировку через этапы oligodendrocytic линии на кондиционирование с некоторыми факторами роста.
Аннотация
Differentiation of human neural progenitors into neuronal and glial cell types offers a model to study and compare molecular regulation of neural cell lineage development. In vitro expansion of neural progenitors from fetal CNS tissue has been well characterized. Despite the identification and isolation of glial progenitors from adult human sub-cortical white matter and development of various culture conditions to direct differentiation of fetal neural progenitors into myelin producing oligodendrocytes, acquiring sufficient human oligodendrocytes for in vitro experimentation remains difficult. Differentiation of galactocerebroside+ (GalC) and O4+ oligodendrocyte precursor or progenitor cells (OPC) from neural precursor cells has been reported using second trimester fetal brain. However, these cells do not proliferate in the absence of support cells including astrocytes and neurons, and are lost quickly over time in culture. The need remains for a culture system to produce cells of the oligodendrocyte lineage suitable for in vitro experimentation.
Culture of primary human oligodendrocytes could, for example, be a useful model to study the pathogenesis of neurotropic infectious agents like the human polyomavirus, JCV, that in vivo infects those cells. These cultured cells could also provide models of other demyelinating diseases of the central nervous system (CNS). Primary, human fetal brain-derived, multipotential neural progenitor cells proliferate in vitro while maintaining the capacity to differentiate into neurons (progenitor-derived neurons, PDN) and astrocytes (progenitor-derived astrocytes, PDA) This study shows that neural progenitors can be induced to differentiate through many of the stages of oligodendrocytic lineage development (progenitor-derived oligodendrocytes, PDO). We culture neural progenitor cells in DMEM-F12 serum-free media supplemented with basic fibroblast growth factor (bFGF), platelet derived growth factor (PDGF-AA), Sonic hedgehog (Shh), neurotrophic factor 3 (NT-3), N-2 and triiodothyronine (T3). The cultured cells are passaged at 2.5e6 cells per 75cm flasks approximately every seven days. Using these conditions, the majority of the cells in culture maintain a morphology characterized by few processes and express markers of pre-oligodendrocyte cells, such as A2B5 and O-4. When we remove the four growth factors (GF) (bFGF, PDGF-AA, Shh, NT-3) and add conditioned media from PDN, the cells start to acquire more processes and express markers specific of oligodendrocyte differentiation, such as GalC and myelin basic protein (MBP). We performed phenotypic characterization using multicolor flow cytometry to identify unique markers of oligodendrocyte.
протокол
Примечание: Для обычного культивирования нейронных предшественников и oligodendrocytic клетках линии, инкубационного делается при 37 ° С в увлажненной 5% CO 2 атмосферы. Каждые 2 дня, среду заменяют, используя 50 до 100% свежей среды, если культура составляет 40-70% вырожденная. Во время возле слияния, культуры пассировать на 2-2.5e6/T75 колбы обычно на недельном графике.
1. Подготовка покрытием колбы
- Для подготовки покрытием колбы разбавлять 5 мг поли-D-лизин (PDL) в 100 мл деионизированной воды (DI-воды), затем слой T75 колбы с 50 мкг / мл PDL при комнатной температуре (RT) в темноте. После 1 ½ часа, аспирации PDL и промойте колбы раз с DI-воды. Пусть колбы сухой перед посевом клеток (табл. 1).
2. Начиная дифференциации нервных клеток-предшественников в Прародитель полученных Олигодендроциты (PDO)
Протокол являетсяolate человека предшественники ЦНС клеток описана в предыдущей публикации, и она не является частью данного протокола 1. Человека предшественники ЦНС клетки были выделены из конечного мозга в 8-недельной беременности мозг плода, полученных в соответствии с руководящими принципами NIH.
- Расти мультипотентных населения нейронных клеток-предшественников на PDL покрытием колбы в Neurobasal среде с добавлением 25 нг / мл шФРФ и 20 нг / мл эпидермального фактора роста (EGF) (рис. 1А). Не используйте их, если выше, чем прохождение 11 (p11).
- Начинают дифференцироваться нервных клеток-предшественников, когда культура составляет около 70% вырожденная.
- Сделайте полную дифференциацию олигодендроцитов среды с использованием бессывороточной DMEM / F12 HAMS 1:01 среде с добавлением бычьего сывороточного альбумина, L-глютамин, гентамицин, N2 компонентов, T3, Shh, NT-3, шФРФ, и PDGF-AA (табл. 1) . Эта среда будет определяться как средняя олиго с факторами роста (олиго средний + GF).
- Удалить Progenitor средств массовой информации из колб, промыть клетки один раз фосфатным буферным раствором (PBS), затем добавить олиго средний + GF (подробно описано в 2,3), чтобы начать олигодендроцитов дифференциации. Только клетки стремится к oligodendrocytic линия будет расти (рис. 1б). Культуры клеток в этой среде в течение 3 недель.
- Каждую неделю, когда клетки находятся на 90-95% слияния, переход их с помощью трипсина (0,05%)-ЭДТА (0,1%) (4 мл на флакон T75). Передача всей среды из ячеек, которые будут пересевать в 50 мл коническую трубку, это кондиционированной среды будет использоваться, чтобы утолить трипсина. Убедитесь, что не высохнут клеток. Затем добавить трипсина.
- Инкубируйте клетки трипсином в течение 5 минут при комнатной температуре, слегка нажав колбу несколько раз, чтобы помочь ячейке отряда.
- Quench трипсина путем добавления 4-5 мл кондиционированной среды в колбу с отдельных клеток.
- Передача среды и клеток те же 50 мл коническую трубку. Центрифуга среды и клеток при 1200 мин (~300 мкг) в течение 5 минут при комнатной температуре.
- Аспирируйте супернатант, ресуспендируют осадок клеток, слегка наклонив трубу, а затем добавьте свежую среду олиго + GF. Аккуратно пипетки средой и клетки вверх и вниз, чтобы сделать однородной суспензии клеток.
- Подсчет клеток и передачи 2.5e6 в каждый новый PDL-T75 покрытием колбы.
3. Последним шагом в дифференциации Олигодендроциты
- После 3 недель культуры в олиго средний + GF, когда клетки находятся на уровне 70-80% слияния, начать окончательный процесс дифференциации (рис. 1С).
- Подготовка средних таким же образом, как средство олиго + GF но без добавления четырех GF: Тсс, NT-3, шФРФ и PDGF-AA. Эта среда без четырех GF будут определены как олиго средний - GF.
- Аспирируйте среднего олиго + GF из колбы, смойте один раз PBS, а затем добавить общий объем 16 мл среды, из которых ¾ (12 мл) олиго среде - GF и ¼ (4 мл) PDN кондиционированной среды, для 6-10 Дней). Использование кондиционированной среды от PDN не является критическим для дифференциации процесса или для выживания клетки. Мы ведь заметил, что только непосредственный контакт с клетками PDO ПДН совместно культуре эксперименты оказали влияние на продолжительность выживания PDO. Время выживания в среде олиго - GF может быть продлен до двух-трех недель, если PDO клетки совместно культивировали с PDN клеток. Протокол различать человеческие нейронных клеток-предшественников в ПДН описано в предыдущей публикации, и она не является частью данного протокола 1. Фактор роста выходе из культуральной среды приводит к постепенному дифференцировать культуру клеток с несколькими процессами (рис. 1D).
4. Анализ проточной цитометрии
Анализ проточной цитометрии сравнивает приобретение олигодендроцитов маркеров при дифференциации процесса в связи с тем, родительских населения.
- Использование нейронных проgenitors в качестве контроля. Семенной PDO клеток при 2.5x10 6 ячеек в двух колбах T75 покрытые поли-D-лизина в олиго средний + GF.
- Через неделю, заменить среде с свежей среды олиго + GF в колбах в качестве контрольной культуры для жизнеспособности клеток, в то время как другие колбы были олиго средний - GF.
- Чтобы отделить PDO клеток в обеих средах использовать 20 Ед / мл папаина, а не трипсина. Это потому, что папаин имеет более мягкий эффект на клетки при диссоциации сохранения клеточной морфологии.
- Добавить 5 мл сбалансированный солевой раствор Эрла (EBSS), чтобы папаин флаконе. Поместите флакон при 37 ° С в течение 10 мин или до папаин полностью растворяется, и раствор становится ясно. Это папаин раствор, используемый для диссоциации клеток.
- Добавить 0,5 мл EBSS в дезоксирибонуклеазы I (аз) флакон (табл. 1). Осторожно перемешать. Добавить 0,25 мл этого раствора в пробирку растворенного папаин. Этот препарат содержит в конечной концентрации примерно 20 ЕД / мл папаина и 0.005% ДНКазы.
- Место папаин решение (как описано выше) на клетки и инкубировать при 37 ° С в течение 15-30 мин; следить за отрядом из клеток с помощью микроскопа. Остановить реакцию с 5 мл среды с или без GF и центрифуге при 1200 оборотов в минуту в течение 7 мин.
- Передача ячейки гранул из обеих колб на две разные 5 мл пробирок из полипропилена и мыть их с нормальной физиологической среде (НПМ: 145 мм NaCl, 5 мМ KCl, 1,8 мМ CaCl 2, 10 мМ Hepes и 10 мМ глюкозы) с добавлением 1 мг / мл бычьего сывороточного альбумина (НПМ + BSA).
- Выполните поверхности иммунной при 4 ° С в течение 20 мин с использованием специфических и надлежащим образом титруют первичных антител для A2B5, О4, Galc (табл. 2).
- Вымойте клеток с НПМ + BSA при 4 ° С в течение 5 мин и инкубировать их с конкретными вторичными антителами при 4 ° С в течение 20 мин (табл. 2).
- Для окраски внутриклеточных антигенов в том числе нестин, глиальных фибриллярный кислый белок (GFAP), класс III и бытьта;-тубулина и основному белку миелина (ОБМ) (табл. 2), исправить клеток в 2% параформальдегида (PFA) в течение 20 мин при комнатной температуре и permeabilize с холодным 70% этанола в течение 15 мин при температуре -20 ° C.
- Вымойте клеток с 1x PBS и инкубируют с конкретными вторичными антителами (табл. 2).
- Чтобы провести различие между неповрежденные клетки и субклеточных мусора в ходе анализа потока цитометрии, пятно клеток с 4,6-диамидино-2-phenyllindole, дигидрохлорид (DAPI) (Life Technologies, Grand Island, NY).
- В оптимизации выше протокола, мы выполнили все соответствующие контрольные эксперименты, чтобы подтвердить специфику каждого иммунореагента. Короче говоря, для непосредственного меченые антитела, соответствующие отрицательным контролем было непосредственно конъюгированных антител того же класса изотипа иммуноглобулина (или подкласс) и флуорохромом сопряженных в качестве основного антитела (т. е. изотипа контроля). Для непрямого иммуноокрашивания первичных антител, соответствующие отрицательным контролем сокак вторичные антитела, конъюгированные с флуорохромом интересов, которые специально предназначены иммуноглобулинов класса (или подкласс), принимающей в котором первичных антител был создан. При первичных антител с нескольких хостов (мышь, кролик, курица), были использованы вместе, мы использовали вторичные антитела ориентированных на первичных антител каждого хоста и каждого вторичного антитела, используемые обычно был перекрестный адсорбированная против иммуноглобулинов от других хостов, чтобы минимизировать поперечное проведение иммунореактивности. Положительного контроля включены прямые или косвенные иммуноокрашивания клеточных препаратов известны, чтобы выразить антигенов интерес использование прямых или косвенных immunoreactions с первичными антителами, специфичными к этим антигенам. Приведенные выше методы оптимизации проводились один раз для каждого типа иммунной экспериментов. Управление immunoreactions не выявило значительных поперечных эпитопа иммунореактивности между первичными и вторичными антителами. Проточной цитометрии проводили на равномерноприостановлено флуоресцентно меченых клеток с использованием FACVantage SE клетки сортировщик (BD Biosciences, San Jose, CA) оснащена тремя лазерами, которые обеспечивают возбуждение волн настроена на 488 нм, 647 нм, а также широкий УФ (351-364 нм) (рис. 2) .
5. Иммунофлуоресцентной
Примечание: Для иммунофлюоресценции экспериментов, PDO высевают в олиго средний + GF или олиго среде - GF в 2.5e5 в 6-луночные планшеты покрытые PDL. Клетки фиксировали в 2% PFA в различные моменты времени после ухода из факторов роста. Антитела пятно осуществляется на пластиковую 6-луночные планшеты вместо стекла покровные.
- Удалите медиа и добавьте 2% PFA. Инкубировать в течение 10 мин при комнатной температуре. Откажитесь PFA. Вымойте клетки 3 раза PBS, 5 минут каждый раз. Будьте осторожны, чтобы не высохнуть клеток.
- Permeabilize клетки для внутриклеточных маркеров использованием 0,25% тритона решение в PBS в течение 10 мин при комнатной температуре.
- Для предотвращения неспецифического связывания, клетки блока Fили 10 мин с HHG (1 мМ HEPES буфера, 2% лошадиной сыворотки и 10% козьей сывороткой в сбалансированном солевом растворе Хэнкса). Развести конкретных первичных антител (табл. 2) к заранее определенной концентрации в HHG. Поместите разбавленный антител на клетки. Инкубировать 1 час при комнатной температуре на шейкере или при температуре 4 ° С в течение ночи.
- Вымойте клетки 3 раза PBS, в течение 5 минут каждый раз. Развести соответствующие вторичные антитела (табл. 2) в сочетании с флуорохромом к заранее определенной концентрации в HHG. Поместите смесь разбавленных вторичных антител на клетки. Инкубировать 1 час при комнатной температуре на шейкере в темноте.
- Вымойте клетки 3 раза PBS, в течение 5 минут каждый раз.
- Чтобы избежать фотообесцвечивания добавить 10 мкл продлить Золото с DAPI в клетки и поместить стекло покровное на них. Визуализируйте меченых клеток с использованием Axiovert 200M микроскоп флуоресценции (Zeiss, Thornwood, Нью-Йорк) (рис. 3).
Результаты
Это очень важно начать процесс дифференциации от 70% -80% вырожденная нейронных культуре клеток-предшественников (рис. 1А). Многие клетки будут вымирать после замены культуральной среды от предшественников в среде олиго так как он включает в себя конкретные факторы роста. Это указывает на то, что рост нейронных клеток-предшественников не стремится oligodendrocytic фенотип не будут поддерживаться новой среде (рис. 1b). Инкубации в среде олиго + GF в течение одной недели в результате промежуточные культуры демонстрируя узкие, биполярное морфологии (рис. 1б). Клетки хранятся в олиго средний + GF в течение 3-4 недель (рис. 1С). Фактор роста выходе из культуральной среде в результате постепенного дифференцировать культуру клеток с несколькими процессами (рис. 1D). Проточной цитометрии используется для количественного представления данных.
На рисунке 2а, 2B и 2C показывают, что большинство нейронных предшественников выразил нейроэпителиальных маркера стволовых клеток нестин, в то время как лишь небольшой субпопуляции выразил линии ограничивающие маркеры, такие как маркер астроцитов GFAP (рис. 2а), маркер нейронов III класса β-тубулина (рис. 2В) , или O4 олигодендроцитов маркером (рис. 2С). При культуральной среде был заменен олиго средний + GF и клетки культивировали в течение 1 недели, снизилась нестин выражении и увеличился A2B5 выражение можно наблюдать (рис. 2D). A2B5 является маркером нейроглии предшественника. Для сравнения, через 2 недели после замены среде, нестин выражении снизился еще дальше и A2B5 выражению одного увеличились (рис. 2E), а также выражение другого олигодендроцитов маркер, O4 (рис. 2F). Два дня сообщению фактор роста выводу, O4 выражении увеличился, а также выражение Galc,олигодендроцитов конце маркера (рис. 2G). Шесть дней поста фактор роста выводу, коэкспрессией O4 и Galc увеличилась (рис. 2H) и сравнима с коэкспрессией Galc и MBP (рис. 2I). Мульти-эпитопов иммуноокрашивания показывает, что более половины клеток в культуре выражают MBP (рис. 2J). Еще одно свидетельство дифференциации PDO характеризуется, с помощью иммунофлуоресценции, по временным увеличением MBP выражение в этих клетках после роста фактора вывода (рис. 3А-C). В целом, человеческого плода нейронных клеток-предшественников способны размножаться в пробирке, сохраняя при этом способность дифференцироваться в 3 основных типа клеток мозга (рис. 4).

Рисунок 1. Фазы контрастной микроскопии оF (A) нейронные клетки-предшественники культивировали в среде предшественников; (B) нейронных клеток-предшественников, выращенных в среде олиго + GF в течение недели демонстрируют измененную узкие, биполярное морфологии; (C) дифференцированных предшественников полученных олигодендроциты выросли на 3 дня в олиго среде После фактор роста вывод выставку олигодендроцитов морфология характеризуется несколькими процессами. 20x увеличением.
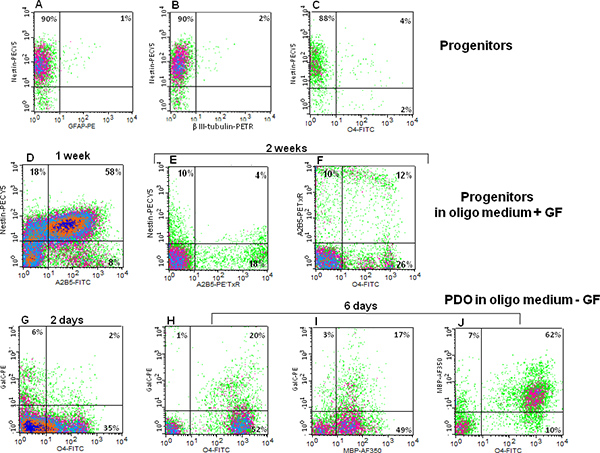
Рисунок 2 проточной цитометрии анализа нейронных клеток-предшественников совместного выражения предшественника-клеточного маркера Nestin (все вертикальные оси) с.: (A) астроцитов GFAP маркер; (B) нейронального маркера β-III тубулина, и (C) oligodendrocytic Маркер O4; (D) нейронных клеток-предшественников выросли за неделю в средствах массовой информации олиго + GF со-экспресс ГНЭПНТп и A2B5; (E) нестин и A2B5 коэкспрессии после двух недель нейронных роста предшественников в олиго средний + GF (F) A2B5 и О4 коэкспрессии после двух недель нейронных роста предшественников в олиго средний + GF; (G) два дней после роста снятие фактора, отличного олигодендроцитов маркеры дифференцировки, O4 и Galc, выражаются. Через шесть дней после вывода фактор роста (H) увеличилась доля клеток с двойным положительным для O4 и Galc; (I) двойной положительный результат на Galc и МПБ, и (J) дважды положительными для O4 и MBP. AJ представляют из четырех независимых экспериментов. Нажмите, чтобы увеличить показатель .

Рисунок 3. Косвенное immunofluorфлуоресценции окрашивания предшественников полученных олигодендроциты для MBP (A) 2 дней, (B) 5 дней, и (C, D) 9 дней после роста снятие фактора. (D) представляет фазу образ 9 дней культуры в среде олиго - GF и (E) является расширением белую коробку и того же изображения (A, B) 20-кратным увеличением; (C, D) 32x увеличением..
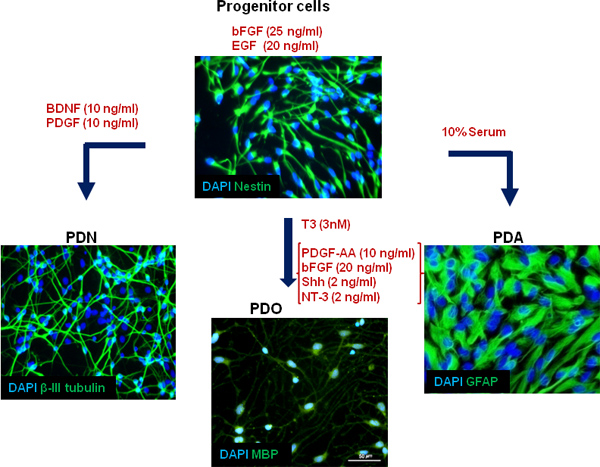
Рисунок 4. Схематическое изображение нашей модели клеточной культуры. Первичные, человеческий мозг плода полученных, мультипотентных нейронных клеток-предшественников размножаются в искусственных условиях при сохранении их пластичности. Использование различных условиях культивирования, нервные клетки-предшественники могут дифференцироваться в нейроны (PDN), астроциты (PDA) и олигодендроцитов (PDO), как показано на конкретных differentiatионный маркеров.
Обсуждение
Этот протокол описывает, как получить плода олигодендроциты из первичных человеческих нервных клеток-предшественников и характеризуют их фенотипа с использованием как проточной цитометрии и иммунофлуоресцентного окрашивания. Расширение и рост нейронных предшественников из ЦНС плода была очень хорошо описал 1-4. Тем не менее, получение достаточных человеческих олигодендроцитов для экспериментов в пробирке остается сложной, хотя это можно идентифицировать и изолировать глиальных предшественников из взрослого человека белом веществе 5-13. Там были различные попытки в развитии различных условиях культивирования прямой дифференциации нервной системы плода предшественников в миелиновой производства олигодендроциты 14-21. Этот протокол описывает далее нестин положительные нейронных клеток-предшественников выразил O4 маркером (рис. 2) при выращивании в течение 3 недель в бессывороточной среде с добавлением выбора фактора роста (PDGF-AA, шФРФ, Shh, и NT-3), тшляпы имеют важное значение для распространения и выживания олигодендроцитов прекурсоров 22-24. Устранение этих факторов роста в O4 + клеток привело к дальнейшей дифференциации и выражения компонент миелина (galactocerebroside и МБ). Кроме того, экспрессия маркеров дифференциации олигодендроцитов совпадает с морфологическим изменениям в клетках, которые на первый взгляд узкий и биполярное (рис. 1б) с клетками, которые становятся многополярного с хорошо развитыми процессами (рис. 1С). Удаление факторов роста в дальнейшем позволит заключительных этапах дифференциации была основана на исследованиях, проведенных как в мышиных и человеческих 15,25. Наличие трийодтиронина (Т3) имеет важное значение для выживания и дифференцировки олигодендроцитов 26 в то время как мы обнаружили, что удаление из четырех факторов роста было необходимо для выражения окончательной маркеры дифференцировки. Это было по сравнению с клетками хранится в олиго средний + GFса управления.
Мы не первые, чтобы описать дифференциацию мультипотентных нейронных клеток-предшественников в олигодендроцитов клеток в ответ на сигналы, такие как Shh и шФРФ 24. Предыдущие доклады показали, что корковый oligodendrogenesis начинается около 10 недель гестационного возраста у людей 24 с мощностью человеческого плода олигодендроцитов в myelinate увеличивается пропорционально со сроком гестации 22. Дифференциация galactocerebroside + и О4 + олигодендроцитов клеток-предшественников из нейронных клеток-предшественников сообщалось использованием втором триместре мозг плода 21,27. Тем не менее, эти клетки не размножаются в отсутствии поддержки клеток, включая астроциты и нейроны, и теряется быстро с течением времени в культуре 21. Наша система поддерживает формирование Galc + и MBP + клеток из человеческого плода культуры с 8 недель беременности. Кроме того, мы описано, что differentiated олигодендроциты могут быть выращены в пробирке, без необходимости поддерживать клетки, астроциты и нейроны, хотя совместного культивирования с нейроны могут продлить срок жизни дифференцированной олигодендроцитов. Еще одним преимуществом этого протокола является возможность обрабатывать большое количество клеток, экспрессирующих O4 + маркер, который можно выращивать и пассировать в культуре в течение недели при сохранении их фенотип. В этот момент те, O4 + клеток может быть отодвинута еще дальше на заключительном этапе дифференциации, когда факторы роста удаляют из среды. Протокол изложенных в настоящем документе говорится о необходимости олигодендроцитов линий подходит для экспериментов в пробирке. Кроме того, мы считаем, что выявление конкретных факторов, которые вызывают дифференциацию каскад нейронных предшественников на предшественников полученных олигодендроцитов важно для понимания клеточных и молекулярных механизмов развитияпереходы. Он также может служить важным инструментом для изучения демиелинизирующих расстройств и вирус-хозяин взаимодействий клетки относятся к патогенезу человека нейротропных вирусов, таких как JCV.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Это исследование было поддержано Внутренние программы исследований в Национальном институте здоровья, NINDS. Авторы хотели бы поблагодарить всех членов лаборатории молекулярной медицины и неврологии, Рик Дрейфус за помощь в микроскопии и Памела С. Рассев за помощь в редактировании.
Материалы
| Name | Company | Catalog Number | Comments | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Название реагента | Компания | Номер в каталоге | Конечная концентрация | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DME / HAMS F12 1:01 | Omega ученый | DM-251 | 1X | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Бычьего альбумина | Сигма | A9418 | 1% | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Гентамицин | Качество биологических препаратов | 120-098-031 | 50 мкг / мл | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| L-Глютамин | Качество биологических препаратов | 118-084-061 | 2 мМ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T3 | Сигма | T2877 | 3 нМ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N2 компоненты | Gibco BRL | 17502 | 1:100 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NT-3 | PeproTech Inc | 450-03 | 2 нг / мл | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shh | R & D системы | 1314-SH/CF | 2 нг / мл | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| шФРФ | PeproTech Inc | 100-18B | 20 нг / мл | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PDGF-AA | PeproTech Inc | 100-13A | 10 нг / мл | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PDL | Сигма | P6407 | 50 мкг / м | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PFA | Электрон наук микроскопии | 15712 | 2% | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Трипсин | Качество биологических препаратов | 118-087-721 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Папаин | Worthington | LK003178 | 20 Ед / мл | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ДНКазы флаконах | Worthington | LK003172 | 0,005% | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EBSS | Worthington | LK003188 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Продлить золото сDAPI | Invitrogen | P36931 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Таблица 1. Реагентов. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Таблица 2. Антитела (АТ), используемые для проточной цитометрии и иммуноцитохимия анализы антитела конъюгаты: PE, фикоэритрин, Петр, фикоэритрин Texas Red, AMCA, амино-метил-кумарин-ацетат, Cy, цианинового; FITC, изотиоцианат флуоресцеина Ig. Иммуноглобулина. . AF: Alexa Fluor; gαm: антимышиного; gαrb: козий анти-кролик; dαck: осел борьбе с курицей. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ссылки
- Messam, C. A., Hou, J., Gronostajski, R. M., Major, E. O. Lineage pathway of human brain progenitor cells identified by JC virus susceptibility. Ann. Neurol. 53, 636-646 (2003).
- Vescovi, A. L., Reynolds, B. A., Fraser, D. D., Weiss, S. bFGF regulates the proliferative fate of unipotent (neuronal) and bipotent (neuronal/astroglial) EGF-generated CNS progenitor cells. Neuron. 11, 951-966 (1993).
- Johe, K. K., Hazel, T. G., Muller, T., Dugich-Djordjevic, M. M., McKay, R. D. Single factors direct the differentiation of stem cells from the fetal and adult central nervous system. Genes Dev. 10, 3129-3140 (1996).
- McKay, R. Stem cells in the central nervous system. Science. 276, 66-71 (1997).
- Belachew, S., et al. Postnatal NG2 proteoglycan-expressing progenitor cells are intrinsically multipotent and generate functional neurons. J. Cell Biol. 161, 169-186 (2003).
- Almazan, G., McKay, R. An oligodendrocyte precursor cell line from rat optic nerve. Brain Res. 579, 234-245 (1992).
- Filipovic, R., Zecevic, N. Neuroprotective role of minocycline in co-cultures of human fetal neurons and microglia. Exp. Neurol. 211, 41-51 (2008).
- Goldman, S. A., Natesan, S. A niche-defying feat: induced oligoneogenesis in the adult dentate gyrus. Cell Stem Cell. 3, 125-126 (2008).
- Nunes, M. C., et al. Identification and isolation of multipotential neural progenitor cells from the subcortical white matter of the adult human brain. Nat. Med. 9, 439-447 (2003).
- Lyssiotis, C. A., et al. Inhibition of histone deacetylase activity induces developmental plasticity in oligodendrocyte precursor cells. Proc. Natl. Acad. Sci. U.S.A. 104, 14982-14987 (2007).
- Sim, F. J., Goldman, S. A. White matter progenitor cells reside in an oligodendrogenic niche. Ernst Schering Res. Found Workshop. , 61-81 (2005).
- Raff, M. C., Miller, R. H., Noble, M. A glial progenitor cell that develops in vitro into an astrocyte or an oligodendrocyte depending on culture medium. Nature. 303, 390-396 (1983).
- Windrem, M. S., et al. Progenitor cells derived from the adult human subcortical white matter disperse and differentiate as oligodendrocytes within demyelinated lesions of the rat brain. J. Neurosci. Res. 69, 966-975 (2002).
- Chen, Y., et al. Isolation and culture of rat and mouse oligodendrocyte precursor cells. Nat. Protoc. 2, 1044-1051 (2007).
- Armstrong, R. C. Isolation and characterization of immature oligodendrocyte lineage cells. Methods. 16, 282-292 (1998).
- Hu, B. Y., Du, Z. W., Li, X. J., Ayala, M., Zhang, S. C. Human oligodendrocytes from embryonic stem cells: conserved SHH signaling networks and divergent FGF effects. Development. 136, 1443-1452 (2009).
- Gard, A. L., Williams, W. C., Burrell, M. R. Oligodendroblasts distinguished from O-2A glial progenitors by surface phenotype (O4+GalC-) and response to cytokines using signal transducer LIFR beta. Dev. Biol. 167, 596-608 (1995).
- Hu, B. Y., Du, Z. W., Zhang, S. C. Differentiation of human oligodendrocytes from pluripotent stem cells. Nat. Protoc. 4, 1614-1622 (2009).
- Reubinoff, B. E., et al. Neural progenitors from human embryonic stem cells. Nat. Biotechnol. 19, 1134-1140 (2001).
- Pfeiffer, S. E., Warrington, A. E., Bansal, R. The oligodendrocyte and its many cellular processes. Trends Cell Biol. 3, 191-197 (1993).
- Zhang, S. C., Ge, B., Duncan, I. D. Tracing human oligodendroglial development in vitro. J. Neurosci. Res. 59, 421-429 (2000).
- Bradl, M., Lassmann, H. Oligodendrocytes: biology and pathology. Acta Neuropathol. 119, 37-53 (2010).
- Chong, S. Y., Chan, J. R. Tapping into the glial reservoir: cells committed to remaining uncommitted. J. Cell Biol. 188, 305-312 (2010).
- Jakovcevski, I., Filipovic, R., Mo, Z., Rakic, S., Zecevic, N. Oligodendrocyte development and the onset of myelination in the human fetal brain. Front Neuroanat. 3, 5 (2009).
- Rao, R. C., Boyd, J., Padmanabhan, R., Chenoweth, J. G., McKay, R. D. Efficient serum-free derivation of oligodendrocyte precursors from neural stem cell-enriched cultures. Stem Cells. 27, 116-125 (2009).
- D'Intino, G., et al. Triiodothyronine administration ameliorates the demyelination/remyelination ratio in a non-human primate model of multiple sclerosis by correcting tissue hypothyroidism. J. Neuroendocrinol. 23, 778-790 (2011).
- Cui, Q. L., et al. Human fetal oligodendrocyte progenitor cells from different gestational stages exhibit substantially different potential to myelinate. Stem Cells Dev. , (2012).
- Messam, C. A., Hou, J., Major, E. O. Coexpression of nestin in neural and glial cells in the developing human CNS defined by a human-specific anti-nestin antibody. Exp. Neurol. 161, 585-596 (2000).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены