Method Article
מערכת מוליד-נגזר Oligodendrocyte תרבות ממוח העוברי של אדם
In This Article
Summary
ראשוני, תאים אנושיים עובריים מופקים ממוח, multipotential progenitor להתרבות במבחנה תוך שמירה על היכולת להתמיין לתאי עצב והאסטרוציטים. עבודה זו מראה כי אבות עצביים יכולים להיגרם להבחין דרך שלבים שונים של שושלת oligodendrocytic ידי מיזוג עם גורמי גדילה נבחרים.
Abstract
בידול של אבות עצביים אדם לסוגי תאים עצביים וגליה מציע מודל ללמוד והשווה תקנה מולקולרית של התפתחות משפחה של תאים עצבית. בהרחבה במבחנה של אבות עצביים מרקמת מערכת עצבים המרכזיים של עובר כבר מאופיין היטב. למרות זיהוי והבידוד של אבות גליה מחומר אנושי בוגרים תת קורטיקלי לבן ופיתוח של תנאי תרבות שונות לבידול ישיר של אבות העובריים עצביים לתוך oligodendrocytes ייצור המיאלין, רכישת oligodendrocytes אדם מספיק לניסויים במבחנה נותר קשה. בידול של galactocerebroside + (GalC) וO4 + מבשר oligodendrocyte או תאי אב (OPC) מתאים מבשרים עצביים כבר דיווח על שימוש במוח עוברי שליש שני. עם זאת, התאים האלה אינם מתרבים בהיעדר תאי תמיכה כולל האסטרוציטים ונוירונים, והולכים לאיבוד במהירות לאורך הזמן בתרבות. הצורך נותר למערכת כדי לייצר תרבות תאים של השושלת המתאימה לניסויים במבחנת oligodendrocyte.
תרבות של oligodendrocytes האנושי הראשוני יכולה, למשל, להיות מודל שימושי ללמוד פתוגנזה של חומרים מזהמים כמו neurotropic polyomavirus האנושי, JCV, שin vivo מדביק תאים אלה. תאים בתרבית אלה גם יכולים לספק מודלים של מחל demyelinating אחרות של מערכת העצבים המרכזית (CNS). ראשוני, עוברי של אדם שמופק ממוח, ותאים עצביים multipotential להתרבות במבחנה, תוך שמירה על היכולת להתמיין לתאי עצב (נוירונים מוליד-derived, PDN) והאסטרוציטים (האסטרוציטים מוליד-derived, מחשבי כף יד) מחקר זה מראה כי אבות עצביים יכולים להיגרם להבדיל דרך כל שלבי התפתחות השושלת oligodendrocytic (oligodendrocytes מוליד-derived, PDO). אנחנו בתאים עצביים התרבות בתקשורת DMEM-F12 סרום נטול supplemented עם גורם טסיות נגזר גידול (PDGF-AA) גורם בסיסי גדילה (bFGF), סוניק קיפוד (שש), גורם neurotrophic 3 (NT-3), N-2 וtriiodothyronine (T3). את התאים בתרבית הם passaged בתאים 2.5e6 לצלוחיות 75cm בערך כל שבעה ימים. שימוש בתנאים אלה, רוב התאים בתרבית לשמור מורפולוגיה המאופיינת במספר תהליכים וסמנים מפורשים של תאים טרום oligodendrocyte, כגון A2B5 ו-O-4. כאשר אנו מסירים את גורמי הגדילה 4 (GF) (bFGF, PDGF-AA, ששש, NT-3) ולהוסיף תקשורת ממוזגת מPDN, התאים להתחיל לרכוש יותר תהליכים וסמנים ספציפיים מפורשים של בידול oligodendrocyte, כגון GalC ומיאלין חלבון בסיסי (MBP). בצענו אפיון הפנוטיפי באמצעות cytometry זרימה הססגונית לזהות סמנים ייחודיים של oligodendrocyte.
Protocol
הערה: לculturing השגרתי של אב עצבי ותאי שושלת oligodendrocytic, הדגירה מתבצעת על 37 מעלות צלזיוס ב5% 2 CO humidified אווירה. כל 2 ימים, הבינוני מוחלף בעזרת 50 עד 100% ממדיום טרי אם התרבות היא confluent 40-70%. בזמן confluency הקרוב, התרבויות הם passaged ב2-2.5e6/T75 בקבוק בדרך כלל על לוח זמנים שבועי.
1. הכנת הבקבוק המצופה
- כדי להכין צלוחיות מצופות לדלל 5 מ"ג של פולי-D-ליזין (PDL) ב100 מיליליטר מי deionized (DI-מים), ואז מעייל T75 צלוחיות עם 50 מיקרוגרם / מ"ל של PDL בטמפרטורת חדר (RT) בחושך. לאחר ½ 1 שעות, לשאוב PDL ולשטוף את צלוחיות פעם אחת עם DI-מים. תן לצלוחיות היבשות לפני זריעת התאים (טבלה 1).
2. החל התמיינות של תאי אב עצביים לתוך oligodendrocytes derived-מולידו (PDO)
הפרוטוקול הואolate בתאים CNS אדם מתואר בפרסום קודם וזה לא חלק מ1 בפרוטוקול זה. תאי אב במערכת עצבים מרכזיים אדם בודדו מtelencephalon של מוח 8-שבוע הריון של עובר, המתקבל בהתאם להנחיות NIH.
- תגדל אוכלוסיית multipotential של תאי אב עצביים בצלוחיות מצופות בPDL בינוני neurobasal בתוספת 25 ng / ml של bFGF ו20 ng / מיליליטר גורם צמיחת אפידרמיס (EGF) (איור 1 א). אל תשתמש בם אם גבוה יותר מקטע 11 (P11).
- התחל כדי לבדל את תאי אב העצביים כאשר התרבות היא כ 70% confluent.
- הפוך בינוני oligodendrocyte בידול מלא באמצעות מדיום סרום ללא DMEM / קותלי חזיר של F12 01:01 בתוספת סרום שור אלבומין, L-גלוטמין, גנטמיצין, רכיבי N2, T3, ששש, NT-3, bFGF, וPDGF-AA (טבלה 1) . מדיום זה יוגדר כבינוני Oligo עם גורמי גדילה (Oligo הבינוני + GF).
- הסר Progenתקשורת itor מהצלוחיות, לשטוף תאים פעם אחת עם פוספט נאגר מלוח (PBS), לאחר מכן להוסיף Oligo בינוני + GF (פרטים מתוארים ב2.3) כדי להתחיל בידול oligodendrocyte. רק תאים המחויבים לשושלת oligodendrocytic יגדלו (1B איור). תרבות התאים במדיום הזה במשך 3 שבועות.
- בכל שבוע, כאשר התאים נמצאים בנקודת מפגש 90-95%, מעברם באמצעות טריפסין (0.05%)-EDTA (0.1%) (4 מ"ל לבקבוק T75). להעביר את כל בינונית מהתאים שpassaged לתוך צינור חרוטי 50 מ"ל; בינוני מזגן זה ישמש כדי להרוות טריפסין. ודא שלא לייבש את התאים. ואז להוסיף טריפסין.
- דגירת תאים בטריפסין למשך 5 דקות בRT, הכה בעדינות על הבקבוק מספר פעמים כדי לעזור ניתוק תא.
- להרוות את טריפסין על ידי הוספה של 4-5 מיליליטר מדיום מותנה לבקבוק עם תאים המשפחתיים.
- להעביר את המדיום ואת התאים לאותו הצינור 50 מיליליטר חרוטים. צנטריפוגה הבינונית והתאים של 1,200 סל"ד (~300 XG) למשך 5 דקות בRT.
- לשאוב supernatant, resuspend תא הגלול, בעדינות להטות את הצינור, ולאחר מכן להוסיף את המקור Oligo טרי + GF. עדינות פיפטה הבינונית ותאים למעלה ולמטה כדי להפוך את השעית תא אחידה.
- ספירת התאים, ו2.5e6 העברה לכל T75 בקבוק חדש PDL מצופה.
3. שלב סופי בבידול של oligodendrocytes
- לאחר 3 שבועות של התרבות בOligo בינוני + GF, כאשר התאים נמצאים בנקודת מפגש 70-80%, להתחיל את התהליך הסופי של התמיינות (התרשים 1C).
- הכן בינוני באותה הדרך כמו Oligo הבינוני + GF אך מבלי להוסיף 4 GF: ששישה, NT-3, bFGF וPDGF-AA. המדיום הזה ללא 4 GF יוגדר כבינוני Oligo - GF.
- לשאוב את מדיום Oligo + GF מהבקבוק, ולשטוף פעם עם PBS ולאחר מכן להוסיף בנפח כולל של 16 מ"ל של מדיום, ש¾ (12 מ"ל) הוא Oligo בינוני - GF ו¼ (4 מ"ל) הוא מדיום מותנה PDN, עבור 6-10 ימים). השימוש במדיום מותנה מPDN אינו חיוני לתהליך ההתמיינות או להישרדות של התאים. אנחנו למעשה ציינו כי קשר היחיד ישיר של PDO עם תאי PDN בניסויי שיתוף התרבות הייתה השפעה על משך הישרדות PDO. זמן ההישרדות בOligo בינוני - GF עשוי להתמשך, לשבועות או שלושה, אם תאי PDO הם שיתוף תרבית עם תאים-PDN. הפרוטוקול להבדיל ובתאים עצביים אדם לPDN מתואר בפרסום קודם וזה לא חלק מ1 בפרוטוקול זה. נסיגה גורם גדילה מהתוצאות הבינוניות התרבות בתרבות מובחנת בהדרגת תאים עם תהליכים מרובים (1D איור).
4. Assay הזרימה cytometry
בדיקת זרימת cytometry משווה את הרכישה של סמני oligodendrocyte במהלך תהליך ההתמיינות במערכת יחסים עם אלו של אוכלוסיית הוריהם.
- השתמש פרו עצביgenitors כשליטה. תאי זרע PDO ב2.5x10 6 תאים בשתי T75 צלוחיות מצופות ב- D-ליזין פולי בOligo הבינוני + GF.
- שבוע לאחר מכן, החלף בינוני עם בינוני Oligo טרי + GF בצלוחיות כתרבות שליטה לכדאיויות תא, בעוד צלוחיות אחרות היו Oligo בינוני - GF.
- כדי לנתק את תאי PDO בשני אמצעי התקשורת להשתמש 20 U / מ"ל של פפאין וטריפסין לא. הסיבה לכך היא פפאין יש השפעה עדינה על התאים במהלך דיסוציאציה שימור המורפולוגיה התאית.
- הוסף 5 מ"ל של תמיסת המלח המאוזנת של ארל (EBSS) לבקבוקון פפאין. הנח את הבקבוקון על 37 מעלות צלזיוס למשך 10 דקות או עד שהוא נמס לגמרי פפאין והפתרון נראה ברור. זהו פתרון פפאין נהג לנתק את התאים.
- הוסף 0.5 מ"ל של EBSS לDeoxyribonuclease בקבוקוני (DNase) (טבלה 1). מערבב בעדינות. הוסף 0.25 מ"ל של פתרון זה לבקבוקון של פפאין המומס. התכשיר מכיל ריכוז סופי של כ 20 U / ml פפאין ו0.005% DNase.
- פתרון המקום פפאין (כמתואר לעיל) על תאים ולדגור על 37 מעלות צלזיוס במשך 15-30 דקות; לפקח על הניתוק של התאים באמצעות מיקרוסקופ. עצור את התגובה עם 5 מ"ל של מדיום עם או בלי GF וצנטריפוגה בסל"ד 1200 עבור 7 דקות.
- העברת כדורים סלולריים משתי הצלוחיות לשני צינורות פוליפרופילן 5 מ"ל שונים ורחץ אותם במדיום הפיזיולוגי הנורמלי (NPM: 145 המ"מ NaCl, 5 המ"מ KCl, 1.8 mM CaCl 2, 10 מ"מ וHepes הגלוקוז mM 10) בתוספת 1 מ"ג / מ"ל שור אלבומין (NPM + BSA).
- לבצע משטח immunostaining ב 4 מעלות צלזיוס למשך 20 דקות באמצעות נוגדנים ספציפיים עיקריים וכראוי לטיטרציה A2B5, O4, GalC (טבלה 2).
- שטפו תאים עם NPM + BSA ב 4 מעלות צלזיוס למשך 5 דקות ודגירתם עם נוגדנים ספציפיים משניים ב4 מעלות צלזיוס למשך 20 דקות (טבלה 2).
- להכתים אנטיגנים תוך תאיים כולל nestin, גליה fibrillary חומץ חלבון (GFAP), מעמד שלישי ויהיהת"א;-טובולין, וחלבון המיאלין בסיסי (MBP) (טבלה 2), לתקן את התאים בparaformaldehyde 2% (PFA) במשך 20 דקות בRT וpermeabilize עם אתנול 70% קר במשך 15 דקות ב -20 ° C.
- שטוף תאים עם 1x PBS ו דגירה עם נוגדנים ספציפיים משניים (טבלה 2).
- כדי להבחין בין תאים שלמים ופסולת subcellular במהלך ניתוח cytometry זרימה, תאים עם כתם 4,6-diamidino-2-phenyllindole, dihydrochloride (DAPI) (חיים טכנולוגיים, גרנד איילנד, ניו יורק).
- באופטימיזציה של הפרוטוקול לעיל, בצעו את כל ניסויי הבקרה המתאימות על מנת לאשר את הספציפיות של כל immunoreagent. בקצרה, לנוגדנים שכותרתו ישירות, השליטה השלילית המתאימה הייתה נוגדן ישירות מצומדת של אותה כיתת אימונוגלובולינים אלוטיפ (או תת) והצמוד fluorochrome כנוגדן ראשוני (כלומר, שליטת אלוטיפ). לimmunostaining העקיף של נוגדנים עיקריים, השליטה השלילית w המתאיםכנוגדן מצומד לfluorochrome עניין שממוקד ברמת אימונוגלובולינים (או תת) של המארח שבו הנוגדן הראשוני נוצר דווקא משני. כאשר נוגדנים עיקריים ממארחים מרובים (עכבר, ארנבת, עוף) היו בשימוש יחד, השתמש בנוגדן המשני מיקוד הנוגדן הראשוני של כל מארח וכל נוגדן משני השתמש היה לחצות adsorbed-בדרך כלל נגד נוגדנים מהצבאות האחרים כדי למזער צולב תארח immunoreactivity. הפקדים החיוביים כללו immunostaining ישיר או עקיף של הכנות סלולריות הידועות לבטא את האנטיגנים של עניין או באמצעות immunoreactions ישיר או עקיף עם נוגדנים הספציפיים לאנטיגנים אלה העיקריים. שיטות אופטימיזציה הנ"ל בוצעו פעם אחת עבור כל סוג של immunostaining ניסויים. immunoreactions הבקרה עולה כי אין immunoreactivity הצולב epitope משמעותי בין נוגדנים ראשוניים ומשניים. cytometry הזרימה בוצע באופן אחידתאים מושעים כותרתו fluorescently באמצעות FACVantage SE תא סדרן (BD Biosciences, סן חוזה, קליפורניה) מצויד בשלושת לייזרים, המספקים אורכי גל עירור מכוון ל488 ננומטר, 647 ננומטר, וUV רחב (351-364 ננומטר) (איור 2) .
5. Assay immunofluorescence
הערה: לניסויי immunofluorescence, PDO מצופים בOligo הבינוני + GF או Oligo בינוני - GF ב2.5e5 ב 6 גם צלחות מצופות PDL. התאים הם קבועים ב2% PFA בנקודתי זמן שונים לאחר נסיגה של גורמי גדילה. נוגדן כתם מבוצע על 6 גם צלחות פלסטיק במקום זכוכית coverslips.
- הסר את המדיה ולהוסיף 2% PFA. דגירה במשך 10 דקות ב RT. השלך PFA. שטוף תאים 3 פעמים עם PBS, 5 דקות בכל פעם. יש להיזהר שלא לייבש את התאים.
- Permeabilize תאים לסמנים תאיים באמצעות 0.25% פתרון טריטון ב PBS עבור 10 דקות ב RT.
- כדי למנוע, תאים לחסום מחייבים שאינם ספציפיים ואו 10 דקות עם HHG (1 חיץ mM HEPES, סרום סוס 2%, וסרום עיזים 10% בתמיסת המלח המאוזנת "הנקס). דלל נוגדנים ספציפיים עיקריים (טבלה 2) לריכוז שנקבע מראש בHHG. הנח נוגדנים מדוללים על גבי תאים. דגירת 1 שעות בRT בייקר או ב 4 ° C למשך הלילה.
- שטוף תאים 3 פעמים עם PBS, למשך 5 דקות בכל פעם. דלל נוגדנים משניים מתאימים (טבלה 2) בשילוב עם fluorochrome לריכוז שנקבע מראש בHHG. הנח את התערובת של נוגדנים משניים מדוללים על גבי תאים. דגירת 1 שעות בRT על שייקר בחושך.
- שטוף תאים 3 פעמים עם PBS, למשך 5 דקות בכל פעם.
- כדי להימנע מphotobleaching להוסיף 10 μl של להאריך זהב עם DAPI לתאים ומקום coverslip זכוכית על ראשם. דמיינו תאים שכותרתו באמצעות מיקרוסקופ פלואורסצנטי Axiovert 200 מ'(Zeiss, Thornwood, ניו יורק) (איור 3).
תוצאות
חשוב מאוד להתחיל את תהליך הבידול מתרבות 70% -80% confluent העצבית מוליד תא (איור 1 א). תאים רבים יגוועו לאחר שינוי התרבות הבינונית ממוליד עד בינוני Oligo שכן הוא כולל גורמי גדילה ספציפיות. זה מצביע על כך שהצמיחה של תאי אב עצביים אינה מחויבים לפנוטיפ oligodendrocytic לא להיות נתמכת על ידי המדיום החדש (1B איור). הדגירה בOligo בינוני + GF במשך שבוע אחד הביאה תרבות ביניים מציגה, מורפולוגיה דו קוטבית צרה (האיור 1B). התאים נשמרים בOligo בינוני + GF ל3-4 שבועות (התרשים 1C). נסיגה גורמת גדילה מהתרבות הבינונית הביאה תרבות מובחנת בהדרגה של תאים עם תהליכים מרובים (1D איור). cytometry הזרימה משמש לייצוג כמותי של הנתונים.
איורים 2 א, 2B ו-2C להוכיח כי רוב האבות עצביים מתבטאים בתאי גזע הסמן nestin neuroepithelial, ואילו רק אוכלוסיות קטנות הביעו סמני שושלת-מגבילים כגון סמן GFAP astrocyte (איור 2 א), סמן הכיתה השלישית העצבי β-טובולין (איור 2 ב ') , או על סמן oligodendrocyte O4 (האיור 2C). כאשר מדיום התרבות הוחלף בOligo הבינוני + GF ותאים בתרבית ל1 שבוע, ירד ביטוי nestin וגדל A2B5 ביטוי ניתן לראות (האיור 2D). A2B5 הוא סמן מקדים neuroglial. לשם השוואה, 2 שבועות לאחר החלפה בינונית, ביטוי nestin ירד עוד יותר וA2B5 ביטוי לבד גדל (2E איור), כמו גם הביטוי של סמן נוסף oligodendrocyte, O4 (האיור 2F). ימי גמילת גורם גדילת הודעה, O4 ביטוי כמו גם הגדיל את הביטוי של GalC,סמן oligodendrocyte מאוחר (האיור 2G). נסיגת שישה ימי הודעה לגורם גדילה, שיתוף והביטוי של O4 GalC מוגברת (איור 2H) והוא דומה לשיתוף הביטוי לGalC וMBP (האיור ט 2). Immunostaining רב epitope מגלה כי יותר ממחצית מהתאים בתרבית מביעה MBP (איור י 2). עדות נוספת לבידול PDO התאפיינה, באמצעות assay immunofluorescence, מהגידול הזמני של ביטוי MBP בתאים אלה לאחר נסיגת גורם גדילה (איור 3A-C). לסיכום, תאי אב עוברי עצביים אדם מסוגלים להתרבות במבחנה, תוך שמירה על היכולת להתמיין לסוגי תאי מוח 3 גדולים (איור 4).

איור 1. שלב ניגוד מיקרוסקופיה of (A) בתאי אב עצביים בתרבית במדיום מוליד; (B) ותאים עצביים הגדלים בOligo בינוני + GF במשך שבוע התערוכה, מורפולוגיה דו קוטבית צרה שינתה; (C) oligodendrocytes בדיל מוליד נגזרות גדל במשך 3 ימים בOligo הבינוני לאחר מורפולוגיה גורם גדילת נסיגת תערוכת oligodendrocyte מאופיין במספר רב של תהליכים. 20x הגדלה.
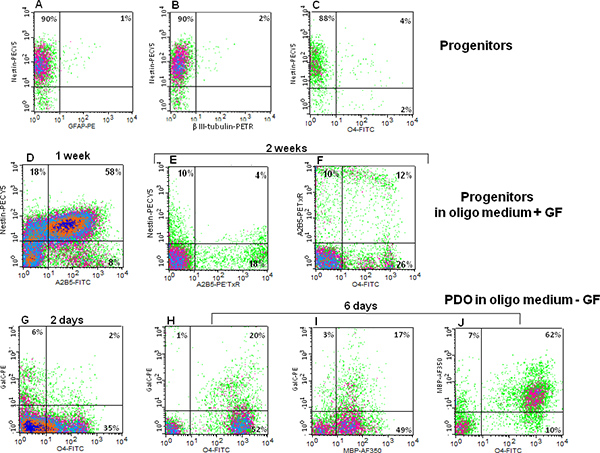
איור 2 ניתוח cytometry זרימה של תאי אב עצביים משותף המבטא את מבשר תאי הסמן Nestin (כל הצירים האנכיים) עם:. () GFAP הסמן astrocytic; (ב) טובולין III β הסמן העצבי, וכן (ג) oligodendrocytic סמן O4; (ד ') ותאים עצביים גדלו במשך שבוע בOligo תקשורת + GF שיתוף המפורש nestin וA2B5; (E) nestin וA2B5 שיתוף ביטוי לאחר שבועות של צמיחת אבות עצביות בOligo בינוני + GF (F) A2B5 וO4 שיתוף ביטוי לאחר שבועות של צמיחת אבות עצביות בOligo הבינוני + GF; (G) 2 ימים לאחר נסיגת גורם גדילה, סמנים שונים oligodendrocyte של בידול, O4 וGalC, באים לידי ביטוי. שישה ימים לאחר נסיגת גורם גדילה (H) שיעור מוגבר של תאים הם כפולים חיוביים לO4 וGalC; (אני) כפולים חיוביים לGalC וMPB; ו( J) כפול חיובי לO4 וMBP. AJ הוא נציג של ארבעה ניסויים עצמאיים. לחץ כאן לצפייה בדמות גדולה.

איור 3. Immunofluor העקיףמכתים escence של oligodendrocytes מוליד-derived לMBP () 2 ימים, (ב) 5 ימים, ו( C, D) 9 ימים לאחר נסיגת גורם גדילה. (ד) מייצג את תמונת השלב של תרבות 9 ימים בOligo הבינוני - GF ו( E) היא גדלה של הקופסה הלבנה של אותה תמונה (A, B) 20x גדלה; (C, D) הגדלת 32x..
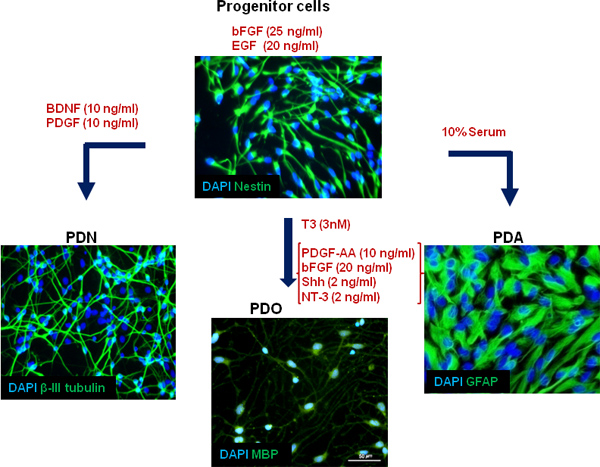
איור 4. ייצוג סכמטי של מודל תרבית התאים שלנו. ראשוני, אנושי עוברי מופק ממוח, ותאים עצביים multipotential להתרבות במבחנה תוך שמירה על גמישותם. שימוש תנאי תרבות שונים, ותאים עצביים יכולים להתמיין לתאי עצב (PDN), האסטרוציטים (PDA) וoligodendrocyte (PDO), כפי שמוצג על ידי ספציפי differentiatסמני יון.
Discussion
פרוטוקול זה מתאר כיצד להפיק oligodendrocytes העוברי מתאי אב עצביים עיקריים אדם ולאפיין פנוטיפ שלהם הוא באמצעות cytometry זרימה ומכתימה immunofluorescence. הגידול וההתרחבות של אבות עצביים ממערכת עצבים מרכזיים בעובר תוארה 1-4 טובים מאוד. עם זאת, קבלת oligodendrocytes אדם מספיק לניסויים במבחנה עדיין קשה, למרות שזה אפשרי לזהות ולבודד מבשרי גליה מחומר לבן אדם בוגר 5-13. היו ניסיונות שונים בהתפתחות של תנאי תרבות שונות לבידול ישיר של אבות עצביים עובריים לייצור מיאלין oligodendrocytes 14-21. פרוטוקול זה ממשיך ומתאר תאי nestin חיוביים עצביים אב המבטאים את סמן O4 (איור 2) כאשר גדל במשך 3 שבועות במדיום סרום ללא תוספת עם גורמים נבחרים צמיחה (PDGF-AA, bFGF, שש, וNT-3), tכובע הוא חיוני לשגשוג וההישרדות של מבשרי oligodendrocyte 22-24. להסרה של גורמי גדילה אלו בO4 תאים + הביאה בידול וביטוי נוסף לרכיבי המיאלין (galactocerebroside וMB). בנוסף, הביטוי של סמני בידול oligodendrocyte עולה בקנה אחד עם שינויים מורפולוגיים מתאים שהופיעו בהתחלה צרה ודו קוטבי (האיור 1B) לתאים שהופכים לmultipolar עם תהליכים מפותחים (התרשים 1C). ההסרה של גורמי גדילה נוספת כדי לאפשר לשלבים הסופיים של בידול התבססה על מחקרים שנעשו בעכבר והן 15,25 אנושיים. הנוכחות של triiodothyronine (T3) היא חשובה להישרדות והבידול של oligodendrocytes 26 בזמן שאנחנו הבחנו כי ההסרה מארבעת גורמי הגדילה הייתה צורך הביטוי של סמנים סופיים של בידול. זה בהשוואה לתאים המשיכו בOligo הבינוני + GFsa שליטה.
אנחנו לא הראשונים שתארנו את ההתמיינות של תאי אב לתאים עצביים multipotent oligodendrocyte בתגובה לאותות כגון שש וbFGF 24. הדיווחים קודמים הראו כי קליפת מוח oligodendrogenesis מתחיל בסביבות גיל הריון 10 שבועות בבני אדם 24 עם הקיבולת של oligodendrocytes העוברי האנושי לmyelinate להגדיל באופן יחסי לגיל הריון 22. בידול של galactocerebroside + + וO4 תאים מבשרים oligodendrocyte מתאי אב עצביים כבר דיווח על שימוש במוח עוברי שליש שני 21,27. עם זאת, התאים האלה אינם מתרבים בהיעדר תאי תמיכה כולל האסטרוציטים ונוירונים, והולכים לאיבוד במהירות לאורך הזמן בתרבות 21. המערכת שלנו תומכת בהקמתה של GalC + וMBP + תאים מתרבות העוברית של אדם מגיל 8 שבועות הריון. כמו כן תארנו כי differeoligodendrocytes ntiated יכול להיות מתורבת במבחנה ללא צורך של תמיכה בתאים כהאסטרוציטים או נוירונים, למרות שיתוף הטיפוח עם הנוירונים יכול להאריך את ההישרדות של oligodendrocytes המובחן. עוד אחד יתרונות של פרוטוקול זה הוא האפשרות לטפח מספר גדול של תאים המבטאים את הסמן + O4 שניתן לגדל וpassaged בתרבות במשך שבועות, תוך שמירה על הפנוטיפ שלהם. באותו הרגע O4 התאים + האלה יכולים להיות דחף נוסף בשלב האחרון של התמיינות כאשר גורמי הגדילה יוסרו מבינוני. הפרוטוקול המפורט במאמר זה מתייחס לצורך בשושלות מתאימות לניסויים במבחנת oligodendrocyte. יתר על כן, אנו מאמינים שזיהוי גורמים ספציפיים אשר יגרמו למפל הבידול של אבות עצביים לכיוון oligodendrocyte מולידו נגזר הוא חשוב להבנת מנגנונים התאיים ומולקולריים של התפתחותיתמעברים. היא עשויה גם לשמש ככלי חשוב ללימוד הפרעות demyelinating ואינטראקציות סלולריות וירוס מארח מתייחסות לפתוגנזה של וירוסי neurotropic אנושיים כמו JCV.
Disclosures
אין ניגודי האינטרסים הכריזו.
Acknowledgements
מחקר זה נתמך על ידי תכנית המחקר העירונית, במכונים הלאומיים לבריאות, NINDS. המחברים מבקשים להודות לכל אנשי המעבדה לרפואה המולקולרית ומדעי המוח, ריק דרייפוס עזר עם מיקרוסקופיה וניפוי ג פמלה לסיוע בעריכה.
Materials
| Name | Company | Catalog Number | Comments | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| שם המגיב | חברה | מספר קטלוגים | ריכוז סופי | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DME / קותלי חזיר של F12 01:01 | אומגת מדען | DM-251 | 1X | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| שור אלבומין | סיגמא | A9418 | 1% | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| גנטמיצין | איכות ביולוגית | 120-098-031 | 50 מיקרוגרם / מ"ל | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| L-גלוטמין | איכות ביולוגית | 118-084-061 | 2 מ"מ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T3 | סיגמא | T2877 | 3 ננומטר | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| רכיבי N2 | Gibco BRL | 17502 | 1:100 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NT-3 | PeproTech Inc | 450-03 | 2 ng / ml | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ששישה | מערכת מו"פ | 1314-SH/CF | 2 ng / ml | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| bFGF | PeproTech Inc | 100-18B | 20 ng / ml | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PDGF-AA | PeproTech Inc | 100-13A | 10 ng / ml | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PDL | סיגמא | P6407 | 50 ק"ג / מ ' | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PFA | מדעי מיקרוסקופ אלקטרונים | 15712 | 2% | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| טריפסין | איכות ביולוגית | 118-087-721 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| פפאין | וורטינגטון | LK003178 | 20 U / ml | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| בקבוקוני DNase | וורטינגטון | LK003172 | 0.005% | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EBSS | וורטינגטון | LK003188 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| להאריך זהב עםDAPI | Invitrogen | P36931 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
טבלת 1. ריאגנטים. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
. טבלה 2 נוגדנים (ABS) המשמשים לזרימה cytometry ומבחני immunocytochemistry conjugates נוגדנים: PE, phycoerythrin; פטר, phycoerythrin טקסס אדומה; AMCA,-methyl-coumarin-יצטט אמין; סי, cyanine; FITC, isothiocyanate fluorescein IG:. אימונוגלובולינים. . AF: Alexa פלואוריד; gαm: עיזים אנטי עכבר; gαrb: עיזים נגד ארנב; dαck: חמור אנטי עוף. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
References
- Messam, C. A., Hou, J., Gronostajski, R. M., Major, E. O. Lineage pathway of human brain progenitor cells identified by JC virus susceptibility. Ann. Neurol. 53, 636-646 (2003).
- Vescovi, A. L., Reynolds, B. A., Fraser, D. D., Weiss, S. bFGF regulates the proliferative fate of unipotent (neuronal) and bipotent (neuronal/astroglial) EGF-generated CNS progenitor cells. Neuron. 11, 951-966 (1993).
- Johe, K. K., Hazel, T. G., Muller, T., Dugich-Djordjevic, M. M., McKay, R. D. Single factors direct the differentiation of stem cells from the fetal and adult central nervous system. Genes Dev. 10, 3129-3140 (1996).
- McKay, R. Stem cells in the central nervous system. Science. 276, 66-71 (1997).
- Belachew, S., et al. Postnatal NG2 proteoglycan-expressing progenitor cells are intrinsically multipotent and generate functional neurons. J. Cell Biol. 161, 169-186 (2003).
- Almazan, G., McKay, R. An oligodendrocyte precursor cell line from rat optic nerve. Brain Res. 579, 234-245 (1992).
- Filipovic, R., Zecevic, N. Neuroprotective role of minocycline in co-cultures of human fetal neurons and microglia. Exp. Neurol. 211, 41-51 (2008).
- Goldman, S. A., Natesan, S. A niche-defying feat: induced oligoneogenesis in the adult dentate gyrus. Cell Stem Cell. 3, 125-126 (2008).
- Nunes, M. C., et al. Identification and isolation of multipotential neural progenitor cells from the subcortical white matter of the adult human brain. Nat. Med. 9, 439-447 (2003).
- Lyssiotis, C. A., et al. Inhibition of histone deacetylase activity induces developmental plasticity in oligodendrocyte precursor cells. Proc. Natl. Acad. Sci. U.S.A. 104, 14982-14987 (2007).
- Sim, F. J., Goldman, S. A. White matter progenitor cells reside in an oligodendrogenic niche. Ernst Schering Res. Found Workshop. , 61-81 (2005).
- Raff, M. C., Miller, R. H., Noble, M. A glial progenitor cell that develops in vitro into an astrocyte or an oligodendrocyte depending on culture medium. Nature. 303, 390-396 (1983).
- Windrem, M. S., et al. Progenitor cells derived from the adult human subcortical white matter disperse and differentiate as oligodendrocytes within demyelinated lesions of the rat brain. J. Neurosci. Res. 69, 966-975 (2002).
- Chen, Y., et al. Isolation and culture of rat and mouse oligodendrocyte precursor cells. Nat. Protoc. 2, 1044-1051 (2007).
- Armstrong, R. C. Isolation and characterization of immature oligodendrocyte lineage cells. Methods. 16, 282-292 (1998).
- Hu, B. Y., Du, Z. W., Li, X. J., Ayala, M., Zhang, S. C. Human oligodendrocytes from embryonic stem cells: conserved SHH signaling networks and divergent FGF effects. Development. 136, 1443-1452 (2009).
- Gard, A. L., Williams, W. C., Burrell, M. R. Oligodendroblasts distinguished from O-2A glial progenitors by surface phenotype (O4+GalC-) and response to cytokines using signal transducer LIFR beta. Dev. Biol. 167, 596-608 (1995).
- Hu, B. Y., Du, Z. W., Zhang, S. C. Differentiation of human oligodendrocytes from pluripotent stem cells. Nat. Protoc. 4, 1614-1622 (2009).
- Reubinoff, B. E., et al. Neural progenitors from human embryonic stem cells. Nat. Biotechnol. 19, 1134-1140 (2001).
- Pfeiffer, S. E., Warrington, A. E., Bansal, R. The oligodendrocyte and its many cellular processes. Trends Cell Biol. 3, 191-197 (1993).
- Zhang, S. C., Ge, B., Duncan, I. D. Tracing human oligodendroglial development in vitro. J. Neurosci. Res. 59, 421-429 (2000).
- Bradl, M., Lassmann, H. Oligodendrocytes: biology and pathology. Acta Neuropathol. 119, 37-53 (2010).
- Chong, S. Y., Chan, J. R. Tapping into the glial reservoir: cells committed to remaining uncommitted. J. Cell Biol. 188, 305-312 (2010).
- Jakovcevski, I., Filipovic, R., Mo, Z., Rakic, S., Zecevic, N. Oligodendrocyte development and the onset of myelination in the human fetal brain. Front Neuroanat. 3, 5 (2009).
- Rao, R. C., Boyd, J., Padmanabhan, R., Chenoweth, J. G., McKay, R. D. Efficient serum-free derivation of oligodendrocyte precursors from neural stem cell-enriched cultures. Stem Cells. 27, 116-125 (2009).
- D'Intino, G., et al. Triiodothyronine administration ameliorates the demyelination/remyelination ratio in a non-human primate model of multiple sclerosis by correcting tissue hypothyroidism. J. Neuroendocrinol. 23, 778-790 (2011).
- Cui, Q. L., et al. Human fetal oligodendrocyte progenitor cells from different gestational stages exhibit substantially different potential to myelinate. Stem Cells Dev. , (2012).
- Messam, C. A., Hou, J., Major, E. O. Coexpression of nestin in neural and glial cells in the developing human CNS defined by a human-specific anti-nestin antibody. Exp. Neurol. 161, 585-596 (2000).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved