Method Article
Изоляция базальных клеток и подслизистой Клетки Канальные железы от трахеи мыши
В этой статье
Резюме
Здесь мы демонстрируем наш протокол для выделения базальной и подслизистого железы воздуховодов клетки из мышиных трахеи. Мы также продемонстрировать метод инъекционного стволовых клеток в спинной панели жира мыши, чтобы создать В естественных условиях Модель подслизистого регенерации железы.
Аннотация
Большая дыхательных путей непосредственно в контакте с окружающей средой и, следовательно, подвержены травмам от токсинов и инфекционных агентов, которые мы дышим в 1. Большая дыхательных путей, следовательно, требуют эффективного механизма ремонт защитить наш организм. Этот процесс восстановления происходит из стволовых клеток в дыхательных путях и выделения стволовых клеток из дыхательных путей имеет важное значение для понимания механизмов восстановления и регенерации. Это также важно для понимания ненормального ремонт, который может привести к заболеваниям дыхательных путей 2. Цель этого метода заключается в изоляции роман популяции стволовых клеток из мышей трахеи подслизистого протоки железы и разместить эти клетки в пробирке и в естественных системах модель для определения механизма ремонт и восстановление подслизистых желез 3. Это производство показывает методы, которые могут быть использованы для выделения и анализа канала и базальных стволовых клеток из больших дыхательных путей 3. Это позволит намдля изучения заболеваний дыхательных путей, таких как муковисцидоз, бронхиальная астма и хроническая обструктивная болезнь легких. В настоящее время не существует методов для выделения подслизистых желез канала клетки и нет в естественных моделей для изучения регенерации подслизистых желез.
протокол
План шаги
1. Вскрытие трахеи
2. Очистка трахеи и резко его
3. Ферменты пищеварения и переработки в суспензии отдельных клеток
4. Окрашивание для FACS и сортировки
5. Обработка отсортированных клеток в естественных условиях и в пробирке моделей
1. Вскрытие трахеи
- Усыпить мыши с внутрибрюшинной инъекции 0,1 мл mg/0.2 пентобарбитала.
- Разрезать брюшной стенки, и двигаться кишечник в сторону, чтобы разоблачить брюшной аорты, а затем вскрыть его.
- Откройте сундук, сокращая через диафрагму и передней грудной стенки с обеих сторон, чтобы открыть сердце и легкие. Продолжайте резать в шею удаления жира и слюнных желез, чтобы разоблачить трахеи.
- Удалить тимуса и сократить легких от его соединения ниже и сзади. Separели трахеи с пищеводом, вставив между ними щипцы затем разрезать трахею в ее верхней части над самым его связь с гортанью. Затем, удерживая трахеи с щипцами и анализировать его от привязанности и продолжают вниз, чтобы удалить его с сердца и легких ан-блок. Вырежьте сердце и легкие рядом с рубчиком, чтобы включить большую часть правого и левого главных бронхов.
- Поместите трахеи в небольшой чашке Петри содержащие накопительной среды на льду.
2. Очистка трахеи и резко его
- Под микроскопом рассечение, используйте очень тонкий момент щипцами (№ 5) и Vannas Тюбингена ножницы (ФСТ 15003-08 finescience.com) для очистки трахеи от всех других тканей прилагается к нему. Это включает в себя: лимфатические узлы, возвратный гортанный нерв, жиров, щитовидной железы и остальных легочных сосудов. В верхней части трахеи требует особого внимания, для удаления больших хрящей гортани без ущерба для крупнейших кучу SMG, которые подали между хрящом перстневидного и первый трахеи хрящевой кольца (C1) 4.
- Вырезать трахеи в верхней части и нижней части между С4 и С5, а затем разрезать обе части через просвет трахеи.
3. Пищеварение фермента и обработки в суспензии отдельных клеток (SCS)
- Инкубируйте нижней части трахеи в 1 мл 16 U диспазы в трубку Eppendorf при комнатной температуре (RT) в течение 30 мин, как описано выше 5. Затем добавить 0,5 мг / мл ДНКазы I в DMEM в течение дополнительных 20 минут при комнатной температуре.
- Снимите переваривается трахеи на свежий сбор среду в стерильные чашки Петри, и лишить поверхности эпителия под рассекает микроскопом. С помощью пипетки перенести среде, содержащей лишен эпителия в 50 мл коническую трубку.
- Спином вниз лишен эпителия при 1000 мкг при 4 ° C. Удалить супернатант и добавить 0,1% трипсина / ЭДТА и инкубируют при встряхивании йэлектронной трубы в 37 ° С инкубатор (200 оборотов в минуту) в течение 30 мин. После инкубации, используя 1.000 мкл наконечник, пипетки вверх и вниз, чтобы разбить скопления и образуют единую клеточной суспензии.
- Установите верхний трахеи в коническую пробирку, содержащую 1 мл 0,15% проназа. Затем инкубировали при 4 ° С в течение 4 часов.
- Аккуратно вихревой трубки, а затем поместить в трахею в свежей среде, сбор и подтвердить под рассекает микроскопом, что есть полный отрыв от поверхности эпителия (SE).
- Фарш трахеи с тонкой ножницы, чтобы открыть SMG отсеков, а затем инкубировать в течение еще одного часа при комнатной температуре проназа с медленным встряхивании.
- Спином вниз трахеи ткани, удалить проназа, добавить 0,1% трипсина / ЭДТА и инкубируют при 37 ° С в течение 30 мин при встряхивании, как указано выше.
- Прохождение усваивается клетками, скопления и все оставшиеся куски желез через 20G, 23G и 26G иглы с помощью 10 мл шприца. Повторите пассажи несколько раз с каждой иглы размером доуйти в отставку. Теперь, большинство клеток должно быть в SCS.
- Фильтр суспензии через 40 мкм фильтр затем промыть фильтр и спином вниз клетки. Тогда восстановить клетки в соответствующих объемов среды, рассчитывать клеток и немедленно приступить к FACS окрашивания и сортировки. Не оставляйте клеток в 4 ° C или на льду в течение нескольких часов, потому что мы обнаружили, что это влияет на жизнеспособность и существенно снижает сферу формирования эффективности.
4. Окрашивание для FACS и сортировка
- Возьмите достаточное количество клеток для подготовки неокрашенных и окрашенных одной трубы компенсации, то пятно остальной части клетки с первичными антителами, козы Trop2 и крысы ITGA6, в течение 15 мин при комнатной температуре. Затем промыть водой с PBS или сбора среду, удаления супернатанта очень тщательно и нарушают клеточный осадок.
- Пятно с соответствующими вторичными антителами, инкубировать в темноте при комнатной температуре в течение 10 мин, промыть и удалить супернатант, а затем разорвать гранул.
- На FACSARIA, после изменения настроек напряжения и компенсации, ворота из мусора, очень маленькие клетки, клетки дублетов и мертвых клеток. Тогда, большинство клеток от SE должно быть положительным TROP2 в то время как 20-50% SMG клетки будут TROP2 + 6.
- Установить сортировку ворота для Trop2 ITGA6 + + клеток от SE (базальные клетки) и Trop2 + клеток (+ /-ITGA6 положительных клеток) от SMG (канал клеток).
5. Обработка Упорядочить Клетки для: экстракорпоральное культуры и в естественных условиях модели
5.1 В пробирке сфере формирования культуры 5-9
- Смешать 100 мкл "Фактор Роста уменьшить Matrigel" со 100 мкл полной среды 10,11 (см. Таблицу 1), содержащее до 50.000 отсортированных клеток затем положить эту смесь в верхней палате 24-и транс-а. Затем положить 400 мкл полной среды в нижнюю палату и инкубировать при температуре 37 ° C. Изменение среды в нижней палате каждый день и добавить дополнительные 100 мкл MatrigelКаждую неделю или раньше, если он становится тонким.
5.2 В модели естественных условиях
- Развести отсортированы осадок клеток в полной среде смешать 1:1 с матригель в концентрации 5,000-10,000 клеток в 50 мкл.
- Anesthetize получателя C57/BL6 мышей. Администрирование Carprofen (5 мг / кг) subcutaenously как анальгетик. Стерилизовать и брить их спинами затем сделать центральный продольный разрез кожи в верхней части спины. Разрез должен быть достаточно большим, чтобы определить место инъекции жира площадки, а также волдырь, которая формируется после инъекции. Используйте тупой стороной ножниц, чтобы расширить пакеты между кожей и задней стенки грудной клетки с обеих сторон для максимального доступа и визуализации.
- Определить медиальный край лопатки нажатием мыши лапы вверх и назад, чтобы увидеть движущиеся лопатки. Принимать по 50 мкл суспензии клеток в 300 мкл шприц инсулина BD, и внедрить его в жировой ткани только медиальнее лопатки и сбокупозвонков. Вы должны быть в состоянии видеть пузырь в противном случае вы слишком глубоко. Повторите то же самое с другой стороны, то клип или сшить разрез кожи. Проверьте мышей и дать Carprofen (5 мг / кг, SC) один раз в сутки в течение 48 часов.
- Через 3 недели, усыпить мышей с pentobarbatol (0,1 mg/0.2 куб.см, IP), откройте кожи, как указано выше и анализировать весь жировой ткани с обеих сторон с запасом, чтобы не пропустить любую ткань структуры, которые могли образоваться и расширен вокруг. Исправить в PFA и вставлять в парафин 12. Особая осторожность должна быть использована во время обрезки и резки блоков не обойти или игнорировать структуру. Лучше всего обрезать 40 мкм один раз, затем вырезать 4 мкм кусочек, положите его на стекло и рассмотреть его под микроскопом, чтобы подтвердить, есть ли "эпителиальных структур" в этой части блока или нет. Если ничего не видел, то обрезать еще раз и повторите этот шаг.
6. Представитель Результаты
Stripping из трахеи мыши приведет к оголенный трахею, которая видна с помощью световой микроскопии, как показано на рисунке 1а. рис. 1б показывает светлое зрения трахеи после удаления эпителия с подслизистых желез освобождения из ткани, напоминающие гроздья винограда.
Проназа удаляет ITGA6 эпитопов, и именно поэтому TROP2 канала клетки не могут быть разделены на ITGA6 + и - население. Тем не менее, диспазы, которая сохраняет ITGA6 эпитопов, переваривает все поверхности эпителия и канал клеток даже при очень коротком времени инкубации, и поэтому не может быть использован для разделения канала из базальных клеток 3. Проточной цитометрии единого клеточные суспензии должна показать рассеяния вперед и боковой разброс участков, которые представлены на рисунке 2А. Хорошее разделение канала клетки от остальных, если трахеи клетки следует рассматривать с Trop2 антител в проточной цитометрии для люминесцентных клеток, активированных сортировонг (FACS), как показано на рисунке 2B. Сферы должны быть видны в матригель примерно через 1 неделю в области культуры и плотны на вид, как показано на рисунке 3. Эффективность этого процесса порядка 1-2%, а отдельные клетки будут присутствовать в матригель и, вероятно, представляют собой клетки из протоков подслизистых желез, которые не обладают способностью к самообновлению. Инъекции канал стволовых клеток в мышь жира результаты площадку в формировании подслизистых желез-подобные структуры, показана на рисунке 4. Они видели в блоках даже без окрашивания H & E. Они имеют сферическую форму и обладают центральным просветом. Многие сечения должны быть сделаны через жировой ткани, чтобы не пропустить эти эпителиальных структур.

Рисунок 1. Ферментативного расщепления трахеи эпителия. Удаление поверхностных эпителиальных клеток показано с BlacА стрелки, удаление клеток в протоках железы подслизистого показан зелеными стрелками. Оголенные трахеи, которые видны с помощью световой микроскопии показано через 30 мин диспазы пищеварения и через 4 часа проназы пищеварения.
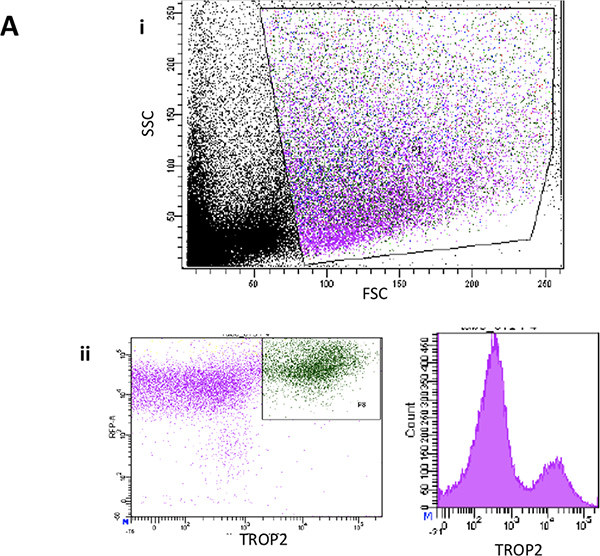
Рисунок 2А. Я. Проточной цитометрии единого клеточные суспензии показывать представитель рассеяния вперед и участков сторону разброс от мыши трахеи после удаления поверхностного эпителия. II. Представитель участков FACS для TROP2 выражение в воздуховоде клетки из мышиных трахеи.
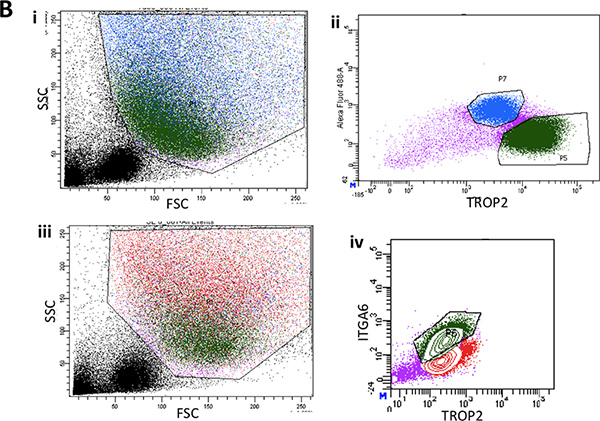
Рисунок 2B. Я. Проточной цитометрии единого клеточные суспензии из лишили поверхности эпителия нижних двух третей трахеи мыши показывать представитель рассеяния вперед и участков сторону разброс. II. Типичный сюжет FACS из ITGA6 выражение в суrface эпителия. III. Другой представитель участок FACS переднего и бокового рассеяния от поверхности эпителия показывает обратно стробирования базальной клеточной популяции в зеленый цвет. внутривенно Типичные ITGA6 и TROP2 выражения клеточной популяции в зеленый цвет.
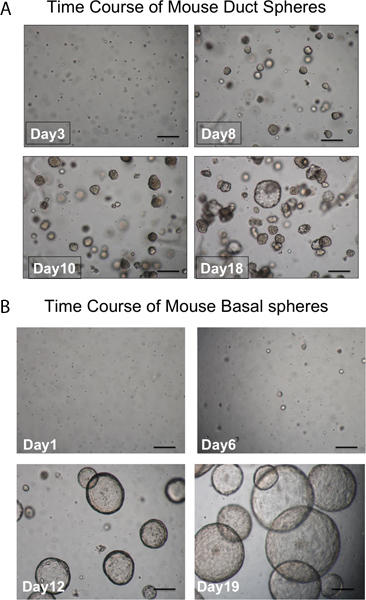
Рисунок 3. Время хода развития сфер. А. Канальные сферах. Сферы должны быть видны в матригель примерно через 1 неделю в области культуры и почти все они плотны на вид. Отдельные клетки, которые не образуют сферы также видели. (Шкалы = 50 мкм). B. Базальная сферы большего просвета и по внешнему виду. Отдельные клетки, которые не образуют сферы также видели. (Шкалы = 50 мкм).
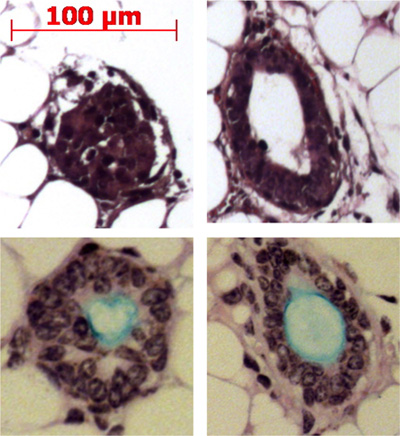
Рисунок 4. Инъекции канал стволовых клеток в мышь жира результаты площадку в формировании подслизистых желез-подобные структуры. Представитель структурприведены в жировой ткани и некоторые из них показали производство муцина (светло-синий) с Alcian синие периодическому Шифф кислота пятна.
Обсуждение
Этот метод, чтобы изолировать воздуховод и базальных клеток из дыхательных путей имеет важное значение для улучшения нашего понимания ремонт дыхательных путей и регенерацию и заболеваний дыхательных путей. Методы, описанные здесь, включают в себя несколько важных этапов. Во-первых, это оптимизированный ферментативных период пищеварения. Во-вторых, это создание единой клеточной суспензии через последовательные пассажи со все более высокие иглы для предотвращения избыточного сдвига клетки, но и разрушить клетки сгустки. Третий FACS анализ и стробирования клеток с соответствующими антителами.
В некоторых ферментов эпитопов поверхности полосы, как ITGA6 и NGFR, одним из возможных модификаций является изменение протоколов ферментативного расщепления, чтобы сэкономить эпитопов. Этот протокол также может быть использован для выделения трахеи эндотелиальные клетки или другие мезенхимальные клетки, изменяя специфические антитела к поверхностным маркерам на типы клеток.
Ограничения разделения канала и базальных клетоксвязано с нашим отсутствием в настоящее время поверхностный маркер отличить канал клеток из клеток базального и необходимость поверхности эпителиальных зачистки и возможность оставить некоторые базальные клетки сзади. Будущее идентификации поверхностных маркеров специально для канала клетки облегчить этот процесс и избежать необходимости снятия поверхностного эпителия. Он также отрицает необходимость использования нижних двух третей трахеи для чистой базальные клеточные препараты.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы хотели бы отметить широкие Stem Cell Research Center FACS и особенно поблагодарить Джессика Скоулз и Felicia Codrea за помощь сортировки клеток. Работа финансировалась CIRM RN2-00904-1, K08 HL074229, Американского торакального общества / ХОБЛ фонда ATS-06-065, концерн фонда, UCLA Jonsson Comprehensive Cancer Центр торакальной онкологии программы / Рак легких SPORE, Университет Калифорнии рака Исследования Координационного комитета и Гвинн Hazen Cherry Мемориал Laboratories (BG).
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | |
| Полной среде 10: DMEM-F-12, 50/50, 1X) | Mediatech | 15-090-CV | |
| Hepes (15 мм) | Invitrogen | 15630 | |
| Бикарбонат натрия (3,6 мм или 0,03%) | Invitrogen | 25080 | |
| L-глютамин (4 мм) | Mediatech | 25-005-Cl | |
| Пенициллина (100 ед / мл) | Mediatech | 30-001-ДИ | |
| Стрептомицин (100 мкг / м) | Mediatech | 30-001-ДИ | |
| Амфотерицин (0,25 мкг / мл) | Lonza | 17-836R | |
| Винсулина (10 мкг / мл) | Сигма | I6634 | |
| Трансферрина (5 мкг / мл) | Сигма | T1147 | |
| Холера токсина (0,1 мкг / мл) | Сигма | C8052 | |
| Эпидермального фактора роста (25 нг / мл) | BD | 354001 | |
| Бычий гипофизарный экстракт (30 мкг / мл) | Invitrogen | 13028-014 | |
| Эмбриональной телячьей сыворотки (5%) | Рыбак | SH3008803HI | |
| Ретиноевая кислота (0,05 мкм) | Сигма | R2625 | |
| Фактор роста Снижение Matrigel | BD | 354230 |
Таблица 1. Завершить медиа компоненты.
| Название реагента | Компания | Номер в каталоге | Комментарии |
| Проназа | Roche | 10165921001 | Используется на 0,15%: -O / N при 4 ° С пищеварением, чтобы изолировать общего трахеи клетки (для культуры ALI) -4 Пищеварения час 4 ° C, чтобы изолировать SMG |
| Диспазы | BD Biosciences | 354235 | Используется на 16 единиц: 30 минут при комнатной температуре |
| ДНКазы I | Сигма | DN25 | Применяется при 0,5 мг / мл: 20-30 минут при комнатной температуре |
Таблица 2. Ферменты для ферментативного расщепления трахеи.
Ссылки
- Bartlett, J. A., Fischer, A. J., McCray, P. B. Innate immune functions of the airway epithelium. Contrib. Microbiol. 15, 147-163 (2008).
- Finkbeiner, W. E. Physiology and pathology of tracheobronchial glands. Respir. Physiol. 118, 77-83 (1999).
- Hegab, A. E. A Novel Stem/Progenitor Cell Population from Murine Tracheal Submucosal Gland Ducts with Multipotent Regenerative Potential. Stem Cells. , (2011).
- Jeffery, P. K. Morphologic features of airway surface epithelial cells and glands. Am. Rev. Respir. Dis. 128, S14-S20 (1983).
- Rock, J. R. Basal cells as stem cells of the mouse trachea and human airway epithelium. Proc. Natl. Acad. Sci. U.S.A. 106, 12771-12775 (2009).
- Goldstein, A. S. Trop2 identifies a subpopulation of murine and human prostate basal cells with stem cell characteristics. Proc. Natl. Acad. Sci. U.S.A. 105, 20882-20887 (2008).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- McQualter, J. L., Yuen, K., Williams, B., Bertoncello, I. Evidence of an epithelial stem/progenitor cell hierarchy in the adult mouse lung. Proc. Natl. Acad. Sci. U.S.A. 107, 1414-1419 (2010).
- Inayama, Y. In vitro and in vivo growth and differentiation of clones of tracheal basal cells. Am. J. Pathol. 134, 539-549 (1989).
- You, Y., Richer, E. J., Huang, T., Brody, S. L. Growth and differentiation of mouse tracheal epithelial cells: selection of a proliferative population. Am. J. Physiol. Lung. Cell. Mol. Physiol. 283, L1315-L1321 (2002).
- Wu, X., Peters-Hall, J. R., Bose, S., Pena, M. T., Rose, M. C. Human Bronchial Epithelial Cells Differentiate to 3D Glandular Acini on Basement Membrane Matrix. Am. J. Respir. Cell Mol. Biol. , (2010).
- Ooi, A. T. Presence of a putative tumor-initiating progenitor cell population predicts poor prognosis in smokers with non-small cell lung cancer. Cancer Res. 70, 6639-6648 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены