Method Article
小鼠气管基底细胞和粘膜下腺体的导管细胞分离
摘要
在这里,我们展示了我们的协议,用于隔离的基础和粘膜下腺体导管细胞从小鼠气管。我们还表明,该方法的干细胞注射到背鼠标脂肪垫,以创建一个模式,粘膜下腺体的再生。
摘要
大航空公司直接与环境接触,因此容易受到伤害的毒素和传染性我们呼吸的1。大航空公司,因此需要一个有效的修复机制来保护我们的身体。这种修复过程发生在呼吸道的干细胞,这些干细胞气道隔离理解的修复和再生的机制是非常重要的。同样重要的是理解异常修复,可导致气道疾病的2。该方法的目标是从小鼠气管粘膜下腺导管分离出一种新的干细胞群体,将这些细胞在体外和体内模型系统,以确定的修复和再生机制的粘膜下腺体3。生产表明,可用于分离和检测从大的气道3中的管道和基底的干细胞的方法,这将允许我们研究疾病,如囊性纤维化,哮喘和慢性阻塞性肺疾病的气道。目前,有没有隔离的粘膜下腺体导管细胞的方法,也没有在体内模型研究粘膜下腺体的再生。
研究方案
纲要的步骤
1。解剖气管
2。清洁气管和切割
3。酶消化,加工成单细胞悬液
4。染色流式细胞仪和分选
5。排序细胞在体内和体外模型处理
1。解剖气管
- 安乐死鼠标0.1 mg/0.2 cc的戊巴比妥钠腹膜内注射。
- 剖开腹壁,移动侧的肠子暴露腹主动脉,然后对它进行解剖。
- 打开胸部,通过双方的隔膜和前胸壁上切割,暴露心脏和肺部。继续到颈部去除脂肪和唾液腺暴露气管切割。
- 取出胸腺和关闭连接下面和后面切肺。 SEPAR吃了从食管气管插入他们之间的钳子,然后在其上大部分高于其与喉切开气管。然后按住气管钳和分析及其附件,并继续向下与心脏和肺的块将其删除。包括大部分的左,右主支气管肺门附近的心脏和肺切掉。
- 将含有在冰上收集介质在一个小的陪替氏培养皿气管。
2。清洁气管和切割
- 在解剖显微镜下,用极细的点钳(第5号)和“Vannas蒂宾根剪刀(FST 15003-08 finescience.com),清洁气管连接到它的所有其他组织。这包括:淋巴结肿大,喉返神经,脂肪,甲状腺,剩余的肺血管。气管的上半部分需要特别注意,以消除大喉软骨无影响最大的一堆竞彩提交之间的环状软骨和优先气管软骨环(C1)4。
- 剪切气管进入C4及C5之间的上部和下部,然后切开气管的管腔通过两个零件。
3。酶消化和加工成单细胞悬液(SCS)
- 孵育气管的下部,在1毫升16 U分离酶在Eppendorf管中,在室温下(RT)30分钟后,如先前所述5。然后添加一个额外的20分钟,RT 0.5毫克/毫升的DNA酶I DMEM。
- 取出消化气管新鲜的收集介质的无菌培养皿中,在解剖显微镜下剥离表面上皮。使用移液管转移的介质含有剥离的上皮50毫升锥形管。
- 自旋向下剥离在1000 XG上皮细胞在4°C。取出上清液,并加入0.1%胰蛋白酶/ EDTA,并培育一阵晃动日Ê管中,在37℃下摇床(200rpm)下30分钟。培养后,使用1,000微升小费,吸取试剂和来打破团块和形成单细胞悬浮液。
- 将含有1毫升0.15%链霉蛋白酶在锥形管中的上部气管。然后在4℃下保温4小时。
- 振荡管,然后将气管进入新鲜收集介质,并确认在解剖显微镜下,是完全脱离表面上皮(SE)。
- 气管剁碎,用细剪刀打开了SMG的车厢,然后在室温下培养一个多小时的蛋白酶缓慢的晃动。
- 自旋向下的气管组织,消除蛋白酶,增加0.1%胰蛋白酶/ EDTA和孵化,在37°C,30分钟颤抖以上。
- 通道的消化细胞,一丛丛,任何剩余的腺体块通过20G,23G和26G的针头,用10毫升的注射器。重复几次传代,每一个针头大小的前下台。现在,大多数细胞应该是在SCS。
- 通过一个40微米的过滤器过滤悬浮液,然后清洗过滤器和自旋向下的细胞。重组细胞在适当体积的介质,细胞计数,并立即着手FACS染色和排序。不要让细胞在4℃或冰上几个小时,因为我们发现,这种影响的可行性和严重降低了球体形成效率。
4。染色流式细胞仪和排序
- 以足够的细胞用于制备未染色的和单一的彩色补偿管,然后染色,剩下的细胞与初级抗体,山羊的TROP2和大鼠ITGA6,在RT下的15分钟。然后用PBS或收集介质,去除上清液非常小心,打破了细胞沉淀。
- 色斑与适当的辅助抗体在室温下10分钟,在黑暗中孵化,洗净,除去上清液,再破颗粒。
- 在FACSARIA,调整后的电压和补偿,门出来的碎片,非常小的细胞,细胞的双峰和死亡的细胞。然后,大部分细胞从SE应该是TROP2阳性,而20%至50%的SMG细胞TROP2 + 6。
- 设置您的选门TROP2 + ITGA6 +细胞从SE(基底细胞)和TROP2 +细胞(+ /-ITGA6阳性细胞)由SMG(管细胞)。
5。加工分选细胞, 在体外培养和体内模型
5.1 在体外球体形成5-9文化
- 混合100μl的“生长因子减少Matrigel的”用100μl的完全培养基10,11( 见表1),含有多达50000排序细胞,然后把该混合物中的上部腔室24孔的反式阱。然后将400μl的完全培养基中,在下部腔室中孵育在37℃下改变介质在下部腔室隔日和添加额外的100微升的Matrigel每一周或更早的版本,如果它变得薄。
5.2 体内模型
- 重新构成的排序条件细胞沉淀,在完全培养基1:1混合的5,000-10,000的细胞每50μl的浓度与基底膜。
- 麻醉收件人C57/BL6小鼠。管理卡洛芬(5毫克/公斤)subcutaenously作为镇痛剂。消毒刮他们的背上,然后在上背部中央纵向切开皮肤。切口应足够大,以确定的脂肪垫,以及注射部位,注射后形成的滤过泡。使用的剪刀钝面扩大袋之间的皮肤和背部的两侧胸壁上最大限度地获取和可视化。
- 通过按下鼠标的前肢和落后的肩胛骨移动确定的肩胛骨内侧缘。取50微升的细胞悬浮液,并将它注入到300微升的BD胰岛素注射器只是在脂肪垫内侧肩胛骨和横向椎骨。你应该能看到一个水泡,否则你太深。然后剪辑或缝合皮肤切口的另一侧,重复相同的。查看小鼠和得到卡洛芬(5毫克/公斤,南卡罗来纳州),每日一次,48小时。
- 3周后,安乐死与pentobarbatol(0.1 mg/0.2毫升,IP)的小鼠,打开上述的皮肤和剖析双方的安全余量,以避免错过任何可能形成的组织结构,并延伸至整个脂肪垫。修复PFA和嵌入在石蜡12。在修整和切割块,绕过或忽略的结构,应格外小心。最好的做法是修剪一次,然后切成4μm的切片,将其放置在载玻片上,在显微镜下检查它,以确认是否有任何“上皮结构”这一部分的块或40微米。如果没有看到,然后修剪一次,然后重复此步骤。
6。代表性的成果
S饰鼠标气管的pping将导致在剥蚀气管内,如在图1A中所示,是通过光学显微镜可见, 图1B示出后的气管上皮剥离从组织和类似葡萄串被释放的粘膜下腺体的明视野图。
链霉蛋白酶删除的ITGA6的抗原表位,这是为什么的的TROP2管细胞可以不被分成ITGA6 +和 - 人口。然而,分散酶,其中保存着ITGA6表位,消化所有的表面上皮细胞即使有很短的孵育时间和管道,并因此不能被用于分离管从基底细胞3。流式细胞术的单细胞悬浮液应显示正散射和侧散点图,在图2A中表示的。的,如果气管细胞TROP2抗体可以看出,在流式细胞仪荧光激活细胞sorti的导管细胞的其余部分良好的分离纳克(FACS),如在图2B中看到。球体应该是可见的,在的基底膜在培养约1周后,在外观上是致密的,如在图3中示出。这个过程的顺序是1-2%,单细胞的效率将仍然存在于基底膜,可能代表细胞的粘膜下腺导管不具备自我更新的能力。导管干细胞注射到小鼠脂肪垫的查询结果粘膜下腺状结构, 如图4所示形成。这些块中,即使没有H&E染色。这些是球形和具有中央管腔。为了不要错过这些上皮的结构,需要做许多的横截面,通过脂肪垫。

图1。气道上皮细胞的酶消化。去除表面上皮细胞示出与黑单肩休闲包K表箭头,切除粘膜下腺导管细胞显示绿色箭头。示出30分钟的分散酶消化后,链霉蛋白酶消化4小时后,用光学显微镜可见的剥蚀气管。
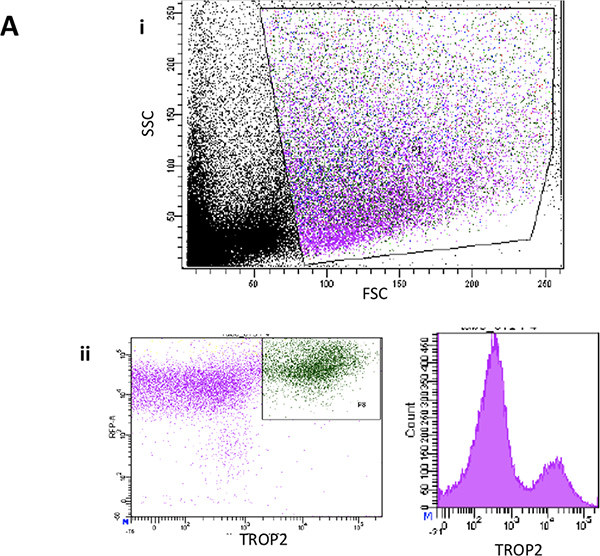
图2(A)。流式细胞仪代表前向散射和侧向散射光图从小鼠气管表面上皮剥离后的单细胞悬液。 (二)代表FACS图TROP2从小鼠气管导管细胞表达的。
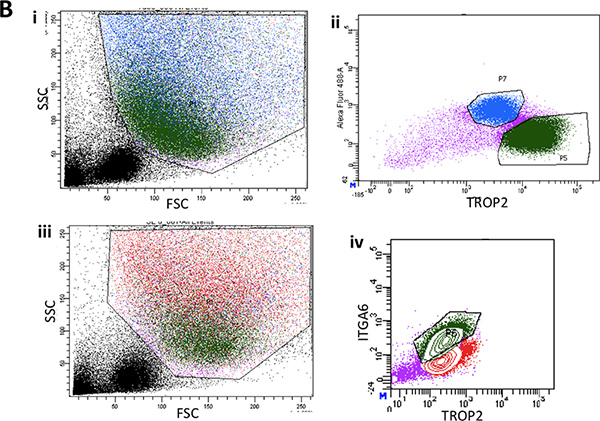
图2B。流式细胞仪的单细胞悬液从精简的表面上皮的低三分之二的小鼠气管代表前向散射和侧向散射光图。 (二)典型的FACS情节ITGA6表达的苏rface上皮细胞。 III。另一位代表的的FACS情节的正向和侧向散射光从表面上皮门的绿色基底细胞人口。 (四)典型ITGA6 TROP2表达细胞亚群的绿色。
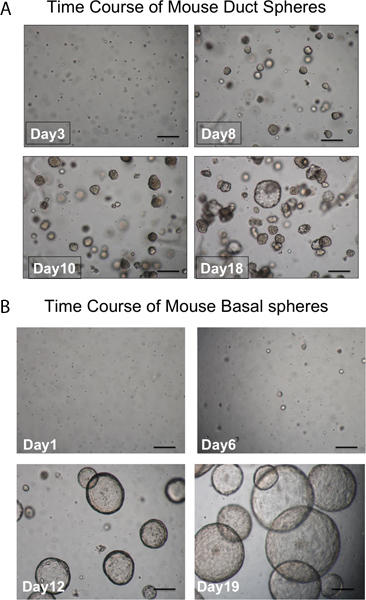
图3。发展领域的时间过程。 A.管道领域。球在基底膜约1周后的文化应该是可见的,几乎全是密集的外观。单细胞不形成球体也看到了。 (比例尺= 50微米)。 B.基底球是在外观上和管腔。单细胞不形成球体也看到了。 (比例尺= 50微米)。
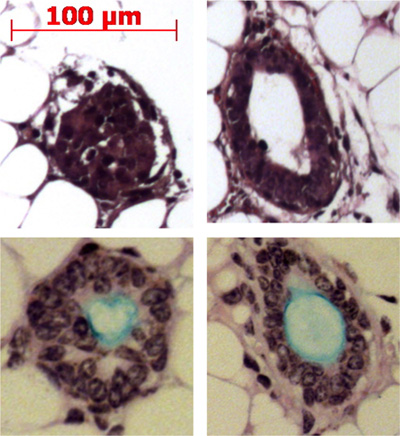
图4。导管干细胞注射到小鼠脂肪垫的查询结果粘膜下腺状结构的形成中。代表结构显示中的脂肪垫和一些人产生粘蛋白(淡蓝色),阿尔辛蓝碘酸雪夫染色。
讨论
这种技术来隔离气道管和基底细胞重要的是,提高我们对气道的修复和再生,气道疾病。这里描述的技术包括几个关键的步骤。第一是优化酶消化期间。第二个是创造的单细胞悬液通过串行逐步提高计针,以防止传代细胞剪切,但分手的细胞团块。第三个是FACS分析,并适当的抗体的细胞的门控。
由于一些酶带钢表面抗原表位,像ITGA6和NGFR,一个可能的修改是改变内切酶酶切协议,以腾出的抗原表位。通过改变类型的细胞上的表面标记的特异性抗体,此协议也可以被用来隔离气管的内皮细胞或其他间充质细胞。
管道和基底细胞的分离的局限性我们目前缺乏的表面标记来区分胆管细胞从基底细胞和表面上皮剥离和后面留下一些基底细胞的可能性需要有关。未来专门为胆管细胞的表面标志识别将使这个过程变得更容易,并避免表面上皮剥离的需要。它也将否定纯基底细胞制剂需要使用的气管的下三分之二。
披露声明
没有利益冲突的声明。
致谢
我们要感谢宽广的干细胞研究中心FACS,尤其要感谢他们的帮助杰西卡·斯科尔斯和Felicia科德雷亚与细胞分选。这项工作是由CIRM RN2-00904-1,K08 HL074229,美国胸科学会/慢性阻塞性肺病基金会ATS-06-065,值得关注的基金会,加州大学洛杉矶分校琼森综合癌症中心胸腔肿瘤计画/肺癌SPORE大学,加州癌症研究协调委员会和格温哈森樱桃纪念实验室(BG)。
材料
| Name | Company | Catalog Number | Comments |
| 的试剂的名称 | 公司 | 目录号 | |
| 完成媒体10: DMEM-F-12,50/50,1X) | 敏达 | 15-090-CV | |
| HEPES(15毫米) | Invitrogen公司 | 15630 | |
| 碳酸氢钠(3.6毫米或0.03%) | Invitrogen公司 | 25080 | |
| (4毫摩尔)L-谷氨酰胺 | 敏达 | 25-005-CL | |
| 青霉素(100 U / ml的) | 敏达 | 30-001-CI | |
| 链霉素(100微克/立方米) | 敏达 | 30-001-CI | |
| 两性霉素B(0.25微克/毫升) | 龙沙 | 17-836R | |
| 在胰岛素(10微克/毫升) | 西格玛 | I6634 | |
| 转铁蛋白(5微克/毫升) | 西格玛 | T1147 | |
| 霍乱毒素(0.1微克/毫升) | 西格玛 | C8052 | |
| 表皮生长因子(25毫微克/毫升) | BD | 354001 | |
| 牛垂体提取物(30微克/毫升) | Invitrogen公司 | 13028-014 | |
| 胎牛血清(5%) | 费舍尔 | SH3008803HI | |
| 视黄酸(0.05微米) | 西格玛 | R2625 | |
| 生长因子减少基底膜 | BD | 354230 |
表1。完整的媒体组件。
| 的试剂的名称 | 公司 | 目录编号 | 评论 |
| 链霉蛋白酶 | 罗氏公司 | 10165921001 | 用于在0.15%: O / N在4°C消化,到提取总的气管细胞(ALI文化) -4小时消化4°C隔离SMG |
| 中性蛋白酶 | BD Biosciences公司 | 354235 | 16单位:30分钟RT |
| DNA酶I | 西格玛 | DN25 | 适用于0.5毫克/毫升: 20-30分钟,在室温下 |
表2。用于气管酶消化酶类。
参考文献
- Bartlett, J. A., Fischer, A. J., McCray, P. B. Innate immune functions of the airway epithelium. Contrib. Microbiol. 15, 147-163 (2008).
- Finkbeiner, W. E. Physiology and pathology of tracheobronchial glands. Respir. Physiol. 118, 77-83 (1999).
- Hegab, A. E. A Novel Stem/Progenitor Cell Population from Murine Tracheal Submucosal Gland Ducts with Multipotent Regenerative Potential. Stem Cells. , (2011).
- Jeffery, P. K. Morphologic features of airway surface epithelial cells and glands. Am. Rev. Respir. Dis. 128, S14-S20 (1983).
- Rock, J. R. Basal cells as stem cells of the mouse trachea and human airway epithelium. Proc. Natl. Acad. Sci. U.S.A. 106, 12771-12775 (2009).
- Goldstein, A. S. Trop2 identifies a subpopulation of murine and human prostate basal cells with stem cell characteristics. Proc. Natl. Acad. Sci. U.S.A. 105, 20882-20887 (2008).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- McQualter, J. L., Yuen, K., Williams, B., Bertoncello, I. Evidence of an epithelial stem/progenitor cell hierarchy in the adult mouse lung. Proc. Natl. Acad. Sci. U.S.A. 107, 1414-1419 (2010).
- Inayama, Y. In vitro and in vivo growth and differentiation of clones of tracheal basal cells. Am. J. Pathol. 134, 539-549 (1989).
- You, Y., Richer, E. J., Huang, T., Brody, S. L. Growth and differentiation of mouse tracheal epithelial cells: selection of a proliferative population. Am. J. Physiol. Lung. Cell. Mol. Physiol. 283, L1315-L1321 (2002).
- Wu, X., Peters-Hall, J. R., Bose, S., Pena, M. T., Rose, M. C. Human Bronchial Epithelial Cells Differentiate to 3D Glandular Acini on Basement Membrane Matrix. Am. J. Respir. Cell Mol. Biol. , (2010).
- Ooi, A. T. Presence of a putative tumor-initiating progenitor cell population predicts poor prognosis in smokers with non-small cell lung cancer. Cancer Res. 70, 6639-6648 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。