Method Article
Вращающийся культуре клеток системы по правам культуры клеток: Человеческие клетки трофобласта в качестве модели
* Эти авторы внесли равный вклад
В этой статье
Резюме
Традиционный, двумерные методы клеточной культуры часто приводит к изменены характеристики относительно дифференцирования маркеры, цитокинов и факторов роста. Трехмерная культуре клеток во вращающейся системе культуры клеток (РКЦ) восстанавливает выражение многие из этих факторов, как показано здесь с extravillous клеточной линии трофобласта.
Аннотация
The field of human trophoblast research aids in understanding the complex environment established during placentation. Due to the nature of these studies, human in vivo experimentation is impossible. A combination of primary cultures, explant cultures and trophoblast cell lines1 support our understanding of invasion of the uterine wall2 and remodeling of uterine spiral arteries3,4 by extravillous trophoblast cells (EVTs), which is required for successful establishment of pregnancy. Despite the wealth of knowledge gleaned from such models, it is accepted that in vitro cell culture models using EVT-like cell lines display altered cellular properties when compared to their in vivo counterparts5,6. Cells cultured in the rotating cell culture system (RCCS) display morphological, phenotypic, and functional properties of EVT-like cell lines that more closely mimic differentiating in utero EVTs, with increased expression of genes mediating invasion (e.g. matrix metalloproteinases (MMPs)) and trophoblast differentiation7,8,9. The Saint Georges Hospital Placental cell Line-4 (SGHPL-4) (kindly donated by Dr. Guy Whitley and Dr. Judith Cartwright) is an EVT-like cell line that was used for testing in the RCCS.
The design of the RCCS culture vessel is based on the principle that organs and tissues function in a three-dimensional (3-D) environment. Due to the dynamic culture conditions in the vessel, including conditions of physiologically relevant shear, cells grown in three dimensions form aggregates based on natural cellular affinities and differentiate into organotypic tissue-like assemblies10,11,12 . The maintenance of a fluid orbit provides a low-shear, low-turbulence environment similar to conditions found in vivo. Sedimentation of the cultured cells is countered by adjusting the rotation speed of the RCCS to ensure a constant free-fall of cells. Gas exchange occurs through a permeable hydrophobic membrane located on the back of the bioreactor. Like their parental tissue in vivo, RCCS-grown cells are able to respond to chemical and molecular gradients in three dimensions (i.e. at their apical, basal, and lateral surfaces) because they are cultured on the surface of porous microcarrier beads. When grown as two-dimensional monolayers on impermeable surfaces like plastic, cells are deprived of this important communication at their basal surface. Consequently, the spatial constraints imposed by the environment profoundly affect how cells sense and decode signals from the surrounding microenvironment, thus implying an important role for the 3-D milieu13.
We have used the RCCS to engineer biologically meaningful 3-D models of various human epithelial tissues7,14,15,16. Indeed, many previous reports have demonstrated that cells cultured in the RCCS can assume physiologically relevant phenotypes that have not been possible with other models10,17-21. In summary, culture in the RCCS represents an easy, reproducible, high-throughput platform that provides large numbers of differentiated cells that are amenable to a variety of experimental manipulations. In the following protocol, using EVTs as an example, we clearly describe the steps required to three-dimensionally culture adherent cells in the RCCS.
протокол
1. Коллаген из бисера подготовка
- Перед загрузкой EVTs для 3-D клеточных культур, необходимо подготовить Cytodex-3 бусины микроносителей:
- Отвесить соответствующее количество Cytodex-3 бусины, необходимых для эксперимента. Этот протокол адаптирован для судна 10мл РКЦ, в котором 0,05 г из бисера не требуется. Для 50мл судна РКЦ, масштаб соответственно. В 50 мл автоклавируемый коническую трубку, смешайте 250 мг Cytodex-3 бусины с фосфатом 12 мл Дульбекко буферном растворе (DPBS). Эта сумма является достаточной для 5 РКЦ судов.
- Обеспечение адекватного объема присутствует в конической трубе, как автоклав процесс приведет к испарению. Свободно колпачок трубки и автоклаве в течение 10 мин при 110 ° С.
- Удалить конической трубе при завершении цикла автоклава и позволяют Cytodex-3 бусинки решение, чтобы охладиться.
- После конической трубе остынет до комнатной температуры, использование стерильных довести совокупный объем 12.5mL использованием 1X DPBS.
- Кап и хранения подготовленных Cytodex-3 бисером при комнатной температуре. Разрешить подготовлены бисером набухать и охладить до комнатной температуры перед использованием. Над подготовкой Cytodex-3 бусины обеспечит в течение пяти 10 мл судов РКЦ. Мы заметили, что длительного хранения Cytodex-3 бисером при комнатной температуре может привести к снижению производительности, так как коллаген дестабилизирует примерно через месяц. Cytodex-3 бусины в диапазоне размеров от 133-215 мкм.
2. Подготовка медиа
Подготовка 1L РКЦ оптимизированы GTSF-2 средства массовой информации (адаптировано из 22), которая состоит из 40% MEM альфа, плюс добавки и 60% L-15 средств массовой информации в Лейбовиц (адаптировано из 22). Во-первых, подготовить 400 мл в общем объеме MEM альфа дополнен:
21.2mM бикарбоната натрия
0,06% пептон
Фруктоза 0,7 мм
1,4 мм Галактоза
Глюкоза 5.6мм
1% HEPES
1% L-глютамин
0,5% ЕЕ
10% FBS- Для подготовки исходного раствора ИТС, растворить в 5 мл стерильной подкисленных H 2 O подготовленный того ледяной уксусной кислоты (около 0.05mL). Swirl растворяться, следовать с 45 мл стерильной воды.
- Отвешивать достаточно L-15 порошок Лейбовиц для 600 мл среды растворяясь в ткани культуры класса H 2 O.
- Довести общий объем клеточной среде культуры 1L с L-15 средний Лейбовиц в. Фильтр-стерилизовать и хранить при температуре 4 ° С в темноте. Добавьте 1% пенициллин-стрептомицина индивидуально к каждому аликвоту среда, используемая.
- Многие формулировки средств массовой информации, кроме GTSF-2 СМИ были успешно протестированы в РКЦ. Индивидуальные лаборатории должны решить для себя, какие среды является оптимальным для эксперимента может быть исполнено.
3. Клетки и бисера Инкубационный
- Распространить EVTs до ~ 80% слияния, trypsinize и рассчитывать с использованием принятых практик культуре клеток.
- Приостановить 1x10 6 EVTs в 4 мл теплойред СМИ.
- Аккуратно перемешайте подготовлены Cytodex-3 бусы. Использование стерильных техник, удалите 2,5 мл подготовленных бисером, используя широкий наконечник, 10 мл пипетки серологические и передачи неиспользованных 15 мл коническую трубку. Обратите внимание, что могут быть небольшие потери из бисера, как они придают пипетки.
- Разрешить Cytodex-3 бусины, чтобы осесть на дне пробирки. После осаждения, использование пипетки для удаления верхнего слоя DPBS, не нарушая Cytodex-3 бусы.
- Смешайте подготовленные 1x10 6 EVTs в средах с подготовленной Cytodex-3 бусы.
- Инкубируйте клеточной шарик смеси при комнатной температуре в течение 30 мин. Периодически аккуратно перемешать. Инкубировать еще 30 мин при 37 ° С и 5% CO 2. Периодически аккуратно перемешать.
4. Загрузка RWV
- В кабинете ламинарного потока, удалить 10 мл РКЦ из упаковки и поместить его в стерильную, 6-а культура пластина для стабильности. См. на рисунке 1 представлена диаграмма помечены RCCS.
- Удалите большие пробки от порта.
- Довести общий объем инкубации клеточной шарик смеси 10 мл подогретой СМИ.
- Нагрузка клетки / гранулы-смесь в РКЦ через большой порт. РКЦ должна быть наклонена под углом 45 ° (крупные до порта) при загрузке, чтобы помочь в устранении потенциальных пузырьки воздуха. Не допускать накопление положительного давления, заполнив судно медленно и неуклонно.
- Замените пробку в крупный порт.
- Удалите поршни от 3-мл шприцы и пустые места шприцы на малых портов. Добавить 1-3 мл средств массовой информации для каждого шприца. Медленно откройте два клапана. Замените поршни шприцев на шприцы мягко. Добавить файлы из одного шприца, пока все пузырьки удаляются из внутренней камеры.
- Возьмите РКЦ и мягко нажмите на стороне, а вращая ее перед вами, чтобы проверить пузыри. Если Есть любые пузыри, вы должны получить их из камеры, как пузырьки воздуха будут мешать образованию ое агрегаты клеток и ввести поперечных сил. Удалить пузырьки поворотом РКЦ, пока пузырьки в небольшой порт. Затем осторожно надавите на шприц на противоположной стороне, чтобы заставить пузырьков в порт и из камеры.
- Закройте одну сторону порта. Аккуратно надавите на поршень шприца другими ввести небольшое количество положительным давлением в сосуд, который предотвращает пузырей. Закрыть второй клапан.
- Нагрузка РКЦ на роторе. Начало ротации на 19rpm в 37 ° C CO 2 инкубатора.
5. Изменение СМИ
- Изменение СМИ через день в течение первых трех дней, то каждый день после этого.
- Выключите ротор и удалить РКЦ. Потяните поршни, чтобы создать некоторые всасывания, удалите шприцы друг от небольшой порт и место РКЦ на угол так, чтобы урегулировать бисером противоположность большим портом.
- После бусины имеют все решено, открыть один из небольших клапанов ипозволяют средства массовой информации вытекать из РКЦ и в контейнер для отходов. Удалите 2 / 3 от средств массовой информации в этой манере. Будьте уверены, чтобы не беспокоить бисера и не отказаться от любых агрегатов.
- Закрыть небольшой клапан и откройте большой порт. Добавить файлы обратно в РКЦ через большой порт. Замените пробку в крупный порт.
- Повторите шаги 4.6 - 4.9.
- Как агрегатов увеличиваются в размерах, вам необходимо увеличить скорость вращения, чтобы держать их во взвешенном состоянии в любое время, желательно в небольшой образец кровообращения на оптимальной скорости. Как правило, увеличение скорости между 0,3-0,7 мин после каждого кормления один раз агрегаты начинают расти заметно.
6. Сбор Размножается Клетки
- Удалить из РКЦ ротора. Удалить шприцы друг от небольшой порт и место РКЦ на угол так, чтобы гранулы могут поселиться противоположность большим портом.
- После бусины имеют все решено, открыть один из малых клапанов и позволяют СМИ вытекать изиз РКЦ и в контейнер для отходов. Удалить 1 / 3 от средств массовой информации в этой манере.
- Закрыть небольшой клапан и откройте большой порт. Аккуратно водоворот судна для разгона агрегатов обратно в раствор. Пустые жидкую смесь в стерильный 50 мл коническую трубку. Разрешить собранных агрегатов, чтобы обосноваться в конической трубе, прежде чем использовать супернатант тщательно мыть культуры судно максимального восстановления агрегатов. Агрегаты могут быть использованы для последующих анализов сразу же, как проточная цитометрия, вторжение анализы, иммунофлюоресценции и другие.
7. Представитель Результаты
Примером ЭВТ-подобных клеток (SGHPL-4 трофобласта клеточной линии), выращенных в РКЦ на Cytodex-3 бусины показано на рисунке 2. ЭВТ-как клеточная линия отображает прогнозы расширения от основного кластера и присоединения к соседней кластеров. Многие из бисера полностью покрыты распространяющихся клеток. После извлечения из РКЦ и плаТед на внеклеточного матрикса, ЭВТ-как 3-D выросла клетки агрессивно вторгаются и / или миграции (рис. 3). RT-PCR данные подтверждают повышенную экспрессию ММП увидеть в 3-D агрегатов, в отличие от традиционной культуре клеток монослоя (рис. 4). Интересно, что гены не связаны с вторжением также upregulated в РКЦ (табл. 1) и может помочь в разграничении таких областях, как иммунные взаимодействия с вторжением трофобласта клеток.

Рисунок 1. Мультфильм изображение вращающейся системе культуры клеток (РКЦ).

Рисунок 2. Фазового контраста микрофотография представитель совокупности через 5 дней роста в РКЦ. Стрелки указывают вторжения клетки и * означает Cytodex-3 бусины микроносителей.

Рисунок 3. РКЦ Выращенные агрегаты были встроены в гели фибрина. Вторжение через геля фибрина наблюдается уже в () 24 часов после фибрина вложения и (B) продолжалось в течение 48 часов. Стрелки указывают вторжения клетки и * означает Cytodex-3 микроносителей бисером (адаптировано с разрешения из работы. 7).
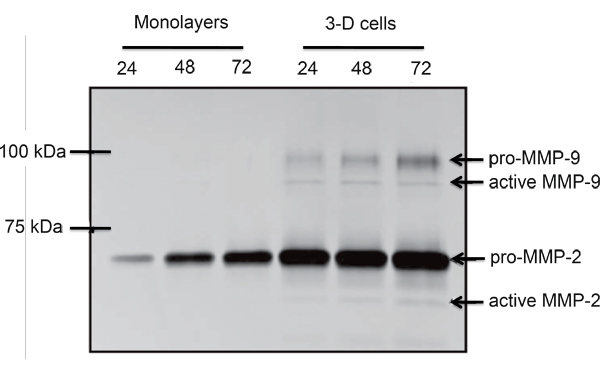
Рисунок 4. Сравнительный желатин zymogram монослоя и РКЦ распространяется SGHPL-4 ЭВТ-подобных клеток. Про-и активные формы MMP-2 и ММП-9 выделяется РКЦ выросли клетки трофобласта (адаптировано с разрешения из работы. 7).
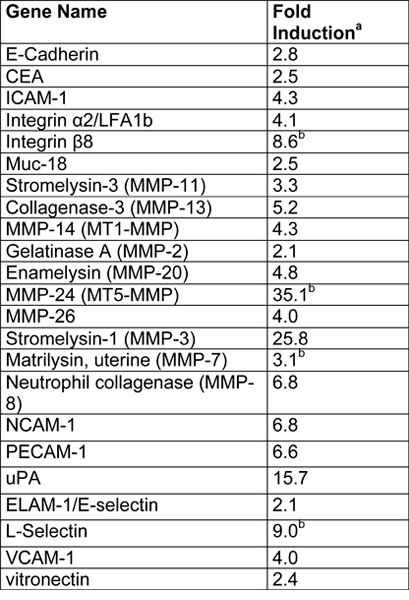
Таблица 1. Резюме микрочипов результаты SGHPL-4 клеток, выращенных в РКЦ (адаптировано с разрешения из работы. 7).
- Fold индукцией в 3-D агрегатов рассчитывается следующим образом: нормированный 3-D гена значение / нормализованное значение гена monlayer.
- Показывает, гены, которые были ниже предела обнаружения в монослоев.
Обсуждение
Культура техника, представленные здесь дает следователям с высоко инвазивный ЭВТ-подобных клеток. В настоящее время признано, что потеря дифференциация происходит в монослоя за счет ингибирования клеточных реакций на химические и молекулярные сигналы в трех измерениях (верхушечные, базальные и боковые поверхности клетки) 10,13. Этот метод отражает характеристики отметил внутриутробно от вторжения EVT клеток. Так как процедура имитирует обычные монослоя ткани кинетики культуры времени, но обеспечивает клетки с дифференциального выражения, сравнительные анализы могут быть использованы. Сотовые кластеры могут быть собраны для использования в экспериментах в любое время. Они могут быть использованы в качестве кластеров или деградации коллагена могут быть использованы для изоляции клеток суспензии отдельных клеток. Cytodex-3 бусины микроносителей может быть замещен леса или микроносителей бусины покрыты других внеклеточных матриц (ECMS), которые могут быть в большей степени способствуют специфические интересы отдельных лабораторий. Чередующихсяively, Есть много других 3-D культуре платформ, которые могут быть более благоприятными для конкретного типа клеток условия культивирования, как культура клеток вставками и кок колбы 10,23. Следует отметить, что культура кинетики может быть различным в этих условиях и должны быть установлены индивидуально. Культура кинетики могут быть легко проверены на удалив образцы из РКЦ через регулярные промежутки времени и анализа для выражения отличительные маркеры дифференцировки, пролиферации и жизнеспособности 15. Оптимальное пролиферацию и дифференцировку кинетики может быть установлено путем сравнения результатов с течением времени и с обычными методами ткани монослоя культуры. Использование SGHPL-4 клетки, как, например, агрегаты были удалены ежедневно и окрашивали Ki67 (для определения распространения) и каспазы-3 (для определения апоптоза), маркеры, характерные для интересов отдельных лабораторий "могут быть легко обмениваются. Техника, описанная здесь, могут быть применены к изучению спиральных артерийремонт, мелкий имплантации, и материнской иммунной реакции на вторжение трофобласта клеток.
Как было опубликовано ранее, это 3-D модель клеточной культуре также может быть использована для целого ряда других клеточных линий 17,14-21. В любом случае, полезность модель должна быть проверена с помощью различных известных маркеров дифференциации. Как и любой в пробирке модель культуры клеток, 3-D клеточных культур по своей сути редукционизма. Ни одна модель культуры будет предоставлять все механистические детали, но в сочетании с опубликованными результатами других моделей, 3-D культур стать дополнительной полезной моделью альтернативой для улучшения нашего понимания связанных с болезнью механизмов, которые могут вместить огромный потенциал для развития новых продуктов и процедур в области диагностики, профилактики и лечения инфекционных заболеваний.
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Работа выполнена при поддержке американского Национального института здоровья грант NIH / NICHD # HD051998 (для CAM).
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| Cytodex микроносителей бисером | Sigma-Aldrich | C3275 | |
| Вращающейся системе культуры клеток (РКЦ) | Synthecon | РКЦ-D | Включает в себя ротор база, блок питания, 4 одноразовых единиц РКЦ |
| РКЦ Одноразовые единиц | Synthecon | Контакт Synthecon | |
| 3 мл Луер-Лок кончике шприца | BD | 309585 | |
| 10мл широким кончиком пипетки серологические | BD | 357504 | |
| MEM Альфа | Invitrogen | 12561-072 | |
| L-15 Лейбовиц в среду, порошок | Invitrogen | 41300-039 | |
| H 2 O, эндотоксина свободный | Рыболов | MT-25-055-СМ | |
| Бикарбонат натрия | Sigma-Aldrich | S-7795 | |
| Пептон | Fisher Scientific | BP1420-100 | |
| Фруктоза | Sigma-Aldrich | F3510-100 | |
| Галактоза | Sigma-Aldrich | G5388-100 | |
| Глюкоза | Sigma-Aldrich | G7528-250 | |
| HEPES | Invitrogen | 15630-080 | |
| L-глютамин | Invitrogen | 25030 | |
| Инсулин-трансферрина-селенит натрия (ИТС) | Sigma-Aldrich | I1884 | |
| FBS | Invitrogen | 10437 | |
| Пенициллин-Стрептомицин | Invitrogen | 15140 |
Ссылки
- Knofler, M. Critical growth factors and signalling pathways controlling human trophoblast invasion. Int. J. Dev. Biol. 54, 269-269 (2010).
- Cartwright, J. E. Remodelling at the maternal-fetal interface: relevance to human pregnancy disorders. Reproduction. 140, 803-803 (2010).
- Harris, L. K. IFPA Gabor Than Award lecture: Transformation of the spiral arteries in human pregnancy: key events in the remodelling timeline. Placenta. 32, S154-S154 (2011).
- Whitley, G. S., Cartwright, J. E. Trophoblast-mediated spiral artery remodelling: a role for apoptosis. J. Anat. 215, 21-21 (2009).
- Apps, R. Genome-wide expression profile of first trimester villous and extravillous human trophoblast cells. Placenta. 32, 33-33 (2011).
- Bilban, M. Trophoblast invasion: assessment of cellular models using gene expression signatures. Placenta. 31, 989-989 (2010).
- LaMarca, H. L. Three-dimensional growth of extravillous cytotrophoblasts promotes differentiation and invasion. Placenta. 26, 709-709 (2005).
- Jovanovic, M., Stefanoska, I., Radojcic, L., Vicovac, L. Interleukin-8 (CXCL8) stimulates trophoblast cell migration and invasion by increasing levels of matrix metalloproteinase (MMP)2 and MMP9 and integrins alpha5 and beta1. Reproduction. 139, 789-789 (2010).
- Husslein, H. Expression, regulation and functional characterization of matrix metalloproteinase-3 of human trophoblast. Placenta. 30, 284-284 (2009).
- Barrila, J. Organotypic 3D cell culture models: using the rotating wall vessel to study host-pathogen interactions. Nat. Rev. Microbiol. 8, 791-791 (2010).
- Hammond, T. G., Hammond, J. M. Optimized suspension culture: the rotating-wall vessel. Am. J. Physiol. Renal. Physiol. 281, 12-12 (2001).
- Unsworth, B. R., Lelkes, P. I. Growing tissues in microgravity. Nat. Med. 4, 901-901 (1998).
- Schmeichel, K. L., Bissell, M. J. Modeling tissue-specific signaling and organ function in three dimensions. J. Cell. Sci. 116, 2377-2377 (2003).
- Bentrup, H. ?. ?. n. e. r. z. u., K, . Three-dimensional organotypic models of human colonic epithelium to study the early stages of enteric salmonellosis. Microbes. Infect. 8, 1813-1813 (2006).
- Carterson, A. J. A549 lung epithelial cells grown as three-dimensional aggregates: alternative tissue culture model for Pseudomonas aeruginosa pathogenesis. Infect. Immun. 73, 1129-1129 (2005).
- Myers, T. A. Closing the phenotypic gap between transformed neuronal cell lines in culture and untransformed neurons. J. Neurosci. Methods. 174, 31-31 (2008).
- Hjelm, B. E. Development and characterization of a three-dimensional organotypic human vaginal epithelial cell model. Biol. Reprod. 82, 617-617 (2010).
- Straub, T. M. In vitro cell culture infectivity assay for human noroviruses. Emerg. Infect. Dis. 13, 396-396 (2007).
- Nickerson, C. A. Three-dimensional tissue assemblies: novel models for the study of Salmonella enterica serovar Typhimurium pathogenesis. Infect. Immun. 69, 7106-7106 (2001).
- Carvalho, H. M., Teel, L. D., Goping, G., O'Brien, A. D. A three-dimensional tissue culture model for the study of attach and efface lesion formation by enteropathogenic and enterohaemorrhagic Escherichia coli. Cell. Microbiol. 7, 1771-1771 (2005).
- Sainz, B., TenCate, V., Uprichard, S. L. Three-dimensional Huh7 cell culture system for the study of Hepatitis C virus infection. Virol. J. 6, 103-103 (2009).
- Lelkes, P. I., Ramos, E., Nikolaychik, V. V., Wankowski, D. M., Unsworth, B. R., Goodwin, T. J. GTSF-2: a new, versatile cell culture medium for diverse normal and transformed mammalian cells. In Vitro Cell. Dev. Biol. Anim. 33, 344-344 (1997).
- Lelkes, P. I., Ramos, E., Nikolaychik, V. V., Wankowski, D. M., Unsworth, B. R., Goodwin, T. J. GTSF-2: a new, versatile cell culture medium for diverse normal and transformed mammalian cells. In Vitro Cell. Dev. Biol. Anim. 33, 344-344 (1997).
- GE Healthcare. Microcarrier Cell Culture - Principles and Methods. Handbooks. , (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены