Method Article
Rotierende Cell Culture Systems für Human Cell Culture: Human Trophoblastzellen als Modell
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Traditional, zweidimensionalen Zellkultur-Techniken oft in veränderten Eigenschaften in Bezug auf die Differenzierung Marker, Zytokine und Wachstumsfaktoren führen. Dreidimensionale Zellkulturen in den rotierenden Zellkultursystem (RCCS) wiederherstellt Expression vieler dieser Faktoren, wie hier mit einem extravillösen Trophoblasten-Zelllinie gezeigt.
Zusammenfassung
Das Feld der menschlichen Trophoblasten Forschung erleichtert das Verständnis der komplexen Umgebung während Plazentation gegründet. Aufgrund der Natur dieser Studien ist die menschliche In-vivo-Experimente unmöglich. Eine Kombination aus primären Kulturen, Explantation Kulturen und Trophoblasten Zelllinien 1-Unterstützung unser Verständnis der Invasion der Gebärmutterwand 2 und Umbau des Uterus Spiralarterien 3,4 von extravillösen Trophoblastzellen (EVTs), die für die erfolgreiche Etablierung einer Schwangerschaft erforderlich ist. Trotz der Fülle an Wissen aus solchen Modellen entnommen, ist es akzeptiert, dass in vitro Zellkultur-Modellen mit EVT-like-Zelllinien Display zellulären Eigenschaften verändert, wenn ihre in vivo Pendants 5,6 verglichen. Cells in den rotierenden Zellkultursystem (RCCS) kultiviert Display morphologische, phänotypische und funktionelle Eigenschaften von EVT-like-Zelllinien, die mehr genau imitieren Differenzierung in utero EVTs mit einer erhöhten Expression von Genen vermitteln Invasion (zB Matrix-Metalloproteinasen (MMPs)) und Trophoblast Differenzierung 7,8,9. The Saint Georges Hospital Plazenta-Zelllinie-4 (SGHPL-4) (freundlicherweise von Dr. Guy Whitley und Dr. Judith Cartwright gespendet) ist ein EVT-like-Zelllinie, die für die Prüfung in der RCCS verwendet wurde.
Das Design des RCCS Kulturgefäß basiert auf dem Prinzip, dass Organe und Gewebe in einer dreidimensionalen (3-D-Umgebung) Funktion. Aufgrund der dynamischen Kulturbedingungen in dem Behälter, einschließlich der Bedingungen der physiologisch relevanten Scher-, Zellen in drei Dimensionen gewachsen bilden Aggregate auf Basis natürlicher zellulärer Affinitäten und differenzieren sich in organotypischen Gewebe-like Baugruppen 10,11,12. Die Wartung einer Flüssigkeit Bahn bietet eine Low-Shear, turbulenzarme Umgebung ähnlich Bedingungen in vivo gefunden. Sedimentation der kultivierten Zellen durch Anpassung der Drehung entgegenGeschwindigkeit des RCCS, um eine konstante freien Fall der Zellen zu gewährleisten. Der Gasaustausch erfolgt durch eine durchlässige hydrophobe Membran auf der Rückseite des Bioreaktors befinden. Wie ihre Eltern Gewebe in vivo sind RCCS-gewachsenen Zellen in der Lage, chemische und molekulare Gradienten in drei Dimensionen (dh an ihrem apikalen, basalen und seitlichen Flächen) zu reagieren, weil sie auf der Oberfläche des porösen Mikroträger Perlen gezüchtet werden. Wenn als zweidimensionale Monolagen auf versiegelten Oberflächen wie Kunststoff gewachsen sind die Zellen dieser wichtigen Kommunikationsmittel, über die basale Fläche entzogen. Folglich ist die räumliche Beschränkungen durch die Umwelt stark beeinflussen, wie Zellen Sinn und decodieren Signale aus dem umgebenden Mikroumgebung, was darauf schließen lässt eine wichtige Rolle für die 3-D Milieu 13.
Wir haben die RCCS verwendet werden, um biologisch sinnvolle 3-D Modelle der verschiedenen menschlichen epithelialen Geweben 7,14,15,16 Ingenieur. Tatsächlich haben viele frühere Berichte DMonstrated, dass Zellen in der RCCS kultiviert werden können physiologisch relevanten Phänotypen, die nicht mit anderen Modellen 10,17-21 möglich zu übernehmen. Zusammenfassend stellt Kultur in der RCCS eine einfache, reproduzierbare, High-Throughput-Plattform, die eine große Anzahl von differenzierten Zellen, die zugänglich für eine Vielzahl von experimentellen Manipulationen bietet. In dem folgenden Protokoll, mit EVTs als ein Beispiel, wir eine klare Beschreibung der erforderlichen Schritte, um dreidimensional Kultur adhärenter Zellen in der RCCS.
Protokoll
1. Collagen Bead Vorbereitung
- Vor dem Laden EVTs für 3-D Zellkultur, muss man die Cytodex-3 Mikroträger Perlen vorzubereiten:
- Wiegen Sie die entsprechende Menge an Cytodex-3 Perlen für das Experiment erforderlich. Dieses Protokoll wird für die 10ml RCCS Schiffes angepasst, in dem 0,05 g Perlen benötigt werden. Für eine 50ml RCCS Schiff, entsprechend skalieren. In einem 50 mL autoklavierbar konischen Rohr, Mix 250 mg Cytodex-3 Perlen mit 12ml Dulbecco phosphatgepufferte Lösung (DPBS). Diese Menge reicht für 5 RCCS Schiffe.
- Für ausreichende Menge vorhanden ist, in dem konischen Rohr, das Autoklav-Verfahren in Verdunstung führt. Lose Kappe der Röhre und Autoklaven für 10 min bei 110 ° C.
- Nehmen Sie die konische Rohr an der Fertigstellung des Autoklaven-Zyklus und damit die Cytodex-3 Bead-Lösung, um abzukühlen.
- Nach dem konischen Rohr auf Raumtemperatur abgekühlt wurde, verwenden Sie sterile Technik, um das Gesamtvolumen auf 12,5 ml zu bringen mit 1X DPBS.
- Cap und speichern Sie die vorbereiteten Cytodex-3 Kügelchen bei Raumtemperatur. Lassen Sie die vorbereiteten Perlen zu quellen und auf Raumtemperatur abkühlen vor zu bedienen. Die oben genannten Vorbereitung Cytodex-3 Perlen wird für fünf 10ml RCCS Schiffe bieten. Wir haben beobachtet, dass längere Lagerung von Cytodex-3 Kügelchen bei Raumtemperatur wird in verminderter Leistung führen, da das Kollagen nach etwa einem Monat zu destabilisieren wird. Cytodex-3 Perlen liegen in der Größenordnung von 133 bis 215 um.
2. Nährmedienzubereitung
Bereiten Sie 1L RCCS optimiert GTSF-2-Medien (in Anlehnung an 22), die von 40% MEM alpha besteht, plus Beilagen und 60% L-15 Leibovitz Medien (in Anlehnung an 22). Zuerst bereiten in einem Gesamtvolumen von MEM alpha ergänzt mit 400 ml:
21,2 mm Natriumbicarbonat
0,06% Pepton
0,7 Fructose
1.4mm Galactose
5.6mm Glucose
1% HEPES
1% L-Glutamin
0,5% ITS
10% FBS- Zur Vorbereitung einer Stammlösung von ITS, in 5 ml sterile angesäuert H 2 O durch Zugabe von Eisessig (ca. 0,05 ml) vorbereitet auflösen. Swirl zu lösen, mit 45ml sterilem Wasser zu folgen.
- Abwiegen genug L-15 Leibovitz Pulver für 600 ml Medium durch Lösen in Gewebe-culture grade H 2 O.
- Bringen Sie das Gesamtvolumen der Zellkulturmedium auf 1L mit L-15 Leibovitz-Medium. Filter-sterilisiert und bei 4 ° C im Dunkeln. Add 1% Penicillin-Streptomycin individuell auf jedes Aliquot des verwendeten Mediums.
- Viele Medien Formulierungen außer GTSF-2-Medien wurden erfolgreich in die RCCS getestet. Einzelne Laboratorien müssen für sich selbst entscheiden, welches Medium eignet sich optimal für das Experiment durchgeführt wird.
3. Cells und Bead Incubation
- Propagieren der EVTs um ~ 80% Konfluenz, trypsinize und zählen nach anerkannten Zellkultur Praktiken.
- Suspend 1x10 6 EVTs in 4 ml warmemed Medien.
- Vorsichtig mischen vorbereitet Cytodex-3 Perlen. Mit sterile Techniken, entfernen Sie 2,5 ml der vorbereiteten Beads mit einer breiten Spitze, 10 ml serologische Pipette und Transfer zu einem nicht verwendeten 15 ml konische Röhrchen. Beachten Sie, dass es möglicherweise einen kleinen Verlust von Beads werden, da sie Wert auf die Pipette.
- Lassen Sie die Cytodex-3 Perlen auf dem Boden des Röhrchens zu begleichen. Nach der Sedimentation, verwenden Sie eine Pipette, um die oberste Schicht der DPBS ohne die Cytodex-3 Perlen zu entfernen.
- Mischen Sie die 1x10 6 hergestellt EVTs in Medien mit dem vorbereiteten Cytodex-3 Perlen.
- Inkubieren Sie die Zell-Bead-Mischung bei Raumtemperatur für 30 min. Von Zeit zu Zeit vorsichtig mischen. Inkubieren für weitere 30 min bei 37 ° C und 5% CO 2. Von Zeit zu Zeit vorsichtig mischen.
4. Das Laden der RWV
- In einer laminaren Strömung Schrank, entfernen Sie einen 10 mL RCCS aus der Verpackung und legen Sie sie in einem sterilen, 6-well Mikrotiterplatte für Stabilität. Siehe Abbildung 1 für eine markierte Diagramm des RC AbbildungCS.
- Entfernen Sie den großen Stopfen aus dem Hafen.
- Bringen Sie das Gesamtvolumen der Inkubation Zell-Bead-Mischung auf 10 ml mit erwärmten Medien.
- Laden Sie die Zelle / Bead-Mischung in die RCCS durch den großen Hafen. Die RCCS sollte gekippt werden im 45 ° Winkel (großer Hafen up) beim Laden um die Entfernung des möglichen Luftblasen zu unterstützen. Prevent Aufbau von Überdruck durch Befüllen des Behälters langsam und stetig.
- Ersetzen Sie den Stopfen in den großen Hafen.
- Entfernen Sie den Kolben aus dem 3-ml-Spritzen und Ort der leeren Spritzen auf die kleinen Häfen. Add 1-3 ml Medium zu jeder Spritze. Langsam öffnen sich die beiden Ventile. Ersetzen Sie die Spritze Kolben auf die Spritzen sanft. Fügen Sie Medien aus einer Spritze, bis alle Luft aus dem Innenraum entfernt werden.
- Nehmen Sie den RCCS und klopfen Sie leicht die Seite beim Drehen sie vor Ihnen, um Luftblasen zu überprüfen. Wenn es irgendwelche Blasen sind, müssen Sie sie aus der Kammer, wie Luftblasen unter Bildung o störenf Zellaggregate und stellen Scherkräfte. Entfernen Sie Luftblasen durch Drehen des RCCS bis die Blasen unter dem kleinen Hafen sind. Dann vorsichtig nach unten auf die Spritze auf der gegenüberliegenden Seite, um die Luftblasen in den Hafen und aus der Kammer zu erzwingen.
- Schließen einer Seite Port. Drücken Sie vorsichtig auf die andere Spritze Kolben eine kleine Menge von positivem Druck in den Behälter, die Blasen verhindert die Bildung von einzuführen. Close zweite Ventil.
- Laden Sie die RCCS auf den Rotor. Starten Sie die Rotation bei 19rpm in einem 37 ° C CO 2-Inkubator.
5. Ändern der Medien
- Ändern Sie die Medien jeden zweiten Tag für die ersten drei Tage, dann jeden Tag danach.
- Schalten Sie den Rotor und entfernen Sie die RCCS. Ziehen Sie den Kolben bis zu einigen Sog erzeugen, entfernen Sie die Spritze aus jedem kleinen Hafen und Ort der RCCS auf einem Winkel, so dass die Perlen Gegenteil von dem großen Hafen zu begleichen.
- Nachdem die Perlen alle niedergelassen haben, öffnen Sie eine der kleinen Ventile undermöglichen die Medien fließen aus dem RCCS und in einen Abfallbehälter. Nehmen Sie 2 / 3 der Medien auf diese Weise. Achten Sie darauf, nicht stören die Perlen und nicht verwerfen Aggregate.
- Schließen Sie das kleine Ventil und öffnen Sie den großen Hafen. Add Medien wieder in die RCCS durch den großen Hafen. Ersetzen Sie den Stopfen in den großen Hafen.
- Wiederholen Sie die Schritte von 4,6 bis 4,9.
- Da die Aggregate an Größe zunehmen, müssen Sie die Drehzahl erhöhen, um sie in der Schwebe zu halten jederzeit, idealerweise in einem kleinen Kreislauf Muster mit optimaler Geschwindigkeit. Generell erhöht die Geschwindigkeit zwischen 0,3 bis 0,7 min nach jeder Fütterung, wenn die Aggregate zusehends beginnen.
6. Sammeln propagierten Cells
- Entfernen Sie die RCCS aus dem Rotor. Entfernen Sie die Spritze aus jedem kleinen Hafen und Ort der RCCS auf einem Winkel, so dass die Perlen Gegenteil von dem großen Hafen niederlassen kann.
- Nachdem die Perlen alle niedergelassen haben, öffnen Sie eine der kleinen Ventile und lassen Sie die Medien heraus zu fließender RCCS und in einen Abfallbehälter. Nehmen Sie 1 / 3 der Medien auf diese Weise.
- Schließen Sie das kleine Ventil und öffnen Sie den großen Hafen. Vorsichtig schwenken das Schiff, um die Aggregate wieder in Lösung zu zerstreuen. Leere flüssige Mischung in ein steriles 50 ml konischen Röhrchen. Lassen Sie die gesammelten Aggregate in den konischen Rohr, bevor Sie Überstand gründlich waschen Kulturgefäß zur Wiederaufnahme der Aggregate zu maximieren begleichen. Die Aggregate können für nachfolgende Tests sofort verwendet werden, z. B. Durchflusszytometrie, Invasionsassays, Immunfluoreszenz und andere.
7. Repräsentative Ergebnisse
Ein Beispiel für EVT-ähnlichen Zellen (SGHPL-4 Trophoblasten-Zelllinie) in der RCCS auf Cytodex-3 Perlen gewachsen ist in Abbildung 2 dargestellt. Das EVT-like-Zelllinie zeigt Vorsprünge entfernt von den wichtigsten Cluster und verbundenen benachbarten Clustern. Viele der Beads sind vollständig mit Zellen bedeckt propagieren. Einmal aus dem RCCS und pla entferntTed auf einer extrazellulären Matrix, die EVT-like 3-D gewachsenen Zellen aggressiv in und / oder zu migrieren (Abbildung 3). RT-PCR Daten bestätigen die erhöhte Expression von MMPs in 3-D-Aggregate gesehen zu traditionellen Zellkultur Monoschichten (Abbildung 4) entgegen. Interessanterweise sind Gene nicht mit Invasion assoziiert auch in der RCCS hochreguliert (Tabelle 1) und kann bei der Abgrenzung dieser Gebiete als immun Interaktionen mit eindringenden Trophoblasten-Zellen zu unterstützen.

Abbildung 1. Cartoon Darstellung der Rotating Cell Culture System (RCCS).

Abbildung 2. Phasenkontrast-Aufnahme von einem Vertreter Aggregat nach 5 Tagen Wachstum in einem RCCS. Die Pfeile zeigen die eindringenden Zellen und * bezeichnet das Cytodex-3 Mikroträger Perlen.

Abbildung 3. RCCS Grown Aggregate wurden in Fibringele eingebettet. Invasion durch die Fibrin-Gel wurde so früh wie (A) 24 Stunden nach der Fibrin Einbettung beobachtet und (B) über 48 Stunden fortgesetzt. Die Pfeile zeigen die eindringenden Zellen und * bezeichnet das Cytodex-3 Mikroträger-Beads (Adaptiert mit Erlaubnis aus Lit.. 7).
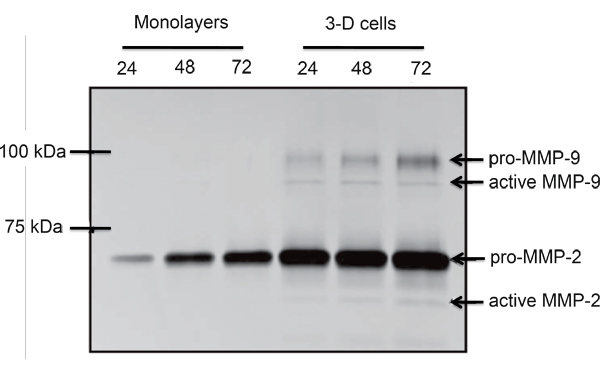
Abbildung 4. Vergleichende Gelatine Zymogramm von Mono-und RCCS propagiert SGHPL-4 EVT-ähnliche Zellen. Pro-und aktiven Formen von MMP-2 und MMP-9 wurden von den RCCS gewachsen Trophoblastzellen (Übernommen mit freundlicher Genehmigung aus Lit.. 7) ausgeschieden.
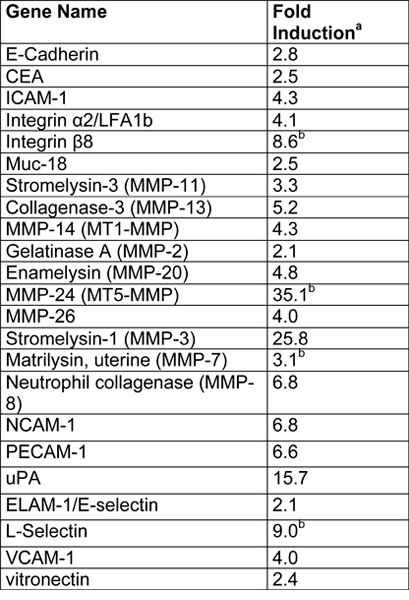
Tabelle 1. Zusammenfassung der Microarray-Ergebnisse aus SGHPL-4-Zellen in einem RCCS gewachsen (Übernommen mit freundlicher Genehmigung aus Lit.. 7).
- fache Induktion in der 3-D-Aggregate wurde wie folgt berechnet.
- Zeigt an, Gene, die unterhalb der Nachweisgrenze in Monoschichten wurden.
Diskussion
Die Kultur hier vorgestellte Technik bietet den Ermittlern sehr invasiv EVT-ähnliche Zellen. Es wurde nun erkannt, dass ein Verlust der Differenzierung in Monoschichten durch die Hemmung der zellulären Reaktionen auf chemische und molekulare Signale in drei Dimensionen (apikalen, basalen und lateralen Zelloberflächen) 10,13 auftritt. Diese Technik spiegelt Eigenschaften in utero auf eindringende EVT-Zellen festgestellt. Da das Verfahren ahmt konventionelle Monolayer Zellkultur Zeitkinetik, bietet aber Zellen mit unterschiedlichen Expression kann vergleichende Tests eingesetzt werden. Zellhaufen kann für die Verwendung in Experimenten jederzeit geerntet werden. Sie kann verwendet werden als Cluster oder Kollagen Abbau eingesetzt werden, um Zellen als einzigen Zellsuspension isolieren werden. Die Cytodex-3 Mikroträger Kügelchen können mit Gerüsten oder Mikroträger Perlen mit anderen extrazellulären Matrix (ECM), die bessere Rahmenbedingungen für die einzelnen Laboratorien spezifischen Interessen können beschichtet ersetzt werden. Alternatively, es gibt viele andere 3-D Kultur-Plattformen, die stärker auf eine bestimmte Zellart Kulturbedingungen, wie Zellkultur-Inserts und Spinnerflaschen 10,23 kann. Es wird darauf hingewiesen, dass die Kultur Kinetik anders sein könnte unter diesen Umständen und sollte individuell festgelegt werden. Kultur Kinetik kann leicht durch Entnahme von Proben aus dem RCCS in regelmäßigen Abständen und Analyse zur Expression von charakteristischen Differenzierungsmarker, Proliferation und Lebensfähigkeit 15 geprüft. Optimal Proliferation und Differenzierung Kinetik ermittelt werden kann durch den Vergleich Ergebnisse über die Zeit und gegen konventionelle Monolayer Zellkultur-Techniken. Mit dem SGHPL-4-Zellen als ein Beispiel, Aggregate entfernt wurden täglich und gefärbt mit Ki67 (um die Proliferation zu bestimmen) und Caspase-3 (die Apoptose zu bestimmen), Marker spezifisch für die einzelnen Labors Interessen können leicht ausgetauscht werden. Die beschriebene Technik kann hier auf das Studium der Spirale Arterie eingesetzt werdenUmbau, flache Implantation und mütterliche Immunantwort auf eindringende Trophoblasten-Zellen.
Wie zuvor veröffentlicht worden sind, können Sie dieses 3-D Zellkultur-Modell auch für eine Vielzahl von anderen Zelllinien 17,14-21 verwendet werden. In jedem Fall ist der Nutzen des Modells durch eine Vielzahl von bekannten Differenzierung Marker getestet werden. Wie bei jeder In-vitro-Zellkultur-Modell sind 3-D-Zellkulturen von Natur reduktionistisch. Keine einzige Kultur-Modell wird alle der mechanistischen Details, aber wenn mit publizierten Ergebnissen aus anderen Modellen, 3-D Kulturen zu einem weiteren wertvollen alternatives Modell zur Verbesserung des Verständnisses von Krankheiten im Zusammenhang mit Mechanismen, die ein enormes Potenzial für die Entwicklung halten können kombiniert neuartiger Produkte und Verfahren in der Diagnostik, Prävention und Behandlung von Infektionskrankheiten.
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde von der US National Institutes of Health NIH Zuschusses / NICHD # HD051998 (zum CAM) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| Cytodex Mikroträger Perlen | Sigma-Aldrich | C3275 | |
| Rotierende Cell Culture System (RCCS) | Synthecon | RCCS-D | Inklusive Rotorgrundkörper, Stromversorgung, 4 Einweg RCCS Einheiten |
| RCCS Einweg-Units | Synthecon | Kontakt Synthecon | |
| 3ml Luer-Lock Spritze | BD | 309585 | |
| 10ml breit Spitze serologischen Pipetten | BD | 357504 | |
| MEM Alpha | Invitrogen | 12561-072 | |
| Leibovitz L-15-Medium, Pulver | Invitrogen | 41300-039 | |
| H 2 O, Endotoxin frei | Fischer | MT-25 bis 055-CM | |
| Natriumbikarbonat | Sigma-Aldrich | S-7795 | |
| Pepton | Fisher Scientific | BP1420-100 | |
| Fructose | Sigma-Aldrich | F3510-100 | |
| Galactose | Sigma-Aldrich | G5388-100 | |
| Glucose | Sigma-Aldrich | G7528-250 | |
| HEPES | Invitrogen | 15630-080 | |
| L-Glutamin | Invitrogen | 25030 | |
| Insulin-Transferrin-Natriumselenit (ITS) | Sigma-Aldrich | I1884 | |
| FBS | Invitrogen | 10437 | |
| Penicillin-Streptomycin | Invitrogen | 15140 |
Referenzen
- Knofler, M. Critical growth factors and signalling pathways controlling human trophoblast invasion. Int. J. Dev. Biol. 54, 269-269 (2010).
- Cartwright, J. E. Remodelling at the maternal-fetal interface: relevance to human pregnancy disorders. Reproduction. 140, 803-803 (2010).
- Harris, L. K. IFPA Gabor Than Award lecture: Transformation of the spiral arteries in human pregnancy: key events in the remodelling timeline. Placenta. 32, S154-S154 (2011).
- Whitley, G. S., Cartwright, J. E. Trophoblast-mediated spiral artery remodelling: a role for apoptosis. J. Anat. 215, 21-21 (2009).
- Apps, R. Genome-wide expression profile of first trimester villous and extravillous human trophoblast cells. Placenta. 32, 33-33 (2011).
- Bilban, M. Trophoblast invasion: assessment of cellular models using gene expression signatures. Placenta. 31, 989-989 (2010).
- LaMarca, H. L. Three-dimensional growth of extravillous cytotrophoblasts promotes differentiation and invasion. Placenta. 26, 709-709 (2005).
- Jovanovic, M., Stefanoska, I., Radojcic, L., Vicovac, L. Interleukin-8 (CXCL8) stimulates trophoblast cell migration and invasion by increasing levels of matrix metalloproteinase (MMP)2 and MMP9 and integrins alpha5 and beta1. Reproduction. 139, 789-789 (2010).
- Husslein, H. Expression, regulation and functional characterization of matrix metalloproteinase-3 of human trophoblast. Placenta. 30, 284-284 (2009).
- Barrila, J. Organotypic 3D cell culture models: using the rotating wall vessel to study host-pathogen interactions. Nat. Rev. Microbiol. 8, 791-791 (2010).
- Hammond, T. G., Hammond, J. M. Optimized suspension culture: the rotating-wall vessel. Am. J. Physiol. Renal. Physiol. 281, 12-12 (2001).
- Unsworth, B. R., Lelkes, P. I. Growing tissues in microgravity. Nat. Med. 4, 901-901 (1998).
- Schmeichel, K. L., Bissell, M. J. Modeling tissue-specific signaling and organ function in three dimensions. J. Cell. Sci. 116, 2377-2377 (2003).
- Bentrup, H. ?. ?. n. e. r. z. u., K, . Three-dimensional organotypic models of human colonic epithelium to study the early stages of enteric salmonellosis. Microbes. Infect. 8, 1813-1813 (2006).
- Carterson, A. J. A549 lung epithelial cells grown as three-dimensional aggregates: alternative tissue culture model for Pseudomonas aeruginosa pathogenesis. Infect. Immun. 73, 1129-1129 (2005).
- Myers, T. A. Closing the phenotypic gap between transformed neuronal cell lines in culture and untransformed neurons. J. Neurosci. Methods. 174, 31-31 (2008).
- Hjelm, B. E. Development and characterization of a three-dimensional organotypic human vaginal epithelial cell model. Biol. Reprod. 82, 617-617 (2010).
- Straub, T. M. In vitro cell culture infectivity assay for human noroviruses. Emerg. Infect. Dis. 13, 396-396 (2007).
- Nickerson, C. A. Three-dimensional tissue assemblies: novel models for the study of Salmonella enterica serovar Typhimurium pathogenesis. Infect. Immun. 69, 7106-7106 (2001).
- Carvalho, H. M., Teel, L. D., Goping, G., O'Brien, A. D. A three-dimensional tissue culture model for the study of attach and efface lesion formation by enteropathogenic and enterohaemorrhagic Escherichia coli. Cell. Microbiol. 7, 1771-1771 (2005).
- Sainz, B., TenCate, V., Uprichard, S. L. Three-dimensional Huh7 cell culture system for the study of Hepatitis C virus infection. Virol. J. 6, 103-103 (2009).
- Lelkes, P. I., Ramos, E., Nikolaychik, V. V., Wankowski, D. M., Unsworth, B. R., Goodwin, T. J. GTSF-2: a new, versatile cell culture medium for diverse normal and transformed mammalian cells. In Vitro Cell. Dev. Biol. Anim. 33, 344-344 (1997).
- Lelkes, P. I., Ramos, E., Nikolaychik, V. V., Wankowski, D. M., Unsworth, B. R., Goodwin, T. J. GTSF-2: a new, versatile cell culture medium for diverse normal and transformed mammalian cells. In Vitro Cell. Dev. Biol. Anim. 33, 344-344 (1997).
- GE Healthcare. Microcarrier Cell Culture - Principles and Methods. Handbooks. , (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten