Method Article
Сбор переменной концентрации Изотермические наборов калориметрия титрования с целью определения обязательных механизмов
В этой статье
Резюме
ЦМТ представляет собой мощный инструмент для изучения связывания лиганда с его хозяином. В сложных системах однако, несколько моделей, может соответствовать данным одинаково хорошо. Метод, описанный здесь, предоставляет средства для выяснения соответствующей моделью привязки для сложных систем и извлечь соответствующие термодинамических параметров.
Аннотация
Изотермические калориметрии титрования (ЦМТ) обычно используется для определения термодинамических параметров, связанных с связывание лигандов с хостом макромолекулы. МТЦ имеет некоторые преимущества по сравнению с общим спектроскопических подходы для изучения хост / лиганд. Например, тепла, выделяемого или поглощаемого когда два компонента взаимодействуют непосредственно измеряется и не требует каких-либо экзогенных журналистам. Таким образом, обязательными энтальпии и постоянной ассоциации (Ka) непосредственно получить из данных ЦМТ, и может быть использована для расчета энтропийного вклада. Более того, форма изотермы зависит от с-стоимость и механистической модели участвуют. С-стоимость определяется как C = N [P] ТКА, где [Р] т является концентрация белка, а п-число лиганд связывающих участков в пределах хоста. Во многих случаях, множественные сайты связывания данного лиганда неэквивалентный и МТК позволяет характеристика термодинамических параметров связывания для каждого отдельного сайта связывания. Это, однако, требует, чтобы правильная модель привязки быть использованы. Этот выбор может быть проблематичным, если различные модели может поместиться в тех же экспериментальных данных. Ранее нами было показано, что эта проблема может быть преодолена путем проведения экспериментов на нескольких с-значениями. Несколько изотерм, полученных при различных с-значения подходят одновременно для отдельных моделей. Правильная модель следующего определены на основе критерия согласия во всем переменным с набором данных. Этот процесс применяется здесь, чтобы аминогликозидов сопротивление вызывающих фермента аминогликозидов N-6'-ацетилтрансферазы-II (AAC (6 ')-II). Хотя наша методология применима к любой системе, необходимость этой стратегии лучше продемонстрировал макромолекулы-лиганд система показывает allostery или кооперативности, и когда различные обязательные модели обеспечивают практически идентичны подходит для тех же данных. Насколько нам известно, Есть нет таких систем на коммерческой основе. AAC (6 ')-II, является гомо-димер, содержащий два активных центров, показывая кооперативности между двумя подразделениями. Однако ЦМТ данных, полученных на одном с-значение может быть одинаково хорошо подходит, по крайней мере две различные модели двух наборов-оф-сайты независимых модели и два сайта последовательными (кооперативные) модели. Через различные с-значение, как указывалось выше, было установлено, что правильная модель привязки для AAC (6 ')-Ii состоит из двух последовательных сайте модель привязки. Здесь мы опишем шаги, которые необходимо предпринять при выполнении ITC экспериментов с целью получения данных подходит для переменной с анализами.
протокол
1. Подготовка исходных растворов
- Purify макромолекулы интересов. (В этом случае, аминогликозидов N-6'-ацетилтрансферазы-II (AAC6'-II), выделяется в виде сообщается в другом месте. 13)
- Подготовка 4 литра диализа буфера. (В данном случае мы использовали 25 мМ 4 - (2-гидроксиэтил)-1-piperazineethanesulfonic кислоты (HEPES, МВт 238,3 г / моль), содержащий 2 мМ этилендиаминтетрауксусной кислоты (ЭДТА, МВт 292,2), при рН 7,5).
- Диализировать белка AAC (6 ')-Ii образца (5 мл на 400 мкМ) должны быть диализу в буфере диализа (3 х 1,3 л). Окончательное решение диализа сохраняется для полоскания машина и для разбавления образцов.
- Фильтры окончательное решение диализа через фильтр 0,45 мкм целлюлозы и хранили при 4 ° C. Будет называться "работает буфер '
- Фильтры белкового раствора через шприц 0,2 мкм фильтр, который был тщательно промыть под управлением буфера. Меру окончательной концентрации белка с использованием стандартного анализа (Bradford, Lowry и т.д.) или УФ-поглощению. Магазин белка максимально долгосрочной стабильности. (В случае AAC (6 ')-II, это означает, хранения при 4 ° C. AAC (6')-Ii не сохраняет активность после замораживания и оттаивания).
- Подготовка 200 мкл 25 мМ маточного раствора ацетил-кофермент (AcCoA, лиганд, МВт 809,57) путем растворения 4,0 мг в управлении буфером. Замораживание при -78 ° С до готовности к использованию.
- Все белка и лиганда образцы должны быть получены от тех же растворы, чтобы свести к минимуму случайные выборки к выборке колебания концентрации. Единый поправочный коэффициент для концентрации белка по всей переменной в наборе данных настраивается в анализе 10.
2. Подготовка образцов МТЦ
- Разбавьте раствор фермента в с-значение 64 с окончательным объемом 2 мл. (В случае AAC (6 ')-II, что соответствует 192 мкм.)
- Быстрое таяние лиганд (AcCoA) исходный раствор в ледяной воде.
- Подготовка 0,5 мл раствора AcCoA 10 раз более концентрированный то число сайтов связывания на белке, в данном случае 4 мм, путем разбавления 80 мкл исходного раствора AcCoA в 420 мкл буфера работает. Перевод на пипетку заполнения трубы. Быстрое возвращение решение AcCoA акции до -78 ° C.
- Дега белка и решений под вакуумом в течение 5 мин при температуре 1 ° С ниже желаемой рабочей температуры (19 ° С).
3. Настройка шприц 14
- Вставьте инъекции шприцем через шприц держатель пока предварительно смонтированный шприц зажим на той же высоте, как держатель.
- Поток второй зажим шприца через инъекции шприцом, чтобы она плотно прижимается к нижней части шприца держателя. Аккуратно затянуть хомут при условии, 0,050 "Болл Драйв Hex Point.
- Место шприца держателя в держатель пипетки.
- Аккуратно вставьте пипетку инжектора в инъекции шприцем. Убедитесь, что наконечник плунжера подается непосредственно в отверстие шприц. После полной вставлены, винт блокировки воротник шприц держатель в пипетку инжектора.
4. Загрузка образцов ячейки 14
- Вымойте кювету с минимум 50 мл работает буфер и удалить оставшуюся жидкость с помощью долгосрочных иглами 2,5 мл стеклянный шприц.
- Медленно привлечь минимум 1,8 мл анализируемого раствора белка в чистом и сухом долгосрочной иглами 2,5 мл шприца. Будьте осторожны, чтобы не вводить никаких пузырей.
- Осторожно вставьте иглу в кюветы и нежно прикоснуться к нижней части клетки. Поднимите кончик слегка (~ 1 мм) и осторожно вводят AAC (6 ')-Ii раствора в камеру, пока лишняя жидкость видна выше верхней части кюветы.
- Медленно поднимите иглу около 1 см, обеспечивая при этом остается в жидком переполнения. Быстро снять, и вводят небольшое количество раствора (~ 0,25 мл), чтобы удалить какой-либо захваченных пузырьков в пробе клеток.
- Удалите все решения переполнения. Это достигается за счет мягко скользящей иглой наряду переполнения в образец клеток. Наконечника шприца ударит выступ, это желание высоты для работы решение. Удалите всю жидкость, которая находится на этой линии.
5. Загрузка инъекции шприцем и инициирование запуска 14
- Прикрепите пластиковый шприц загрузки заполнить трубу в порт.
- Нижний наконечник плунжера в начало заполнять порт.
- Место решение AcCoA в пипетку заполнения трубки в нижней части держателя пипетки. Наконечника шприца не должны касаться нижней части заполнения трубы.
- Медленно привлечь раствора в шприце пока небольшое количество поступает в трубку загрузки шприца.
- Закрыть заполнить порта за счет снижения наконечник плунжера и нажмите на кнопку Закрыть Заполните порта. Чистки и пополнения счета, нажав на Purge-> кнопка Refill, 3 раза, чтобы удалить пузырьки воздуха, которые могут попасть в ловушку во время загрузки.
- Удалить заполнения трубки из пипетки держатель и осторожно протрите наконечника шприца.
- Возьмите пипетку сборки и аккуратно опустите шприца в кюветы. Выполните медленно, как шприц можно легко согнуть, поэтому особое внимание на то необходимости. Обеспечить шприц полностью вставлен, нажав на базе блокировки воротник.
- Установите нужное рабочей температуры (в данном случае 20 ° C) и выберите ссылку власти, который немного больше, чем максимальный тепловой поток инъекции ожидается (в данном случае 20μcal/sec).
- Программа желаемого инъекций объемов и задержек. (В этом случае, 28 инъекций были заняты. Первая инъекция была объемом 2 мкл с 60 с задержкой. Все последующие инъекции были объемах 10 мкл с задержкой 330 сек.)
6. Последующих запусках
- Во всех последующих запусков повторите шаги 2-5, при уменьшении AAC (6 ')-II И AcCoA концентрации на коэффициент 2,4,8,16 и 32.
7. Анализ данных
- Использование установки процедура, которая глобально подходит все изотермы на единый набор обязательных параметров, как описано выше 10.
8. Представитель Результаты
Представитель данные представлены на рисунке 1. Форма изотермы должны меняться в зависимости от концентрации. Более резкие переходы ожидаются выше с-значения (то есть больше белка и лиганда концентрации) (рис. 2).
В случае AAC (6 ')-II, два сайта последовательными модель дает лучше подходит, чем один описывающих два набора одинаковых, независимых сайтов с регулируемым стехиометрии.
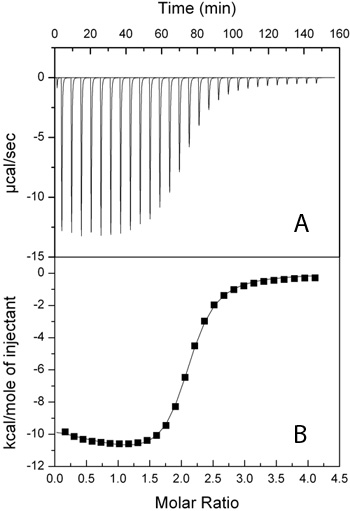
Рисунок 1. Изотермы производства титрования AcCoA (3,86 ммоль) в AAC (6 ')-Ii (192 мкМ). А) Сырье следа ЦМТ. B) Интегрированный значения, используемые для определения обязательных параметров (квадраты) с 2-сайта последовательными подходит (-).
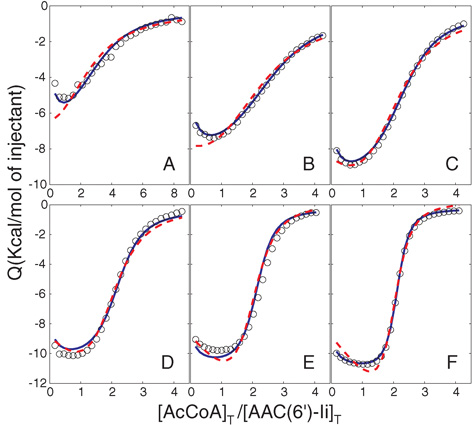
Рисунок 2. ITC изотермы AcCoA титруют в AAC (6 ')-Ii при различных концентрациях. Экспериментальными данными (кружки) были пригодны для 2-наборов-оф-сайты независимых модели (пунктирная пурпурный) и 2-сайте последовательной модели (сплошная синяя). 2-сайте sequentional модель, очевидно, дает лучшую общую соглашения. Концентрации были заняты) 6 мкм, 0,25 мм, B) 12 мкм, 0,25 мМ, С) 24 мкМ, 0,5 мм, D) 48 мкМ, 1,0 мм, E) 96 мкМ, 1,9 мм и F) 196 мкМ, 3,86 мм, для AAC (6 ')-II И AcCoA соответственно.
Обсуждение
Эта аналитическая часть переменной с установки был ранее подробно описаны 10. Здесь мы приводим практические аспекты сбора переменных данных с подходящим для этого подхода. Очень важно, чтобы все белка и лиганда образцы взяты из тех же растворов акций. Поэтому важно, чтобы достаточное маточного раствора готовится первоначально завершить целую серию экспериментов. Это гарантирует, отношение AAC (6 ')-II И AcCoA постоянно среди всех экспериментов, а также снижает случайные флуктуации концентрации на выборки к выборочной основе.
В этом случае, многое необходимо соблюдать осторожность при обращении с лигандом. AcCoA химически неустойчивы в растворах, поэтому важно, что исходный раствор остается в жидком состоянии в течение очень коротких промежутков времени. Как только необходимые суммы аликвоты от маточного раствора, акции должны быть немедленно замораживать. Если этого не сделать, то AcCoA может со временем ухудшаться и концентрации не будет правильным в дальнейшем работает. Как только аликвоты, AcCoA образцы должны быть использованы немедленно. В случае с белками, которые являются нестабильными, подобные меры будут необходимы.
Эта процедура может быть легко модифицирована для изучения других сложных систем. 10 используемых концентрациях должны быть адаптированы к константы связывания конкретной системы. Широкий диапазон значений с примерно между 1 и 1000 8,10 требуется по набору данных.
Раскрытие информации
Благодарности
Работа выполнена при поддержке Канадского института исследований в области здравоохранения (CIHR), Национальным научным и инженерным исследованиям Совета (NSERC), а также обучение CIHR предоставлять стипендии (для LF). Мы благодарим профессора Джерарда Д. Райт (McMaster University, Канада) для AAC (6)-Ii выражение плазмиды.
Материалы
| Name | Company | Catalog Number | Comments |
| Acetyl c–nzyme A (AcCoA) | Sigma-Aldrich | A2056 | |
| 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES) | Fisher Scientific | 7365-45-9 | |
| ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | 431788 | |
| Spectra/Por 2 Dialysis Tubing | Spectrum Labs | 132678 | |
| Sterile Syringe Filter (0.2 μm) | VWR international | 281445-477 | |
| Cellulos Nitrate Membrane Filters (0.45 μm) | Whatman, GE Healthcare | 7184-004 | |
| VP-ITC | MicroCal | VP-ITC | Microcalorimeter used for measurements |
| ThermoVac | MicroCal | USB Thermo Vac | Temperature Controlled Degassing Station |
Ссылки
- Cliff, M. J., Ladbury, J. E. A survey of the year 2002 literature on applications of isothermal titration calorimetry. Journal of Molecular Recognition. 16, 383-391 (2003).
- Cliff, M. J., Gutierrez, A., Ladbury, J. E. A survey of the year 2003 literature on applications of isothermal titration calorimetry. Journal of Molecular Recognition. 17, 513-523 (2004).
- Ababou, A., Ladbury, J. E. Survey of the year 2004: literature on applications of isothermal titration calorimetry. Journal of Molecular Recognition. 19, 79-89 (2006).
- Ababou, A., Ladbury, J. E. Survey of the year 2005: literature on applications of isothermal titration calorimetry. Journal of Molecular Recognition. 20, 4-14 (2007).
- Okhrimenko, O. ksana, J, I. A survey of the year 2006 literature on applications of isothermal titration calorimetry. Journal of Molecular Recognition. 21, 1-19 (2008).
- Bjelic, S., Jelesarov, I. A survey of the year 2007 literature on applications of isothermal titration calorimetry. Journal of Molecular Recognition. 21, 289-312 (2008).
- Leavitt, S., Freire, E. Direct measurement of protein binding energetics by isothermal titration calorimetry. Current Opinion in Structural Biology. 11, 560-566 (2001).
- Wiseman, T., Williston, S., Brandts, J. F., Lin, L. -N. Rapid measurement of binding constants and heats of binding using a new titration calorimeter. Analytical Biochemistry. 179, 131-137 (1989).
- Capaldi, S. The X-Ray Structure of Zebrafish (Danio rerio) Ileal Bile Acid-Binding Protein Reveals the Presence of Binding Sites on the Surface of the Protein Molecule. Journal of Molecular Biology. 385, 99-116 (2009).
- Freiburger, L. A., Auclair, K., Mittermaier, A. K. Elucidating Protein Binding Mechanisms by Variable-c ITC. ChemBioChem. 10, 2871-2873 (2009).
- Wybenga-Groot, L. E., Draker, K. -a, Wright, G. D., Berghuis, A. M. Crystal structure of an aminoglycoside 6'-N-acetyltransferase: defining the GCN5-related N-acetyltransferase superfamily fold. Structure. 7, 497-507 (1999).
- Draker, K., Northrop, D. B., Wright, G. D. Kinetic Mechanism of the GCN5-Related Chromosomal Aminoglycoside Acetyltransferase AAC(6')-Ii from Enterococcus faecium: Evidence of Dimer Subunit Cooperativity. Biochemistry. 42, 6565-6574 (2003).
- Wright, G. D., Ladak, P. Overexpression and characterization of the chromosomal aminoglycoside 6'-N-acetyltransferase from Enterococcus faecium. Antimicrob. Agents Chemother. 41, 956-960 (1997).
- MicroCal. ITC Data Analysis in Origin. , 7 edn, MicroCal. (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены