Method Article
Маркировка F-актин Колючая Заканчивается родамин-актина в проницаемыми нейронов конусы роста
В этой статье
Резюме
Метод для визуализации и количественной оценки F-актин колючей заканчивается в нейронных конусы роста описывается. После культивирования нейронов на стекле покровные, клетки с проницаемыми сапонина содержащего решение. Затем, короткий инкубационный с буфера, содержащего сапонин родамин-актина включает в себя люминесцентные актина на свободные актина колючей концах.
Аннотация
The motile tips of growing axons are called growth cones. Growth cones lead navigating axons through developing tissues by interacting with locally expressed molecular guidance cues that bind growth cone receptors and regulate the dynamics and organization of the growth cone cytoskeleton3-6. The main target of these navigational signals is the actin filament meshwork that fills the growth cone periphery and that drives growth cone motility through continual actin polymerization and dynamic remodeling7. Positive or attractive guidance cues induce growth cone turning by stimulating actin filament (F-actin) polymerization in the region of the growth cone periphery that is nearer the source of the attractant cue. This actin polymerization drives local growth cone protrusion, adhesion of the leading margin and axonal elongation toward the attractant.
Actin filament polymerization depends on the availability of sufficient actin monomer and on polymerization nuclei or actin filament barbed ends for the addition of monomer. Actin monomer is abundantly available in chick retinal and dorsal root ganglion (DRG) growth cones. Consequently, polymerization increases rapidly when free F-actin barbed ends become available for monomer addition. This occurs in chick DRG and retinal growth cones via the local activation of the F-actin severing protein actin depolymerizing factor (ADF/cofilin) in the growth cone region closer to an attractant8-10. This heightened ADF/cofilin activity severs actin filaments to create new F-actin barbed ends for polymerization. The following method demonstrates this mechanism. Total content of F-actin is visualized by staining with fluorescent phalloidin. F-actin barbed ends are visualized by the incorporation of rhodamine-actin within growth cones that are permeabilized with the procedure described in the following, which is adapted from previous studies of other motile cells11, 12. When rhodamine-actin is added at a concentration above the critical concentration for actin monomer addition to barbed ends, rhodamine-actin assembles onto free barbed ends. If the attractive cue is presented in a gradient, such as being released from a micropipette positioned to one side of a growth cone, the incorporation of rhodamine-actin onto F-actin barbed ends will be greater in the growth cone side toward the micropipette10.
Growth cones are small and delicate cell structures. The procedures of permeabilization, rhodamine-actin incorporation, fixation and fluorescence visualization are all carefully done and can be conducted on the stage of an inverted microscope. These methods can be applied to studying local actin polymerization in migrating neurons, other primary tissue cells or cell lines.
протокол
Для родамин-актина маркировки, нейроны культивировали на покровных стекла помещены в нижней части 35 мм блюда пластика, или на покровные стекла вклеены в "видео" блюд.
1. Подготовка Покровные стекла или "Видео" Блюда
- Многие типы нейронов плохо клея в пробирке субстратов. Стекла покровные, которые требуются для этой процедуры, не могут обеспечить достаточное количество нейронов субстрата адгезии, если они должным образом очищены и подготовлены. Подробный порядок кислоты мойки и очистки стекла покровные описан в книге культивирования нервных клеток, под редакцией Банкир и Гослин. Кроме того, нитроцеллюлозные покрытия для покровные, которые активно связывается молекул субстрата, это описано в пунктах 1.7 и 1.8 ниже.
- Стекла покровные (например, 18 мм, квадрата или 24 мм кружки) промывают в дН 2 O и запеченные в сухое тепло (≥ 225 ° C) как можно дольше (минимум нескольких дней до трех месяцев и более), чтобы удалить следы органических соединений. Перейдите к пункту 1.6 или для видео блюда приступить к 1,3.
- Для создания тонкой ясно стеклянной подложки для высокого videomicroscopy резолюцию, круглые отверстия соответствующего диаметра бурятся на дне 35 или 50 мм Петри пластиковые или блюда культуры тканей с помощью электрического бура пробки (или аналогичный документ). Бурение осуществляется медленно, с легким нажимом, чтобы избежать растрескивания пластика. Края отверстия являются соскабливают ножницами, чтобы создать гладкую поверхность с обеих сторон.
- Стекла покровные уборка для тканевой культуры использования, как описано в 1.1 или 1.2. Покровные стекла приклеены на место через отверстия, с использованием нетоксичных силиконовые аквариуме цемента (на покровных 18x18mm, 12 мм диаметр бита используется). Цемент отверждается в течение 24 часов.
- (Следующие шаги выполняются с помощью стерильных условиях) видео блюда промыть 3 раза стерильной дН 2 O и позволил высохнуть на воздухе.
- Покровные стекла покрыты молекул субстрата для нейронов культуры. Во-первых, покровное поверхность покрыта (250 мкл на покровное 18х18) растворе 100 мкг / мл поли-D-лизина в PBS в течение 4-8 часов (или на ночь) в увлажненные 38 ° C инкубатора. Покровные стекла, затем промыть 3 раза стерильной дН 2 O для удаления несвязанных поли-D-лизина и позволил высохнуть на воздухе. Многие типы нейронов культивировали на покровных покрытые поли-D-лизина в одиночестве, если сывороточные белки входят в культуральной среде. Однако результаты более релевантными в естественных условиях получаются путем использования природных молекул субстрата. Решения этих молекул, таких как ламинин, фибронектин или L1 CAM (1-20 мкг / мл в PBS), могут быть непосредственно применены к поли-D-лизин покрытием покровных в течение 4-8 часов или на ночь, но в нашей лаборатории мы обычно пальто подготовлены покровные с тонкой пленкой нитроцеллюлозы перед применением молекул клеточной адгезии к увеличению белка-субстрата.
- Сделать 1% нитроцеллюлозы раствор путем растворения 5 г нитроцеллюлозы в 5 мл на 100% амилацетат. Применяют 10 мкл этого раствора до покровного и мягко распростерла его над поверхностью. Воздух сухой 10 минут.
- Применить 250 мкл раствора 25 мкг / мл ламинин или 4 мкг / мл L1 CAM в ФБР и распространяются на нитроцеллюлозные поверхности. Инкубируйте 4 часа (или на ночь) в увлажненные 38 ° C инкубатор, аспирация субстрат и сразу же добавить культуральной среде, поэтому субстрат не сушит.
2. Подготовка нейронных культур
- Эмбриональные день 7 куриных эмбрионов удаляются из яйца, и помещены в 100 мм чашках Петри содержащей культуральной среде с 10% сыворотки для вскрытия, чтобы удалить внутренние органы от грудной клетки и живота, с помощью стереомикроскопа.
- Эмбрионов затем промыть средних и переехал в 60 мм блюдо с жидкой средой и в дальнейшем, чтобы удалить расчлененных и подготовить эксплантов спинных ганглиев корня (DRG) или нервных тканей сетчатки. Подробное описание вскрытия могут быть найдены в методы в клеточной биологии, том 71, Нейроны: методы и приложения для сотовых биолог, под редакцией Холленбек и Bamburg. DRG эксплантов являются 1/2-whole ганглиев и нервных сетчатки эксплантов 1 мм или менее в диаметре.
- После очистки эксплантов посторонних тканей, отдельных эксплантатов перемещаются с часовщиками щипцы для покровные, которые уже в культуре блюда с питательной среды. Под микроскопом рассекает, эксплантов мягко прижимается к центру покровное щипцами, чтобы предотвратить движение при транспортировке в инкубаторе. Эксплантов культивируют в среде с F12 B27 добавки, буфер 10 мМ HEPES до рН 7,4 и помещен на ночь в увлажненных 38 ° C инкубатора. Факторы роста могут быть добавлены, по мере необходимости, в культуральной среде. Нейротрофинов часто добавляют в DRG культуры от старших эмбрионы, хотя E7 DRG нейроны продлит аксонов от эксплантов без добавления нейротрофинов. Эксплантов нейронных аксонов сетчатки расширить в этом культуральной среде безdding факторов роста.
- Культуры инкубируют в течение по крайней мере 18 часов, чтобы обеспечить достаточное аксонального результат до начала процедуры ниже.
3. Подготовка родамин-актина пермеабилизации буфера
- Исходный раствор пермеабилизации буфера, содержащего 138 мМ KCl, 10 мМ ТРУБЫ, 3 мм EGTA, 4мм MgCl 2 и 1% BSA (рН = 6,9) могут быть сохранены до 2 недель при температуре 4 ° C11. Просто перед употреблением, следующие компоненты добавлены для конечной концентрации: 0,025% сапонина, 0,1 мМ АТФ, и 100 нМ Alexa Fluor 350-фаллоидином.
- Отдельное решение также свежеприготовленные непосредственно перед использованием этих же компонентов плюс 0.45μM родамина без мышц актина решение поочередно перемешивают и tritrated в течение 5 минут, чтобы растворить родамин-актина сгустки, и перемешивали в течение 1 мин на первоначальном этапе, пермеабилизации для предотвращения полимеризации в трубке. Если несмотря на это, нити сборки в трубке остается проблемой, решение может быть центрифугировали перед использованием.
4. Пермеабилизации нейронных культур и включение родамин-актина на F-актин Колючая Заканчивается
- Культуры блюдо с DRG или сетчатки эксплантов тщательно удалить из инкубатора и выполняются следующие шаги при комнатной температуре.
- Все изменения решений должно быть сделано аккуратно. Кончика пипетки должны быть размещены на краю покровного стекла, и решения должны быть удалены и добавил, медленно и с минимальной силой.
- Культуральной среде удаляют пипеткой осторожно, но неуклонно, и достаточно буфера пермеабилизации для покрытия клетки добавляется в течение 1 мин (для 18мм х 18мм покровное, ~ 60 мкл). Культура не промывать любые другие решения, прежде чем добавлять пермеабилизации буфер, и покровное не дают высохнуть, прежде чем добавлять пермеабилизации буфера.
- Пермеабилизации буфер аккуратно удалены пипетки и заменены пермеабилизации буфера, содержащего 0,45 мкм родамина без мышц актина в течение 4 мин.
- Родамин-актин-содержащего буфер аккуратно удалены пипетки, а нейроны устанавливаются путем добавления раствора 4% параформальдегида (лабораторные класса, сделанный с фосфатным буфером, рН 7,3), 0,05% глутарового альдегида и 10% сахарозы. После фиксации 5 минут покровные мягко промывают PBS, и монтируется в Slowfade на 3-дюймовым слайды стекло.
- Альтернативный подход к изменению решений является использование проточной ячейки. Это может быть коммерчески доступных проточной ячейки, или простой клетки поток может быть сделано путем размещения небольших кусочков пластика (≤ 1 мм) в качестве прокладки по углам покровного стекла, а затем монтаж равного размера покровное на вершине покровное. Решения могут быть обменены на размещение пипетки с одной стороны проточной ячейки и снятия решения с фитиль (хлопок или Kimwipe) на другой стороне.
- Включение родамин-актина на F-актин колючей концы и флуоресцентных фаллоидином маркировка F-актин роста конусов визуализируется с эпи-флуоресценции оптики через 60X цель погружения нефть, и изображения собраны, используя охлаждением ПЗС-камерой. Конфокальной микроскопии может обеспечить улучшенные изображения.
- Для лучшего количественного родамин-актина включения все изображения должны быть собраны в один сеанс, используя те же выгоды и параметры экспозиции в цифровой чувствительность камеры для каждого изображения. Анализ маркировка должна быть изготовлена из эквивалентной регионов каждого изображения; Метаморф, изображение J или аналогичными компьютеризированных инструментов для анализа изображений могут быть использованы.
ВАРИАЦИИ этой процедуры
5. Изменение Один: Собрать изображения в реальном времени сотовый До родамин-актина маркировки
- Видео блюда помещаются на столик микроскопа нагревается, и изображения в реальном времени конуса роста собираются. Рифленые покровные могут быть использованы, или офорты и / или ручка маркировки на покровное может быть сделано, чтобы легче найти специфические клетки после маркировки, или видео блюдо может быть установлена в месте на столике микроскопа на время процедуры.
- Пермеабилизации, включение родамин-актин, и фиксации клеток ведутся на видео блюдо, включен или выключен столик микроскопа. После исправления, PBS добавляется видео блюд для немедленной обработки изображений. Чтобы сохранить образец для последующего отображения, slowfade монтажа среду добавляется покровное и покровное одинакового размера аккуратно укладывать поверх (избегая пузырьков), а по краям затем опечатаны прозрачным лаком ногтей.
6. Изменение второй: иммунохимии к сотрудничеству этикетке Дополнительная Белки
- Родамин-актина регистрации и фиксация может быть проведена на нейроны культивировали на покровных или в видео блюда, как описано выше (4.2-4.4).
- После фиксации и промывки в PBS, клетки обрабатывают 15 мин с 0,1 М глицина в PBS и затем экстрагировали 0,1% Тритон Х-100 (TX-100) в PBS с 2% сыворотки козьего и 1% BSA в течение 1 ч. Покровныеинкубировали с первичными антителами разводят в PBS, содержащем 1% BSA в течение 1 ч. Покровные стекла, затем промыть и инкубировали в 0,1% TX-100 в PBS с 2% сыворотки козьего и 1% BSA в течение 1 часа, перед применением флуоресцентных вторичными антителами в разведении 1:1000 в PBS с 1% BSA в течение 1 ч. После полоскания, покровные вновь инкубировали в 0,1% TX-100 в PBS с 2% сыворотки козьего и 1% BSA в течение 30 мин, промывают и монтируется в анти-выцветания среды. Локализация некоторых белков нарушается начальный шаг пермеабилизации (4,3). Для сохранения этих белков для локализации с антителами, 0,05% параформальдегида и 0,05% глутаральдегида может быть добавлен к пермеабилизации буфера в течение 1 мин (то есть, прежде чем добавлять родамин-актин), не затрагивая колючей маркировки закончится родамин-актина.
- Изображения тройной меченных конусы роста собираются флуоресценции или конфокальной микроскопии.
7. Изменение три: Оценка воздействия ориентации Cues на F-актин бесплатно Колючая Заканчивается
- Фактор роста или руководства кием добавляют к культуре блюда в инкубаторе при концентрации нескольких нанограмм / мл в течение нескольких минут (или соответствующее время лечения), прежде чем снимать блюдо из инкубатора и начала пермеабилизации процедуры. Это позволяет оценить краткосрочные эффекты факторов роста или руководства сигналы на F-актин свободной колючей концах.
- Видео блюдо с нейрональных культурах могут быть размещены на столике микроскопа нагревается, и факторы роста или руководства сигналы могут быть освобождены от микропипетки в градиент около конуса роста перед началом пермеабилизации и родамин-актина регистрации. Например, NGF может быть освобожден для DRG нейроны или netrin для нейронных ганглиозных клеток сетчатки. Пипетки могут быть введены для максимально короткими 1-2 минут до начала пермеабилизации процедуры. Это позволяет оценить местные эффекты градиента руководством кием по образованию F-актин свободной колючей заканчивается в конусе роста ведущих полях (см. ссылку 10 цитат для изображений).
- Эти изменения могут быть объединены с антитело-опосредованной маркировки других нейронов компоненты, как описано в разделе 6.2 выше.
8. Изменение четыре: F-актин бесплатно Колючая Маркировка End на трансфицированных Нейроны
- Использование конститутивно активный или доминантно-негативного конструкций или белка нокдаун использованием РНК-интерференции (с флуоресцентным маркером выявления) может быть использован для оценки участия белка в регулировании F-актин свободной колючей концах. В зависимости от белка, его локализации в пределах конуса роста, и если он сливается с флуоресцентные тег, флуоресцентный белок выразил в трансфекции клетки могут быть потеряны при пермеабилизации. Если это так, видео блюда могут быть использованы для идентификации трансфицированных ячейки микроскопически до пермеабилизации и пермеабилизации может быть выполнена на столике микроскопа, после маркировки позиций трансфекции клеток. Кроме того, GFP-актин конструкция может быть со-трансфицированных GFP-построить интересов. В этом случае, GFP-актин, будут включены в F-актин, и не будут потеряны пермеабилизации, позволяющие идентифицировать трансфекции клеток после пермеабилизации.
- Этот вариант можно комбинировать с добавлением руководством реплики, как это описано в 7.1-7.3 выше.
9. Представитель Результаты

Рисунок 1. Глобальное добавление NGF увеличивает общую F-актин и F-актин колючей заканчивается в конусе роста ведущих маржи. При DRG конус рост стимулируется фактор роста нервов (ФРН) в течение 5 минут, актина полимеризации стимулируется на переднем краю, и светлая полоса родамин-актина маркировка видна на периферии конуса роста. Рисунок 1 сравнивает родамин-актина включения в нестимулированных DRG конуса роста и NGF-стимулированного роста DRG конуса. Зеленая флуоресценция в объединенной изображений фаллоидином маркировка F-актина в рост конуса и красный родамин-актина маркировки. Хороший контроль за колючей маркировки конец добавить 10-6 М или выше цитохалазин или D в пермеабилизации буфере с шагом 4.2 и 4.3. Cytochalasins крышка F-актин колючей заканчивается, и подавляют родамин-актина привязки к колючей концах. Это должно сильно уменьшить или устранить включение родамин-актина в клетке. Шкала баров, 10 мкм.

Рисунок 2. NGF градиент локально увеличивает F-актин колючей концах. Микропипетки, что релизы NGF доводится до одной стороне DRG конуса роста в течение 2 минут, после чего маркировка F-актин свободной колючей концах. Изображения ниже показывают, что воздействие градиента NGF локально стимулирует увеличение F-актин свободной колючей заканчивается в регионе рост конуса ближе к пипетки. Объединить изображение показывает фаллоидином в зеленоми родамин-актина в красный цвет. Шкала бар, 10 мкм.
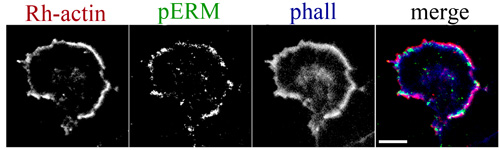
Рисунок 3. Активированный ERM белков накапливаются на рост конуса ведущего края. Иммуноцитохимическая маркировки phospho-Ezrin/Radixin/Moesin (г. Пермь) с F-актин свободной колючей концах. Gluteraldehyde (0,05%) и параформальдегида (0,05%) были включены в первоначальный буфер пермеабилизации для одного мин сохранить ERM локализации. Родамин-актин, красный; ПЕРМЬ, зеленый; фаллоидином, синий. Шкала бар, 10 мкм.

Рисунок 4. Стимуляция полимеризации актина требует активных белков ERM. Диссоциированных ДРГ были совместно трансфицированных GFP-актин и контроль GFP плазмида или доминантно-негативного Эзрин / Radixin / Moesin (DN ERM) конструкции. Использование GFP-актин позволяет идентифицировать трансфекции клеток после пермеабилизации. Здесь, NGF было добавлено 5 минут до маркировка F-актин колючей концах. Обратите внимание на рост конуса трансфицированных DN ERM сократила колючей уровни заканчиваются в конусе роста ведущих маржа (ниже среднего панели), который контрастирует с рядом untransfected конуса роста (нижняя панель) или с контролем GFP (верхняя панель посередине). Родамин-актин, красный; GFP-актин, зеленый. Шкала баров, 10 мкм.
Обсуждение
Методы, представленные здесь, позволяют временным и пространственным разрешением клеточных компонентов, которые участвуют в динамической реконструкции актина цитоскелета на переднем крае миграции роста конусов. Действие аттрактанта молекул, как и NGF или netrin, быстро стимулировать полимеризации актиновых филаментов раскрывается как локальное увеличение актина колючей концов, созданный разрыв актиновых филаментов активированными ADF / cofilin 10, как показано на рисунках 1 и 2. Метод позволяет локализации других белков, участвующих в посредничестве роста конуса chemotropic ответов, таких как radixin, ERM белка, изображенные на рисунках 3 и 4. Эти методы могут быть применены и для анализа регуляции актин основе подвижности в миграции нейронов, глиальных клеток или других типов клеток.
Деликатный характер роста конусов или другие небольшие подвижные структур существенным ограничением в использовании этого метода. Рост конуса ведущего поля или аналогичных подвижных регионов клетки содержат несколько структурных элементов, отличных от актиновых нитей и мембраны плазмы, так что забота должна быть взята на каждом шагу. Сотовые агрегатов или эксплантов может быть нарушена при изменении поверхностного натяжения, как решения обмениваются. Как указано в протоколе, то лучше всего разместить пипетки на краю покровные для изменения решения, а также использование проточной ячейки бы избавиться от проблем, от поверхностного натяжения.
Альтернативный метод для визуализации актиновых колючей заканчивается в подвижных областях клеток включает в себя ячейки трансфекции выразить флуоресцентные аналоги колючей конце-связывающими белками, таких как Ena / VASP или миозина X. Однако, актин динамику в полях роста конуса могут быть изменены по нерегулируемым выражение из этих регуляторных белков актина.
Филоподий не так сильно, помеченных этим родамин-актина метода маркировки, которые lamellipodia. Филоподий могут быть нарушены, хотя они помечены и стабилизировать флуоресцентных фаллоидином, содержащиеся в пермеабилизации буфера. Эта разница в lamellipodial против filopodial включение родамин-актин, возможно, отражает количественные ограничения в визуализации включены родамин-актин, или может быть разница в присутствии колючей конце укупорки белков в этих подвижных структур. Это вызывает дополнительное ограничение, что маркировка свободной колючей заканчивается этот метод не раскрывает ли помечены колючей концы вновь созданные, например, путем АПД / cofilin разрыв F-актин, или F-актин не разорваны, но колючей концах освобождаются путем удаления колючей конце укупорки белков.
Раскрытие информации
Благодарности
Авторы выражают благодарность д-р Джеймс Bamburg и члены его лаборатории для сотрудничества в этих исследованиях. Эта работа финансировалась за счет грантов NIH HD19950, EY07133 и за счет субсидий из Миннесоты Медицинский фонд.
Материалы
| Name | Company | Catalog Number | Comments |
| 18x18 mm coverslip | Gold Seal | 3305 | |
| 35mm Petri dishes | Falcon BD | 351008 | |
| Aquarium cement | DAP 100% silicone aquarium sealant | Any hardware store | |
| Poly-D-lysine (mw > 300,000) | Sigma-Aldrich | P1024 | |
| Natural mouse laminin | Invitrogen | 23017-015 | |
| L1 CAM | R&D Systems | 777-NC | |
| Alexa-fluor 350 phalloidin | Invitrogen | A22281 | |
| Rhodamine non-muscle actin | Cytoskeleton, Inc. | APHR-A | |
| F12 Culture medium | Invitrogen | 21700-075 | |
| B27 | Invitrogen | 17504-044 | |
| Slowfade | Invitrogen | 536937 |
Ссылки
- Lowery, L. A., Van Vactor, D. The trip of the tip: Understanding the growth cone machinery. Nat Rev Mol Cell Biol. 10, 332-343 (2009).
- Letourneau, P. Axonal Pathfinding: Extracellular Matrix Role. Encyclopedia of Neuroscience. Squire, L. R. , Academic Press. Oxford. 1139-1145 (2008).
- Kalil, K., Dent, E. W. Touch and go: Guidance cues signal to the growth cone cytoskeleton. Curr Opin Neurobio. 15, 521-526 (2005).
- Dent, E. W., Gertler, F. B. Cytoskeletal dynamics and transport in growth cone motility and axon guidance. Neuron. 40, 209-227 (2003).
- Pak, C. W., Flynn, K. C., Bamburg, J. R. Actin-binding proteins take the reins in growth cones. Nat Rev Neurosci. 9, 136-147 (2008).
- Guan, K. L., Rao, Y. Signaling mechanisms mediating neuronal responses to guidance cues. Nat Rev Neurosci. 4, 941-956 (2003).
- Gallo, G., Letourneau, P. C. Regulation of growth cone actin filaments by guidance cues. J. Neurobiology. 58, 92-102 (2004).
- Fass, J., Gehler, S., Sarmiere, P., Letourneau, P., Bamburg, J. R. Regulating filopodial dynamics through actin-depolymerizing factor/cofilin. Anat Sci Inter. 79, 173-183 (2004).
- Bernstein, B. W., Bamburg, J. R. ADF/cofilin: A functional node in cell biology. Trends Cell Biol. 20, 187-195 (2010).
- Marsick, B. M., Flynn, K. C., Santiago, M., Bamburg, J. R., Letourneau, P. C. Activation of ADF/cofilin mediates attractive growth cone turning toward nerve growth factor and netrin-1. Dev Neurobiol. 70, 565-588 (2010).
- Symons, M. H., Mitchison, T. J. Control of actin polymerization in live and permeabilized fibroblasts. J Cell Biol. 114, 503-513 (1991).
- Chan, A. Y., Raft, S., Bailly, M., Wyckoff, J. B., Segall, J. E., Condeelis, J. S. EGF stimulates an increase in actin nucleation and filament number at the leading edge of the lamellipod in mammary adenocarcinoma cells. J Cell Sci. 111, 199-211 (1998).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены