Method Article
Labeling F-Aktin Barbed Endet mit Rhodamin-Aktin in permeabilisierten Neuronale Growth Cones
In diesem Artikel
Zusammenfassung
Eine Methode zur Visualisierung und Quantifizierung von F-Aktin Stacheldraht endet in neuronale Wachstum Kegel beschrieben. Nach Kultivierung Neuronen auf Deckgläschen werden die Zellen mit einer Saponin-haltigen Lösung permeabilisiert. Dann enthält eine kurze Inkubation mit dem Saponin-Puffer mit Rhodamin-Aktin fluoreszierende Aktin auf freien Aktin Stacheldraht endet.
Zusammenfassung
Die beweglichen Spitzen der wachsenden Axone genannt Wachstum Kegel. Wachstum Kegel führen Navigation Axone durch die Entwicklung von Geweben durch die Interaktion mit lokal ausgedrückt molekulare Orientierung Hinweise, dass das Wachstum Kegel-Rezeptoren binden und regulieren die Dynamik und die Organisation des Zytoskeletts Wachstum Kegel 3-6. Das Hauptziel dieser Navigations-Signale ist das Aktin-Filament-Geflecht, dass das Wachstum Kegel Peripherie und treibt Wachstum Kegel Motilität durch kontinuierliche Aktin-Polymerisation und dynamischen Umbau 7 füllt. Positive oder attraktive Führung Signale induzieren Wachstum Kegel drehen durch Stimulierung Aktin-Filament (F-Aktin) Polymerisation in der Region das Wachstum Kegel Peripherie, die näher an der Quelle der Lockstoff Cue. Das Aktin-Polymerisation Laufwerke lokales Wachstum Kegel Vorsprung, die Haftung der führenden Rand und axonale Elongation in Richtung der Lockstoff.
Aktin-Filament-Polymerisation hängt von der Verfügbarkeit ausreichender Aktin-Monomer und auf Polymerisationskeime oder Aktin-Filament-Stacheldraht endet für die Zugabe von Monomer. Aktin Monomer ist reichlich vorhanden in chick Netzhaut-und Spinalganglien (DRG) Wachstum Kegel. Folglich steigt der Polymerisation schnell, wenn der freie F-Aktin Stacheldraht endet für Monomerzugabe werden. Dies geschieht in chick DRG und Retina Wachstum Kegel über die lokale Aktivierung der F-Aktin-Abtrennung Aktin Depolymerisation Faktor (ADF / Cofilin) in das Wachstum Kegel Region näher an einem Lockstoff 8-10. Diese erhöhte ADF / Cofilin Aktivität trennt Aktinfilamente zu neuen F-Aktin Stacheldraht endet für die Polymerisation zu erzeugen. Die folgende Methode demonstriert diesen Mechanismus. Gesamtgehalt an F-Aktin ist durch Färbung mit Fluoreszenz-Phalloidin. F-Aktin Stacheldraht endet visualisiert werden durch den Einbau von Rhodamin-Aktin im Wachstum Kegel, die mit dem Verfahren in den folgenden, die aus früheren Studien anderer bewegliche Zellen 11, 12 angepasst ist beschrieben permeabilisiert werden. Wenn Rhodamin-Aktin bei einer Konzentration oberhalb der kritischen Konzentration für die Aktin-Monomer neben Stacheldraht endet hinzugefügt wird, baut Rhodamin-Aktin auf freie Stacheldraht endet. Wenn die attraktive Cue in einen Farbverlauf, wie wird aus einer Mikropipette positioniert, um eine Seite eines Wachstums Kegel freigegeben präsentiert wird, wird die Aufnahme von Rhodamin-Aktin auf F-Aktin Stacheldraht endet größer das Wachstum Kegel Seite in Richtung der Mikropipette 10 .
Growth Zapfen sind klein und zart Zellstrukturen. Die Verfahren der Permeabilisierung, Rhodamin-Aktin Einbau, Fixierung und Fluoreszenz-Visualisierung sind alle sorgfältig gemacht und kann auf der Bühne einem inversen Mikroskop durchgeführt werden. Diese Methoden können auf das Studium vor Ort Aktin-Polymerisation in wandernde Neuronen, andere primäre Gewebe oder Zelllinien werden.
Protokoll
Für Rhodamin-Aktin Kennzeichnung, sind Neurone auf Deckgläschen in den Boden 35 mm Kunststoff-Schalen gelegt, oder auf Deckgläschen in "video" Gerichte geklebt kultiviert.
1. Vorbereitung der Deckgläser oder "Video" Dishes
- Viele neuronale Typen sind schlecht Klebstoff in vitro Substrate. Deckgläser, die für dieses Verfahren erforderlich sind, kann nicht genügend Neuron-Substrat-Haftung, sofern sie angemessen gereinigt und aufbereitet. Eine detaillierte Beschreibung des Verfahrens für den sauren Wasch-und Reinigungsmitteln Deckgläschen wird in dem Buch Kultivierung Nervenzellen, herausgegeben von Banker und Goslin beschrieben. Alternativ ist eine Nitrozellulose-Beschichtung für Deckgläser, die eifrig bindet Substrat-Moleküle, in Stufen 1,7 und 1,8 beschrieben.
- Deckgläser (z. B. 18 mm Quadrate oder 24 mm Kreise) sind in dH 2 O gespült und gebacken in trockene Hitze (≥ 225 ° C) so lange wie möglich (mindestens einige Tage bis zu drei Monaten oder länger), um Spuren von organischen entfernen Verbindungen. Zum 1.6 oder für Video-Gerichte gehen zu 1,3 Schritt.
- So erstellen Sie eine dünne klare Glassubstrat für hochauflösende Videomikroskopie sind kreisrunde Löcher mit entsprechendem Durchmesser in den Boden von 35 oder 50 mm Kunststoff-Petri-oder Gewebekultur-Schalen mit einem elektrischen Korkbohrer (oder ähnliches Instrument) gebohrt. Drilling wird langsam mit leichtem Druck zur Vermeidung von Rissen im Kunststoff gemacht. Die Kanten der Bohrung sind mit einer Schere abgekratzt, um eine glatte Oberfläche auf beiden Seiten zu schaffen.
- Deckgläser für Gewebekultur Gebrauch gereinigt, wie in 1.1 oder 1.2 beschrieben. Deckgläser sind vorhanden über die Löcher geklebt, mit ungiftigen Silikon Aquarium Zement (für 18x18mm Deckgläser, ein 12mm Durchmesser Bit verwendet wird). Der Zement wird für 24 Stunden ausgehärtet.
- (Die folgenden Schritte sind getan mit sterilen Bedingungen) Das Video Gerichte sind 3-mal mit sterilem dH 2 O gespült und an der Luft trocknen lassen.
- Deckgläser werden mit Substrat-Moleküle für neuronale Kultur beschichtet. Zunächst wird die Oberfläche mit Deckglas beschichtet (250 ul für 18x18 Deckglas) eine Lösung von 100 ug / ml Poly-D-Lysin in PBS für 4-8 Stunden (oder über Nacht) in einem befeuchteten 38 ° C Inkubator. Deckgläser werden dann 3 mal mit sterilem dH 2 O gespült, um ungebundene Poly-D-Lysin zu entfernen und an der Luft trocknen lassen. Viele neuronale Typen sind auf Deckgläsern mit Poly-D-Lysin allein beschichtet, wenn die Serum-Proteine in das Kulturmedium enthalten sind kultiviert. Allerdings Ergebnisse relevanter für in vivo-Bedingungen werden mit natürlichen Substrat-Moleküle erhalten. Lösungen dieser Moleküle, wie Laminin, Fibronektin oder L1 CAM (1-20 ug / ml in PBS), können direkt auf Poly-D-Lysin-beschichtete Deckgläser für 4-8 Stunden oder über Nacht angewendet werden, aber in unserem Labor haben wir routinemäßig Mantel der vorbereiteten Deckgläser mit einem dünnen Film aus Nitrozellulose, bevor Zelladhäsionsmoleküle, um Protein-Substrat-Bindung zu erhöhen.
- Machen Sie eine 1% Nitrocellulose-Lösung durch Auflösen von 5 g Nitrozellulose in 5 ml 100% Amylacetat. Auftragen von 10 ul dieser Lösung für das Deckglas und sanft verteilen sie über die Oberfläche. Der Luft trocknen lassen 10 Minuten.
- Apply 250 ul einer Lösung von 25 ug / mL Laminin oder 4 ug / ml L1 CAM in PBS und breiten sich über die Nitrozellulose Oberfläche. Inkubieren 4 Stunden (oder über Nacht) in einem befeuchteten 38 ° C Inkubator, absaugen Substrat und sofort Kulturmedium, so das Substrat nicht austrocknet.
2. Vorbereitung der neuronalen Kulturen
- Embryonale Tag 7 Hühnerembryonen sind aus Eiern entfernt, und in 100 mm Petrischalen mit Kulturmedium mit 10% Serum für die Präparation der inneren Organe aus der Brust und Hinterleib entfernen, mit einem Stereomikroskop.
- Die Embryonen werden dann mit Medium gespült und zog nach einer 60-mm-Schale mit flüssigem Medium und weitere seziert zu entfernen und vorzubereiten Explantate der Spinalganglien (DRG) oder neuronale Retina Gewebe. Methoden und Anwendungen für den Cell-Biologe, von Hollenbeck und Bamburg bearbeitet: Eine ausführliche Beschreibung finden Sie in Dissektion Methods in Cell Biology, Volume 71, Neuronen gefunden werden. DRG Explantate 1/2-whole Ganglien und neuronalen Retina Explantate 1 mm oder weniger im Durchmesser.
- Nach dem Reinigen der Explantate von fremden Geweben sind die einzelnen Explantate mit Uhrmacher Pinzette auf die Deckgläser, die bereits in Kulturschalen mit dem Kulturmedium verschoben. Unter einem Binokular, ist die Explantation sanft in die Mitte des Deckglases mit einer Pinzette, um Bewegung zu verhindern, während Transport in den Inkubator gedrückt. Explantate werden in F12-Medium mit B27 Zusatzstoffe, mit 10 mM HEPES auf pH 7,4 gepuffert und über Nacht in einer feuchten 38 ° C Inkubator gestellt kultiviert. Wachstumsfaktoren können hinzugefügt werden, je nach Bedarf, zum Kulturmedium. Neurotrophine sind oft DRG Kulturen aus älteren Embryonen aufgenommen, obwohl E7 DRG Neuronen Axone aus Explantaten ohne zusätzliche Neurotrophine zu verlängern. Explantate von neuronalen Netzhaut verlängern Axone in diesem Kulturmedium ohnedding Wachstumsfaktoren.
- Die Kulturen werden für mindestens 18 Stunden inkubiert, um eine ausreichende axonalen Auswachsen vor Beginn des Verfahrens unter ermöglichen.
3. Vorbereitung der Rhodamin-Aktin Permeabilisierung Buffer
- Eine Stammlösung von Permeabilisierung Puffer mit 138 mM KCl, 10 mM PIPES, 3 mM EGTA, 4mm MgCl 2, und 1% BSA (pH = 6,9) kann bis zu 2 Wochen aufbewahrt werden bei 4 ° C11. Kurz vor Gebrauch werden die folgenden Komponenten für eine Endkonzentration von fügte hinzu: 0,025% Saponin, 0,1 mM ATP und 100 nM Alexa-Fluor 350 Phalloidin.
- Eine separate Lösung ist auch frisch unmittelbar vor Gebrauch mit den gleichen Komponenten plus 0.45 Rhodamin non-muscle actin Die Lösung wird abwechselnd gevortext und tritrated für 5 min auf Rhodamin-Aktin Klumpen auflösen vorbereitet und ist für 1 min während der ersten Permeabilisierung Schritt gevortext zu verhindern Polymerisation in die Röhre. Sollten trotz dieser bleibt Filament Montage in das Rohr ein Problem, kann die Lösung vor zentrifugiert werden, um zu verwenden.
4. Permeabilisierung der neuronalen Kulturen und Einarbeitung von Rhodamin-Aktin auf F-Aktin Barbed Ends
- Eine Kulturschale mit DRG-oder Retina-Explantaten wird sorgfältig aus dem Brutschrank entnommen und die folgenden Schritte bei Raumtemperatur durchgeführt.
- Alle Änderungen der Lösungen müssen sorgfältig ausgeführt werden. Die Pipettenspitze sollte am Rande des Deckglases gebracht werden, und Lösungen sollten entfernt und hinzugefügt werden langsam und mit minimalem Kraftaufwand.
- Das Kulturmedium wird mit einer Pipette vorsichtig entfernt, aber stetig, und genug Permeabilisierung Puffer, um Zellen Abdeckung für 1 min (für 18mm x 18mm Deckglas, ~ 60 ul) aufgenommen. Die Kultur ist nicht mit anderen Lösungen vor der Zugabe der Permeabilisierung Puffer gespült, und das Deckglas ist nicht erlaubt, vor der Zugabe der Permeabilisierung Puffer trocken.
- Die Permeabilisierung Puffer vorsichtig mit einer Pipette entfernt und durch die Permeabilisierung Puffer mit 0,45 um Rhodamin non-muscle actin für 4 min.
- Die Rhodamin-Aktin-Puffer wird vorsichtig mit einer Pipette entfernt, und die Neuronen sind fest durch Zugabe einer Lösung von 4% Paraformaldehyd (Laborqualität, machte mit Phosphat-Puffer, pH 7,3), 0,05% Glutaraldehyd und 10% Saccharose. Nach 5 Minuten Fixierung der Deckgläser sind vorsichtig mit PBS gespült und montiert in Slowfade auf 3-Zoll-Glasplättchen.
- Ein alternativer Ansatz zur Veränderung Lösungen ist es, eine Durchflusszelle verwenden. Dies kann ein im Handel erhältliches Durchflusszelle werden, oder eine einfache Durchflusszelle können, indem sie kleine Stücke aus Kunststoff (≤ 1 mm dick) als Abstandshalter an den Ecken des Deckglases gemacht werden, und dann Montage eines gleich großen Deckglas auf der Oberseite des Deckglas. Lösungen können, indem Sie die Pipette an einer Seite der Messzelle und Aberkennung der Lösungen mit einem Docht (Baumwolle oder Kimwipe) auf der anderen Seite ausgetauscht werden.
- Die Aufnahme von Rhodamin-Aktin auf F-Aktin Stacheldraht endet und Fluoreszenz-Phalloidin Kennzeichnung von F-Aktin in Wachstum Kegel visualisiert mit Auflicht-Fluoreszenz-Optik durch ein 60X Ölimmersionsobjektiv und Bilder gesammelt werden, mit einer gekühlten CCD-Kamera. Einem konfokalen Mikroskop kann eine verbesserte Bildgebung.
- Für eine optimale Quantifizierung von Rhodamin-Aktin Einbindung aller Bilder sollten in einer einzigen Sitzung gesammelt werden, mit den gleichen Gewinn und Belichtungseinstellungen der Kamera die Empfindlichkeit für jedes Bild. Die Analyse der Kennzeichnung sollte von entsprechenden Regionen von jedem Bild gemacht werden; Metamorph, Image J oder ähnlichen EDV-Werkzeuge für die Bildanalyse verwendet werden kann.
Variationen dieses VERFAHREN
5. Variation One: Collect Live Cell Bilder vor dem Rhodamin-Aktin Labeling
- Video Gerichte werden auf einer vorgewärmten Mikroskoptisch gelegt, und Live-Wachstum Kegel Bilder gesammelt werden. Gitter und Deckgläser verwendet werden, oder Radierungen und / oder Stift Markierungen auf dem Deckglas gemacht, um leichter zu finden spezifischen Zellen nach der Markierung, oder die Video-Gericht kann in Platz auf dem Mikroskoptisch werden für die Dauer des Verfahrens festgelegt.
- Permeabilisierung der Einbau von Rhodamin-Aktin und Zellfixierung sind in der Video-Gericht durchgeführt, entweder an oder aus dem Mikroskoptisch. Nach der Fixierung wird PBS, um Video Gerichte für die sofortige Bildgebung aufgenommen. Zur Wahrung der Probe für die spätere Bildverarbeitung, ist slowfade Eindeckmedium auf das Deckglas gegeben und ein Deckglas von gleicher Größe ist leicht auf der Oberseite platziert (Vermeidung von Blasen), und die Ränder werden dann mit klarem Nagellack versiegelt.
6. Variation II: Immunochemistry zu Co-label zusätzliche Proteine
- Rhodamin-Aktin Aufnahme und Fixierung auf Neuronen auf Deckgläsern oder in Video-Schalen kultiviert, durchgeführt werden, wie oben (4,2-4,4) beschrieben.
- Nach der Fixierung und Spülung in PBS werden die Zellen 15 min mit 0,1 M Glycin in PBS behandelt und dann mit 0,1% Triton X-100 (TX-100) in PBS mit 2% Ziegenserum und 1% BSA für 1 h Deckgläsersind mit dem primären Antikörper in PBS verdünnt mit 1% BSA für 1 h inkubiert Die Deckgläser werden dann gespült und in 0,1% TX-100 in PBS mit 2% Ziegenserum und 1% BSA für 1 h, bevor fluoreszierenden Sekundärantikörper bei 1:1000-Verdünnung in PBS mit 1% BSA für 1 h Nach dem Spülen werden die Deckgläschen wieder in 0,1% TX-100 in PBS mit 2% Ziegenserum und 1% BSA für 30 min inkubiert, gespült und montiert in Anti-Fading-Medium. Die Lokalisation einiger Proteine wird durch die ersten Permeabilisierung Schritt (4,3) gestört. Zur Erhaltung dieser Proteine für die Lokalisierung mit Antikörpern, 0,05% Paraformaldehyd und 0,05% Glutaraldehyd kann die Permeabilisierung Puffer für 1 min (dh vor der Zugabe der Rhodamin-Aktin) hinzugefügt, ohne die mit Widerhaken versehene Ende Kennzeichnung von Rhodamin-Aktin.
- Bilder von Triple-markierten Wachstum Kegel sind durch Fluoreszenz-oder konfokalen Mikroskopie gesammelt.
7. Variation Drei: Beurteilung der Auswirkungen der Guidance Cues auf F-Aktin Freie Barbed Ends
- Ein Wachstumsfaktor oder Anleitung Cue ist Kulturschalen in den Brutschrank bei Konzentrationen von mehreren ng / mL für ein paar Minuten (oder eine geeignete Behandlung der Zeit) vor dem Entfernen der Schale aus dem Inkubator und dem Beginn der Permeabilisierung Verfahren aufgenommen. Dies ermöglicht eine Beurteilung der kurzfristigen Effekte von Wachstumsfaktoren oder Anleitung Hinweise auf F-Aktin frei Stacheldraht endet.
- Ein Video Schüssel mit neuronalen Kulturen können auf einer erwärmten Objekttisch gelegt werden, und Wachstumsfaktoren oder Anleitung Hinweise können aus einer Mikropipette in ein Gefälle in der Nähe ein Wachstum Kegel vor Beginn der Permeabilisierung und Rhodamin-Aktin Einbau freigegeben werden. Zum Beispiel kann NGF für DRG-Neuronen oder Netrin für neuronale retinalen Ganglienzellen freigegeben werden. Die Pipette kann für so kurz wie 1-2 Minuten vor Beginn der Permeabilisierung Verfahren eingeführt werden. Dies ermöglicht die Beurteilung der lokalen Auswirkungen einer Führung Cue Gradienten auf die Bildung von F-Aktin frei Stacheldraht endet in Wachstum Kegel führenden Margen (siehe Referenz Zitat 10 für Bilder).
- Diese Variationen können mit Antikörper-vermittelten Kennzeichnung von anderen neuronalen Komponenten, wie in 6,2 oben beschrieben kombiniert werden.
8. Variation Four: F-Aktin Freie Barbed End Labeling auf transfizierten Neuronen
- Die Verwendung von konstitutiv aktiven oder dominant-negative Konstrukte oder Protein Knockdown mittels RNAi (mit einem fluoreszierenden Marker zu identifizieren) können verwendet werden, um ein Protein, das Engagement bei der Regulierung der F-Aktin frei Stacheldraht endet beurteilen. Je nach Protein, dessen Lokalisation im Wachstum Kegel, und wenn es zu einem fluoreszierenden Marker fusioniert ist, die fluoreszierende exprimierten Proteins in transfizierten Zellen können auf Permeabilisierung verloren. Wenn dies der Fall ist, kann Video-Gerichten verwendet werden, um eine transfizierte Zelle mikroskopisch vor Permeabilisierung zu identifizieren, und die Permeabilisierung kann auf dem Mikroskoptisch durchgeführt werden, nach dem Markieren der Positionen der transfizierten Zellen. Alternativ kann ein GFP-Aktin-Konstrukt mit einem Interesse GFP-Konstrukt co-transfiziert werden. In diesem Fall wird GFP-Aktin in F-Aktin einbezogen werden, und wird nicht durch Permeabilisierung verloren werden, so dass die Identifizierung der transfizierten Zellen nach Permeabilisierung.
- Diese Variante kann mit der Zugabe von Leitlinien Cues kombiniert werden, wie in 7,1-7,3 oben beschrieben.
9. Repräsentative Ergebnisse

Abbildung 1. Globale Zugabe von NGF erhöht insgesamt F-Aktin-und F-Aktin Stacheldraht endet am Wachstum Kegel führenden Marge. Wenn ein DRG Wachstum Kegel mit nerve growth factor (NGF) für 5 Minuten stimuliert wird, Aktin-Polymerisation zu den führenden Marge wird angeregt, und ein helles Band von Rhodamin-Aktin Kennzeichnung ist um das Wachstum Kegel Peripherie gesehen. Abbildung 1 vergleicht Rhodamin-Aktin Einbau in ein unstimulierten DRG Wachstum Konus und einem NGF-stimulierten DRG Wachstum Kegel. Die grüne Fluoreszenz in der fusionierten Bilder ist Phalloidin Kennzeichnung für F-Aktin in der Wachstum Kegel und das Rot ist Rhodamin-Aktin Kennzeichnung. Eine gute Kontrolle für die mit Widerhaken versehene Ende Kennzeichnung ist bis 10-6 M oder höher Cytochalasin B oder D in der Permeabilisierung Puffer in Schritten 4.2 und 4.3 hinzugefügt. Cytochalasine cap F-Aktin Stacheldraht endet und hemmen Rhodamin-Aktin-Bindung an Stacheldraht endet. Dies sollte stark reduzieren oder zu eliminieren Aufnahme von Rhodamin-Aktin in der Zelle. Scale-Bars, 10 pm.

Abbildung 2. Ein NGF Gradienten lokal erhöht F-Aktin Stacheldraht endet. Eine Mikropipette dass Freisetzungen NGF auf einer Seite eines DRG Wachstum Kegel für 2 Minuten, durch die Kennzeichnung von F-Aktin frei Stacheldraht endet, gefolgt gebracht wird. Die Bilder unten zeigen, dass die Exposition auf einem Gefälle von NGF lokal stimuliert eine Erhöhung der F-Aktin frei Stacheldraht endet im Wachstum Kegel Region näher an der Pipette. Das fusionierte Bild zeigt Phalloidin in grünund Rhodamin-Aktin in rot. Scale-bar, 10 pm.
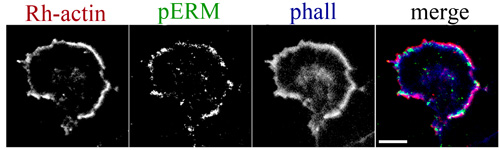
Abbildung 3. Aktiviert ERM-Proteine akkumulieren an der Wachstumskegel führenden Marge. Immunzytochemische Kennzeichnung phospho-Ezrin/Radixin/Moesin (Perm) mit F-Aktin frei Stacheldraht endet. Glutaraldehyd (0,05%) und Paraformaldehyd (0,05%) waren die ersten Permeabilisierung Puffer für eine Minute zu ERM Lokalisierung erhalten aufgenommen. Rhodamin-Aktin, rot; PERM, grün; Phalloidin, blau. Scale-bar, 10 pm.

Abbildung 4. Stimulation des Aktin-Polymerisation erfordert eine aktive ERM-Proteine. Dissoziierte DRGs wurden mit GFP-Aktin und GFP Kontroll-Plasmid oder eine dominant-negative Ezrin / Radixin / Moesin (DN ERM)-Konstrukt co-transfiziert. Die Verwendung von GFP-Aktin ermöglicht die Identifizierung von transfizierten Zellen nach Permeabilisierung. Hier wurde NGF 5 min vor der Markierung von F-Aktin Stacheldraht endet aufgenommen. Beachten Sie das Wachstum Kegel mit DN ERM transfizierten hat Widerhaken versehene Ende Ebenen, auf das Wachstum Kegel führenden Rand (untere Mitte), die mit einem in der Nähe untransfizierte Wachstum Kegel (untere Reihe) Kontraste, oder mit dem GFP-Kontrolle (obere Mitte) reduziert. Rhodamin-Aktin, rot; GFP-Aktin, grün. Scale-Bars, 10 pm.
Diskussion
Die hier vorgestellten Methoden erlauben zeitliche und räumliche Auflösung der zellulären Komponenten, die in der dynamischen Umbau des Aktin-Zytoskeletts bei den führenden Marge von Migration Wachstum Kegel beteiligt sind. Die Wirkung von Lockstoff-Moleküle, wie NGF oder Netrin, um schnell zu stimulieren Aktin-Filament-Polymerisation wird als eine lokale Erhöhung der Aktin Stacheldraht endet, von Aktin-Filament-Abtrennung von aktivierten ADF / Cofilin 10 erstellt, wie in den Abbildungen 1 und 2 dargestellt enthüllt. Das Verfahren erlaubt Lokalisierung von anderen Proteinen bei der Vermittlung Wachstum Kegel chemotropische Reaktionen, wie Radixin, ein ERM-Protein, in den Abbildungen 3 und 4 abgebildet beteiligt. Diese Methoden können auch angewendet, um die Regulation der Aktin-basierte Motilität in der Migration Neuronen, Gliazellen oder andere Zelltypen zu analysieren.
Die zarten Natur des Wachstums Kegel oder andere kleine bewegliche Strukturen ist eine erhebliche Einschränkung in der Anwendung dieser Methode. Wachstum Kegel führenden Margen oder ähnliche bewegliche Regionen Zellen enthalten einige Strukturelemente andere als Aktin-Filamenten und der Plasmamembran, so kümmern muss bei jedem Schritt getan werden. Zellaggregate oder Explantate können durch Veränderungen in der Oberflächenspannung gestört werden, wie Lösungen ausgetauscht werden. Wie im Protokoll erwähnt, ist es am besten, Pipetten am Rande der Deckgläser für den Wechsel Lösungen statt, und die Verwendung einer Durchflusszelle würde Probleme von Oberflächenspannungen zu beseitigen.
Eine alternative Methode zur Aktin Stacheldraht endet in beweglichen Regionen von Zellen visualisieren beinhaltet Zelltransfektion zu fluoreszierenden Analoga mit Widerhaken versehene Ende-bindende Proteine, wie zB Ena / VASP oder Myosin X. Allerdings äußern kann Aktindynamik in Wachstum Kegel Margen durch unregulierte Expression verändert werden dieser regulatorischen Proteine Aktin.
Filopodien sind nicht so stark von dieser Rhodamin-Aktin Kennzeichnung Methode wie Lamellipodien gekennzeichnet. Die Filopodien kann gestört werden, obwohl sie gekennzeichnet sind und durch die fluoreszierenden-Phalloidin in der Permeabilisierung Puffer enthalten stabilisiert. Dieser Unterschied in lamellipodialen vs filopodialen Aufnahme von Rhodamin-Aktin könnte darüber nachdenken, eine quantitative Begrenzung in der Visualisierung der eingebauten Rhodamin-Aktin, oder es kann einen Unterschied in der Anwesenheit von Stacheldraht Endverkappung Proteine in diesen beweglichen Strukturen. Dies wirft eine zusätzliche Einschränkung, dass die Kennzeichnung von freien Stacheldraht endet mit dieser Methode nicht erkennen, ob die markierten Stacheldraht endet neu erstellt werden, z. B. durch ADF / Cofilin Abtrennen von F-Aktin, oder ob F-Aktin ist nicht durchtrennt, sondern Stacheldraht endet werden durch die Beseitigung von Stacheldraht Endverkappung Proteinen befreit.
Offenlegungen
Danksagungen
Die Autoren danken Dr. James Bamburg und Mitglieder seines Labors für die Zusammenarbeit in diesen Studien. Diese Arbeit wurde vom NIH gewährt HD19950, EY07133 und durch Zuschüsse aus dem Minnesota Medical Foundation finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| 18x18 mm coverslip | Gold Seal | 3305 | |
| 35mm Petri dishes | Falcon BD | 351008 | |
| Aquarium cement | DAP 100% silicone aquarium sealant | Any hardware store | |
| Poly-D-lysine (mw > 300,000) | Sigma-Aldrich | P1024 | |
| Natural mouse laminin | Invitrogen | 23017-015 | |
| L1 CAM | R&D Systems | 777-NC | |
| Alexa-fluor 350 phalloidin | Invitrogen | A22281 | |
| Rhodamine non-muscle actin | Cytoskeleton, Inc. | APHR-A | |
| F12 Culture medium | Invitrogen | 21700-075 | |
| B27 | Invitrogen | 17504-044 | |
| Slowfade | Invitrogen | 536937 |
Referenzen
- Lowery, L. A., Van Vactor, D. The trip of the tip: Understanding the growth cone machinery. Nat Rev Mol Cell Biol. 10, 332-343 (2009).
- Letourneau, P. Axonal Pathfinding: Extracellular Matrix Role. Encyclopedia of Neuroscience. Squire, L. R. , Academic Press. Oxford. 1139-1145 (2008).
- Kalil, K., Dent, E. W. Touch and go: Guidance cues signal to the growth cone cytoskeleton. Curr Opin Neurobio. 15, 521-526 (2005).
- Dent, E. W., Gertler, F. B. Cytoskeletal dynamics and transport in growth cone motility and axon guidance. Neuron. 40, 209-227 (2003).
- Pak, C. W., Flynn, K. C., Bamburg, J. R. Actin-binding proteins take the reins in growth cones. Nat Rev Neurosci. 9, 136-147 (2008).
- Guan, K. L., Rao, Y. Signaling mechanisms mediating neuronal responses to guidance cues. Nat Rev Neurosci. 4, 941-956 (2003).
- Gallo, G., Letourneau, P. C. Regulation of growth cone actin filaments by guidance cues. J. Neurobiology. 58, 92-102 (2004).
- Fass, J., Gehler, S., Sarmiere, P., Letourneau, P., Bamburg, J. R. Regulating filopodial dynamics through actin-depolymerizing factor/cofilin. Anat Sci Inter. 79, 173-183 (2004).
- Bernstein, B. W., Bamburg, J. R. ADF/cofilin: A functional node in cell biology. Trends Cell Biol. 20, 187-195 (2010).
- Marsick, B. M., Flynn, K. C., Santiago, M., Bamburg, J. R., Letourneau, P. C. Activation of ADF/cofilin mediates attractive growth cone turning toward nerve growth factor and netrin-1. Dev Neurobiol. 70, 565-588 (2010).
- Symons, M. H., Mitchison, T. J. Control of actin polymerization in live and permeabilized fibroblasts. J Cell Biol. 114, 503-513 (1991).
- Chan, A. Y., Raft, S., Bailly, M., Wyckoff, J. B., Segall, J. E., Condeelis, J. S. EGF stimulates an increase in actin nucleation and filament number at the leading edge of the lamellipod in mammary adenocarcinoma cells. J Cell Sci. 111, 199-211 (1998).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten