13.6 : Период полураспада реакции
Период полураспада реакции (t1/2) — это время, необходимое для потребления половины заданного количества реагент. В течение каждого последующего полусрока службы потребляется половина оставшейся концентрации реагент. Например, во время разложения перекиси водорода, в течение первого периода полураспада (с 0.00 часов до 6.00 часов) концентрация H2O2 снижается с 1.000 м до 0.500 М. во время второго периода полураспада (с 6.00 часов до 12.00 часов) концентрация снижается с 0.500 м до 0.250 м, В то время как в течение третьего периода полураспада она падает с 0.250 м до 0.125 М., следовательно, в течение каждого последующего периода в 6.00 часов концентрация H2O2 уменьшается вдвое.
Период полураспада реакции первого порядка не зависит от концентрации реагент. Однако, полураспада реакций с другими заказами зависят от концентрации реагенты.
Период полураспада реакций первого порядка
Уравнение, связанное с периодом полураспада реакции первого порядка на его константу скорости, может быть образовано из его интегрированного закона скорости:

Согласно определению Half-Life, в то время как t1/2 концентрация реагент A составляет половину ее начальной концентрации. Поэтому; t = t1/2и [A]t = ½ [A]0.
Подстановка этих терминов в реорганизованный интегрированный закон о процентной ставке и упрощение приводит к уравнению в течение половины срока службы:

Это уравнение полураспада описывает ожидаемую обратную связь между периодом полураспада реакции и её константой скорости, к. Более быстрые реакции демонстрируют более крупные константы скорости и соответственно более короткие полужизни, в то время как более медленные реакции демонстрируют более мелкие константы скорости и более продолжительные полужизни.
Период полураспада реакций второго порядка
В соответствии с тем же подходом, что и в случае реакций первого порядка, уравнение, связанное с периодом полураспада реакции второго порядка с его константой скорости и начальной концентрацией, может быть получено из его интегрированного закона скорости:

При замене t = t1/2и [A]t = ½[A]0, интегрированный закон о скорости упрощен:
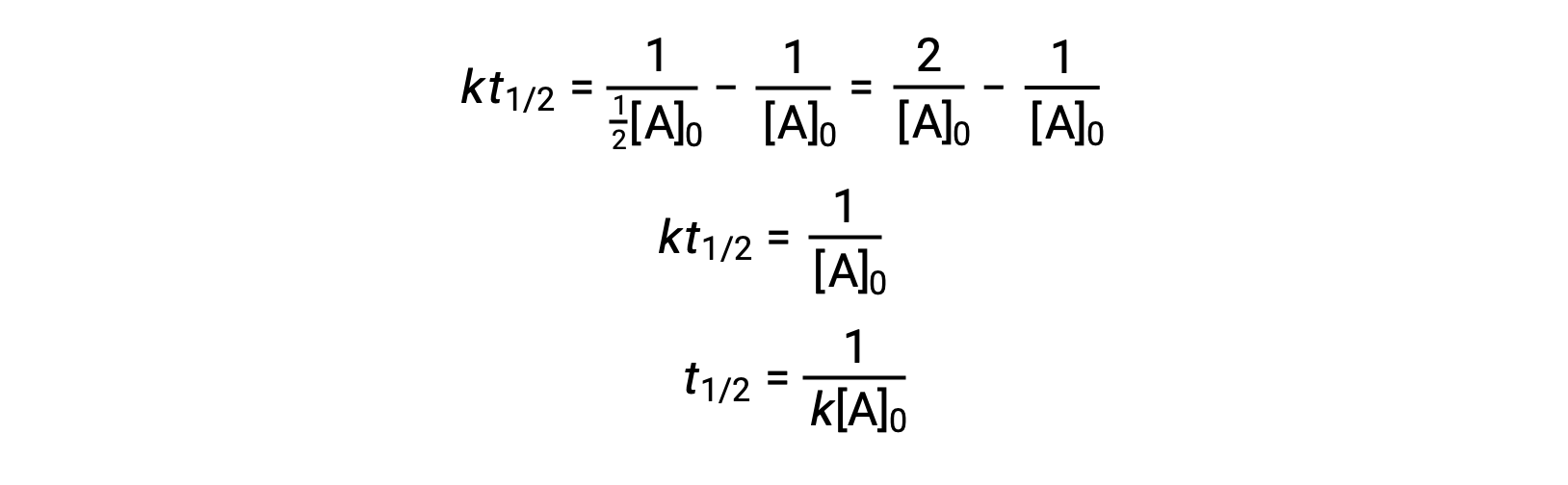
В случае реакции второго порядка T1/2 обратно пропорционален концентрации реагент, и период полураспада увеличивается по мере развития реакции, так как концентрация реагент уменьшается. В отличие от реакций первого порядка, константа скорости реакции второго порядка не может быть вычислена непосредственно из полураспада, если не известна начальная концентрация.
Период полураспада реакций нулевого порядка
Уравнение для полураспада нулевого порядка также может быть получено из его интегрированного закона ставок:

Подстановка t = t1/2и[A]t = ½ [A]0, в соответствии с законом об интегрированной ставке нулевого порядка дает:

Период полураспада для реакции нулевого порядка обратно пропорционален его постоянной скорости. Однако период полураспада реакции нулевого порядка увеличивается по мере увеличения начальной концентрации.
Этот текст был адаптирован к Openstax, Химия 2е изд., раздел 12.4: Законы о комплексных тарифах.
Из главы 13:

Now Playing
13.6 : Период полураспада реакции
Химическая кинетика
33.9K Просмотры

13.1 : Скорость реакции
Химическая кинетика
50.6K Просмотры

13.2 : Измерение скорости реакции
Химическая кинетика
24.2K Просмотры

13.3 : Закон о концентрации и скорости
Химическая кинетика
29.7K Просмотры

13.4 : Определение порядка реакции
Химическая кинетика
54.6K Просмотры

13.5 : Закон интегрированной скорости: зависимость концентрации от времени
Химическая кинетика
34.1K Просмотры

13.7 : Зависимость температуры от скорости реакции
Химическая кинетика
80.8K Просмотры

13.8 : Графики Аррениуса
Химическая кинетика
38.0K Просмотры

13.9 : Механизмы реакции
Химическая кинетика
25.0K Просмотры

13.10 : Шаги, определяющие скорость
Химическая кинетика
31.4K Просмотры

13.11 : Катализ
Химическая кинетика
26.4K Просмотры

13.12 : Ферменты
Химическая кинетика
80.2K Просмотры
Авторские права © 2025 MyJoVE Corporation. Все права защищены