13.6 : 反応の半減期
反応の半減期(t1/2)は、反応物の半分が消費されるのに必要な時間です。後続のそれぞれの半減期では、反応物の残りの濃度の半分が消費されます。例えば、過酸化水素の分解中、最初の半減期(0.00時間から6.00時間)の間に、H2O2の濃度は1.000 Mから0.500 Mへと減少します。2番目の半減期(6.00時間から12.00時間)の間に、濃度は0.500 Mから0.250 Mに減少し、3番目の半減期の間に0.250 Mから0.125 Mに減少します。 連続した6.00時間において、H2O2の濃度は半分に減少しています。
一次反応の半減期は、反応物の濃度に依存しません。しかし、他の次数の反応の半減期は、反応物の濃度に依存します。
一次反応の半減期
一次反応の半減期と速度定数の関係式は、その積分速度則から導き出すことができます。

半減期の定義から、時間t1/2において、反応物Aの濃度は初期濃度の1/2になります。したがって、t = t1/2であり、[A]t = ½ [A]0となります。
これらの項を積分速度則に代入し、簡略化すると半減期の式が得られます。

この半減期の式は、反応の半減期とその速度定数kとの間に予想される逆数の関係を示しています。速い反応は速度定数が大きく、それに応じて半減期が短くなり、遅い反応は速度定数が小さく、半減期が長くなります。
二次反応の半減期
一次反応と同じ方法で、二次反応の半減期とその速度定数および初期濃度との関係式を、その積分速度則から導き出すことができます。

t = t1/2と[A]t = ½[A]0を代入すると、積分速度式が簡略化されます。
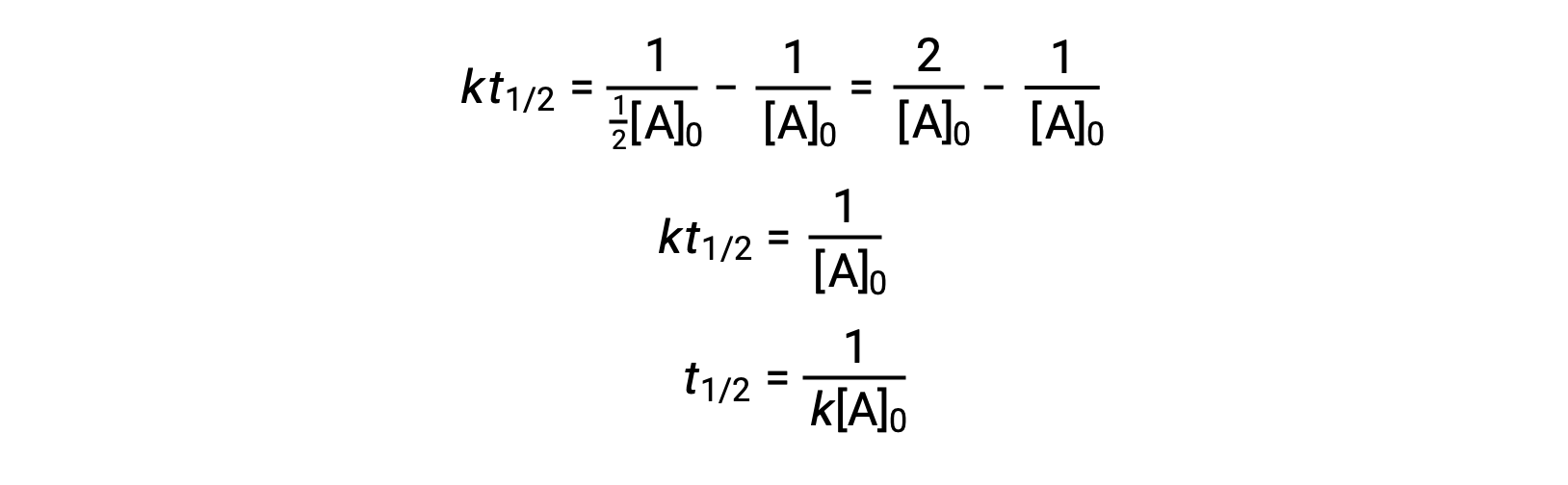
二次反応の場合、t1/2は反応物の濃度に反比例し、反応物の濃度が低下するため、反応が進むにつれて半減期が長くなります。二次反応の速度定数は、一次反応と異なり、初期濃度がわからないと半減期から直接計算することはできません。
ゼロ次反応の半減期
ゼロ次反応における半減期は、その積分速度則から次のように導かれることもあります。

t = t1/2 との[A]t = ½の[A]0を、0次の積分速度則に代入すると、次のようになります。

ゼロ次反応の半減期は速度定数に反比例します。ただし、セロ次反応の半減期は、初期濃度が高くなるほど長くなります。
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section 12.4: Integrated Rate Laws.
章から 13:

Now Playing
13.6 : 反応の半減期
化学動力学
33.9K 閲覧数

13.1 : 反応速度
化学動力学
50.6K 閲覧数

13.2 : 反応速度の測定
化学動力学
24.1K 閲覧数

13.3 : 濃度と反応速度の関係性
化学動力学
29.6K 閲覧数

13.4 : 反応順序の決定
化学動力学
54.6K 閲覧数

13.5 : 積分速度則:反応濃度と時間
化学動力学
34.0K 閲覧数

13.7 : 温度依存の反応速度
化学動力学
80.7K 閲覧数

13.8 : アレニウスプロット
化学動力学
37.9K 閲覧数

13.9 : 反応メカニズム
化学動力学
25.0K 閲覧数

13.10 : 反応速度の決定ステップ
化学動力学
31.4K 閲覧数

13.11 : 触媒作用
化学動力学
26.4K 閲覧数

13.12 : 酵素
化学動力学
80.2K 閲覧数
Copyright © 2023 MyJoVE Corporation. All rights reserved