Method Article
Isolamento de Pequenas Vesículas Extracelulares Derivadas de Células-Tronco Mesenquimais de Amostras de Grande Volume com Conformidade com GMP para Ensaios Clínicos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Pequenas vesículas extracelulares derivadas de células-tronco mesenquimais (MSC-sEVs) foram destacadas como uma modalidade de tratamento livre de células com efeitos adversos mínimos. Este estudo fornece um protocolo que combina hemodiálise com ultracentrifugação, reduzindo significativamente o tempo gasto em todo o processo e garantindo a conformidade com os padrões de boas práticas de fabricação (BPF).
Resumo
Pequenas vesículas extracelulares (sEV) derivadas de células-tronco mesenquimais (MSC-sEVs) foram destacadas como uma modalidade de tratamento livre de células com efeitos adversos mínimos. Em contraste, os métodos tradicionais de extração, como ultracentrifugação e cromatografia de exclusão de tamanho, são limitados por sua intensidade de tempo, custo e escalabilidade. Para superar essas limitações, propomos um método que integra hemodialisador e ultracentrifugação. Essa abordagem utiliza um dispositivo de hemodiálise com uma membrana de corte de peso molecular (MWCO) de 100 kDa, que concentra seletivamente sEVs enquanto filtra uma infinidade de proteínas, aumentando assim o rendimento e a pureza dos sEVs. Esta etapa inicial de purificação é seguida por ultracentrifugação para refinar ainda mais a preparação de sEV. A integração dessas duas tecnologias não apenas reduziu significativamente o tempo gasto em todo o processo, mas também garantiu a conformidade com os padrões de boas práticas de fabricação (GMP). O método aqui demonstra alta eficiência no isolamento de sEVs de um grande volume de amostras, oferecendo um avanço significativo em relação aos métodos tradicionais. Este protocolo promete acelerar a tradução de terapias baseadas em EV para a prática clínica, fornecendo uma solução escalável, econômica e compatível com GMP.
Introdução
Pequenas vesículas extracelulares derivadas de células-tronco mesenquimais (MSC-sEVs) são vesículas heterogêneas enriquecidas com múltiplos componentes, como mRNA, micro-RNA, citocinas, lipídios e metabólitos1. Nos últimos anos, muitos estudos ressaltaram o imenso potencial terapêutico das MSC-sEVs como uma modalidade de tratamento livre de célulascom efeitos adversos mínimos 2, mostrando-se promissor na abordagem de um espectro de condições, incluindo envelhecimento, degeneração tecidual, câncer e distúrbio inflamatório 3,4,5,6. No entanto, um desafio crítico persiste na extração em larga escala de sEV, com os métodos tradicionais provando ser trabalhosamente demorados ou economicamente inviáveis. Além disso, garantir a reprodutibilidade é fundamental para a aplicação clínica e tradução de terapias baseadas em EV7. Os pesquisadores precisam urgentemente de um método de purificação que não seja apenas simples e eficiente, mas também compatível com os padrões de boas práticas de fabricação (GMP)8.
Os métodos convencionais de purificação, incluindo ultracentrifugação, ultrafiltração, cromatografia de exclusão por tamanho, imunoafinidade e precipitação de polímeros, foram amplamente aplicados em pesquisas anteriores9. Em geral, os métodos tradicionais de isolamento de sEV apresentam limitações como baixa taxa de rendimento, pureza comprometida e desafios no cumprimento de rigorosos padrões assépticos. Além disso, pesquisas anteriores relataram o potencial de técnicas promissoras como sistemas microfluídicos10,11, isolamento magnético sem marcação12 e isolamento químico covalente13 para alcançar um desempenho excepcional. No entanto, a necessidade de equipamentos especializados torna essas técnicas avançadas desafiadoras para a maioria das equipes de pesquisa adotarem. Em resumo, o método eficiente para isolar sEVs de grau GMP de um grande volume de amostras continua sendo um obstáculo crítico, limitando o progresso de várias equipes em pesquisas e aplicações clínicas.
A ultracentrifugação é o método mais amplamente adotado para isolamento de sEV e é reconhecida como o método padrão-ouro14,15. É uma técnica que aproveita as diferenças de densidade e tamanho para isolar sEVs. Os sEVs isolados são comumente enxaguados com solução salina tamponada com fosfato (PBS) para eliminar contaminantes residuais. Em seguida, um volume apropriado de PBS é geralmente usado para ressuspender os sEVs enxaguados e diferentes concentrações esperadas de sEVs podem ser colhidas controlando o volume de PBS. Além disso, é relatado que a pureza dos sEVs plasmáticos obtidos por ultracentrifugação parece ser melhor do que a dos sEVs plasmáticos isolados por cromatografia de exclusão de tamanho (SEC), e os sEVs obtidos por ultracentrifugação têm menores impurezas de partículas extracelulares não vesiculares (NVEPs). Isso também torna a ultracentrifugação a mais amplamente utilizada e difícil de substituir em muitos tratamentos que requerem altas concentrações de sEVs. No entanto, além da qualidade e pureza, a eficiência também é um fator que não pode ser ignorado na extração de sEV em grande volume. Até o momento, uma única rodada de ultracentrifugação pode suportar um volume de amostra de até aproximadamente 600 mL, o que determina que é difícil atender à demanda de extração em larga escala apenas por ultracentrifugação16.
Um dispositivo de hemodiálise consiste em um módulo baseado em membrana que abriga milhares de fibras ocas. O sangue circula por essas fibras dentro de uma câmara cilíndrica fechada17. Os constituintes do sangue podem passar seletivamente por essas membranas com base em seu tamanho molecular e concentração iônica. Na clínica, é amplamente utilizado como rim artificial para remover resíduos e excesso de líquidos do sangue dos pacientes 18,19,20. Em outras palavras, o hemodialisador também tem o potencial de concentrar amostras de grande volume, contando com um processo semelhante à filtração de fluxo tangencial (TFF). Na recente diretriz emitida pela Sociedade Internacional de Vesículas Extracelulares (ISEV), os concentrados de sEV são considerados adequados para amostras de grande volume, como meio de cultura de células. Após décadas de desenvolvimento, os hemodialisadores foram amplamente adotados em hospitais, apoiados por uma abundância de consumíveis maduros e um grupo de operadores qualificados, o que torna mais fácil manter a amostra estéril.
Este estudo apresenta um método de purificação de sEV baseado em hemodialisador e ultracentrífuga compatível com GMPs. Aqui, escolhemos dialisadores de corte de peso molecular (MWCO) de 100 kDa, que demonstraram capturar efetivamente sEVs e filtrar várias proteínas22. A ultracentrifugação também fornece uma etapa para purificação adicional. O trabalho demonstra que o hemodialisador é igualmente adequado para a concentração de sEVs. Este protocolo permite que os pesquisadores isolem sEVs de amostras de grande volume de forma eficiente. Registramos o ensaio clínico no Registro Chinês de Ensaios Clínicos (ChiCTR, NO. ChiCTR2200059018), que ainda está em andamento e ainda não foi concluído. Embora os dados clínicos não estejam prontamente disponíveis para publicação neste momento, um método confiável, em larga escala, eficiente e compatível para a produção de sEVs, conforme relatado neste protocolo, é um pré-requisito para a realização de ensaios pré-clínicos e clínicos.
Protocolo
O protocolo foi aprovado e conduzido de acordo com o Comitê de Ética em Pesquisa com Seres Humanos do Southwest Hospital.
1. Remoção de detritos celulares do meio de cultura
NOTA: Os procedimentos abaixo devem ser operados em um ambiente compatível com GMP, especialmente quando as amostras podem ser diretamente expostas ao meio ambiente.
- Dada a exigência de ausência de microbiota, certifique-se de que o filtro e o tubo de borracha sejam autoclavados para uma esterilização eficaz. Certifique-se de que todos os outros consumíveis que possam encontrar o meio de cultura estejam estéreis e em embalagens lacradas. Execute o processo de remoção de detritos celulares em um gabinete de fluxo laminar.
- Monte a membrana de filtração de 0,45 μm e 0,22 μm no aparelho filtrante. Conecte uma bomba peristáltica (consulte a Tabela de Materiais) e o aparelho de filtro com o tubo de borracha. Posicione a membrana de 0,45 μm acima da membrana de 0,22 μm; caso contrário, pode diminuir a eficiência da filtragem (Figura 1). Preste atenção à distinção entre os lados frontal e traseiro da membrana de microfiltração.
- Ligue a bomba peristáltica para a filtração. Alimentado pela bomba, o meio basal de células-tronco mesenquimais (MSCBM) com suplemento de 5% (ver Tabela de Materiais) passa pelo filtro por uma extremidade, e o meio de cultura filtrado pode ser obtido na outra extremidade do filtro, conforme mostrado na (Figura 1). Recolher o meio de cultura filtrado num saco de drenagem com canais duplos. Mantenha a integridade do sistema de filtração otimizando a velocidade da bomba peristáltica e substituindo a membrana de filtração conforme necessário.
- Após a conclusão da filtração, feche a válvula de entrada no saco de drenagem e feche-o com parafilme (consulte a Tabela de Materiais). Prossiga para o passo seguinte ou armazene temporariamente o meio de cultura celular filtrado a 4 °C.
2. Concentrando o meio de cultura filtrado com um hemodialisador
NOTA: Evite usar o meio de águia modificado de Dulbecco (DMEM) contendo vermelho de fenol em cultura de células, pois o detector de vazamento de sangue no hemodialisador será ativado ou desligue o detector de vazamento de sangue no ambiente do hemodialisador.
- Prepare os consumíveis.
- Prepare linhagens, membranas de polissulfona de alto fluxo MWCO de 100 kDa, dialisador de sangue, conjunto de infusão, solução salina fisiológica, bolsa de infusão, solução de iodo e cotonetes antes da concentração (consulte a Tabela de Materiais).
- Ligue o sistema e faça o autoteste.
- Verifique a conexão do cabo de alimentação do hemodialisador e ligue a alimentação principal.
- Aguarde até que a máquina conclua todo o procedimento de autodiagnóstico.
- Instale as linhagens e o dialisador.
- Verifique as datas de validade das linhagens descartáveis e do dialisador de sangue, garantindo a integridade de sua embalagem externa e verificando se há danos nas linhagens.
- Instale a tubulação na mesma direção do fluxo sanguíneo no circuito extracorpóreo, fechando sequencialmente as válvulas de ramificação para formar uma circulação de circuito fechado.
- Inicie o procedimento de enxágue.
- Use um conjunto de infusão para conectar a solução salina fisiológica (sem heparina) de um tubo antes da bomba ao circuito de diálise. Conecte o local de coleta venosa ao saco de fluido residual.
NOTA: A solução salina fisiológica não deve conter heparina ou quaisquer outros anticoagulantes. - Conecte as linhas de suprimento/retorno do dialisado ao dialisador.
- Inicie o hemodialisador e ajuste a taxa de fluxo para 80-100 mL / min. Expulse todo o ar do circuito de diálise e do dialisador para garantir que todo o sistema de tubulação esteja cheio de fluido.
- Ajuste o plano líquido nas câmaras arterial e venosa para aproximadamente 2/3 cheio. A solução salina flui sequencialmente através da linha arterial, do dialisador, da linha venosa e da bolsa de fluido residual.
- Use um conjunto de infusão para conectar a solução salina fisiológica (sem heparina) de um tubo antes da bomba ao circuito de diálise. Conecte o local de coleta venosa ao saco de fluido residual.
- Inicie a concentração de ultrafiltração.
- Depois de terminar o procedimento de enxágue, pendure a bolsa de drenagem contendo o meio de cultura filtrado no suporte de infusão, desinfete o canal de saída com cotonetes embebidos em iodo e conecte o canal de saída da bolsa de drenagem a uma porta de pré-bomba usando um conjunto de infusão.
- Junte a porta arterial e a porta venosa das linhagens. Estabelecer um circuito de diálise de ultrafiltração (ISO-UF, ultrafiltração sem fluxo de dialisato) (Figura 1).
- Ajuste o volume alvo de ultrafiltração na máquina de diálise para corresponder ao volume total de fluido presente na bolsa de drenagem. Defina o tempo de diálise da ultrafiltração para o tempo operacional mínimo do sistema. Depois que os parâmetros forem definidos com sucesso, inicie a ultrafiltração.
NOTA: Devido ao cálculo do sistema de hemodiálise, o tempo de diálise não será muito curto, mas será mantido em uma taxa mais moderada.
- Obtenha o fluido concentrado.
- Depois de atingir o volume de desidratação alvo, feche o grampo arterial e conecte a porta venosa a uma bolsa de infusão estéril.
- Abra a porta de pré-bomba das linhas de sangue descartáveis equipadas com um filtro de ar. Ative a bomba de sangue a uma velocidade de aproximadamente 50 mL/min, permitindo que o fluido dentro das linhagens circule mais uma vez da linha arterial para a linha venosa. Retraia todo o fluido concentrado, aproximadamente 158 mL, do circuito de volta para a bolsa de infusão estéril.
- Na fase final da concentração, recolher o líquido desperdiçado da linha de retorno do dialisato. Aplique processos subsequentes idênticos aos do meio de cultura concentrado à amostra de fluido desperdiçada para monitorar qualquer perda acidental de sEVs que possa ter ocorrido durante a concentração.
- Feche todas as válvulas e remova a bolsa de infusão, o dialisador e todas as linhas. Desligue a fonte de alimentação e desinfete a máquina limpando-a.
3. Separando os sEVs com ultracentrífuga
- Transfira o meio de cultura concentrado para tubos de ultracentrífuga e equilibre-os.
- Centrifugue em uma ultracentrífuga de grau clínico (consulte a Tabela de Materiais) a 110.000 × g por 70 min, depois lave o pellet com solução salina estéril e prossiga com uma segunda centrifugação a 110.000 × g por mais 70 min.
- Ressuspenda os sEVs peletizados em uma quantidade apropriada de solução salina estéril.
- Transfira os sEVs para um tubo estéril para testes adicionais ou armazene-os a -80 °C para uso futuro.
4. Caracterização dos sEVs obtidos
- Análise de rastreamento de nanopartículas (NTA)
- Diluir os sEVs obtidos (1 μL) com PBS (1 mL) (ver Tabela de Materiais). Ajuste o número de sEVs visíveis no campo de visão atual para ficar entre 50 e 200.
- Injete cuidadosamente a amostra diluída no poço da amostra, evitando a introdução de bolhas de ar.
- Realize a medição quando o número de partículas no campo de visão for o mais alto e estável possível para todas as posições. Os parâmetros de análise são os seguintes: Área máxima: 1000, Área mínima: 10, Brilho mínimo: 30, Comprimento do traço: 15, Temperatura: 25 °C, Sensibilidade: 75.
- Meça cada amostra pelo menos três vezes.
- Análise de Western blotting
- Diluir a solução de sEVs em PBS. Use um kit de ensaio de proteína de ácido bicinchonínico (BCA) (consulte a Tabela de Materiais) para medir a concentração de proteína.
- Ferva os sEVs no tampão de amostra a 100 °C por 5 min.
- Prepare um gel de eletroforese em gel de dodecil sulfato-poliacrilamida a 12% de sódio (SDS-PAGE) (consulte a Tabela de Materiais). Monte o aparelho de eletroforese em gel. Carregue quantidades iguais de proteína de cada amostra nos poços de gel SDS-PAGE. Defina a tensão da eletroforese para 80 V para concentração e 100 V para separação.
- Ative a membrana de difluoreto de polivinilideno (PVDF) (consulte a Tabela de Materiais) com metanol por 1 min e, em seguida, mergulhe a membrana de PVDF em tampão de transferência antes de prosseguir com a transferência a 100 V por 1 h.
- Mergulhe a membrana de PVDF em tampão TBST (20 mM Tris, 150 mM NaCl e 0,1% Tween 20) contendo 5% de albumina de soro bovino (BSA; ver Tabela de Materiais) e, em seguida, bloqueie por 30 min.
- Incubar a membrana de PVDF com o anticorpo primário durante a noite a 4 °C num agitador. Os anticorpos primários usados são os seguintes: anti-CD63 humano (diluição 1:1000), anti-CD9 humano (diluição 1:1000) e anti-HSP70 humano (diluição 1:1000) (ver Tabela de Materiais).
- No dia seguinte, lave a membrana de PVDF com solução de TBST cinco vezes por 5 min cada e depois incube com anticorpo secundário conjugado com HRP (diluição 1:10000) (consulte a Tabela de Materiais) à temperatura ambiente (RT) por 1 h.
- Depois de lavar com TBST cinco vezes, use um reagente de detecção de quimioluminescência para obter imagens em um sistema de quimioluminescência.
- Microscopia eletrônica de transmissão
- Adicione uma gota de amostra diluída em PBS de 20 μL a um papel encerado. Em seguida, coloque uma grade de cobre (consulte a Tabela de Materiais) na gota para que a gota de amostra possa cobrir a grade de cobre e deixe-a repousar em RT por 20 min.
- Absorva o excesso de líquido com papel de filtro. Em seguida, fixe as amostras em uma solução de 20 μL de paraformaldeído a 2%, glutaraldeído a 2% e solução de fosfato 0,05 M por 2 min.
- Enxágue a grade de cobre três vezes com água bidestilada e, em seguida, comente com 20 μL de ácido fosfotúngstico (PTA) a 2% por 1 min em RT.
- Absorva o líquido redundante com papel de filtro. Seque as grades durante a noite antes de serem analisadas por microscopia eletrônica de transmissão (consulte a Tabela de Materiais).
NOTA: As configurações recomendadas para TEM são as seguintes: Exposição: 1.0 s, Tensão HT 100.00 kV, Corrente do feixe: 50 μA, Tamanho do ponto: 1, Modo: TEM. Essas configurações podem mudar de acordo com as instruções do fabricante (consulte Tabela de materiais).
Resultados
Caracterização morfológica de sEVs
No estágio final de concentração, o fluido desperdiçado também foi coletado conforme descrito. O meio concentrado e o fluido desperdiçado foram ultracentrifugados, respectivamente. As precipitações foram coletadas para análise de microscopia eletrônica de transmissão (MET). Como previsto, um número significativo de nanovesículas em forma de taça foi observado no grupo do meio concentrado ( Figura 2A, B ). No entanto, partículas típicas de sEV não foram detectadas no grupo de fluido desperdiçado. Esses achados fornecem evidências de que o protocolo é capaz de separar sEVs sem sofrer perdas significativas durante a etapa crucial de concentração.
Caracterização de marcadores proteicos para sEVs
Além disso, a análise de Western blot foi empregada para caracterizar os marcadores proteicos (CD9, CD81, HSP70) dos sEVs isolados. Bandas de proteína claras foram observadas no grupo do meio concentrado, enquanto nenhuma banda correspondente foi detectada em amostras de fluido desperdiçado (Figura 2C). Juntos, esses resultados validam a presença de componentes sEV.
Características de tamanho e rendimento de vesículas extracelulares
Para caracterizar ainda mais a quantidade e o tamanho, o NTA foi aplicado às amostras obtidas por ultracentrifugação tradicional (UC tradicional) e ao nosso protocolo. Como ambos os métodos utilizaram ultracentrifugação, sEVs isolados do meio de cultura MSC por UC tradicional foram usados como controle, que incluíram principalmente centrifugação a 300 × g por 15 min, depois 2.000 × g por 15 min e uma ultracentrífuga a 110.000 × g por 70 min a 4 °C, e então os pellets foram lavados em solução salina e a segunda ultracentrifugação foi realizada por 70 min a 110, 000 × g. O resultado demonstrou que a faixa de tamanho dos sEVs obtidos por este protocolo foi de 48,1 nm a 166,2 nm com um tamanho médio de 103,6 nm, a faixa de tamanho dos sEVs obtidos por UC tradicional foi de 51,8 nm a 186,7 nm com um tamanho médio de 112,6 nm (Figura 3A, B). Além disso, introduzimos a razão de diluição nos resultados do NTA para medir o total de partículas colhidas por dois protocolos. O resultado também indicou que, embora a perda não pudesse ser evitada, colhemos uma quantidade considerável de sEVs. Em seguida, dois diagramas de padrões demorados de protocolos de isolamento são apresentados aqui (Figura 3C). Em seguida, quantificou-se o consumo de tempo dos protocolos. O método tradicional de UC exigiu cerca de 2030 min, e este protocolo exigiu 260 min (Figura 3D). O rendimento foi maior usando este protocolo (Figura 3E), mostrando a eficiência do protocolo para amostras de grande volume.
Testes de esterilidade de controle de qualidade
Os testes de esterilidade são essenciais para garantir que os produtos sejam seguros. Detecções de bactérias, fungos, vírus e endotoxinas foram aplicadas aos sEVs que isolamos. Os resultados foram classificados aqui (Tabela 1). E os resultados indicaram que os sEVs obtidos por nosso protocolo estavam bem protegidos dos contaminantes.

Figura 1: Ilustração esquemática do protocolo para concentração e isolamento de MSC-sEVs do sobrenadante de cultura MSC. Clique aqui para ver uma versão maior desta figura.
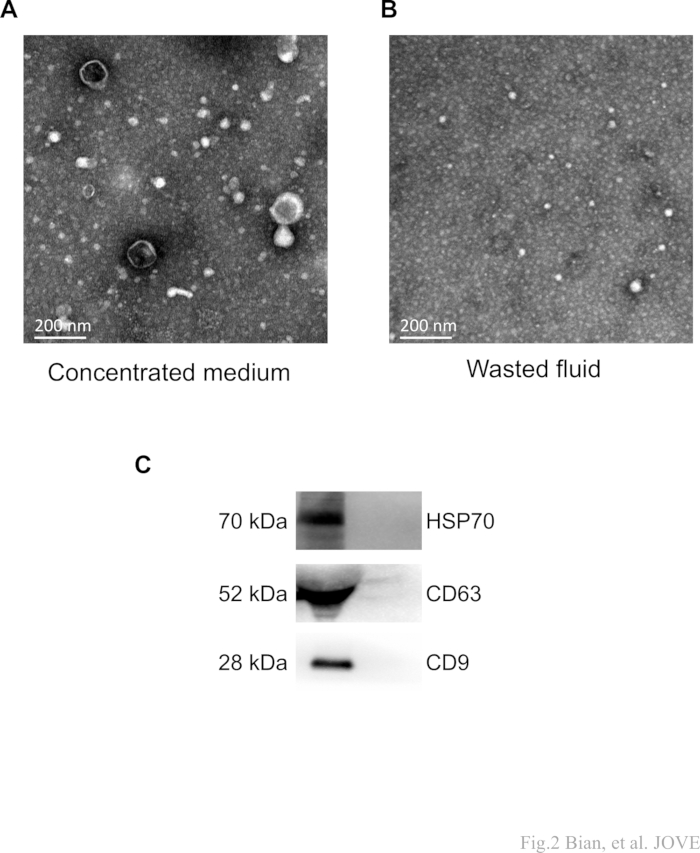
Figura 2: Imagens representativas de TEM e western blot de sEVs. (A,B) O protocolo visa obter um meio concentrado (amostra). Após concentração e subsequente ultracentrifugação, o fluido desperdiçado denota os resíduos coletados. Os MSC-sEVs "em forma de xícara" foram detectados nas amostras alvo (meio concentrado) e não foram observados no resíduo de fluido. Barras de escala: 200 nm. (C) Bandas proteicas claras de CD63, CD9 e HSP70 foram observadas no meio concentrado, enquanto nenhuma banda correspondente foi detectada em amostras de fluido desperdiçado. Clique aqui para ver uma versão maior desta figura.
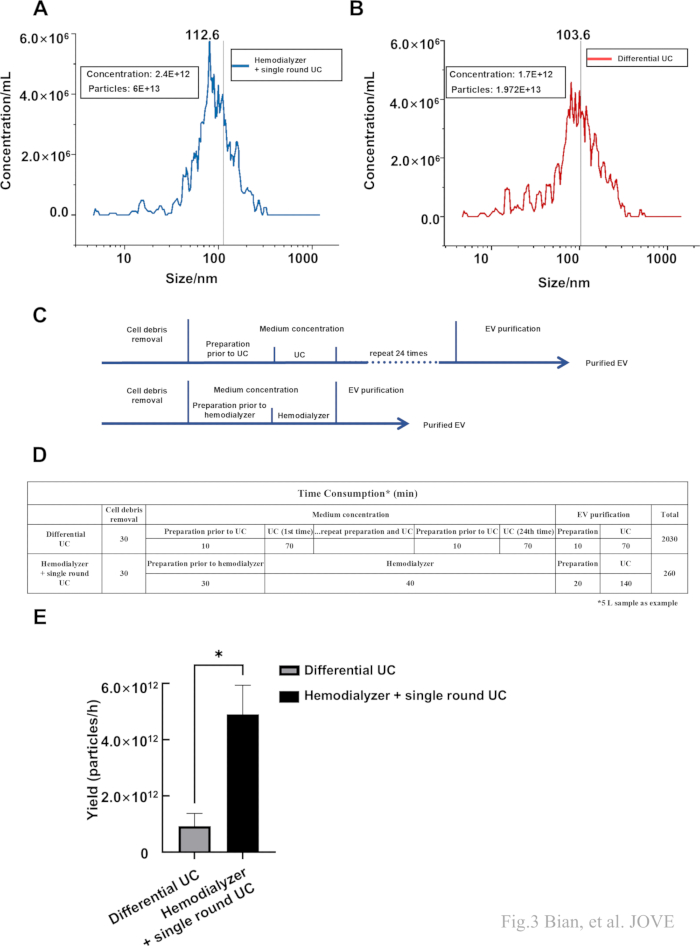
Figura 3: Tamanho da nanopartícula e número de partículas detectado pelo NTA. (A,B) O tamanho e a concentração de sEVs isolados por UC tradicional e este protocolo. (C) O fluxograma do UC tradicional (superior) e Hemodialisador + UC de rodada única (inferior). (D) O consumo de tempo do UC tradicional e do Hemodialisador + UC de rodada única. (E) O rendimento (partículas obtidas por hora) de dois protocolos diferentes. Os dados foram representados como média ± desvio-padrão (*p < 0,05). Clique aqui para ver uma versão maior desta figura.
| Teste | Resultado | Unidade | Referência | |
| Bactéria | Negativo | Nenhum crescimento bacteriano observado após 5 dias de cultura normal | ||
| Parede celular | Negativo | Nenhum crescimento fúngico observado após 5 dias de cultura normal | ||
| Endotoxinas | <0,0050 | EU/mL | ||
| Vírus | Vírus da hepatite B (HBV) | Abaixo do limite inferior | UI/mL | Quantificação do ADN-VHB, limite mínimo de detecção 20 |
| Vírus da hepatite C (HCV) | Negativo | UI/mL | Quantificação do HCV-RNA | |
| Vírus Epstein-Barr (EBV) | Negativo | cópias/mL | Detecção de fluorescência PCR | |
| Citomegalovírus (CMV) | Negativo | cópias/mL | Detecção de fluorescência PCR |
Tabela 1: Os testes de esterilidade do controle de qualidade.
Discussão
Os métodos tradicionais para o isolamento de sEVs incluem ultracentrifugação diferencial, cromatografia de exclusão de tamanho e precipitação de PEG, cada um com seus próprios méritos e deméritos. Embora a fusão dessas técnicas díspares possa aumentar o rendimento ou a pureza dos sEVs, etapas adicionais geralmente introduzem mais oportunidades de contaminação da amostra. Existem sistemas integrados que alegam extrair sEVs em massa e aderir aos padrões GMP surgiram no mercado21. No entanto, sua adoção generalizada representa um desafio econômico significativo, principalmente para o número crescente de equipes de pesquisa de veículos elétricos. Além disso, a ausência de protocolos padronizados e procedimentos reconhecidos para esses novos dispositivos pode introduzir um certo nível de risco. O GMP requer mais tentativas na metodologia e no equipamento para garantir a conformidade simultânea com rendimento e pureza.
De acordo com uma revisão recente das aplicações clínicas dos sEVs23, 35% dos estudos empregaram exclusivamente esse método; Outros 12,5% dos estudos utilizaram ultracentrifugação em combinação com outras técnicas. Sua ampla aplicação também implica que as ultracentrífugas se tornaram equipamentos acessíveis a uma parcela considerável dos pesquisadores24.
Em termos práticos, o emprego da ultracentrifugação ajuda nosso método a isolar com precisão derivados celulares precisos de outros elementos, como células maiores, fragmentos de células e células mortas25. Além disso, deve-se destacar que, embora os sEVs tenham sido relatados como eficazes, a realização de eficácia terapêutica satisfatória normalmente requer o uso de altas concentrações de sEVs, particularmente em experimentos com animais, estudos pré-clínicos com animais de grande porte e ensaios clínicos. A ultracentrifugação é atualmente o método mais crucial para a obtenção de sEVs de alta concentração, o que aumenta a relevância do protocolo para os cenários de aplicação acima mencionados. E como um método maduro, a ultracentrifugação possui as vantagens de ser aplicável a amostras amplas e ser econômica.
O hemodialisador tem sido utilizado de forma inovadora para o processamento de grandes volumes de amostras sobrenadantes de cultura de células, permitindo o subsequente isolamento de sEVs por meio de ultracentrifugação de rodada única. Conforme descrito na etapa 2.5.2, o modo usado na ultrafiltração é ISO-UF. O hemodialisador neste modo é o mesmo que o TFF. Como nenhum dialisato exógeno é usado, apenas pequenas moléculas passam pela membrana do filtro, como H2O. O TFF já é um protocolo de enriquecimento de sEVs amplamente comprovado e recomendado. No entanto, o equipamento TFF compatível com GMP para isolamento de sEV é caro e muitas vezes carece de padrões operacionais. Este tipo de equipamento é menos verificado, pelo que a qualidade do produto é difícil de garantir. Em contraste, o hemodialisador é complementado por consumíveis estabelecidos, protocolos operacionais padronizados e pessoal treinado. Este método oferece uma solução viável para concentrar amostras, especialmente para equipes de pesquisa hospitalares envolvidas em ensaios clínicos. Além disso, como extensão, devido às suas propriedades físicas próximas, acreditamos que este protocolo é teoricamente adequado para o isolamento de sEVs de todas as MSCs de várias linhagens, mas com certeza, é necessária uma verificação experimental adicional.
Este protocolo fornece um requisito de esterilidade mais facilmente atendido, que é um requisito crucial em ambientes GMP. Realizamos testes abrangentes ao explorar o protocolo, incluindo bactérias, fungos, vírus e endotoxinas nas amostras, e os resultados são todos negativos. (Tabela 1) O teste aqui não é a chave para a operação do protocolo que relatamos, portanto, optamos por não incluir os resultados. A esterilidade é um requisito em todo o protocolo, incluindo a amostra, operação, equipamento, ambiente, etc. O teste de esterilidade é essencial, especialmente para produtos destinados ao uso terapêutico. Além disso, outros controles de qualidade (CQ) para conformidade com as BPF devem ser considerados a partir de aspectos como identidade e potência. Aqui, identificamos as características físicas e marcadores proteicos do sEV. A potência dos sEVs isolados também deve ser verificada se os pesquisadores pretendem usar o produto para aplicação posterior.
Deve-se notar também que, em primeiro lugar, este protocolo incorpora uma etapa de filtração dupla com filtros de 0,45 μm e 0,22 μm para remover detritos celulares e vesículas maiores que 220 nm26. Embora métodos alternativos, como centrifugação de baixa velocidade, possam teoricamente preceder a ultracentrifugação27, isso pode resultar em diminuição da eficiência durante operações em larga escala. Se as amostras de sobrenadante de células contiverem uma quantidade excessiva de material particulado devido a operações anteriores à filtração, a membrana filtrante usada aqui tem uma probabilidade maior de reduzir a velocidade de filtração devido ao bloqueio no processo. Assim, também é recomendável sempre ter membranas filtrantes estéreis sobressalentes preparadas para substituição em caso de entupimento. Além disso, a operação de hemodiálise não é considerada complexa, principalmente para profissionais capacitados. No entanto, é importante garantir que o meio de cultura celular não contenha vermelho de fenol. Essa precaução é tomada não apenas porque as evidências sugerem que o indicador pode afetar potencialmente as funções biológicas do sEV, mas também devido à sua capacidade de acionar o alarme de vazamento de sangue da hemodiálise.
Este protocolo não é adequado para tarefas com um pequeno volume de amostras a serem processadas. Quando o isolamento pode ser realizado por 2 rodadas de ultracentrifugação, este protocolo não oferece uma vantagem de tempo. No entanto, à medida que o volume aumenta, esse protocolo pode se tornar um método de isolamento eficiente. A etapa de concentração deste protocolo utiliza apenas ultrafiltração sem o uso de tampão de diálise. É concebível que, ao empregar diferentes tampões de diálise, possa ser alcançada uma maior descontaminação de substâncias co-isoladas de sEVs. Não está excluído que o tampão de diálise possa afetar a estabilidade da membrana externa do sEV; portanto, mais pesquisas são necessárias para verificar isso.
Em resumo, apresentamos um método para o isolamento em larga escala de MSC-sEVs que atende aos padrões GMP. Ele depende principalmente de hemodialisadores e ultracentrífugas, que são mais acessíveis a muitas equipes de pesquisa do que alguns dos equipamentos especializados mais recentes disponíveis no mercado. Caracterizamos os sEVs obtidos e, além disso, realizamos um exame dos resíduos de filtração para identificar processos críticos que podem levar à perda de sEVs. Os resultados indicam que não houve perda significativa, sugerindo a eficiência e estabilidade do protocolo. Ao utilizar totalmente os equipamentos de laboratório existentes para atender às novas demandas, essa abordagem também fornece uma nova perspectiva de pesquisa.
Divulgações
Os autores declaram não haver interesses financeiros concorrentes.
Agradecimentos
Este trabalho foi apoiado por financiamento da Fundação Nacional de Ciência da China (822101167, para BB) e da Fundação de Ciências Naturais de Chongqing (CSTB2022NSCQ-MSX0020 para BB), Projeto de Pesquisa Científica "Through Train" de Chongqing PhD da China (CSTB2022BSXM-JCX0031 para BB) e Fundação Nacional de Ciência da China (82271132 para YL). Somos gratos pela assistência do Departamento de Nefrologia, do Primeiro hospital afiliado, da Terceira Universidade Médica Militar (Universidade Médica do Exército) e do Instituto de Patologia e do Centro de Câncer do Sudoeste, Hospital do Sudoeste, Terceira Universidade Médica Militar (Universidade Médica do Exército) pelo equipamento e suporte técnico.
Materiais
| Name | Company | Catalog Number | Comments |
| Anti-CD63 | SBI System Biosciences | EXOAB-CD63A-1 | 1:1000 dilution |
| Anti-CD9 | SBI System Biosciences | EXOAB-CD9A-1 | 1:1000 dilution |
| Anti-HSP70 | SBI System Biosciences | EXOAB-Hsp70A-1 | 1:1000 dilution |
| Bicinchoninic Acid Protein Assay Kit | Beyotime | P0012 | |
| Bloodlines | Fresenius Medical Care | AP16641 | |
| Bovine serum albumin 5% | Solarbio | 9048-46-8 | |
| Cell culture supplement | Helios | HPCPLCGL05 | 5% (v/v) in cell culture media |
| Copper grid | Precise | RGRS GP-SMPG-1 | |
| Dialyzer | Helixone | FX8 | 100 kDa MWCO |
| Drainage bag | CZRUIDE | YLD-01 | |
| Goat Anti-Rabbit HRP | SBI System Biosciences | EXOAB-CD63A-1 | 1:10000 dilution |
| Goat Anti-Rabbit HRP | SBI System Biosciences | EXOAB-CD9A-1 | 1:10000 dilution |
| Goat Anti-Rabbit HRP | SBI System Biosciences | EXOAB-Hsp70A-1 | 1:10000 dilution |
| Mesenchymal Stem Cell Basal Medium (MSCBM) | Dakewe | DKW34-BM20500 | |
| Microfiltration membrane | shanghaixingya | WKLM-50-10 | 0.45 μm and 0.22 μm |
| Parafilm | Fisher Scientific | 1337416 | |
| Peristaltic pump | LongerPump | YZ1515x | |
| Phosphate buffer saline | Solarbio | P1022-500ml | |
| Immun-Blot PVDF Membrane | BIO-RAD | 1620177 | |
| SDS-PAGE Gel Quick Preparation Kit | Beyotime | P0012AC | |
| SDS-PAGE Sample Loading Buffer | Beyotime | P0015A | |
| Super ECL Plus Western Blotting Substrate | BIOGROUND | BG0001 | |
| TBST buffer | Solarbio | T1081 | |
| Ultracentrifuge tubes 38.5 mL | Beckman | 344058 | |
| Bio-Rad ChemiDoc MP Imaging System | BIO-RAD | ||
| Hemodialyzer | NIKKISO | DBB-27 | |
| Nanoparticle Tracking Analysis | ZetaView | PMX120 | To measure particle size distribution and particle concentration |
| Transmission Electron Microscopy | JEOL | JEM-1400PLUS | Recommended settings?Exposure: 1.0 s, HT Voltafe 100.00 kV, Beam Curr: 50 μA, Spot Size: 1, Mode: TEM. |
| Ultracentrifuge | BECKMAN COULTER | OPTIMA XPN-100 | SW 28Ti SwingingBucket Rotor |
Referências
- Tan, F., et al. Clinical applications of stem cell-derived exosomes. Signal Transduct Target Ther. 9 (1), 17 (2024).
- Xia, Y., Zhang, J., Liu, G., Wolfram, J. Immunogenicity of extracellular vesicles. Adv Mater. 36 (33), e2403199 (2024).
- Andaloussi, S. E. L., Mäger, I., Breakefield, X. O., Wood, M. J. Extracellular vesicles: Biology and emerging therapeutic opportunities. Nat Rev Drug Discov. 12 (5), 347-357 (2013).
- Harrell, C. R., Jovicic, N., Djonov, V., Arsenijevic, N., Volarevic, V. Mesenchymal stem cell-derived exosomes and other extracellular vesicles as new remedies in the therapy of inflammatory diseases. Cells. 8 (12), 1605 (2019).
- Lin, Z., et al. Mesenchymal stem cell-derived exosomes in cancer therapy resistance: Recent advances and therapeutic potential. Mol Cancer. 21 (1), 179 (2022).
- Matsuzaka, Y., Yashiro, R. Therapeutic strategy of mesenchymal-stem-cell-derived extracellular vesicles as regenerative medicine. Int J Mol Sci. 23 (12), 6480 (2022).
- Syromiatnikova, V., Prokopeva, A., Gomzikova, M. Methods of the large-scale production of extracellular vesicles. Int J Mol Sci. 23 (18), 10522 (2022).
- Chen, J., et al. Review on strategies and technologies for exosome isolation and purification. Front Bioeng Biotechnol. 9, 811971 (2021).
- Stam, J., Bartel, S., Bischoff, R., Wolters, J. C. Isolation of extracellular vesicles with combined enrichment methods. J Chromatogr B Analyt Technol Biomed Life Sci. 1169, 122604 (2021).
- Bajo-Santos, C., et al. Extracellular vesicles isolation from large volume samples using a polydimethylsiloxane-free microfluidic device. Int J Mol Sci. 24 (9), 7871 (2023).
- Shin, S., et al. Separation of extracellular nanovesicles and apoptotic bodies from cancer cell culture broth using tunable microfluidic systems. Sci Rep. 7 (1), 9907 (2017).
- Zeng, L., et al. Extraction of small extracellular vesicles by label-free and biocompatible on-chip magnetic separation. Lab Chip. 22 (13), 2476-2488 (2022).
- Dong, J., et al. Coupling nanostructured microchips with covalent chemistry enables purification of sarcoma-derived extracellular vesicles for downstream functional studies. Adv Funct Mater. 30 (49), 2003237 (2020).
- Meng, Y., et al. Direct isolation of small extracellular vesicles from human blood using viscoelastic microfluidics. Sci Adv. 9 (40), eadi5296 (2023).
- Martins, T. S., Vaz, M., Henriques, A. G. A review on comparative studies addressing exosome isolation methods from body fluids. Anal Bioanal Chem. 415 (7), 1239-1263 (2023).
- Börger, V., Staubach, S., Dittrich, R., Stambouli, O., Giebel, B. Scaled isolation of mesenchymal stem/stromal cell-derived extracellular vesicles. Curr Protoc Stem Cell Biol. 55 (1), e128 (2020).
- Mohajerani, F., Clark, W. R., Ronco, C., Narsimhan, V. Mass transport in high-flux hemodialysis: Application of engineering principles to clinical prescription. Clin J Am Soc Nephrol. 17 (5), 749-756 (2022).
- Zawada, A. M., et al. Impact of hydrophilic modification of synthetic dialysis membranes on hemocompatibility and performance. Membranes (Basel). 12 (10), 932 (2022).
- Ghannoum, M., Roberts, D. M. Management of poisonings and intoxications. Clin J Am Soc Nephrol. 18 (9), 1210-1221 (2023).
- Khan, M. S., et al. Managing heart failure in patients on dialysis: State-of-the-art review. J Card Fail. 29 (1), 87-107 (2023).
- Chen, Y., et al. Exosome detection via the ultrafast-isolation system: Exodus. Nat Methods. 18 (2), 212-218 (2021).
- Welsh, J. A., et al. Minimal information for studies of extracellular vesicles (misev2023): From basic to advanced approaches. J Extracell Vesicles. 13 (2), e12404 (2024).
- Koch, L. F., et al. Novel insights into the isolation of extracellular vesicles by anion exchange chromatography. Front Bioeng Biotechnol. 11, 1298892 (2023).
- Akbar, A., Malekian, F., Baghban, N., Kodam, S. P., Ullah, M. Methodologies to isolate and purify clinical grade extracellular vesicles for medical applications. Cells. 11 (2), 186 (2022).
- Li, P., Kaslan, M., Lee, S. H., Yao, J., Gao, Z. Progress in exosome isolation techniques. Theranostics. 7 (3), 789-804 (2017).
- Théry, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Curr Protoc Cell Biol. Chapter 3 (Unit 3.22), (2006).
- Colombo, M., Raposo, G., Théry, C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annu Rev Cell Dev Biol. 30, 255-289 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados