Method Article
בידוד שלפוחיות חוץ-תאיות קטנות שמקורן בתאי גזע מזנכימליים מדגימות בנפח גדול עם תאימות ל-GMP לניסויים קליניים
* These authors contributed equally
In This Article
Summary
שלפוחיות חוץ-תאיות קטנות שמקורן בתאי גזע מזנכימליים (MSC-sEVs) הודגשו כשיטת טיפול נטולת תאים עם תופעות לוואי מינימליות. מחקר זה מספק פרוטוקול המשלב המודיאליזה עם אולטרה-צנטריפוגה, מפחית משמעותית את הזמן המושקע בתהליך כולו ומבטיח עמידה בתקני GMP (תנאי ייצור נאותים).
Abstract
שלפוחיות חוץ-תאיות קטנות (sEV) שמקורן בתאי גזע מזנכימליים (MSC-sEVs) הודגשו כשיטת טיפול נטולת תאים עם תופעות לוואי מינימליות. לעומת זאת, שיטות מיצוי מסורתיות כגון אולטרה-צנטריפוגה וכרומטוגרפיה של אי הכללת גודל מוגבלות על ידי עוצמת הזמן, העלות והמדרגיות שלהן. כדי להתגבר על מגבלות אלה, אנו מציעים שיטה המשלבת המודיאליזר ואולטרה-צנטריפוגה. גישה זו משתמשת במכשיר המודיאליזה עם ממברנת חיתוך משקל מולקולרי (MWCO) של 100 kDa, המרכזת באופן סלקטיבי sEVs תוך סינון שפע של חלבונים, ובכך משפרת את התפוקה והטוהר של sEVs. שלב הטיהור הראשוני הזה מלווה באולטרה-צנטריפוגה כדי לחדד עוד יותר את הכנת ה-sEV. השילוב של שתי הטכנולוגיות הללו לא רק הפחית משמעותית את הזמן המושקע בתהליך כולו אלא גם הבטיח עמידה בתקני תנאי ייצור נאותים (GMP). השיטה כאן מדגימה יעילות גבוהה בבידוד sEVs מנפח גדול של דגימות, ומציעה התקדמות משמעותית על פני שיטות מסורתיות. פרוטוקול זה טומן בחובו הבטחה להאצת התרגום של טיפולים מבוססי EV לפרקטיקה קלינית על ידי מתן פתרון מדרגי, חסכוני ותואם GMP.
Introduction
שלפוחיות חוץ-תאיות קטנות שמקורן בתאי גזע מזנכימליים (MSC-sEVs) הן שלפוחיות הטרוגניות המועשרות ברכיבים מרובים כגון mRNA, מיקרו-RNA, ציטוקינים, ליפידים ומטבוליטים1. בשנים האחרונות, מחקרים רבים הדגישו את הפוטנציאל הטיפולי העצום של MSC-sEVs כשיטת טיפול נטולת תאים עם תופעות לוואי מינימליות2, והראו הבטחה בטיפול בספקטרום של מצבים, כולל הזדקנות, ניוון רקמות, סרטן והפרעה דלקתית 3,4,5,6 . עם זאת, אתגר קריטי נמשך במיצוי sEV בקנה מידה גדול, כאשר שיטות מסורתיות מוכיחות את עצמן כעתירות זמן או בלתי אפשריות מבחינה כלכלית. יתר על כן, הבטחת שחזור היא בעלת חשיבות עליונה ליישום קליני ותרגום של טיפולים מבוססי EV7. חוקרים זקוקים נואשות לשיטת טיהור שהיא לא רק פשוטה ויעילה אלא גם תואמת לתקני GMP (תנאי ייצור נאותים)8.
שיטות הטיהור הקונבנציונליות, כולל אולטרה-צנטריפוגה, אולטרה-סינון, כרומטוגרפיה של אי הכללת גודל, אימונואפיניות ומשקעי פולימרים, יושמו בהרחבה במחקרים קודמים9. באופן כללי, שיטות מסורתיות לבידוד sEV מציגות מגבלות כגון שיעור תפוקה נמוך, טוהר פגום ואתגרים בעמידה בתקנים אספטיים מחמירים. יתר על כן, מחקרים קודמים דיווחו על הפוטנציאל של טכניקות מבטיחות כמו מערכות מיקרופלואידיות10,11, בידוד מגנטי ללא תוויות12 ובידוד כימי קוולנטי13 להשגת ביצועים יוצאי דופן. עם זאת, הדרישה לציוד מיוחד הופכת את הטכניקות המתקדמות הללו למאתגרות עבור רוב צוותי המחקר. לסיכום, השיטה היעילה לבודד רכבי EV בדרגת GMP מנפח גדול של דגימות נותרה מכשול קריטי, המגביל את התקדמותם של צוותים רבים הן במחקר והן ביישומים קליניים.
אולטרה-צנטריפוגה היא השיטה המאומצת ביותר לבידוד sEV ומוכרת כשיטת תקן הזהב14,15. זוהי טכניקה הממנפת הבדלים בצפיפות ובגודל כדי לבודד רכבי EV. sEVs מבודדים נשטפים בדרך כלל עם מי מלח עם חוצץ פוספט (PBS) כדי לסלק מזהמים שיוריים. לאחר מכן, בדרך כלל משתמשים בנפח מתאים של PBS כדי להשעות מחדש את ה-sEVs השטופים וניתן לקצור ריכוזים צפויים שונים של sEVs על ידי שליטה בנפח ה-PBS. יתר על כן, דווח כי נראה כי הטוהר של sEVs בפלזמה המתקבלים על ידי אולטרה-צנטריפוגה טוב יותר מזה של sEVs בפלזמה המבודדים על ידי כרומטוגרפיה של אי הכללת גודל (SEC), ול-sEVs המתקבלים על ידי אולטרה-צנטריפוגה יש זיהומים נמוכים יותר של חלקיקים חוץ-תאיים שאינם שלפוחית (NVEPs). זה גם הופך את האולטרה-צנטריפוגה לשימוש הנפוץ ביותר וקשה להחלפה בטיפולים רבים הדורשים ריכוזים גבוהים של sEVs. עם זאת, בנוסף לאיכות וטוהר, יעילות היא גם גורם שאי אפשר להתעלם ממנו במיצוי sEV בנפח גדול. עד כה, סבב יחיד של אולטרה-צנטריפוגה יכול לתמוך בנפח דגימה של עד כ-600 מ"ל, מה שקובע שקשה לענות על הביקוש למיצוי בקנה מידה גדול על ידי אולטרה-צנטריפוגה16 בלבד.
מכשיר המודיאליזה מורכב ממודול מבוסס ממברנה המאכלס אלפי סיבים חלולים. דם מסתובב דרך סיבים אלה בתוך תא גלילי סגור17. מרכיבי הדם יכולים לעבור באופן סלקטיבי דרך הממברנות הללו על סמך גודלם המולקולרי וריכוזם היוני. במרפאה נעשה בו שימוש נרחב ככליה מלאכותית להסרת פסולת ועודפי נוזלים מדמם של חולים 18,19,20. במילים אחרות, להמודיאליזר יש גם פוטנציאל לרכז דגימות בנפח גדול, תוך הסתמכות על תהליך הדומה לסינון זרימה משיק (TFF). בהנחיה האחרונה שפורסמה על ידי האגודה הבינלאומית לשלפוחיות חוץ-תאיות (ISEV), תרכיזי sEV נחשבים מתאימים לדגימות בנפח גדול, כגון מדיום תרבית תאים. לאחר עשרות שנים של פיתוח, המודיאליזרים אומצו באופן נרחב בבתי חולים, נתמכים על ידי שפע של חומרים מתכלים בוגרים ומאגר של מפעילים מיומנים, מה שמקל על שמירה על הדגימה סטרילית.
מחקר זה מציג שיטת טיהור sEV המבוססת על המודיאליזר ואולטרה-צנטריפוגה התואמים ל-GMP. כאן, אנו בוחרים בדיאליזרים של חיתוך משקל מולקולרי של 100 kDa (MWCO), שהוכח כיעיל לוכד sEVs ולסנן חלבונים רבים22. אולטרה-צנטריפוגה מספקת גם שלב לטיהור נוסף. העבודה מדגימה כי ההמודיאליזר מתאים באותה מידה לריכוז ה-sEVs. פרוטוקול זה מאפשר לחוקרים לבודד sEVs מדגימות בנפח גדול ביעילות. רשמנו את הניסוי הקליני ברישום הניסויים הקליניים הסיני (ChiCTR, NO. ChiCTR2200059018), שעדיין מתבצע ועדיין לא הושלם. למרות שנתונים קליניים אינם זמינים לפרסום כרגע, שיטה אמינה, בקנה מידה גדול, יעילה ותואמת לייצור sEVs כפי שדווח בפרוטוקול זה היא תנאי מוקדם לביצוע ניסויים פרה-קליניים וקליניים.
Protocol
הפרוטוקול אושר ונערך בהתאם לוועדת האתיקה של מחקר אנושי של בית החולים הדרום-מערבי.
1. הסרת פסולת תאים ממדיום התרבות
הערה: יש להפעיל את הנהלים שלהלן בסביבה תואמת GMP, במיוחד כאשר הדגימות עשויות להיות חשופות ישירות לסביבה.
- בהתחשב בדרישה ללא מיקרוביוטה, ודא שהמסנן וצינור הגומי עוברים חיטוי לעיקור יעיל. ודא שכל החומרים המתכלים האחרים שעלולים להיתקל במדיום התרבות הם סטריליים ובאריזה אטומה. בצע את תהליך הסרת פסולת התאים בארון זרימה למינרית.
- הרכיבו את קרום הסינון של 0.45 מיקרומטר ו-0.22 מיקרומטר למנגנון המסנן. חבר משאבה פריסטלטית (ראה טבלת חומרים) ואת מכשיר המסנן עם צינור הגומי. מקם את הממברנה של 0.45 מיקרומטר מעל הממברנה של 0.22 מיקרומטר; אחרת, זה עלול להפחית את יעילות הסינון (איור 1). שימו לב להבחנה בין הצד הקדמי והאחורי של קרום המיקרו-סינון.
- הפעל את המשאבה הפריסטלטית לסינון. מופעל על ידי המשאבה, המדיום הבסיסי של תאי גזע מזנכימליים (MSCBM) עם תוספת של 5% (ראה טבלת חומרים) עובר דרך המסנן מקצה אחד, וניתן להשיג את מדיום התרבית המסונן בקצה השני של המסנן, כפי שמוצג ב (איור 1). אוספים את מדיום התרבות המסונן בשקית ניקוז עם תעלות כפולות. שמור על שלמות מערכת הסינון על ידי אופטימיזציה של מהירות המשאבה הפריסטלטית והחלפת קרום הסינון לפי הצורך.
- לאחר השלמת הסינון, סגור את שסתום הכניסה על שקית הניקוז ואטום אותו עוד יותר עם פרפילם (ראה טבלת חומרים). המשך לשלב הבא או אחסן באופן זמני את מדיום תרבית התאים המסונן בטמפרטורה של 4 מעלות צלזיוס.
2. ריכוז מדיום התרבות המסונן עם המודיאליזר
הערה: הימנע משימוש במדיום הנשר השונה (DMEM) של Dulbecco המכיל פנול אדום בתרבית תאים, מכיוון שגלאי דליפת הדם בהמודיאליזר יופעל או יכבה את גלאי דליפת הדם בהגדרת ההמודיאליזר.
- הכן את החומרים המתכלים.
- הכינו קווי דם, ממברנות פוליסולפון בשטף גבוה של 100 kDa MWCO, דיאליזה בדם, ערכת עירוי, תמיסת מלח פיזיולוגית, שקית עירוי, תמיסת יוד וצמר גפן לפני הריכוז (ראה טבלת חומרים).
- הפעל את המערכת ובדוק את עצמך.
- בדוק את החיבור של כבל החשמל של המודיאליזר והפעל את החשמל הראשי.
- המתן עד שהמכשיר ישלים את כל הליך האבחון העצמי.
- התקן את קווי הדם והדיאליזה.
- ודא את תאריכי התפוגה של קווי הדם החד פעמיים ודיאליזר הדם, ודא את שלמות האריזה החיצונית שלהם ובדוק אם יש נזק לקווים.
- התקן את הצינור באותו כיוון כמו זרימת הדם במעגל החוץ-גופני, וסגור ברצף את שסתומי הענף ליצירת זרימת לולאה סגורה.
- התחל את הליך השטיפה.
- השתמש בערכת עירוי כדי לחבר את תמיסת המלח הפיזיולוגית (ללא הפרין) מצינור לפני המשאבה למעגל הדיאליזה. חבר את אתר האיסוף הוורידי לשקית נוזל הפסולת.
הערה: מי המלח הפיזיולוגיים לא צריכים להכיל הפרין או כל נוגדי קרישה אחרים. - חבר את קווי האספקה/החזרה של הדיאליזה לדיאליזה.
- הפעל את ההמודיאליזר והגדר את קצב הזרימה ל-80-100 מ"ל/דקה. הוצא את כל האוויר ממעגל הדיאליזה ומהדיאליזה כדי להבטיח שכל מערכת הצינורות מלאה בנוזל.
- כוונן את מישור הנוזל בתאי העורקים והוורידים לכ-2/3 מלא. מי המלח זורמים ברצף דרך קו העורקים, הדיאליזה, הקו הוורידי ושקית נוזל הפסולת.
- השתמש בערכת עירוי כדי לחבר את תמיסת המלח הפיזיולוגית (ללא הפרין) מצינור לפני המשאבה למעגל הדיאליזה. חבר את אתר האיסוף הוורידי לשקית נוזל הפסולת.
- התחל את ריכוז האולטרה-סינון.
- לאחר סיום הליך השטיפה, תלו את שקית הניקוז המכילה את מדיום התרבות המסונן על מעמד העירוי, חטאו את תעלת הפלט עם צמר גפן ספוג יוד, וחברו את תעלת הפלט של שקית הניקוז ליציאת משאבה מוקדמת באמצעות ערכת עירוי.
- הצטרף לפתח העורקי ולנמל הוורידי של קווי הדם. הקמת מעגל דיאליזה אולטרה-סינון מבודד (ISO-UF, אולטרה-סינון ללא זרימת דיאליזה) (איור 1).
- כוונן את נפח יעד האולטרה-סינון במכונת הדיאליזה כך שיתאים לנפח הכולל של הנוזל הקיים בשקית הניקוז. הגדר את זמן הדיאליזה של האולטרה-סינון לזמן הפעולה המינימלי של המערכת. לאחר הגדרת הפרמטרים בהצלחה, התחל את האולטרה-סינון.
הערה: בשל חישוב מערכת ההמודיאליזה, זמן הדיאליזה לא יהיה קצר מדי אלא יישמר בקצב מתון יותר.
- השג את הנוזל המרוכז.
- לאחר השגת נפח ההתייבשות המטרה, סגור את המהדק העורקי וחבר את הפתח הוורידי לשקית עירוי סטרילית.
- פתח את יציאת המשאבה המוקדמת של קווי הדם החד פעמיים המצוידים במסנן אוויר. הפעל את משאבת הדם במהירות של כ-50 מ"ל לדקה, מה שמאפשר לנוזל בתוך קווי הדם להסתובב שוב מקו העורקים לקו הוורידי. החזר את כל הנוזל המרוכז, כ -158 מ"ל, מהמעגל בחזרה לשקית העירוי הסטרילית.
- בשלב המאוחר של הריכוז, אסוף את הנוזל המבוזבז מקו החזרת הדיאליזה. החל תהליכים עוקבים זהים לאלה של מדיום התרבית המרוכז על דגימת הנוזל המבוזבז כדי לנטר כל אובדן מקרי של sEVs שעלול להתרחש במהלך הריכוז.
- סגור את כל השסתומים והסר את שקית העירוי, הדיאליזה וכל הקווים. כבה את אספקת החשמל וחטא את המכונה על ידי ניגובה.
3. הפרדת ה-sEVs עם אולטרה-צנטריפוגה
- העבירו את מדיום התרבות המרוכז לצינורות אולטרה-צנטריפוגה ואז אזנו אותם.
- צנטריפוגה באולטרה-צנטריפוגה בדרגה קלינית (ראה טבלת חומרים) ב-110,000 × גרם למשך 70 דקות, לאחר מכן שטפו את הגלולה בתמיסת מלח סטרילית והמשיכו בצנטריפוגה שנייה ב-110,000 × גרם למשך 70 דקות נוספות.
- השעו מחדש את ה-sEVs הגלולים בכמות מתאימה של תמיסת מלח סטרילית.
- העבירו את הרכבים החשמליים לצינור סטרילי לבדיקה נוספת או אחסנו אותם בטמפרטורה של -80 מעלות צלזיוס לשימוש עתידי.
4. אפיון של sEVs שהושגו
- ניתוח מעקב אחר ננו-חלקיקים (NTA)
- לדלל את ה-sEVs המתקבלים (1 מיקרוליטר) עם PBS (1 מ"ל) (ראה טבלת חומרים). התאימו את מספר רכבי ה-SV הנראים בשדה הראייה הנוכחי כך שיהיה בין 50 ל-200.
- הזרקו בזהירות את הדגימה המדוללת לבאר הדגימה, הימנעו מהכנסת בועות אוויר.
- בצע את המדידה כאשר מספר החלקיקים בשדה הראייה גבוה ויציב ככל האפשר לכל העמדות. פרמטרי הניתוח הם כדלקמן: שטח מקסימלי: 1000, שטח מינימום: 10, בהירות מינימלית: 30, אורך עקבות: 15, טמפרטורה: 25 מעלות צלזיוס, רגישות: 75.
- מדוד כל דגימה לפחות שלוש פעמים.
- ניתוח כתמים מערביים
- דילול פתרון sEVs ב-PBS. השתמש בערכת בדיקת חלבון של חומצה ביצינצ'ונינית (BCA) (ראה טבלת חומרים) כדי למדוד את ריכוז החלבון.
- הרתיחו את ה-sEVs במאגר הדגימה ב-100 מעלות צלזיוס למשך 5 דקות.
- הכן ג'ל אלקטרופורזה של ג'ל נתרן דודציל סולפט-פוליאקרילאמיד (SDS-PAGE) 12% (ראה טבלת חומרים). הרכיבו את מנגנון האלקטרופורזה של הג'ל. טען כמויות שוות של חלבון מכל דגימה לבארות הג'ל SDS-PAGE. הגדר את מתח האלקטרופורזה ל-80 וולט לריכוז ו-100 וולט להפרדה.
- הפעל את ממברנת הפוליווינילידן דיפלואוריד (PVDF) (ראה טבלת חומרים) עם מתנול למשך דקה אחת, ולאחר מכן השרו את קרום ה-PVDF במאגר העברה לפני שתמשיך בהעברה ב-100 וולט למשך שעה.
- טבלו את קרום ה-PVDF במאגר TBST (20 מ"מ טריס, 150 מ"מ NaCl ו-0.1% טווין 20) המכיל 5% אלבומין בסרום בקר (BSA; ראה טבלת חומרים) ולאחר מכן חסמו למשך 30 דקות.
- דגרו את קרום ה-PVDF עם הנוגדן העיקרי למשך הלילה ב-4 מעלות צלזיוס על שייקר. הנוגדנים העיקריים המשמשים הם כדלקמן: אנטי-CD63 אנושי (דילול 1:1000), אנטי-CD9 אנושי (דילול 1:1000) ואנטי-HSP70 אנושי (דילול 1:1000) (ראה טבלת חומרים).
- למחרת, שטפו את קרום ה-PVDF בתמיסת TBST חמש פעמים למשך 5 דקות כל אחת ולאחר מכן דגרו עם נוגדן משני מצומד HRP (דילול של 1:10000) (ראה טבלת חומרים) בטמפרטורת החדר (RT) למשך שעה.
- לאחר שטיפה עם TBST חמש פעמים, השתמש במגיב לזיהוי כימילומינסנציה להדמיה במערכת כימילומינסנציה.
- מיקרוסקופ אלקטרונים שידור
- הוסף טיפת דגימה מדוללת PBS של 20 מיקרוליטר לנייר שעווה. לאחר מכן, הנח רשת נחושת (ראה טבלת חומרים) על הטיפה כך שטיפה הדגימה תוכל לכסות את רשת הנחושת ותן לה לעמוד ב-RT למשך 20 דקות.
- ספוג עודפי נוזלים עם נייר פילטר. לאחר מכן, תקן את הדגימות בתמיסה של 20 מיקרוליטר של 2% פרפורמלדהיד, 2% גלוטראלדהיד ו-0.05 M פוספט למשך 2 דקות.
- שטפו את רשת הנחושת שלוש פעמים במים מזוקקים כפולים, ולאחר מכן צבעו ב-20 מיקרוליטר של 2% חומצה פוספוטונגסטית (PTA) למשך דקה אחת ב-RT.
- ספוג נוזל מיותר עם נייר פילטר. יבש את הרשתות למשך הלילה לפני ניתוח על ידי מיקרוסקופ אלקטרונים שידור (ראה טבלת חומרים).
הערה: ההגדרות המומלצות עבור TEM הן כדלקמן: חשיפה: 1.0 שניות, HT Voltage 100.00 kV, זרם קרן: 50 μA, גודל נקודה: 1, מצב: TEM. הגדרות אלה עשויות להשתנות בהתאם להוראות היצרן (ראה טבלת החומרים).
תוצאות
אפיון מורפולוגי של sEVs
בשלב הריכוז הסופי נאסף גם הנוזל המבוזבז כמתואר. המדיום המרוכז והנוזל המבוזבז היו אולטרה-צנטריפוגה, בהתאמה. אספנו את המשקעים לניתוח מיקרוסקופ אלקטרונים הולכה (TEM). כצפוי, מספר משמעותי של ננו-שלפוחיות בצורת נצפה בקבוצת המדיום המרוכז (איור 2A,B). עם זאת, חלקיקי sEV אופייניים לא זוהו בקבוצת הנוזל המבוזבז. ממצאים אלה מספקים ראיות לכך שהפרוטוקול מסוגל להפריד sEVs מבלי לחוות אובדן משמעותי במהלך שלב הריכוז המכריע.
אפיון סמני חלבון עבור sEVs
יתר על כן, נעשה שימוש בניתוח כתמים מערביים כדי לאפיין את סמני החלבון (CD9, CD81, HSP70) של ה-sEVs המבודדים. רצועות חלבון ברורות נצפו בקבוצת המדיום המרוכז, בעוד שלא זוהו רצועות תואמות בדגימות נוזל מבוזבזות (איור 2C). יחד, תוצאות אלו מאמתות את נוכחותם של רכיבי sEV.
גודל, מאפייני ותשואה של שלפוחיות חוץ-תאיות
כדי לאפיין עוד יותר את הכמות והגודל, NTA יושמה על הדגימות שהתקבלו על ידי אולטרה-צנטריפוגה מסורתית (UC מסורתי) והפרוטוקול שלנו. מכיוון ששתי השיטות השתמשו באולטרה-צנטריפוגה, sEVs שבודדו ממדיום תרבית MSC על ידי UC מסורתי שימשו כבקרה, שכללה בעיקר צנטריפוגה ב-300 × גרם למשך 15 דקות, לאחר מכן 2,000 × גרם למשך 15 דקות ואולטרה-צנטריפוגה ב-110,000 × גרם למשך 70 דקות ב-4 מעלות צלזיוס, ולאחר מכן הכדורים נשטפו במי מלח ואולטרה-צנטריפוגה שנייה בוצעה במשך 70 דקות ב-110. 000 × גרם. התוצאה הראתה שטווח הגודל של sEVs שהתקבלו על ידי פרוטוקול זה היה בין 48.1 ננומטר ל-166.2 ננומטר עם גודל ממוצע של 103.6 ננומטר, טווח הגודל של רכבי SEV שהתקבלו על ידי UC מסורתי היה מ-51.8 ננומטר עד 186.7 ננומטר עם גודל ממוצע של 112.6 ננומטר (איור 3A,B). בנוסף, הכנסנו את יחס הדילול לתוצאות NTA כדי למדוד את סך החלקיקים שנאספו על ידי שני פרוטוקולים. התוצאה גם הצביעה על כך שלמרות שלא ניתן היה להימנע מאובדן, אספנו כמות ניכרת של רכבי sEV. לאחר מכן, דיאגרמות תבניות גוזלות זמן של שני פרוטוקולי בידוד מוצגות כאן (איור 3C). לאחר מכן, כימתנו את צריכת הזמן של הפרוטוקולים. שיטת ה-UC המסורתית דרשה כ-2030 דקות, ופרוטוקול זה דרש 260 דקות (איור 3D). התשואה הייתה גבוהה יותר באמצעות פרוטוקול זה (איור 3E), מה שמראה את יעילות הפרוטוקול עבור דגימות בנפח גדול.
בדיקות סטריליות בקרת איכות
בדיקות הסטריליות הן קריטיות להבטחת בטיחות המוצרים. זיהויים של חיידקים, פטריות, וירוסים ואנדוטוקסין יושמו על ה-sEVs שבודדנו. התוצאות מוינו כאן (טבלה 1). והתוצאות הצביעו על כך שה-sEVs שהושגו על ידי הפרוטוקול שלנו היו מוגנים היטב מפני המזהמים.

איור 1: איור סכמטי של הפרוטוקול עבור ריכוז MSC-sEVs ובידוד מסופרנטנט תרבית MSC. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של איור זה.
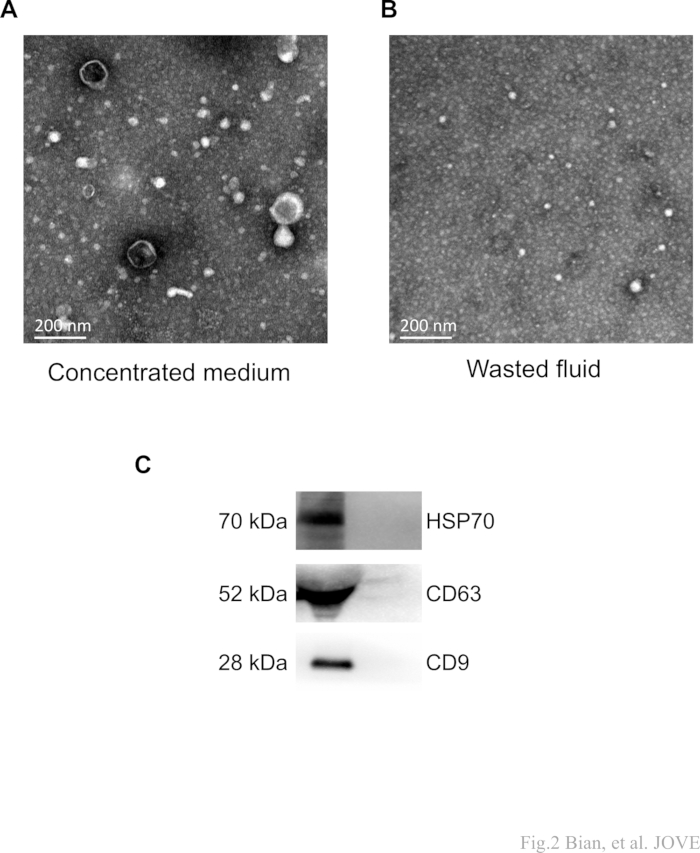
איור 2: תמונות TEM מייצגות וכתם מערבי של sEVs. (A,B) הפרוטוקול שואף להשיג מדיום מרוכז (מדגם). לאחר ריכוז ואולטרה-צנטריפוגה לאחר מכן, הנוזל המבוזבז מציין את הפסולת שנאספה. ה-MSC-sEVs "בצורת" זוהו בדגימות המטרה (מדיום מרוכז) ולא נצפו בפסולת הנוזלים. מוטות קנה מידה: 200 ננומטר. (C) רצועות חלבון שקופות של CD63, CD9 ו-HSP70 נצפו בתווך המרוכז, בעוד שלא זוהו רצועות תואמות בדגימות נוזלים מבוזבזות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
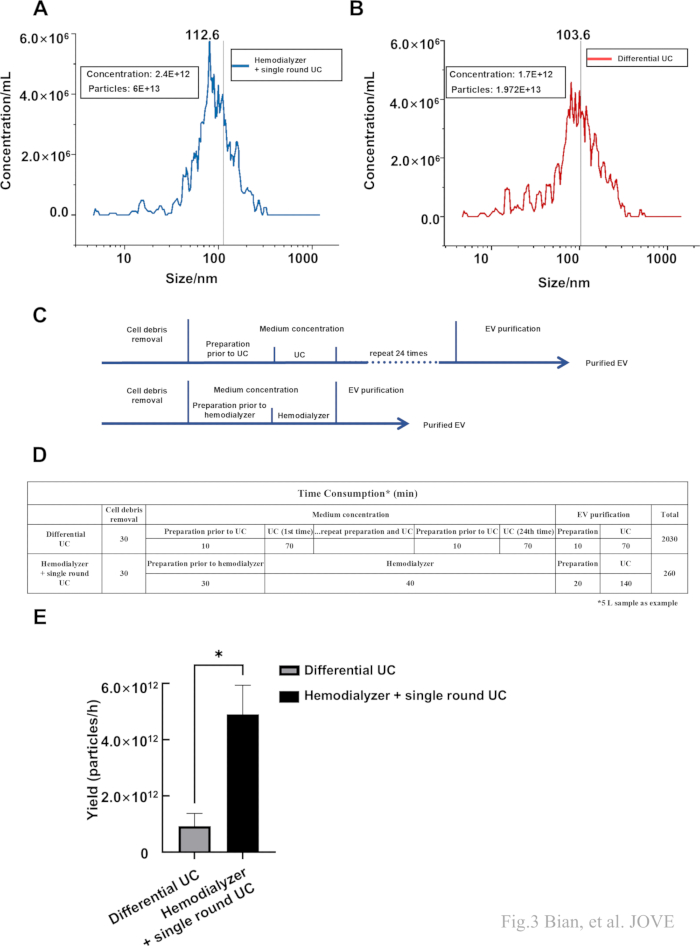
איור 3: גודל ננו-חלקיקים ומספר חלקיקים שזוהו על ידי NTA. (A,B) הגודל והריכוז של sEVs שבודדו על ידי UC מסורתי ופרוטוקול זה. (C) תרשים הזרימה של ה-UC המסורתי (למעלה) וההמודיאליזר + UC עגול יחיד (למטה). (D) צריכת הזמן של ה-UC המסורתי וההמודיאליזר + UC עגול יחיד. (E) התפוקה (חלקיקים המתקבלים לשעה) של שני פרוטוקולים שונים. הנתונים יוצגו כממוצע ± סטיית תקן (*p < 0.05). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| מבחן | תוצאה | יחידה | הפניה | |
| חיידקים | שלילי | לא נצפתה צמיחת חיידקים לאחר 5 ימים של תרבית רגילה | ||
| פטריות | שלילי | לא נצפתה צמיחה פטרייתית לאחר 5 ימים של תרבית רגילה | ||
| אנדוטוקסין | <0.0050 | האיחוד האירופי/מ"ל | ||
| נגיף | נגיף הפטיטיס B (HBV) | מתחת למגבלה הנמוכה ביותר | IU/מ"ל | כימות HBV-DNA, מגבלת זיהוי מינימלית 20 |
| נגיף הפטיטיס C (HCV) | שלילי | IU/מ"ל | כימות HCV-RNA | |
| וירוס אפשטיין-בר (EBV) | שלילי | עותקים/מ"ל | זיהוי פלואורסצנטי PCR | |
| ציטומגלווירוס (CMV) | שלילי | עותקים/מ"ל | זיהוי פלואורסצנטי PCR |
טבלה 1: בדיקות סטריליות בקרת איכות.
Discussion
שיטות מסורתיות לבידוד של sEVs כוללות אולטרה-צנטריפוגה דיפרנציאלית, כרומטוגרפיה של אי הכללת גודל ומשקעי PEG, כל אחת עם היתרונות והחסרונות שלה. בעוד שמיזוג של טכניקות שונות אלה עשוי לשפר את התפוקה או הטוהר של sEVs, צעדים נוספים מציגים לעתים קרובות הזדמנויות נוספות לזיהום דגימה. ישנן מערכות משולבות המתיימרות להפיק רכבי EV בכמויות גדולות ולעמוד בתקני GMP הופיעו בשוק21. עם זאת, האימוץ הנרחב שלהם מהווה אתגר כלכלי משמעותי, במיוחד עבור המספר ההולך וגדל של צוותי מחקר EV. יתר על כן, היעדר פרוטוקולים סטנדרטיים ונהלים מוכרים עבור מכשירים חדשים אלה עלול להציג רמה מסוימת של סיכון. GMP דורש ניסיונות נוספים הן במתודולוגיה והן בציוד כדי להבטיח עמידה בו-זמנית בתפוקה ובטוהר.
על פי סקירה עדכנית של היישומים הקליניים של sEVs23, 35% אחוז מהמחקרים השתמשו אך ורק בשיטה זו; 12.5% נוספים מהמחקרים השתמשו באולטרה-צנטריפוגה בשילוב עם טכניקות אחרות. היישום הנרחב שלו מרמז גם על כך שאולטרה-צנטריפוגות הפכו לציוד נגיש לחלק ניכר מהחוקרים24.
מבחינה מעשית, השימוש באולטרה-צנטריפוגה מסייע לשיטה שלנו לבודד במדויק נגזרות תאיות מדויקות מאלמנטים אחרים כגון תאים גדולים יותר, שברי תאים ותאים מתים25. יתר על כן, יש להדגיש כי למרות ש-sEVs דווחו כיעילים, מימוש יעילות טיפולית משביעת רצון דורש בדרך כלל שימוש בריכוזים גבוהים של sEVs, במיוחד בניסויים בבעלי חיים, ניסויים פרה-קליניים בבעלי חיים גדולים וניסויים קליניים. אולטרה-צנטריפוגה היא כיום השיטה החיונית ביותר להשגת sEVs בריכוז גבוה, מה שמשפר את הרלוונטיות של הפרוטוקול לתרחישי היישום שהוזכרו לעיל. וכשיטה בוגרת, לאולטרה-צנטריפוגה יש את היתרונות של היותה ישימה לדגימות רחבות טווח וחסכונית.
ההמודיאליזר שימש באופן חדשני לעיבוד כמויות גדולות של דגימות סופרנטנט של תרבית תאים, מה שמאפשר בידוד לאחר מכן של sEVs באמצעות אולטרה-צנטריפוגה בסיבוב יחיד. כמתואר בשלב 2.5.2, המצב המשמש באולטרה-סינון הוא ISO-UF. ההמודיאליזר במצב זה זהה ל-TFF. מכיוון שלא נעשה שימוש בדיאליזה אקסוגנית, רק מולקולות קטנות יוצאות מקרום המסנן, כגון H2O. TFF הוא כבר פרוטוקול העשרת sEVs מוכח ומומלץ מאוד. עם זאת, ציוד TFF תואם-GMP עבור בידוד sEV הוא יקר ולעתים קרובות חסר תקנים תפעוליים. ציוד מסוג זה פחות מאומת, ולכן קשה להבטיח את איכות המוצר. לעומת זאת, המודיאליזר משלים על ידי חומרים מתכלים מבוססים, פרוטוקולי הפעלה סטנדרטיים וכוח אדם מיומן. שיטה זו מציעה פתרון בר-קיימא לריכוז דגימות, במיוחד עבור צוותי מחקר מבוססי בתי חולים העוסקים בניסויים קליניים. יתר על כן, כהרחבה, בשל תכונותיהם הפיזיקליות הקרובות, אנו מאמינים כי פרוטוקול זה מתאים תיאורטית לבידוד של sEVs מכל MSCs משושלות שונות, אך בוודאות, יש צורך באימות ניסיוני נוסף.
פרוטוקול זה מספק דרישה קלה יותר לסטריליות, שהיא דרישה מכרעת בסביבות GMP. ערכנו בדיקות מקיפות בעת בחינת הפרוטוקול, כולל חיידקים, פטריות, וירוסים ואנדוטוקסין בדגימות, והתוצאות כולן שליליות. (טבלה 1) הבדיקה כאן אינה המפתח לפעולת הפרוטוקול שדיווחנו עליה, ולכן אנו בוחרים לא לכלול את התוצאות. סטריליות היא דרישה לאורך כל הפרוטוקול, כולל הדגימה, התפעול, הציוד, הסביבה וכו'. בדיקת הסטריליות חיונית, במיוחד עבור מוצרים המיועדים לשימוש טיפולי. חוץ מזה, יש לשקול בקרת איכות אחרת (QC) לעמידה ב-GMP מהיבטים כמו זהות ועוצמה. כאן, זיהינו את המאפיינים הפיזיקליים וסמני החלבון של sEV. יש לאמת את העוצמה של sEVs מבודדים גם אם החוקרים מתכוונים להשתמש במוצר ליישום נוסף.
כמו כן, יש לציין כי ראשית, פרוטוקול זה משלב שלב סינון כפול עם מסננים של 0.45 מיקרומטר ו-0.22 מיקרומטר להסרת פסולת תאית ושלפוחיות גדולות מ-220 ננומטר26. למרות ששיטות חלופיות, כגון צנטריפוגה במהירות נמוכה יותר, יכולות תיאורטית להקדים אולטרה-צנטריפוגה27, הדבר עלול לגרום ליעילות מופחתת במהלך פעולות בקנה מידה גדול. אם דגימות הסופרנטנט של התא מכילות כמות מוגזמת של חומר חלקיקי עקב פעולות לפני הסינון, לקרום המסנן המשמש כאן יש סבירות גדולה יותר להפחית את מהירות הסינון עקב חסימה בתהליך. לפיכך, מומלץ תמיד להכין ממברנות פילטר סטריליות רזרביות להחלפה במקרה של סתימה. יתר על כן, פעולת המודיאליזה אינה נחשבת למורכבת, במיוחד עבור אנשי מקצוע מיומנים. עם זאת, חשוב לוודא שמדיום תרבית התאים אינו מכיל פנול אדום. אמצעי זהירות זה ננקט לא רק מכיוון שהראיות מצביעות על כך שהמחוון עשוי להשפיע על התפקודים הביולוגיים של sEV אלא גם בשל יכולתו להפעיל את אזעקת דליפת הדם של המודיאליזה.
פרוטוקול זה אינו מתאים למשימות עם נפח קטן של דגימות לעיבוד. כאשר ניתן לבצע את הבידוד על ידי 2 סבבים של אולטרה-צנטריפוגה, פרוטוקול זה אינו מציע יתרון זמן. עם זאת, ככל שהנפח גדל, פרוטוקול זה יכול להפוך לשיטת בידוד יעילה. שלב הריכוז של פרוטוקול זה משתמש אך ורק באולטרה-סינון ללא שימוש במאגר דיאליזה. ניתן להעלות על הדעת כי על ידי שימוש במאגרי דיאליזה שונים, ניתן להשיג טיהור נוסף של חומרים מבודדים מ-sEVs. לא נכלל כי מאגר דיאליזה עשוי להשפיע על יציבות הממברנה החיצונית של ה-sEV; לפיכך, יש צורך במחקר נוסף כדי לאמת זאת.
לסיכום, הצגנו שיטה לבידוד בקנה מידה גדול של MSC-sEVs העומדת בתקני GMP. הוא מסתמך בעיקר על המודיאליזרים ואולטרה-צנטריפוגות, הנגישים יותר לצוותי מחקר רבים מאשר חלק מהציוד המיוחד החדש יותר הקיים בשוק. אפיינו את ה-sEVs שהושגו ובנוסף, ערכנו בדיקה של פסולת הסינון כדי לזהות תהליכים קריטיים שעלולים להוביל לאובדן sEVs. התוצאות אינן מצביעות על אובדן משמעותי, מה שמרמז על היעילות והיציבות של הפרוטוקול. על ידי ניצול מלא של ציוד המעבדה הקיים כדי לענות על דרישות חדשות, גישה זו מספקת גם נקודת מבט מחקרית חדשה.
Disclosures
המחברים מצהירים שאין אינטרסים פיננסיים מתחרים.
Acknowledgements
עבודה זו נתמכה על ידי מימון מהקרן הלאומית למדע של סין (822101167, ל-BB) והקרן למדעי הטבע של צ'ונגצ'ינג (CSTB2022NSCQ-MSX0020 ל-BB), פרויקט המחקר המדעי של צ'ונגצ'ינג "דרך הרכבת" של סין (CSTB2022BSXM-JCX0031 ל-BB) והקרן הלאומית למדע של סין (82271132 ל-YL). אנו אסירי תודה על הסיוע של המחלקה לנפרולוגיה, בית החולים המסונף הראשון, האוניברסיטה הרפואית הצבאית השלישית (האוניברסיטה הרפואית הצבאית), והמכון לפתולוגיה ומרכז הסרטן הדרום-מערבי, בית החולים הדרום-מערבי, האוניברסיטה הצבאית השלישית לרפואה (האוניברסיטה הרפואית הצבאית) על הציוד והתמיכה הטכנית.
Materials
| Name | Company | Catalog Number | Comments |
| Anti-CD63 | SBI System Biosciences | EXOAB-CD63A-1 | 1:1000 dilution |
| Anti-CD9 | SBI System Biosciences | EXOAB-CD9A-1 | 1:1000 dilution |
| Anti-HSP70 | SBI System Biosciences | EXOAB-Hsp70A-1 | 1:1000 dilution |
| Bicinchoninic Acid Protein Assay Kit | Beyotime | P0012 | |
| Bloodlines | Fresenius Medical Care | AP16641 | |
| Bovine serum albumin 5% | Solarbio | 9048-46-8 | |
| Cell culture supplement | Helios | HPCPLCGL05 | 5% (v/v) in cell culture media |
| Copper grid | Precise | RGRS GP-SMPG-1 | |
| Dialyzer | Helixone | FX8 | 100 kDa MWCO |
| Drainage bag | CZRUIDE | YLD-01 | |
| Goat Anti-Rabbit HRP | SBI System Biosciences | EXOAB-CD63A-1 | 1:10000 dilution |
| Goat Anti-Rabbit HRP | SBI System Biosciences | EXOAB-CD9A-1 | 1:10000 dilution |
| Goat Anti-Rabbit HRP | SBI System Biosciences | EXOAB-Hsp70A-1 | 1:10000 dilution |
| Mesenchymal Stem Cell Basal Medium (MSCBM) | Dakewe | DKW34-BM20500 | |
| Microfiltration membrane | shanghaixingya | WKLM-50-10 | 0.45 μm and 0.22 μm |
| Parafilm | Fisher Scientific | 1337416 | |
| Peristaltic pump | LongerPump | YZ1515x | |
| Phosphate buffer saline | Solarbio | P1022-500ml | |
| Immun-Blot PVDF Membrane | BIO-RAD | 1620177 | |
| SDS-PAGE Gel Quick Preparation Kit | Beyotime | P0012AC | |
| SDS-PAGE Sample Loading Buffer | Beyotime | P0015A | |
| Super ECL Plus Western Blotting Substrate | BIOGROUND | BG0001 | |
| TBST buffer | Solarbio | T1081 | |
| Ultracentrifuge tubes 38.5 mL | Beckman | 344058 | |
| Bio-Rad ChemiDoc MP Imaging System | BIO-RAD | ||
| Hemodialyzer | NIKKISO | DBB-27 | |
| Nanoparticle Tracking Analysis | ZetaView | PMX120 | To measure particle size distribution and particle concentration |
| Transmission Electron Microscopy | JEOL | JEM-1400PLUS | Recommended settings?Exposure: 1.0 s, HT Voltafe 100.00 kV, Beam Curr: 50 μA, Spot Size: 1, Mode: TEM. |
| Ultracentrifuge | BECKMAN COULTER | OPTIMA XPN-100 | SW 28Ti SwingingBucket Rotor |
References
- Tan, F., et al. Clinical applications of stem cell-derived exosomes. Signal Transduct Target Ther. 9 (1), 17 (2024).
- Xia, Y., Zhang, J., Liu, G., Wolfram, J. Immunogenicity of extracellular vesicles. Adv Mater. 36 (33), e2403199 (2024).
- Andaloussi, S. E. L., Mäger, I., Breakefield, X. O., Wood, M. J. Extracellular vesicles: Biology and emerging therapeutic opportunities. Nat Rev Drug Discov. 12 (5), 347-357 (2013).
- Harrell, C. R., Jovicic, N., Djonov, V., Arsenijevic, N., Volarevic, V. Mesenchymal stem cell-derived exosomes and other extracellular vesicles as new remedies in the therapy of inflammatory diseases. Cells. 8 (12), 1605 (2019).
- Lin, Z., et al. Mesenchymal stem cell-derived exosomes in cancer therapy resistance: Recent advances and therapeutic potential. Mol Cancer. 21 (1), 179 (2022).
- Matsuzaka, Y., Yashiro, R. Therapeutic strategy of mesenchymal-stem-cell-derived extracellular vesicles as regenerative medicine. Int J Mol Sci. 23 (12), 6480 (2022).
- Syromiatnikova, V., Prokopeva, A., Gomzikova, M. Methods of the large-scale production of extracellular vesicles. Int J Mol Sci. 23 (18), 10522 (2022).
- Chen, J., et al. Review on strategies and technologies for exosome isolation and purification. Front Bioeng Biotechnol. 9, 811971 (2021).
- Stam, J., Bartel, S., Bischoff, R., Wolters, J. C. Isolation of extracellular vesicles with combined enrichment methods. J Chromatogr B Analyt Technol Biomed Life Sci. 1169, 122604 (2021).
- Bajo-Santos, C., et al. Extracellular vesicles isolation from large volume samples using a polydimethylsiloxane-free microfluidic device. Int J Mol Sci. 24 (9), 7871 (2023).
- Shin, S., et al. Separation of extracellular nanovesicles and apoptotic bodies from cancer cell culture broth using tunable microfluidic systems. Sci Rep. 7 (1), 9907 (2017).
- Zeng, L., et al. Extraction of small extracellular vesicles by label-free and biocompatible on-chip magnetic separation. Lab Chip. 22 (13), 2476-2488 (2022).
- Dong, J., et al. Coupling nanostructured microchips with covalent chemistry enables purification of sarcoma-derived extracellular vesicles for downstream functional studies. Adv Funct Mater. 30 (49), 2003237 (2020).
- Meng, Y., et al. Direct isolation of small extracellular vesicles from human blood using viscoelastic microfluidics. Sci Adv. 9 (40), eadi5296 (2023).
- Martins, T. S., Vaz, M., Henriques, A. G. A review on comparative studies addressing exosome isolation methods from body fluids. Anal Bioanal Chem. 415 (7), 1239-1263 (2023).
- Börger, V., Staubach, S., Dittrich, R., Stambouli, O., Giebel, B. Scaled isolation of mesenchymal stem/stromal cell-derived extracellular vesicles. Curr Protoc Stem Cell Biol. 55 (1), e128 (2020).
- Mohajerani, F., Clark, W. R., Ronco, C., Narsimhan, V. Mass transport in high-flux hemodialysis: Application of engineering principles to clinical prescription. Clin J Am Soc Nephrol. 17 (5), 749-756 (2022).
- Zawada, A. M., et al. Impact of hydrophilic modification of synthetic dialysis membranes on hemocompatibility and performance. Membranes (Basel). 12 (10), 932 (2022).
- Ghannoum, M., Roberts, D. M. Management of poisonings and intoxications. Clin J Am Soc Nephrol. 18 (9), 1210-1221 (2023).
- Khan, M. S., et al. Managing heart failure in patients on dialysis: State-of-the-art review. J Card Fail. 29 (1), 87-107 (2023).
- Chen, Y., et al. Exosome detection via the ultrafast-isolation system: Exodus. Nat Methods. 18 (2), 212-218 (2021).
- Welsh, J. A., et al. Minimal information for studies of extracellular vesicles (misev2023): From basic to advanced approaches. J Extracell Vesicles. 13 (2), e12404 (2024).
- Koch, L. F., et al. Novel insights into the isolation of extracellular vesicles by anion exchange chromatography. Front Bioeng Biotechnol. 11, 1298892 (2023).
- Akbar, A., Malekian, F., Baghban, N., Kodam, S. P., Ullah, M. Methodologies to isolate and purify clinical grade extracellular vesicles for medical applications. Cells. 11 (2), 186 (2022).
- Li, P., Kaslan, M., Lee, S. H., Yao, J., Gao, Z. Progress in exosome isolation techniques. Theranostics. 7 (3), 789-804 (2017).
- Théry, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Curr Protoc Cell Biol. Chapter 3 (Unit 3.22), (2006).
- Colombo, M., Raposo, G., Théry, C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annu Rev Cell Dev Biol. 30, 255-289 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved