Method Article
Análise da atividade de células T humanas em um ambiente de co-cultura alogênica de células tumorais pré-tratadas
Neste Artigo
Resumo
O presente protocolo descreve um fluxo de trabalho experimental que permite a análise ex vivo da estimulação de células T humanas em um sistema de co-cultura alogênica com células tumorais pré-tratadas.
Resumo
As células T citotóxicas desempenham um papel fundamental na eliminação de células tumorais e são, portanto, intensamente estudadas na imunologia do câncer. A frequência e a atividade das células T citotóxicas dentro dos tumores e seu microambiente tumoral (TME) são agora biomarcadores prognósticos e preditivos bem estabelecidos para vários tipos de tumores. No entanto, é bem sabido que várias modalidades de tratamento de tumores, incluindo radioterapia, quimioterapia, imunoterapia e terapia direcionada, modulam não apenas a imunogenicidade do tumor, mas também o próprio sistema imunológico. Consequentemente, a interação entre células tumorais e células T requer um estudo mais intensivo em diferentes contextos terapêuticos para entender completamente o papel complexo das células T durante a terapia tumoral. Para atender a essa necessidade, foi desenvolvido um protocolo para analisar a atividade e a capacidade proliferativa de células T citotóxicas humanas (CD8+) em co-cultura com células tumorais pré-tratadas. Especificamente, as células T CD8+ de doadores saudáveis são coradas com o marcador de proliferação não tóxico éster succinimidílico de diacetato de carboxifluoresceína (CFSE) e estimuladas usando placas revestidas com CD3/CD28. Posteriormente, as células T são co-cultivadas com células tumorais pré-tratadas. Como leitura, a proliferação de células T é quantificada medindo a distribuição do sinal CFSE e avaliando a expressão de marcadores de ativação de superfície por citometria de fluxo. Isso pode ser complementado pela quantificação da liberação de citocinas usando ensaio imunoenzimático (ELISA). Este método facilita a avaliação das alterações induzidas pelo tratamento na interação entre células tumorais e células T, fornecendo uma base para análises mais detalhadas das modalidades de tratamento do tumor e sua imunogenicidade em um ambiente ex vivo humano. Além disso, contribui para a redução das análises pré-clínicas in vivo .
Introdução
Hoje em dia, está se tornando cada vez mais evidente que o crescimento e o progresso dos tumores são fortemente dependentes da manipulação e supressão efetivas do sistema imunológico do hospedeiro. Células transformadas surgem todos os dias, mesmo em um organismo saudável. No entanto, a formação de tumores macroscópicos é um evento bastante raro, pois as células transformadas emergentes são removidas do organismo com alta eficiência. Para a remoção de células malignas, diferentes tipos de células imunes, como células T citotóxicas, células T natural killer (NK), células NK ou macrófagos, entram em ação 1,2,3. No entanto, às vezes podem surgir clones de células transformadas que sobrevivem em um estado de equilíbrio com o sistema imunológico do hospedeiro, que é caracterizado por diferentes estratégias imunossupressoras do clone de células tumorais4. Eventualmente, algumas células transformadas adquirem funções adicionais que permitem que as células tumorais suprimam ativamente a resposta imune, o que consequentemente leva ao crescimento do tumor. Essa imunossupressão é mediada por vários mecanismos, que incluem a expressão de ligantes imunossupressores nas células tumorais ou o recrutamento ativo ou priming de populações de células imunes imunorreguladoras ou imunossupressoras. Esse chamado conceito de edição imunológica demonstra o papel fundamental da modulação imunológica durante a formação e crescimento do tumor5.
Assim, não é surpreendente que o sistema imunológico seja hoje um foco importante não apenas na terapia do câncer, mas também como um fator preditivo e prognóstico em muitas entidades tumorais e cenários terapêuticos. Nos últimos anos, os inibidores de checkpoint imunológico (ICIs) surgiram como opções terapêuticas promissoras em diferentes entidades sólidas de câncer, como carcinoma espinocelular de cabeça e pescoço (CECP) ou câncer de pulmão de células não pequenas (CPCNP) com o objetivo de modular o microambiente tumoral (TME) em direção a uma resposta imune antitumoral mais eficiente e uma imunossupressão diminuída das células tumorais6. Os inibidores de checkpoint imunológico visam aumentar a morte de células tumorais mediadas por células T, visando moléculas de checkpoint imunológico, como as da proteína de morte programada 1 (PD-1) e seu ligante 1 (PD1 / PD-L1). Este fato enfatiza o papel fundamental das células T na imunidade antitumoral. No CECP, por exemplo, os ICIs foram aprovados com sucesso como terapia de primeira linha no CECP recorrente e metastático7. Em consonância com isso, a presença de células T citotóxicas no TME, bem como a expressão de PD1 e PD-L1 nas células tumorais e células T correspondentemente, podem servir como biomarcadores preditivos no CECP 8,9,10.
Embora as células T tenham um papel crucial na imunologia tumoral e na terapia tumoral, muitas questões em aberto sobre suas interações com o tumor ainda precisam ser abordadas. Atualmente, sabe-se que a resposta imune tumoral é um processo dinâmico e que a imunogenicidade dos tumores pode mudar ao longo do curso da doença e dos tratamentos. Diferentes modalidades de tratamento, como quimioterapia (TC), radioterapia (RT) ou terapia direcionada (TT), são especialmente conhecidas por modular o fenótipo imunológico das células tumorais. A RT pode conduzir à regulação positiva de moléculas de checkpoint imunológico no tecido tumoral e alterar a frequência de células infiltrantes de tumor 11,12. O TT, por outro lado, também pode endossar alterações favoráveis dentro do tumor e do TME pela modulação direta da resposta imune adaptativa 13,14,15,16. No entanto, essas modulações são difíceis de estudar em pacientes, pois isso exigiria o exame repetitivo do tecido tumoral durante o curso do tratamento. Assim, sistemas de modelos experimentais conclusivos são necessários para estudar o fenótipo imunológico dinâmico de células tumorais e células T e, mais importante, suas interações.
Portanto, com o objetivo de analisar a atividade das células T e as interações de células tumorais e células T, é necessário um ensaio abrangente de co-cultura ex vivo que seja fácil de implementar em qualquer laboratório com base em trabalho direto de cultura de células e análises de citometria de fluxo comumente usadas. Com base na literatura existente e disponível, nenhum protocolo fácil de usar e comumente usado sobre a co-cultura de células T e células tumorais foi publicado até o momento. Embora vários ensaios de co-cultura para células T e organoides tumorais tenham sido publicados recentemente, a técnica de cultura de células 3D ainda não é implementada como uma técnica padrão em todos os laboratórios. Assim, fornecemos um protocolo para o uso em cultura de células 2D, que também pode ser estabelecido para cultura de células 3D no futuro. Outros protocolos de co-cultura 2D são frequentemente mais complexos, pois exigem, por exemplo, a transdução de células tumorais com luciferase17 ou são adequados apenas para neoplasias hematológicas (co-cultura de células T não pareadas com células leucêmicas)18. No ensaio aqui descrito, as células T de doadores saudáveis normais são isoladas do sangue periférico e estimuladas com anticorpos anti-CD3 e anti-CD28. Posteriormente, as células T são co-cultivadas com células tumorais (pré-)tratadas para analisar a capacidade proliferativa das células T, bem como sua atividade via citometria de fluxo. Assim, os efeitos de diferentes modalidades de tratamento no fenótipo imunológico das células tumorais, como RT, CT ou TT, que por sua vez influenciam a atividade e a proliferação das células T, podem ser facilmente rastreados e usados como base para análises mecanicistas mais profundas e análises pré-clínicas in vivo selecionadas consecutivas. O ensaio descrito aqui oferece uma configuração fácil de usar, pois não são necessários dispositivos, técnicas ou materiais não convencionais. Além disso, o ensaio pode ser facilmente adaptado a diferentes linhagens de células tumorais ou subconjuntos específicos de células T (por exemplo, células T CD4+). Usando esta técnica, alta padronização e reprodutibilidade são alcançadas.
Protocolo
Este ensaio envolve coletas de sangue e o cultivo de células primárias humanas. Portanto, um voto ético é obrigatório para essas análises. Todos os resultados apresentados neste manuscrito são cobertos pela aprovação ética do estudo IMMO-NHD, e o consentimento informado por escrito foi obtido de todos os doadores. A aprovação foi concedida pelo conselho de revisão institucional da Friedrich-Alexander-Universität Erlangen-Nürnberg em 9 de novembro de 2022 (número do pedido 21-415-B). As células tumorais HSC4 usadas neste estudo são de uma linha celular disponível comercialmente.
Este ensaio exemplifica todas as etapas do ensaio de cocultura de células T e células tumorais, usando a linha celular de carcinoma de células escamosas de cabeça e pescoço humano (HNSCC) HSC4 em um ambiente de tratamento envolvendo radioterapia (RT) e dois inibidores específicos de quinase. Consequentemente, parâmetros como número de células, tempos de tripsinização e esquemas de tratamento são específicos para esse cenário de co-cultura e devem ser adaptados para outras linhagens de células tumorais (consulte também a seção Discussão). Todas as etapas de centrifugação foram realizadas à temperatura ambiente. Neste estudo, os inibidores de quinase AZD0156 e VE-822 foram usados para direcionar o sistema de reparo de danos ao DNA (DDR) das células HSC4. AZD0156 (Selleckchem) inibe a proteína mutada da ataxia telangiectasia (ATM), enquanto o VE-822 (Selleckchem) tem como alvo a ataxia telangiectasia e a proteína relacionada ao Rad3 (ATR). Ambos os inibidores têm sido discutidos como agentes potenciais para aumentar a radiossensibilidade em células tumorais. Eles são dissolvidos em dimetilsulfóxido (DMSO) e armazenados a -20 °C. A Figura 1 fornece um fluxograma do ensaio ex vivo , detalhando a co-cultura de células tumorais pré-tratadas com células T CD8+ humanas estimuladas por CD3/CD28. Os reagentes e equipamentos utilizados estão listados na Tabela de Materiais.

Figura 1: Fluxograma do ensaio ex vivo de células tumorais pré-tratadas em co-cultura com células T CD8+ humanas estimuladas (CD3/CD28). Dia 1: Semeadura de células tumorais HSC4. Dia 2: Tratamento de células tumorais e isolamento, coloração CFSE e semeadura em placas revestidas com CD3/CD28 de células T CD8+ humanas. Dia 3: Tratamento das células tumorais. Dia 4: Contagem de poços representativos de células tumorais. Colheita e contagem de todas as células T. Co-cultivo de células T e células tumorais HSC4 na proporção de 1:1. Dia 5-Dia 8: Incubação de co-cultura. Dia 8: Colheita de cocultura, congelamento de sobrenadantes, coloração baseada em anticorpos e análise das células por citometria de fluxo. Clique aqui para ver uma versão maior desta figura.
1. Semeadura de células tumorais (Dia 1)
NOTA: Tempo: 1 h. As células tumorais HSC4 humanas são semeadas a partir de frascos de cultura de células T75 em placas de 96 poços.
- Rejeitar o sobrenadante (meio D10) do frasco de cultura de células.
- Lave as células tumorais com 5 mL de PBS quente a 37 °C. Descarte o PBS.
- Como as células tumorais HSC4 tendem a aderir firmemente aos frascos de cultura de células, recomenda-se a tripsinização em duas etapas para garantir que todas as células sejam destacadas. Para isso, adicione 3 mL de tripsina e coloque o frasco em uma placa de aquecimento a 37 °C por 3 min, depois descarte a tripsina com uma pipeta.
- Adicione mais 3 mL de tripsina, coloque o frasco na placa de aquecimento e espere até que a suspensão unicelular seja atingida. Verifique microscopicamente se há suspensão de célula única.
- Interrompa a tripsina adicionando o volume duplo de meio D10 (DMEM suplementado com 10% de soro fetal bovino e 1% de penicilina-estreptomicina), ressuspenda completamente e transfira as células para um tubo de centrifugação de 50 mL.
- Determine o número de células da suspensão de célula única e, em seguida, calcule a quantidade total de células tumorais de acordo com o volume total. Uma câmara celular de Neubauer é recomendada para a determinação da contagem de células.
- Centrifugue o tubo de centrifugação de 50 mL contendo as células tumorais a 300 x g por 5 min em temperatura ambiente. Descarte o sobrenadante.
- Ressuspenda as células tumorais HSC4 em um volume adequado de meio D10 para atingir uma concentração de 15.000 células em um meio de 200 μL.
- De acordo com os tratamentos planejados de células tumorais, semeie para cada condição pelo menos 3 poços contendo 15.000 células tumorais HSC4 em meio de 200 μL em duas placas de 96 poços (1x amostra, 1x célula tumoral apenas controle, 1x célula contando bem para o dia de co-cultura).
NOTA: O número de células depende da linha celular e do tempo de duplicação. O número de células para diferentes tratamentos precisa ser examinado em pré-experimentos para evitar 100% de confluência durante a incubação. - Incubar as células durante 24 h a 37 °C e 5% de CO2 e humidade saturada.
2. Tratamento de células tumorais (Dia 2)
NOTA: Tempo: 3-5 h. Após um tempo de incubação de 24 h, as células HSC4 previamente semeadas podem ser tratadas de acordo com o esquema de tratamento desejado. Neste caso exemplar, as células tumorais são tratadas com um inibidor de ATM ou ATR. Aqui, adicionalmente, uma das duas placas de 96 poços também é irradiada com 2x 5 Gy depois.
- Prepare inibidores de quinase para obter uma concentração de 1 μM AZD0156 (inibidor de ATM) e 0,1 μM de VE-822 (inibidor de ATR) para tratar células tumorais.
- Trate as células tumorais de acordo, por exemplo, tratando uma fileira de amostras com 3,1 μL do inibidor de ATM e uma segunda com 3,1 μL do inibidor de ATR em cada placa.
- Após 3-5 h de incubação a 37 °C, irradiar uma placa com 5 Gy.
- Depois de incubar por mais 24 horas, irradiar novamente a mesma placa com 5 Gy.
3. Isolamento de células T (Dia 2)
NOTA: Tempo: 4 h. As células T CD8 + são isoladas magneticamente com microesferas anti-CD8 de PBMCs após centrifugação com gradiente de densidade de sangue periférico (PB) derivado de doadores adultos saudáveis. As células T isoladas são então coradas com CFSE e incubadas em uma placa de poço revestida com CD3 / CD28 para estimulação. Para poder trabalhar com recursos e materiais amigáveis em etapas posteriores, é importante estimar a quantidade de células T necessárias para os experimentos de co-cultura. Na dependência do doador, entre 50.000.000 e 100.000.000 PBMCs podem ser isolados de cerca de 45 ml de sangue EDTA. Cerca de 10% do total de PBMCs são células T CD8+.
- Centrifugação com gradiente de densidade
- Transfira 3-5 tubos de sangue EDTA de 9 mL derivados de um doador saudável para dois tubos de centrifugação de 50 mL.
- Encha ambos os tubos de centrifugação até 50 mL com PBS + 2% FBS.
- Preparar seis tubos de centrifugação (com incrustações de plástico para a separação dos PBMC) e encher cada um com 15 ml de meio gradiente de densidade fria + 4 °C.
- Cubra cuidadosamente o meio de gradiente de densidade com 12-15 mL do sangue diluído da etapa 3.1.2.
- Centrifugue a 1200 x g por 10 min (sem necessidade de desaceleração).
- Preparação de uma placa de 6 poços para estimulação de células T
- Prepare anticorpos: Prepare uma solução anti-CD3 (clone OKT3) de 1 mg / mL com PBS. Prepare uma solução anti-CD28 (clone 28.2) de 0,1 mg / mL com PBS.
- Recomendação: use o tempo durante a centrifugação (etapa 3.1.5) para a preparação das soluções de revestimento e o próprio revestimento dos poços para a estimulação das células T.
- Misture 5 μL de solução de anticorpo CD3 com 4,995 μL de PBS e 50 μL de solução de anticorpo CD28 com 4,950 μL de PBS (concentração final: 1 μg / μL).
- Adicione 1.000 μL de ambas as soluções de anticorpos a cada poço da placa de 6 poços.
- Cubra 2 ou 3 poços, dependendo da quantidade esperada de células T, da placa de 6 poços e incube por pelo menos 2 h a 37 °C.
- Preparação do meio de células T
NOTA: Preparação de 100x L-Lisina: Dissolva 200 mg de cloridrato de L-lisina em 50 mL de água destilada em um tubo de centrifugação de 50 mL. Esterilize a solução usando um filtro de seringa de 0,2 μm e transfira-a para um novo tubo de 50 mL usando uma seringa de perfusão de 50 mL. Conservar a solução a 4-8 °C e utilizá-la no prazo de 3 meses. Preparação de 15 mM de L-arginina: Dissolva 26 mg de L-arginina em 10 mL de DPBS. Esterilize a solução usando um filtro de seringa de 0,2 μm e transfira-a para um novo tubo usando uma seringa de 10 mL. Conservar a solução a 4-8 °C e utilizá-la no prazo de 3 meses.- Use o tempo de centrifugação mencionado na etapa 1.5 para preparar o meio de células T.
- Prepare cerca de 10-30 mL de meio de células T, dependendo da quantidade esperada de células T.
- Misture o meio RPMI livre de L-arginina e L-lisina com 10% de FBS inativado por calor, 1% de penicilina-estreptomicina, 1% de L-arginina, 1% de L-lisina e 1% de L-glutamina. Exemplo: 25,8 mL de meio RPMI + 3 mL de FBS + 0,3 mL de Pen/Strep + 0,3 mL de L-Arginina + 0,3 mL de L-Lisina + 0,3 mL de L-Glutamina.
- Conservar o meio restante a 4 °C durante os dois dias seguintes, a utilizar no dia 4 - Início da cocultura. Para cada nova execução de todo o experimento, recomenda-se que um novo meio de cultura seja preparado.
- Isolamento PBMC
- Após a centrifugação (passo 3.1.5), transferir o sobrenadante para quatro novos tubos de centrifugação de 50 ml e rejeitar os tubos utilizados.
- Encha os tubos de centrifugação até 50 mL com PBS + 2% FBS.
- Centrifugue a 300 x g por 8 min em temperatura ambiente.
- Descarte o sobrenadante, ressuspenda o pellet celular em 1 mL de PBS + 2% de FBS cada e combine-os em dois tubos de centrifugação.
- Reabasteça os tubos para 50 mL com PBS + 2% FCS.
- Centrifugue a 120 x g por 10 min em temperatura ambiente.
- Descarte o sobrenadante, ressuspenda cuidadosamente o pellet celular em 1 mL de PBS + 2% FBS e combine os dois pellets em um falcão.
- Encha o tubo de centrifugação até 50 mL com PBS + 2% FBS.
- Conte o número total de PBMCs usando uma câmara de contagem de Neubauer. Recomendação: diluir a suspensão celular 1:10 com azul de tripano para a contagem.
- Separação de células T CD8+
NOTA: Use CD8 MicroBeads humanos junto com colunas de separação magnética (MS) e buffer de classificação de células ativadas magnéticas mais (MACS+) para separar magneticamente as células T CD8+ de acordo com o protocolo do fabricante (consulte a Tabela de Materiais).- Centrifugue os PBMCs (após contagem de células) a 300 x g por 10 min.
- Descarte o sobrenadante e ressuspenda o pellet celular em 80 μL de tampão MACS+ (500 mL de PBS suplementado com 10 mM de EDTA e 0,5% de BSA) por 107 células (por exemplo, 60.000.000 PBMCs são ressuspensos em 6 x 80 μL = 480 μL de tampão).
NOTA: Exemplo: 465 mL de PBS + 10 mL (0,5 M) de EDTA e 25 mL de solução BSA-Stock. - Adicione 20 μL de CD8 MicroBeads por 107 células e misture cuidadosamente pipetando para cima e para baixo. Incubar durante 15 min a 4 °C.
- Após a incubação, lave as células adicionando 2 mL de tampão MACS+ por 107 células.
- Centrifugue a 300 x g por 10 min em temperatura ambiente. Descarte o sobrenadante e ressuspenda as células em 1.000 μL de tampão MACS+.
- Coloque duas colunas MS no ímã e coloque dois tubos de centrifugação de 15 mL embaixo.
- Prepare as colunas com tampão MACS+ de 500 μL. O tampão atravessa as colunas e pode ser coletado nos tubos de centrifugação abaixo. Esta etapa também pode ser feita paralelamente à etapa 3.5.6.
- Em seguida, pipete a suspensão da célula igualmente nas colunas MS preparadas. O fluxo pode ser coletado nos mesmos tubos de centrifugação. Ele agora contém todas as células CD8-negativas não marcadas.
- Nivele as colunas adicionando 3x 500 μL de tampão MACS+. Adicione um novo buffer no topo das colunas apenas assim que elas secarem ou pararem de pingar.
- Rotule as células finais coletadas como "Flow-through" ou "CD8 negativo" e combine-as em um único tubo de centrifugação. Isso pode ser usado posteriormente para medir a pureza do isolamento por citometria de fluxo.
- Pegue um novo tubo de centrifugação de 15 mL rotulado como "células T CD8 +". As colunas são removidas do ímã e colocadas no tubo de centrifugação.
- Lave ambas as colunas contendo as células T CD8 positivas marcadas magneticamente com 1.000 μL de tampão MACS+ cada. Portanto, pipete o tampão nas colunas e comece imediatamente a empurrar cuidadosamente a solução para fora das colunas usando o êmbolo fornecido pelo fabricante.
NOTA: Faça isso para ambas as colunas, coletando 2 mL de suspensão total de células T em centrifugação. - Conte o número total de células T usando uma câmara de contagem de Neubauer. Recomendação: Use uma diluição de 1:4 com azul de tripano.
- Coloração de células T com CFSE
- Centrifugue as células T isoladas a 300 x g por 5 min.
- Durante a centrifugação, prepare a solução de coloração CFSE misturando 1,1 μL de solução CFSE em 10 mL de PBS. A concentração final deve ser de 1 μM.
- Descarte o sobrenadante e ressuspenda o pellet celular em 1.000 μL de PBS. Centrifugue a 300 x g por 5 min.
- Rejeitar o sobrenadante e ressuspender o sedimento celular em 2000 μL de solução de coloração CFSE (1 μM). Incubar durante 20 min a 37 °C.
- Centrifugue as células coradas a 300 x g por 5 min. Descarte o sobrenadante e ressuspenda o pellet celular em 1.000 μL de PBS.
- Centrifugue a 300 x g por 5 min. Descarte o sobrenadante e ressuspenda o pellet celular na quantidade apropriada de meio de células T para atingir uma concentração de 1,5-2 x 106 células T em cerca de 3-4 mL de meio de células T.
- Semeadura de células T em uma placa de 6 poços
- Descarte a solução de revestimento da placa de 6 poços.
- Semeie 1,5-2 milhões de células T isoladas e coradas em meio de células T de 3-4 mL por poço.
- Incubar células T a 37 °C e 5% de CO2 nas próximas 48 h
NOTA: Ajuste a densidade de semeadura sempre para 1,5 milhões de células / 3 mL. Evite semear células T em uma densidade mais baixa. Uma densidade mais alta é possível, mas precisa ser testada.
4. Início da co-cultura (Dia 4)
NOTA: Tempo: 2 h. Depois de determinar a contagem de células das células tumorais HSC4, as células T são adicionadas às placas de 96 poços na proporção de 1:1.
- Coletando um poço por condição para determinar uma contagem de células representativa
- Rejeitar o sobrenadante do poço que foi exemplarmente semeado para a determinação da contagem de células.
- Primeiro, lave as células com 100 μL de PBS e, em seguida, descarte o PBS.
- Adicione 100 μL de tripsina e incube por 5 min em uma placa de aquecimento. Em seguida, ressuspenda e verifique a suspensão unicelular ao microscópio; se as células não se soltarem, adicione mais 50 μL de tripsina.
- Assim que todas as células se separarem, interrompa a reação de tripsina adicionando 100 μL (ou 150 μL se 50 μL adicionais de tripsina foram adicionados antes) do meio D10 e ressuspenda.
- Transfira todo o volume de 200 μL do poço para um tubo de amostra de 1,5 mL e use 100 μL para medir a contagem de células. Lembre-se de ajustar o número de células medido ao volume da amostra.
- Coloração de células tumorais HSC4 com um corante de rastreamento de células fluorescentes não tóxico
- Prepare o rastreador de células (consulte a Tabela de Materiais) dissolvendo 2 μL em 20 mL de PBS (concentração final de 0,1 μM de acordo com o fabricante).
- Retire o meio D10 de todos os poços contendo células tumorais e descarte-o.
- Adicione 200 μL da solução de rastreador de células aos poços de células tumorais. Incubar durante 20 min a 37 °C.
- Após a incubação, descarte a solução de coloração e lave adicionando 100 μL de PBS. Posteriormente, descarte também o PBS.
- Adicione 200 μL de meio D10 fresco.
- Colheita de células T (placa de 6 poços)
- Ressuspenda cuidadosamente as células T em seu meio; a maioria das células T está em suspensão e pode ser colhida simplesmente sendo pipetada para fora de seu poço.
- Verificar microscopicamente se os poços estão vazios; caso contrário, colha usando 1.000 μL de tripsina, coloque a placa em uma placa de aquecimento a 37 ° C até que as células T se desprendam e, em seguida, pare a reação adicionando 1.000 μL de PBS ou meio de células T (opcional).
- Conte as células T usando uma câmara de contagem de Neubauer. Em seguida, centrifugue as células T a 300 x g por 5 min.
- Ressuspenda as células T no meio de células T (use o mesmo meio preparado no dia 2 de isolamento de células T) até uma concentração final de 10.000 células T por 20 μL.
- Adição de células T a células tumorais HSC4 (placa de 96 poços)
- Adicione a quantidade desejada de células T aos poços de células tumorais de acordo com a contagem de células tumorais previamente determinada na proporção de 1:1.
- Mantenha uma célula tumoral bem por condição livre de células T como um controle de "apenas células tumorais". Esse controle de "única célula tumoral" permite o controle preciso dos dados de fluxo.
- Adicione 200 μL da suspensão de células T a um poço vazio como um controle "apenas de células T" (200.000 células T). Este controle de "única célula T" permite o controle preciso dos dados de fluxo.
- Incubar a cocultura por 96 h (37 °C, 5% CO2)
5. Quantificação da proliferação de células T por citometria de fluxo (Dia 7)
NOTA: Tempo: 3h. Após incubar a co-cultura por mais 96 h, os poços são colhidos e corados por uma mistura de anticorpos contendo diferentes anticorpos, dependendo da hipótese de pesquisa (por exemplo, anticorpos anti-CD3, CD8, HLA-DR e CD25). Em seguida, as células são analisadas por citometria de fluxo multicolorida.
- Prepare e inscreva um lote de tubos FACS e tubos de microcentrífuga para cada poço a ser colhido.
- Colheita de células
- Ressuspenda as células em seu meio e transfira-as para os tubos FACS.
- Lave as células usando 100 μL de PBS e transfira-as para os tubos FACS.
- Adicione 100 μL de tripsina aos alvéolos e incube na placa de aquecimento (37 °C) por 5 min.
- Ressuspenda as células e, em seguida, controle microscopicamente se todas as células estiverem separadas. Em caso afirmativo, transfira a suspensão de células tripsinadas para os tubos FACS.
- Verifique microscopicamente se todos os poços estão vazios; caso contrário, repita as etapas 5.2.3 a 5.2.4.
- Coletando o sobrenadante da co-cultura para experimentos posteriores
- Centrifugue os tubos cheios de células a 300 x g por 5 min.
- Pipete cuidadosamente cerca de 300 μL do sobrenadante para fora dos tubos e para um lote diferente de tubos de microcentrífuga para serem congelados a -20 ° C. O sobrenadante pode ser usado posteriormente para realizar, por exemplo, ensaios ELISA para quantificar citocinas secretadas.
- Coloração das células com anticorpos para realizar citometria de fluxo
- Prepare a mistura de anticorpos: Adicione 5 μL de laranja anti-CD3-Krome, 0,5 μL de anti-CD8-PerCE-Cyp5.5, 1 μL de anti-HLA-DR-APCVio770, 2,5 μL de anti-CD25-PE-Dazzle a 91 μL de tampão PBS/FACS.
- Adicione 200 μL de tampão FACS (PBS suplementado com 2% de FBS e 2% de EDTA) a cada tubo e ressuspenda.
- Centrifugue novamente a 300 x g por 5 min. Rejeitar o sobrenadante e ressuspender as células em 100 μL da mistura de anticorpos previamente preparada (passo 5.4.1). Incube por 30-45 min a 4 °C na geladeira protegida da luz.
- Após a incubação, centrifugue a 300 x g por 5 min. Rejeitar o sobrenadante e ressuspender as células em 100 μL de tampão FACS.
- Realizar citometria de fluxo em um citômetro capaz de discriminar todos os anticorpos fluorescentes acima mencionados e o sinal do CSFE.
6. Estratégia de bloqueio e análise de dados
- Excluindo dupletos e identificando a população correta de células T (Figura 2A).
- Exclua a população de duplicatas com base em forward vs. área de dispersão lateral (FSC-A vs. SSC-A) (Singletes).
- Plote "Singlets" para identificação de células T com base em forward vs. área de dispersão lateral (FSC-A vs. SSC-A) (células T).
NOTA: Para melhor exclusão de tamanho, meça as amostras "Somente células T" e "Somente células tumorais" em paralelo (Figura 2B). - Plote a expressão de CD3 em relação ao SSC-A para discriminar as células T. Além disso, as células T CD8-positivas podem ser identificadas plotando o sinal CD8 contra o SSC-A. Todas as células T são CD3 + / CD8 + (células T CD8 +) (Figura 2A).
- Plote o sinal CFSE de todas as "células T CD8+" como um histograma.
NOTA: Gating da subpopulação não proliferativa (sinal CFSE mais alto), da subpopulação proliferativa (todas as células T com sinal CFSE reduzido) e da subpopulação altamente proliferativa (todas as células T do4º pico CFSE ou menos intensivo).
- Análise de marcadores de superfície associados à atividade na população de células T
- Siga as etapas de passagem (etapa 6.1) (Figura 3A).
- Opção A: Escolha as "células T CD8+" como entrada e analise-as quanto à sua expressão de CD25 ou HLA-DR, plotando a respectiva fluorescência do marcador de superfície em relação às características SSC-A.
NOTA: Se uma subpopulação distinta de CD25 alto for detectável, recomenda-se o bloqueio para a população de CD25 alto. O mesmo se aplica ao gating/análise de HLA-DR em células T (Figura 3B). - Opção B: Escolha as "células T CD8+" como entrada e analise-as quanto à sua expressão de CD25 ou HLA-DR, plotando a respectiva fluorescência do marcador de superfície em relação às características SSC-A.
NOTA: Se nenhuma subpopulação distinta for detectável (dependente do marcador de superfície analisado), recomenda-se a análise do deslocamento da intensidade média de fluorescência (MFI) de toda a população de células T (Figura 3C).

Figura 2: Estratégia de gating de células T pré-estimuladas e coradas com CFSE para análise da proliferação após 96 h de co-cultura com células tumorais de HNSCC pré-tratadas. As células T e as células tumorais são colhidas 96 h após a co-cultura de uma placa de 96 poços, coradas usando um marcador de superfície específico para células T e medidas usando um dispositivo de citometria de fluxo. (A) Os dupletos foram excluídos com base no FSC-A/FSC-H, e as células T foram fechadas primeiro pelo tamanho (FSC-A/SSC-A). As células T foram analisadas quanto à sua expressão de CD3 (anti-CD3 Krome Orange) e CD8 (anti-CD8 PerCP-Cy5.5). As células T CD3+/CD8+ foram plotadas em um histograma e a intensidade do sinal CFSE foi analisada. O sinal CFSE representa subgrupos de células T com comportamento de proliferação diverso. As células T com o sinal CFSE mais alto foram definidas como "não proliferativas". Todas as subpopulações que mostraram uma perda de sinal CFSE, causada pela divisão celular levando à redução pela metade do sinal, em picos distintos foram resumidas como "proliferativas". As células T que se dividiram mais de três vezes (mais de três picos de sinal de CFE) foram definidas como "altamente proliferativas". (B) Como controle, amostras consistindo apenas de células T pré-estimuladas e apenas células tumorais pré-tratadas são medidas adicionalmente. As células T e as células tumorais HSC4 podem ser discriminadas por tamanho usando FSC-A vs. Sinal SCC-A. Além disso, as células T CD8 + não estimuladas foram analisadas para verificar a ativação de células T com base no co-cultivo apenas com células tumorais alogênicas. (C) Como controle, foi incluída a incubação de células T coradas com CFSE não estimuladas por 96 h em paralelo à co-cultura. (D) Células T não estimuladas e coradas com CFSE foram co-cultivadas com células tumorais pré-tratadas. Após 96 h, as células foram colhidas e o sinal CFSE foi medido usando o procedimento padrão. As células T não estimuladas não apresentaram proliferação isoladamente ou após co-cultivo com células tumorais pré-tratadas. Clique aqui para ver uma versão maior desta figura.
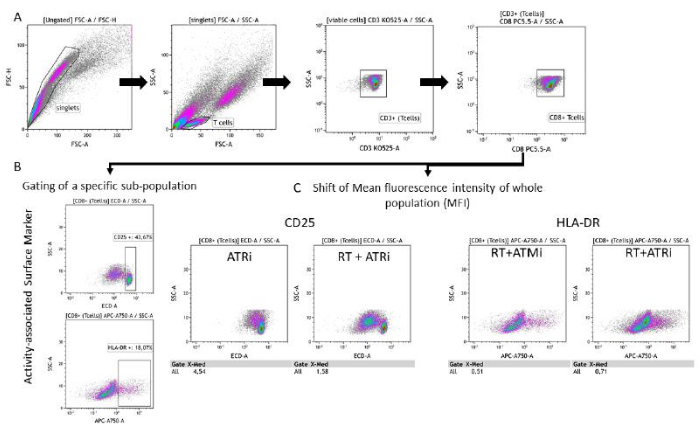
Figura 3: Estratégia de gating da expressão do marcador de superfície (CD25 e HLA-DR) associada à atividade das células T após 96 h de co-cultivo com células HNSCC pré-tratadas. (A) Os gibões foram excluídos com base em suas características FSC-A/FSC-H, e as células T foram fechadas primeiro por tamanho (FSC-A/SSC-A). As células T foram analisadas quanto à sua expressão de CD3 (anti-CD3 Krome Orange) e CD8 (anti-CD8 PerCP-Cy5.5). A ativação dos marcadores de atividade CD25 (anti-CD25 PEDazzle594) e HLA-DR (anti-HLA-DR APC-Vio770) na superfície da célula T pode ser realizada em duas configurações diferentes. (B) Gating de todas as células T CD8 + para a porcentagem de uma subpopulação específica de CD25alto ou HLA-DRalta com base em gráficos de densidade. (C) Alternativamente, a medição de um deslocamento MFI de toda a população de células T CD8 + é realizada para ambos os marcadores de atividade. Imagens representativas da análise da expressão do marcador de superfície de células T após co-cultivo com células tumorais HSC4 são mostradas. Clique aqui para ver uma versão maior desta figura.
Resultados
As células tumorais HSC4 derivadas de um CECP foram semeadas e incubadas durante a noite. Após 24 h, as células foram tratadas com um inibidor de quinase. Após 3 h, foram aplicadas as duas primeiras doses de 5 Gy por fração. Após 24 h, a segunda dose foi aplicada e as células foram novamente incubadas durante a noite. Paralelamente, 48 h antes do início da co-cultura, as células T foram isoladas do sangue de um doador saudável. Primeiro, os PBMCs foram isolados usando tubos de centrifugação com gradiente de densidade e um meio de separação estéril. As PBMCs foram contadas usando uma câmara de contagem de células e as células T CD8+ foram isoladas usando o kit de isolamento de células T CD8+. As células T CD8+ isoladas foram então coradas com CFSE (1 μM) e posteriormente contadas. As células T foram semeadas em placas de poços pré-revestidas CD3/CD28 com densidade de 1,5 x 106 células/3 mL. Após 48 h de estimulação, as células T foram colhidas, contadas e ressuspensas em uma densidade de 10.000 células/10 μL. Além disso, poços representativos das células tumorais semeadas foram colhidos e contados, e o meio foi trocado por todos os poços restantes. As células T foram adicionadas às células tumorais na proporção de 1:1. A co-cultura foi colhida após 96 h, o sobrenadante foi armazenado a -20 °C e as células foram coradas e medidas por citometria de fluxo (Figura 1).
As células T foram identificadas por exclusão de tamanho e positividade para CD3/CD8. O sinal CFSE de células CD3+/CD8+ positivas mostrou a distribuição de células T não proliferativas (alto sinal CFSE) e subpopulações distintas de células T proliferativas (perda da intensidade do sinal CFSE). A proporção de células T em proliferação foi exemplarmente medida para a linha celular HSC4 HNSCC (Figura 4A). Todas as células T que apresentaram pelo menos uma divisão foram definidas como "proliferativas". As células T que apresentaram mais de 3 divisões foram definidas como "altamente proliferativas" (Figura 4B). Para a linhagem celular HPV-negativa HSC4, um ligeiro aumento na taxa de proliferação foi detectado quando as células T foram co-cultivadas com células tumorais irradiadas. RT e RT mais inibição de ATR resultaram em um aumento significativo da proliferação consecutiva de células T quando comparadas a co-culturas de células HSC4 tratadas com inibição de ATM com células T. Em relação à fração "altamente proliferativa" de células T, o pré-tratamento de células HSC4 com RT mais inibição de ATR foi mais eficaz em estimular a proliferação de células T (Figura 4B).

Figura 4: Proliferação de células T coradas com CFSE para análises de alterações dependentes do tratamento HSC4 na proliferação de células T. (A) Proporção de células T em proliferação após 96h de co-cultura com células tumorais HSC4 negativas para HPV pré-tratadas. A proliferação de células T foi significativamente menor após a co-cultura com células tumorais HSC4 tratadas com RT + ATMi quando comparada ao tratamento com RT ou RT mais ATRi. (B) RT de células tumorais HSC4 induziu uma fração maior de células T altamente proliferantes (mais de três divisões celulares. Após a co-cultura de células tumorais HSC4 pré-tratadas com RT + ATRi com células T, a porcentagem de células T altamente proliferativas foi a mais alta. As barras mostram dados de quatro experimentos independentes com as células T de quatro doadores independentes e saudáveis (n = 4; Média ± DP). (*p≤ 0,05, **p≤ 0,01, ***p≤ 0,001, ****p≤ 0,0001; significância estatística testada comparando todas as condições experimentais com cada uma usando Mann-Whitney-U bicaudal para dados não normalmente distribuídos). Clique aqui para ver uma versão maior desta figura.
A perda de CFSE baseada em proliferação pode ser usada para quantificar a taxa de proliferação de células T. Além disso, vários marcadores de superfície celular são descritos como associados à atividade das células T, como CD25 e HLADR. Portanto, foi realizada análise de CD25 e HLA-DR na superfície de todas as células T CD3+ e CD8+ por citometria de fluxo (Figura 5). A expressão pode ser quantificada se subpopulações distintas de CD25alto ou HLA-DRalto forem detectáveis e puderem ser discriminadas por gating dessas células altamente positivas ( Figura 3B ). Se nenhuma subpopulação distinta for detectável, a intensidade média de fluorescência (MFI) de toda a população pode ser medida e os deslocamentos baseados na condição do MFI podem ser quantificados (Figura 3C).
Exemplarmente, a expressão identificada pelo MFI de CD25 e HLA-DR foi analisada após 96 h de co-cultura com células tumorais HSC4 pré-tratadas (Figura 5). Após a co-cultura de células T com células tumorais HSC4 tratadas com RT, a expressão de CD25 nas células T foi fortemente regulada negativamente. Notavelmente, o pré-tratamento das células tumorais apenas com ATMi resultou em uma expressão significativamente diminuída de CD25 quando comparado ao pré-tratamento com ATRi. No cenário combinado com RT, embora a RT tenha resultado em diminuição da expressão de CD25 nas células T, a combinação de RT com ATMi resultou em um aumento da expressão de CD25 quando comparada a RT mais ATRi (Figura 5A). Em relação à expressão de HLA-DR em células T, o RT geralmente levou à regulação positiva do HLA-DR, mas, novamente, em combinação com ATMi ou ATRi, um comportamento diferente foi observado (Figura 5B). As células T co-cultivadas com células HSC4 que foram pré-tratadas com uma combinação de RT+ATRi aumentaram a expressão de HLA-DR em comparação com RT sozinho ou RT+ATMi.

Figura 5: Expressão dos marcadores de ativação CD25 e HLA-DR na superfície das células T após 96 h de co-cultura com células tumorais HSC4 pré-tratadas. A expressão de CD25 e HLA-DR foi analisada com base no deslocamento do MFI de toda a população de células T. A RT de HSC4 resultou em uma diminuição da expressão de CD25 nas células T e um aumento da expressão de HLA-DR. A combinação de RT com ATMi resultou em padrões de expressão significativamente diferentes quando comparados a RT mais ATRi. Os boxplots mostram dados de quatro experimentos independentes com as células T de quatro doadores independentes e saudáveis (n = 4; Média ± DP). Os dados foram analisados comparando todas as condições experimentais entre si usando um teste bicaudal de Mann-Whitney-U para dados normalmente não distribuídos (*p≤ 0,050). Clique aqui para ver uma versão maior desta figura.
Esses dados indicam exemplarmente que o tratamento de células tumorais, neste caso de células HSC4 HNSCC, impacta a imunogenicidade das células tumorais. Isso pode ser monitorado pelo co-cultivo das células tumorais com células T pré-estimuladas, o que leva a um comportamento diversificado de proliferação e expressão de marcadores de ativação em células T humanas com base no regime de tratamento de células tumorais aplicado.
Discussão
O protocolo apresentado aqui oferece um método rápido e fácil para analisar a capacidade proliferativa das células T juntamente com seu status de ativação em um ambiente de co-cultura com células tumorais pré-tratadas. Assim, os efeitos de diferentes modalidades de tratamento, como RT, CT ou TT, na atividade e proliferação de células T podem ser facilmente rastreados, construindo a base para análises imunológicas subsequentes mais profundas de abordagens promissoras. Os resultados representativos mostrados neste manuscrito provam que este ensaio de co-cultura de células T alogênicas está tendo um bom desempenho. Diferenças significativas na proliferação de células T, bem como na atividade de células T, foram observadas para a co-cultura com células HSC4 humanas (HNSCC) pré-tratadas diferencialmente (Figura 4 e Figura 5). Verificou-se que o tratamento do HSC4 com RT isoladamente ou em combinação com TT resultou em um aumento da proliferação das células T, em particular no que diz respeito à fração altamente proliferativa das células T (Figura 4). De acordo com a quantificação da taxa de proliferação, o estado de ativação das células T também foi afetado diferencialmente pelos diferentes regimes de tratamento. Em resumo, a aplicação de RT resultou em uma forte regulação negativa da expressão de CD25 em células T, enquanto a expressão de HLA-DR foi regulada positivamente. A RT induz danos ao DNA nas células tumorais irradiadas, o que, por sua vez, leva a respostas de estresse celular que incluem a liberação de moléculas e citocinas associadas ao estresse e ao dano, bem como a expressão de ligantes da superfície celular imunomoduladores19.
A combinação de RT com TT na forma de inibidores de reparo de DNA está aumentando e mantendo ainda mais esses efeitos, pois as células tumorais não podem reparar com eficiência o dano ao DNA induzido por RT. Isso pode promover e manter ainda mais a secreção de fatores imunogênicos e a expressão de ligantes imunogênicos da superfície celular20. De acordo com isso, demonstramos anteriormente que o tratamento de células tumorais (CECP) com inibidores de danos ao DNA e RT altera o fenótipo imunológico na superfície da célula tumoral. A modulação do fenótipo imune incluiu a regulação da molécula imunoestimuladora ICOS-L, bem como da molécula imunossupressora PD-L111. Em resposta a essa modulação do fenótipo imunológico das células tumorais, as células T também podem regular a expressão de marcadores de ativação em sua superfície celular. Além disso, a RT é bem conhecida por estimular a liberação de citocinas pró-inflamatórias, como IFNγ ou IL-6, que por sua vez afetam a proliferação e a atividade das células T21. A expressão de marcadores de ativação em células T é um processo altamente dinâmico. Dados de Zimmerman et al.22 mostraram que o CD25 é altamente expresso 24 h após a estimulação, mas é regulado novamente após 96 h após a estimulação. Isso está de acordo com nossas descobertas. Em contraste, o HLA-DR é um marcador de ativação de fase tardia e geralmente é precedido por um aumento de CD25 e CD6923. Visivelmente, a combinação de RT + ATRi leva a uma regulação positiva significativa de HLA-DR em células T em comparação com RT + ATMi. Esse achado está de acordo com o trabalho de Dillion e col., que demonstraram efeitos sinérgicos de ATRi + RT na indução de um TME inflamatório24. Uma modulação menos pronunciada da atividade e proliferação das células T foi alcançada pelo tratamento com células tumorais apenas com os inibidores de quinase (Figura 5). Isso pode ser devido ao fato de que os inibidores de reparo de DNA ATMi e ATRi estão funcionando como um intensificador do dano ao DNA induzido por RT e, consequentemente, não são muito imunogênicos quando aplicados como monoterapia. Já demonstramos a toxicidade mínima de ATMi ou ATRi isolada11. Em resumo, os resultados confirmam o potencial imunogênico da RT (e TT com inibidores de danos ao DNA) e indicam ainda que este sistema experimental é adequado para rastrear as capacidades imunoestimulatórias de diferentes modalidades de tratamento em células de câncer de cabeça e pescoço humano.
Embora o método apresentado aqui seja fácil e robusto, existem algumas etapas críticas no protocolo que devem ser consideradas de antemão. A presença de altas concentrações de EDTA durante o processo de isolamento, bem como durante a análise por citometria de fluxo das células T, é necessária. Assim, recomenda-se a coleta do sangue do doador em tubos de coleta revestidos com EDTA e o uso de um tampão MACS suplementado com EDTA 10 mM para garantir o isolamento eficiente das células T e a geração de uma suspensão homogênea de célula única para a avaliação da citometria de fluxo. Além disso, a composição do meio de células T é de grande importância para a capacidade proliferativa das células T. Após testar diferentes composições de meios de cultura, um meio com baixas concentrações de L-arginina e L-lisina resulta no melhor sinal de proliferação de células T, pois a L-arginina é crítica para o metabolismo e sobrevivência das células T e deve ser fornecida em concentração adequada25,26. No entanto, deve-se ter em mente que as soluções de L-arginina e L-lisina não são estáveis a longo prazo e, portanto, precisam ser usadas dentro de 3 meses. Para uma estimulação ideal, o meio de células T suplementado com os aminoácidos precisa ser preparado recentemente para cada experimento de cultivo de células T. Além disso, o número de células das células T, bem como os das células tumorais, são fatores críticos que precisam ser considerados, pois afetam a leitura do experimento.
Para as células tumorais, por um lado, deseja-se uma confluência celular de 70% a 80% ao final do experimento de co-cultura. Um crescimento excessivo das células tumorais pode resultar na secreção de fatores que inibem o crescimento celular e, posteriormente, também afetariam a taxa de proliferação de células T. Como o crescimento das células tumorais é altamente dependente da linhagem celular individual, recomendamos testar minuciosamente o comportamento de crescimento da respectiva linhagem de células tumorais em diferentes placas de poços e para os diferentes regimes de tratamento. Além disso, as células tumorais e as células T devem ser co-cultivadas na proporção de 1:1. Portanto, é obrigatório semear um poço extra de células tumorais para cada condição de tratamento, que pode ser usado para a determinação da contagem de células no dia do início da co-cultura. Assim, pode-se garantir que um número adequado de células T será semeado para as diferentes condições de tratamento. Em relação ao número de células T, é necessário considerar que a quantidade de células T que podem ser isoladas de um doador saudável é muito individual. As células T representam cerca de 45% a 70% das PBMCs de um doador saudável27. Assim, a quantidade necessária de células T já deve ser amplamente estimada no momento da coleta de sangue. Além disso, a densidade de células T é importante para a eficiência da ativação das células T e sua sobrevivência. Consequentemente, as células T devem ser semeadas em uma concentração de pelo menos 1,5 milhão de células por poço de uma placa de 6 poços em 3 mL de meio de células T para a estimulação inicial antes do início da cocultura. Uma densidade de células T mais alta é possível, mas uma densidade mais baixa deve ser evitada. A ativação das células T também pode ser avaliada morfologicamente ao microscópio, pois as células T ativadas tendem a formar aglomerados de células.
Como este método é um sistema experimental simplificado para estudar as capacidades imunoestimulatórias de diferentes linhagens de células tumorais e modalidades de tratamento, ele apresenta algumas limitações que precisam ser levadas em consideração. Primeiro, este ensaio é baseado em um sistema alogênico, o que significa que as células T do doador não são compatíveis com o HLA com a respectiva linhagem de células tumorais. Assim, essa incompatibilidade HLA-descasamento já pode induzir a estimulação de células T e, posteriormente, a proliferação de células T sem estimulação adicional do tratamento com células tumorais28. Para quantificar esse efeito indesejado, células T isoladas foram co-cultivadas com a linhagem celular HSC4 sem estimulação prévia com anticorpos CD28 e CD3. Verificou-se que quase nenhuma proliferação foi induzida neste cenário, o que indica que a incompatibilidade HLA-mismatch tem apenas efeitos menores na ativação de células T neste ambiente experimental específico. Além disso, foram encontradas diferenças significativas na proliferação e ativação de células T com base no tratamento com células tumorais, apesar do cenário alogênico. No entanto, para o estabelecimento deste ensaio, a potencial proliferação alogênica induzida de células T deve ser testada e quantificada uma vez no início dos experimentos. Os controles recomendados de "apenas células T" e "apenas células tumorais" são necessários para gating suficiente e são obrigatórios em todas as replicações dos experimentos. No entanto, é preciso ter em mente que um sistema de co-cultura alogênico carece de reconhecimento de antígeno específico do tumor. Assim, esse sistema pode não refletir com precisão a resposta antitumoral específica, como ocorreria in vivo em pacientes29,30. Para melhorias adicionais, um ambiente mais sofisticado seria uma abordagem autóloga de co-cultura. Nesse cenário, biópsias tumorais derivadas de pacientes precisam ser cultivadas e trazidas para cultura com células T isoladas do sangue periférico do mesmo paciente28. Essa abordagem experimental, no entanto, pode ser desafiadora não apenas em termos de cultura de células tumorais primárias, mas também em termos de disponibilidade de biomaterial derivado do paciente. Uma outra limitação que precisa ser considerada é a proporção das células tumorais e das células T na co-cultura. Como a proporção recomendada das células é de 1:1, a relação não reflete a situação fisiológica do TME nos pacientes31. No entanto, essa limitação deve ser aceita, pois com contagens mais baixas de células T, as mudanças na taxa de proliferação e no status de ativação não são quantificáveis.
No campo da imunologia tumoral, este ensaio oferece a oportunidade de rastrear a imunogenicidade de diferentes modalidades de tratamento em um ambiente experimental in vitro fácil e rápido. Portanto, não apenas o tempo pode ser economizado pela pré-triagem das abordagens mais promissoras em termos de imunogenicidade, mas também por experimentos in vivo . Os modelos animais podem ser reduzidos, pois apenas esquemas de tratamento promissores podem ser prosseguidos em modelos animais para refletir o sistema imunológico como um todo em um organismo. Além disso, como este ensaio é baseado em células primárias humanas e linhagens de células cancerígenas humanas, os resultados podem ser mais traduzíveis para a clínica do que ensaios baseados em outros sistemas e espécies modelo.
No futuro, este ensaio pode ser modulado e adaptado para responder a questões de pesquisa mais específicas. Por exemplo, pode-se incluir um tratamento das células T para refletir um cenário de tratamento mais próximo da situação dos pacientes. Como as células T tumor-reativas são encontradas principalmente no TME, elas são igualmente afetadas por terapias locais, como RT, e provavelmente também são afetadas por terapias sistêmicas, como TC ou TT32. Um aprimoramento adicional do ensaio é o co-cultivo de células T com esferoides tumorais de linhagens de células tumorais ou mesmo o co-cultivo com organoides tumorais derivados de pacientes. Essas culturas tridimensionais são mais comparáveis à estrutura de um tumor em um paciente28. Finalmente, também a leitura do experimento via citometria de fluxo pode ser adaptada facilmente para investigar outras moléculas na superfície das células T ou analisando a expressão de moléculas de checkpoint imunológico nas células tumorais. Além da determinação do fenótipo imunológico das células T, pode-se usar os sobrenadantes de cultura de células dos experimentos de co-cultura para a quantificação de citocinas ou quimiocinas secretadas para obter mais informações sobre a atividade das células T. Em resumo, este protocolo oferece um ensaio de co-cultura abrangente, robusto e fácil de células T e células tumorais que permite a triagem da imunogenicidade de diferentes modalidades de tratamento do câncer. Como este ensaio é adaptável a questões específicas de pesquisa, ele é adequado para aplicação no amplo campo da imunologia tumoral.
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Esta pesquisa foi parcialmente financiada pelo Centro Interdisciplinar de Pesquisa Clínica de Erlangen (IZKF Erlangen) e pelo Bayerisches Zentrum für Krebsforschung (BZKF).
Materiais
| Name | Company | Catalog Number | Comments |
| 15 mL Cellstar tubes | Greiner Bio-One GmbH | 188271 | |
| 50 mL Cellstar tubes | Greiner Bio-One GmbH | 227261 | |
| 6 well cell culture plate sterile, with lid | Greiner Bio-One GmbH | 657160 | |
| 96 well cell culture plate sterile, F-bottom, with lid | Greiner Bio-One GmbH | 655180 | |
| AZD0156 | Selleck Chemicals GmbH | S8375 | |
| Berzosertib (VE-822) | Selleck Chemicals GmbH | S7102 | |
| CASYcups | OMNI Life Science GmbH & Co KG | 5651794 | |
| CASYton | OMNI Life Science GmbH & Co KG | 5651808 | |
| CD25a, PE-Dazzle594, Mouse IgG1 | Biolegend | 356126 | |
| CD28-UNLB | Beckmann Coulter, Inc. | IM1376 | |
| CD3a,Krome Orange, Mouse IgG1 | Beckmann Coulter, Inc. | B00068 | |
| CD3e Monoclonal Antibody | Thermo-Fisher Scientific, Inc. | MA1-10176 | |
| CD4, APC, Mouse Anti-Human Mouse IgG1 | BD Pharmingen | 555349 | |
| CD8 MicroBeads, human | Miltenyi Biotec, Inc. | 130-045-201 | |
| CD8a, PerCP-Cy5.5, Mouse IgG1 | Biolegend | 300924 | |
| CellTracker Deep Red Dye | Thermo Fisher Scientific, Inc. | C34565 | |
| CFSE | Merck KGaA (Sigma-Aldrich) | 21888 | |
| DMEM (Dulbecco´s Modified Eagle´s Medium) | PAN-Biotech GmbH | P04-02500 | |
| DxFlex Flow Cytometer (with Auto Loader) | Beckmann Coulter, Inc. | C44326, C02846 | |
| EDTA disodium salt dihydrate | Carl Roth GmbH + Co. KG | 8043.2 | |
| FBS superior | Merck KGaA (Sigma-Aldrich) | S0615-500ML | |
| FBS superior | Merck KGaA (Sigma-Aldrich) | S0615-100ML | For production of heat-inactivated FBS. Heat up for 30 min at 56 °C with mixing to inactivate complement proteins. |
| Graph Pad Prism (version number 9) | GraphPad Software | - | |
| HLA-DR, DP, DQ Antibody, anti-human, APC-Vio770 | Miltenyi Biotec, Inc. | 130-123-550 | |
| Kaluza (version number 2.1) | Beckmann Coulter, Inc. | - | |
| L-Arginin | Merck KGaA (Sigma-Aldrich) | A8094-25G | |
| L-Lysin-monohydrochloride | Merck KGaA (Sigma-Aldrich) | L5626-100G | |
| MACS BSA Stock Solution | Miltenyi Biotec, Inc. | 130-091-376 | |
| MS Columns | Miltenyi Biotec, Inc. | 130-042-201 | |
| Neubauer-improved counting chamber | Paul Marienfeld GmbH & Co. KG | 640010 | |
| PBS | Merck KGaA (Sigma-Aldrich) | D8537-500mL | |
| Penicillin-Streptomycin | Thermo-Fisher Scientific, Inc. | 1514-122 | |
| ROTISep 1077 | Carl Roth GmbH + Co. KG | 0642.2 | |
| RPMI-1640 Medium | Merck KGaA (Sigma-Aldrich) | R1790 | |
| SepMate 50mL tubes | Stemcell Technologies | 85450 | |
| Trypan blue | Merck KGaA (Sigma-Aldrich) | T6146-25G | |
| Trypsin | Thermo-Fisher Scientific, Inc. | 15400054 |
Referências
- Hiam-Galvez, K. J., Allen, B. M., Spitzer, M. H. Systemic immunity in cancer. Nat Rev Cancer. 21 (6), 345-359 (2021).
- Mantovani, A., Allavena, P., Marchesi, F., Garlanda, C. Macrophages as tools and targets in cancer therapy. Nat Rev Drug Discov. 21 (11), 799-820 (2022).
- Waldman, A. D., Fritz, J. M., Lenardo, M. J. A guide to cancer immunotherapy: From t cell basic science to clinical practice. Nat Rev Immunol. 20 (11), 651-668 (2020).
- Dunn, G. P., Old, L. J., Schreiber, R. D. The immunobiology of cancer immunosurveillance and immunoediting. Immunity. 21 (2), 137-148 (2004).
- Mittal, D., Gubin, M. M., Schreiber, R. D., Smyth, M. J. New insights into cancer immunoediting and its three component phases--elimination, equilibrium and escape. Curr Opin Immunol. 27, 6-25 (2014).
- Irianto, T., Gaipl, U. S., Ruckert, M. Immune modulation during anti-cancer radio(immuno)therapy. Int Rev Cell Mol Biol. 382, 239-277 (2024).
- Burtness, B., et al. Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (keynote-048): A randomized, open-label, phase 3 study. Lancet. 394 (10212), 1915-1928 (2019).
- Hecht, M., et al. Safety and efficacy of single cycle induction treatment with cisplatin/docetaxel/ durvalumab/tremelimumab in locally advanced HNSCC: First results of checkered-CD8. J Immunother Cancer. 8 (2), e001378 (2020).
- Chen, J. A., Ma, W., Yuan, J., Li, T. Translational biomarkers and rationale strategies to overcome resistance to immune checkpoint inhibitors in solid tumors. Cancer Treat Res. 180, 251-279 (2020).
- Solomon, B., Young, R. J., Rischin, D. Head and neck squamous cell carcinoma: Genomics and emerging biomarkers for immunomodulatory cancer treatments. Semin Cancer Biol. 52 (Pt 2), 228-240 (2018).
- Meidenbauer, J., et al. Inhibition of atm or atr in combination with hypo-fractionated radiotherapy leads to a different immunophenotype on transcript and protein level in HNSCC. Front Oncol. 14, 1460150 (2024).
- Kumari, S., et al. Immunomodulatory effects of radiotherapy. Int J Mol Sci. 21 (21), 8151 (2020).
- Wimmer, S., et al. Hypofractionated radiotherapy upregulates several immune checkpoint molecules in head and neck squamous cell carcinoma cells independently of the HPV status while icos-l is upregulated only on HPV-positive cells. Int J Mol Sci. 22 (17), 9114 (2021).
- Derer, A., et al. Chemoradiation increases pd-l1 expression in certain melanoma and glioblastoma cells. Front Immunol. 7, 610 (2016).
- Schatz, J., et al. Normofractionated irradiation and not temozolomide modulates the immunogenic and oncogenic phenotype of human glioblastoma cell lines. Strahlenther Onkol. 199 (12), 1140-1151 (2023).
- Xu, M. M., Pu, Y., Zhang, Y., Fu, Y. X. The role of adaptive immunity in the efficacy of targeted cancer therapies. Trends Immunol. 37 (2), 141-153 (2016).
- Olivo Pimentel, V., Yaromina, A., Marcus, D., Dubois, L. J., Lambin, P. A novel co-culture assay to assess anti-tumor cd8(+) t cell cytotoxicity via luminescence and multicolor flow cytometry. J Immunol Methods. 487, 112899 (2020).
- Kulp, M., Diehl, L., Bonig, H., Marschalek, R. Co-culture of primary human t cells with leukemia cells to measure regulatory t cell expansion. STAR Protoc. 3 (3), 101661 (2022).
- Ruckert, M., et al. Immune modulatory effects of radiotherapy as basis for well-reasoned radioimmunotherapies. Strahlenther Onkol. 194 (6), 509-519 (2018).
- Samstein, R. M., Riaz, N. The DNA damage response in immunotherapy and radiation. Adv Radiat Oncol. 3 (4), 527-533 (2018).
- Meeren, A. V., Bertho, J. M., Vandamme, M., Gaugler, M. H. Ionizing radiation enhances il-6 and il-8 production by human endothelial cells. Mediators Inflamm. 6 (3), 185-193 (1997).
- Zimmerman, M., et al. Ifn-gamma upregulates survivin and ifi202 expression to induce survival and proliferation of tumor-specific T cells. PLoS One. 5 (11), e14076 (2010).
- Saraiva, D. P., et al. Expression of HLA-dr in cytotoxic t lymphocytes: A validated predictive biomarker and a potential therapeutic strategy in breast cancer. Cancers (Basel). 13 (15), (2021).
- Dillon, M. T., et al. Atr inhibition potentiates the radiation-induced inflammatory tumor microenvironment. Clin Cancer Res. 25 (11), 3392-3403 (2019).
- Geiger, R., et al. L-Arginine modulates T cell metabolism and enhances survival and anti-tumor activity. Cell. 167 (3), 829-842.e13 (2016).
- Rodriguez, P. C., Quiceno, D. G., Ochoa, A. C. L-Arginine availability regulates t-lymphocyte cell-cycle progression. Blood. 109 (4), 1568-1573 (2007).
- Lozano-Ojalvo, D., López-Fandiño, R., López-Expósito, I., Verhoeckx, K. . The impact of food bioactives on health: In vitro and ex vivo models. , 169-180 (2015).
- Gronholm, M., et al. Patient-derived organoids for precision cancer immunotherapy. Cancer Res. 81 (12), 3149-3155 (2021).
- Perez, C., Gruber, I., Arber, C. Off-the-shelf allogeneic t cell therapies for cancer: Opportunities and challenges using naturally occurring "universal" donor t cells. Front Immunol. 11, 583716 (2020).
- Martinez Bedoya, D., Dutoit, D., Migliorini, D. Allogeneic car t cells: An alternative to overcome challenges of car t cell therapy in glioblastoma. Front Immunol. 12, 640082 (2021).
- Schnellhardt, S., et al. The prognostic value of FOXP3+ tumor-infiltrating lymphocytes in rectal cancer depends on immune phenotypes defined by CD8+ cytotoxic T cell density. Front Immunol. 13, 781222 (2022).
- Wang, W., Green, M., Rebecca Liu, J., Lawrence, T. S., Zou, W., Zitvogel, L., Kroemer, G. . Oncoimmunology: A practical guide for cancer immunotherapy. , 23-39 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados