Method Article
在预处理肿瘤细胞的同种异体共培养环境中分析人 T 细胞活性
摘要
本方案描述了一种实验工作流程,该工作流程允许在同种异体共培养系统中与预处理的肿瘤细胞对人 T 细胞刺激进行 离体 分析。
摘要
细胞毒性 T 细胞在消除肿瘤细胞中起关键作用,因此在癌症免疫学中受到深入研究。肿瘤内细胞毒性 T 细胞的频率和活性及其肿瘤微环境 (TME) 现在是多种肿瘤类型的公认预后和预测生物标志物。然而,众所周知,各种肿瘤治疗方式,包括放疗、化疗、免疫疗法和靶向治疗,不仅调节肿瘤的免疫原性,还调节免疫系统本身。因此,肿瘤细胞和 T 细胞之间的相互作用需要在不同的治疗环境中进行更深入的研究,以充分了解 T 细胞在肿瘤治疗过程中的复杂作用。为了满足这一需求,开发了一种方案来分析人细胞毒性 (CD8+) T 细胞与预处理的肿瘤细胞共培养的活性和增殖能力。具体来说,来自健康供体的 CD8 + T 细胞用无毒增殖标志物羧基荧光素二乙酸琥珀酰亚胺酯 (CFSE) 染色,并使用 CD3/CD28 包被板刺激。随后,将 T 细胞与预先处理的肿瘤细胞共培养。作为读数,通过测量 CFSE 信号分布 并通过流式 细胞术评估表面活化标志物的表达来量化 T 细胞增殖。这可以通过使用酶联免疫吸附测定 (ELISA) 定量细胞因子的释放来进一步补充。该方法有助于评估治疗诱导的肿瘤细胞和 T 细胞之间相互作用的变化,为更详细地分析人类 离体 环境中的肿瘤治疗方式及其免疫原性奠定了基础。此外,它还有助于减少临床前 体内 分析。
引言
如今,越来越明显的是,肿瘤的生长和进展在很大程度上取决于对宿主免疫系统的有效纵和抑制。转化的细胞每天都会出现,即使在健康的生物体中也是如此。然而,肉眼可见肿瘤的形成是一个相当罕见的事件,因为新出现的转化细胞被高效地从生物体中去除。为了去除恶性细胞,不同的免疫细胞类型,如细胞毒性 T 细胞、自然杀伤 (NK)T 细胞、NK 细胞或巨噬细胞开始发挥作用 1,2,3。尽管如此,有时可能会出现转化的细胞克隆,它们在与宿主免疫系统的平衡状态下存活,其特征是肿瘤细胞克隆4 的免疫抑制策略不同。最终,一些转化的细胞获得进一步的功能,使肿瘤细胞能够主动抑制免疫反应,从而导致肿瘤的生长。这种免疫抑制是由多种机制介导的,包括免疫抑制配体在肿瘤细胞上的表达或免疫调节或免疫抑制免疫细胞群的主动募集或启动。这种所谓的免疫编辑概念证明了免疫调节在肿瘤形成和生长过程中的关键作用5。
因此,免疫系统如今不仅是癌症治疗的主要焦点,而且是许多肿瘤实体和治疗环境中的预测和预后因素,这并不奇怪。在过去的几年里,免疫检查点抑制剂 (ICI) 在头颈部鳞状细胞癌 (HNSCC) 或非小细胞肺癌 (NSCLC) 等不同的实体癌实体中成为有前途的治疗选择,目的是调节肿瘤微环境 (TME),以实现更有效的抗肿瘤免疫反应和减少肿瘤细胞的免疫抑制6.免疫检查点抑制剂旨在通过靶向免疫检查点分子,例如程序性死亡蛋白 1 (PD-1) 及其配体 1 (PD1/PD-L1) 轴的分子,来促进 T 细胞介导的肿瘤细胞杀伤。这一事实强调了 T 细胞在抗肿瘤免疫中的关键作用。例如,在 HNSCC 中,ICI 已成功获批作为复发和转移性 HNSCC 的一线治疗7。与此一致,TME 中细胞毒性 T 细胞的存在,以及相应的肿瘤细胞和 T 细胞上 PD1 和 PD-L1 的表达,可以作为 HNSCC 的预测生物标志物 8,9,10。
尽管 T 细胞在肿瘤免疫学和肿瘤治疗中起着至关重要的作用,但关于它们与肿瘤相互作用的许多悬而未决的问题仍需要解决。如今,众所周知,肿瘤免疫反应是一个动态过程,肿瘤的免疫原性可以在整个疾病和治疗过程中发生变化。化疗 (CT)、放疗 (RT) 或靶向治疗 (TT) 等不同的治疗方式尤其广泛地知道可以调节肿瘤细胞的免疫表型。RT 可以驱动肿瘤组织中免疫检查点分子的上调,并改变肿瘤浸润细胞的频率11,12。另一方面,TT 还可以通过直接调节适应性免疫反应来支持肿瘤和 TME 内的有利变化 13,14,15,16。然而,在患者中研究这些调节具有挑战性,因为这需要在治疗过程中重复检查肿瘤组织。因此,需要结论性的实验模型系统来研究肿瘤细胞和 T 细胞的动态免疫表型,更重要的是,它们的相互作用。
因此,为了分析 T 细胞活性以及肿瘤细胞和 T 细胞的相互作用,需要一种全面的 离体 共培养测定,该测定基于简单的细胞培养工作和常用的流式细胞术分析,在任何实验室中都易于实施。根据现有和可用的文献,到目前为止,尚未发表关于 T 细胞和肿瘤细胞共培养的易于使用和常用的方案。尽管最近已经发表了几种 T 细胞和肿瘤类器官的共培养检测方法,但 3D 细胞培养技术如今仍未作为每个实验室的标准技术实施。因此,我们提供了一种用于 2D 细胞培养的方案,该方案也可能为将来的 3D 细胞培养建立。其他 2D 共培养方案通常更复杂,因为它们需要用荧光素酶17 转导肿瘤细胞,或者仅适用于血液系统恶性肿瘤(不匹配的 T 细胞与白血病细胞的共培养)18。在此处描述的检测中,从外周血中分离来自正常健康供体的 T 细胞,并用抗 CD3 和抗 CD28 抗体刺激。随后,将 T 细胞与(预)处理的肿瘤细胞共培养,以便 通过 流式细胞术分析 T 细胞的增殖能力及其活性。因此,不同治疗方式对肿瘤细胞免疫表型的影响,如 RT、CT 或 TT,进而影响 T 细胞活性和增殖,可以很容易地筛选并用作更深入的机制分析和连续选择的临床前 体内 分析的基础。此处描述的分析提供了一种易于使用的设置,因为不需要非常规的设备、技术或材料。此外,该检测试剂盒可轻松适应不同的肿瘤细胞系或特异性 T 细胞亚群(例如 CD4+ T 细胞)。使用这种技术,可以实现高度标准化和可重复性。
研究方案
该检测涉及采血和人原代细胞的培养。因此,这些分析必须进行道德投票。本手稿中介绍的所有结果均包含在 IMMO-NHD 试验的伦理批准范围内,并且已获得所有捐献者的书面知情同意书。2022 年 11 月 9 日,弗里德里希-亚历山大-埃尔朗根-纽伦堡大学机构审查委员会批准了该申请(申请编号 21-415-B)。本研究中使用的 HSC4 肿瘤细胞来自市售细胞系。
该测定法举例说明了 T 细胞和肿瘤细胞共培养测定法的所有步骤,在涉及放疗 (RT) 和两种特异性激酶抑制剂的治疗环境中使用人头颈部鳞状细胞癌 (HNSCC) 细胞系 HSC4。因此,细胞数量、胰蛋白酶消化时间和治疗方案等参数是特定于这种共培养环境的,应适用于其他肿瘤细胞系(另见讨论部分)。所有离心步骤均在室温下进行。在本研究中,激酶抑制剂 AZD0156 和 VE-822 用于靶向 HSC4 细胞的 DNA 损伤修复 (DDR) 系统。AZD0156 (Selleckchem) 抑制共济失调毛细血管扩张症突变 (ATM) 蛋白,而 VE-822 (Selleckchem) 靶向共济失调毛细血管扩张症和 Rad3 相关 (ATR) 蛋白。这两种抑制剂都已被讨论为增加肿瘤细胞放射敏感性的潜在药物。将它们溶解在二甲基亚砜 (DMSO) 中并储存在 -20 °C。 图 1 提供了 离体 测定的流程图,详细说明了预处理的肿瘤细胞与 CD3/CD28 刺激的人 CD8 + T 细胞的共培养。使用的试剂和设备列在 材料表中。

图 1:与 (CD3/CD28) 刺激的人 CD8+ T 细胞共培养的预处理肿瘤细胞的 离体 测定流程图。 第 1 天:HSC4 肿瘤细胞接种。第 2 天:处理肿瘤细胞并分离、CFSE 染色和接种到人 CD8+ T 细胞的 CD3/CD28 包被板中。第 3 天:治疗肿瘤细胞。第 4 天:计数肿瘤细胞的代表性孔。收获和计数所有 T 细胞。T 细胞和 HSC4 肿瘤细胞以 1:1 的比例共培养。第 5 天-第 8 天:共培养孵育。第 8 天:收获共培养物、冷冻上清液、基于抗体的染色和通过流式细胞术分析细胞。 请单击此处查看此图的较大版本。
1. 肿瘤细胞接种(第 1 天)
注:计时:1 小时。将人 HSC4 肿瘤细胞从 T75 细胞培养瓶接种到 96 孔板中。
- 丢弃细胞培养瓶的上清液(D10 培养基)。
- 用 5 mL 的 37 °C 温 PBS 洗涤肿瘤细胞。丢弃 PBS。
- 由于 HSC4 肿瘤细胞往往紧密粘附在细胞培养瓶上,因此建议进行两步胰蛋白酶消化以确保所有细胞都分离。为此,加入 3 mL 胰蛋白酶,将瓶子放在 37 °C 的加热板上 3 分钟,然后用移液管丢弃胰蛋白酶。
- 再加入 3 mL 胰蛋白酶,将瓶子放在加热板上,等待获得单细胞悬液。显微镜检查单细胞悬液。
- 通过添加双倍体积的 D10 培养基(补充有 10% 胎牛血清和 1% 青霉素-链霉素的 DMEM)来终止胰蛋白酶,彻底重悬,并将细胞转移到 50 mL 离心管中。
- 确定单细胞悬液的细胞数,然后根据总体积计算肿瘤细胞的总量。建议使用 Neubauer 细胞室来确定细胞计数。
- 在室温下以 300 x g 离心含有肿瘤细胞的 50 mL 离心管 5 分钟。丢弃上清液。
- 将 HSC4 肿瘤细胞重悬于适当体积的 D10 培养基中,使其在 200 μL 培养基中达到 15,000 个细胞的浓度。
- 根据肿瘤细胞的计划处理,在两个 96 孔板(1x 样品,1x 肿瘤细胞仅对照,1x 细胞计数孔)中,为每种条件接种至少 3 个孔,在 200 μL 培养基中含有 15,000 个 HSC4 肿瘤细胞。
注:细胞数量取决于细胞系和倍增时间。需要在预实验中检查用于不同处理的细胞数量,以避免在孵育过程中 100% 汇合。 - 将细胞在 37 °C、5% CO2 和饱和湿度下孵育 24 小时。
2. 肿瘤细胞的治疗(第 2 天)
注意:时间:3-5 小时。孵育 24 小时后,可以根据所需的处理方案处理先前接种的 HSC4 细胞。在这个示例案例中,肿瘤细胞用 ATM 或 ATR 抑制剂处理。在此,此外,两个 96 孔板中的一个随后也用 2x 5 Gy 照射。
- 制备激酶抑制剂以获得浓度为 1 μM AZD0156(ATM 抑制剂)和 0.1 μM VE-822(ATR 抑制剂)以处理肿瘤细胞。
- 相应地处理肿瘤细胞,例如,在每个板中用 3.1 μL 的 ATM 抑制剂处理一排样品,用 3.1 μL 的 ATR 抑制剂处理第二排样品。
- 在 37 °C 下孵育 3-5 小时后,用 5 Gy 照射一个板。
- 再孵育 24 小时后,再次用 5 Gy 照射同一板。
3. T 细胞分离(第 2 天)
注:时间:4 小时。对来自健康成人供体的外周血 (PB) 进行密度梯度离心后,用来自 PBMC 的抗 CD8 微珠磁性分离 CD8 + T 细胞。然后用 CFSE 对分离的 T 细胞进行染色,并在 CD3/CD28 包被的孔板中孵育以进行刺激。为了能够在后续步骤中节省资源和材料,估计共培养实验所需的 T 细胞数量非常重要。根据供体的不同,可以从大约 45 ml 的 EDTA 血液中分离出 50,000,000 到 100,000,000 个 PBMC。大约 10% 的总 PBMC 是 CD8+ T 细胞。
- 密度梯度离心
- 将来自健康供体的 3-5 根 9 mL EDTA 血管转移到两支 50 mL 离心管中。
- 用 PBS + 2% FBS 将两个离心管填充至 50 mL。
- 准备六根离心管(带有用于分离 PBMC 的塑料嵌体),并用 15 mL + 4 °C 冷密度梯度培养基填充每根离心管。
- 小心地将密度梯度培养基与步骤 3.1.2 中的 12-15 mL 稀释血液叠加。
- 以 1200 x g 离心 10 分钟(无需减速)。
- 制备用于 T 细胞刺激的 6 孔板
- 制备抗体:用 PBS 制备 1 mg/mL 的抗 CD3(克隆 OKT3)溶液。用 PBS 制备 0.1 mg/mL 的抗 CD28(克隆 28.2)溶液。
- 建议:利用离心过程中的时间(步骤 3.1.5)制备包被溶液,并利用孔本身的包被来刺激 T 细胞。
- 将 5 μL CD3 抗体溶液与 4.995 μL PBS 混合,将 50 μL CD28 抗体溶液与 4.950 μL PBS 混合(终浓度:1 μg/μL)。
- 向 6 孔板的每个孔中加入 1.000 μL 两种抗体溶液。
- 根据 T 细胞的预期量,涂覆 6 孔板的 2 或 3 个孔,并在 37 °C 下孵育至少 2 小时。
- T 细胞培养基的制备
注:100x L-赖氨酸的制备:将 200 mg L-赖氨酸盐酸盐溶于 50 mL 离心管中的 50 mL 蒸馏水中。使用 0.2 μm 注射器过滤器对溶液进行灭菌,并使用 50 mL 灌注注射器将其转移到新的 50 mL 试管中。将溶液储存在 4-8 °C 并在 3 个月内使用。15 mM L-精氨酸的制备:将 26 mg L-精氨酸溶解在 10 mL DPBS 中。使用 0.2 μm 注射器过滤器对溶液进行灭菌,并使用 10 mL 注射器将其转移到新管中。将溶液储存在 4-8 °C 并在 3 个月内使用。- 使用步骤 1.5 中提到的离心时间制备 T 细胞培养基。
- 准备大约 10-30 mL 的 T 细胞培养基,具体取决于预期的 T 细胞量。
- 将不含 L-精氨酸和 L-赖氨酸的 RPMI 培养基与 10% 热灭活的 FBS、1% 青霉素-链霉素、1% L-精氨酸、1% L-赖氨酸和 1% L-谷氨酰胺混合。示例:25.8 mL RPMI 培养基 + 3 mL FBS + 0.3 mL Pen/Strep + 0.3 mL L-精氨酸蛋白 + 0.3 mL L-溶血素 + 0.3 mL L-谷氨酰胺。
- 将剩余的培养基在 4 °C 下储存接下来两天,以便在第 4 天 - 共培养开始时使用。对于整个实验的每次新运行,建议制备新鲜的培养基。
- PBMC 分离
- 离心后(步骤 3.1.5),将上清液转移到四个新的 50 mL 离心管中,并丢弃用过的试管。
- 用 PBS + 2% FBS 填充离心管至 50 mL。
- 在室温下以 300 x g 离心 8 分钟。
- 弃去上清液,将细胞沉淀重悬于 1 mL PBS + 2% FBS 中,并将它们合并到两个离心管中。
- 用 PBS + 2% FCS 将试管重新填充至 50 mL。
- 在室温下以 120 x g 离心 10 分钟。
- 弃去上清液,小心地将细胞沉淀重悬于 1 mL PBS +2% FBS 中,然后将两个沉淀合并成一个猎鹰。
- 将离心管填充至 50 mL,加入 PBS + 2% FBS。
- 使用 Neubauer 计数室计算 PBMC 的总数。建议:用台盼蓝以 1:10 的比例稀释细胞悬液进行计数。
- CD8+ T 细胞的分离
注:根据制造商的方案,将人 CD8 微珠与磁性分离 (MS) 柱和磁性激活细胞分选加 (MACS+) 缓冲液一起使用,以磁性分离 CD8+ T 细胞(参见 材料表)。- 将 PBMC(细胞计数后)以 300 x g 离心 10 分钟。
- 弃去上清液,将细胞沉淀重悬于每 107 个细胞 80 μL MACS+ 缓冲液(500 mL PBS 补充有 10 mM EDTA 和 0.5% BSA)中(例如,将 60,000,000 个 PBMC 重悬于 6 x 80 μL = 480 μL 缓冲液中)。
注:示例:465 mL PBS + 10 mL (0.5 M) EDTA 和 25 mL BSA 储备液。 - 每 107 个细胞添加 20 μL CD8 微珠,并通过上下吹打小心混合。在 4 °C 下孵育 15 分钟。
- 孵育后,每 107 个细胞添加 2 mL MACS+ 缓冲液洗涤细胞。
- 在室温下以 300 x g 离心 10 分钟。弃去上清液,将细胞重悬于 1,000 μL MACS+ 缓冲液中。
- 在磁力架中放置两根 MS 色谱柱,并在下方放置两根 15 mL 离心管。
- 用 500 μL MACS + 缓冲液制备色谱柱。缓冲液流经色谱柱,可以收集在下面的离心管中。此步骤也可以与步骤 3.5.6 并行完成。
- 然后,将细胞悬液均匀地移液到制备的 MS 柱中。流通液可以收集在相同的离心管中。它现在包含所有未标记的 CD8 阴性细胞。
- 通过添加 3x 500 μL MACS+ 缓冲液来冲洗色谱柱。只有在色谱柱干涸或停止滴落后,才在色谱柱顶部添加新的缓冲液。
- 将最终收集的细胞标记为“流通”或“CD8 阴性”,并将它们合并到一个离心管中。这稍后可用于 通过 流式细胞术测量分离物的纯度。
- 取标有“CD8+ T 细胞”的新 15 mL 离心管。将色谱柱从磁力架上取下并放置在离心管上。
- 用 1,000 μL MACS+ 缓冲液冲洗含有磁性标记的 CD8 阳性 T 细胞的两根色谱柱。因此,将缓冲液移液到色谱柱中,并立即开始使用制造商提供的柱塞小心地将溶液推出色谱柱。
注:对两根色谱柱执行此作,在离心中收集 2 mL T 细胞总悬浮液。 - 使用 Neubauer 计数室计数 T 细胞的总数。建议:使用台盼蓝的 1:4 稀释液。
- 用 CFSE 对 T 细胞进行染色
- 将分离的 T 细胞以 300 x g 离心 5 分钟。
- 在离心过程中,通过将 1.1 μL CFSE 溶液与 10 mL PBS 混合来制备 CFSE 染色溶液。最终浓度需要为 1 μM。
- 弃去上清液,将细胞沉淀重悬于 1,000 μL PBS 中。以 300 x g 离心 5 分钟。
- 弃去上清液,将细胞沉淀重悬于 2000 μL CFSE 染色溶液 (1 μM) 中。在 37 °C 下孵育 20 分钟。
- 将染色的细胞以 300 x g 离心 5 分钟。弃去上清液,将细胞沉淀重悬于 1,000 μL PBS 中。
- 以 300 x g 离心 5 分钟。弃去上清液,将细胞沉淀重悬于适量的 T 细胞培养基中,使其在约 3-4 mL T 细胞培养基中达到 1.5-2 x 106 T 细胞的浓度。
- 将 T 细胞接种到 6 孔板中
- 丢弃 6 孔板中的涂层溶液。
- 每孔在 3-4 mL T 细胞培养基中接种 1.5-200 万个分离和染色的 T 细胞。
- 将 T 细胞在 37 °C 和 5% CO2 下孵育接下来的 48 小时
注意:将接种密度始终调整为 1.5 Mio 细胞/3 mL。避免以较低密度接种 T 细胞。可以达到更高的密度,但需要进行测试。
4. 共培养开始(第 4 天)
注意:计时:2 小时。在确定 HSC4 肿瘤细胞的细胞计数后,将 T 细胞以 1:1 的比例添加到 96 孔板中。
- 每个条件收获一个孔以确定代表性细胞计数
- 丢弃用于测定细胞计数的示例接种孔的上清液。
- 首先,用 100 μL PBS 洗涤细胞,然后丢弃 PBS。
- 加入 100 μL 胰蛋白酶,在加热板上孵育 5 分钟。然后重悬并在显微镜下检查单细胞悬液;如果细胞没有分离,则再添加 50 μL 胰蛋白酶。
- 一旦所有细胞都分离,立即加入 100 μL(如果之前额外添加了 50 μL 胰蛋白酶,则为 150 μL)的 D10 培养基并重悬,以终止胰蛋白酶反应。
- 将 200 μL 的全部体积从孔中转移到 1.5 mL 样品管中,并使用 100 μL 测量细胞计数。请记住根据样品体积调整测得的细胞数。
- 用无毒荧光细胞示踪染料对 HSC4 肿瘤细胞进行染色
- 通过将 2 μL 溶解在 20 mL PBS(根据制造商的终浓度为 0.1 μM)中来制备细胞追踪器(参见 材料表)。
- 从所有含有肿瘤细胞的孔中吸取 D10 培养基并将其丢弃。
- 向肿瘤细胞孔中加入 200 μL 细胞追踪剂溶液。在 37 °C 下孵育 20 分钟。
- 孵育后,弃去染色溶液并加入 100 μL PBS 洗涤。随后,也丢弃 PBS。
- 加入 200 μL 新鲜的 D10 培养基。
- 收获 T 细胞(6 孔板)
- 小心地将 T 细胞重悬于其培养基中;大多数 T 细胞处于悬浮状态,只需从孔中移出即可收获。
- 显微镜检查孔是否为空;如果没有,使用 1,000 μL 胰蛋白酶收获,将板放在 37 °C 的加热板上,直到 T 细胞分离,然后加入 1,000 μL PBS 或 T 细胞培养基(可选)终止反应。
- 使用 Neubauer 计数室对 T 细胞进行计数。然后将 T 细胞以 300 x g 离心 5 分钟。
- 将 T 细胞重悬于 T 细胞培养基中(使用与第 2 天 T 细胞分离时制备的培养基相同的培养基)至终浓度为每 20 μL 10,000 个 T 细胞。
- 向 HSC4 肿瘤细胞添加 T 细胞(96 孔板)
- 根据先前确定的肿瘤细胞计数,以 1:1 的比例将所需量的 T 细胞添加到肿瘤细胞孔中。
- 每个条件保持一个肿瘤细胞井,不含 T 细胞作为“仅肿瘤细胞”对照。这种“仅肿瘤细胞”对照可实现流式数据的精确门控。
- 将 200 μL T 细胞悬液添加到空孔中作为“仅 T 细胞”对照(200,000 个 T 细胞)。这种“仅 T 细胞”控制可实现流式数据的精确门控。
- 共培养物孵育 96 小时(37 °C,5% CO2 )
5. 通过流式细胞术定量 T 细胞增殖(第 7 天)
注意:时间:3 小时。将共培养物再孵育 96 小时后,收获孔并用含有不同抗体的抗体混合物染色,具体取决于研究假设(例如,抗 CD3、CD8、HLA-DR 和 CD25 抗体)。然后,通过多色流式细胞术分析细胞。
- 为每个要收获的孔准备并铭刻一批 FACS 管和微量离心管。
- 细胞收获
- 将细胞重悬于其培养基中,并将其转移到 FACS 管中。
- 使用 100 μL PBS 洗涤细胞,然后将其转移到 FACS 管中。
- 向孔中加入 100 μL 胰蛋白酶,并在加热板 (37 °C) 上孵育 5 分钟。
- 重悬细胞,如果所有细胞都分离,则在显微镜下控制。如果是这样,请将胰蛋白酶消化的细胞悬液转移到 FACS 管中。
- 显微镜检查是否所有孔都是空的;如果没有,请重复步骤 5.2.3-5.2.4。
- 收集共培养物的上清液用于进一步实验
- 将装满细胞的试管以 300 x g 离心 5 分钟。
- 小心地将约 300 μL 的上清液从试管中吸出,并移入不同批次的微量离心管中,在 -20°C 下冷冻。上清液稍后可用于进行 ELISA 测定等,以定量分泌的细胞因子。
- 用抗体对细胞进行染色以进行流式细胞术
- 制备抗体混合物:将 5 μL 抗 CD3-Krome Orange、0.5 μL 抗 CD8-PerCE-Cyp5.5、1 μL 抗 HLA-DR-APCVio770、2.5 μL 抗 CD25-PE-Dazzle 添加到 91 μL PBS/FACS 缓冲液中。
- 向每个试管中加入 200 μL FACS 缓冲液(PBS 补充有 2% FBS 和 2% EDTA)并重悬。
- 再次以 300 x g 离心 5 分钟。弃去上清液,将细胞重悬于 100 μL 先前制备的抗体混合物中(步骤 5.4.1)。在 4 °C 下在冰箱中避光孵育 30-45 分钟。
- 孵育后,以 300 x g 离心 5 分钟。弃去上清液,将细胞重悬于 100 μL FACS 缓冲液中。
- 在能够区分所有上述荧光抗体和 CSFE 信号的细胞仪上进行流式细胞术。
6. 门控策略和数据分析
- 排除双峰并识别正确的 T 细胞群(图 2A)。
- 根据 forward 与 排除 doublets 填充。侧向散射面积(FSC-A 与SSC-A) (单线体)。
- 绘制“单峰”以基于正向 vs 鉴定 T 细胞。侧向散射面积(FSC-A 与SSC-A)(T 细胞)。
注意:为了获得最佳尺寸排除,请平行测量“仅 T 细胞”和“仅肿瘤细胞”样品(图 2B)。 - 绘制 CD3 表达与 SSC-A 的对比图以区分 T 细胞。此外,可以通过绘制 CD8 信号与 SSC-A 的图谱来识别 CD8 阳性 T 细胞。所有 T 细胞都是 CD3 + / CD8 + (CD8 + T 细胞)(图 2A)。
- 将所有“CD8 + T 细胞”的 CFSE 信号绘制为直方图。
注:非增殖亚群(最高 CFSE 信号)、增殖亚群(所有 CFSE 信号减弱的 T 细胞)和高度增殖亚群(第 4 个 或更低强度的 CFSE 峰值的所有 T 细胞)的门控。
- 分析 T 细胞群上的活性相关表面标志物
- 按照门控步骤(步骤 6.1)(图 3A)。
- 选项 A:选择“CD8+ T 细胞”作为输入,并通过绘制相应的表面标志物荧光与 SSC-A 特性来分析它们的 CD25 或 HLA-DR 表达。
注:如果可检测到不同的 CD25 高亚群,建议对 CD25 高群体进行设门。这同样适用于 T 细胞上 HLA-DR 的门控/分析(图 3B)。 - 选项 B:选择“CD8 + T 细胞”作为输入,并通过绘制相应的表面标志物荧光与 SSC-A 特性来分析它们的 CD25 或 HLA-DR 表达。
注意:如果未检测到明显的亚群(取决于分析的表面标记物),则建议分析整个 T 细胞群的平均荧光强度 (MFI) 的变化(图 3C)。

图 2:CFSE 染色、预刺激的 T 细胞的门控策略,用于分析与预处理的 HNSCC 肿瘤细胞共培养 96 小时后的增殖。 从 96 孔板共培养后 96 小时收获 T 细胞和肿瘤细胞,使用 T 细胞特异性表面标记染色,并使用流式细胞术设备测量。(A) 根据 FSC-A/FSC-H 排除双峰,首先按大小 (FSC-A/SSC-A) 对 T 细胞进行门控。进一步分析 T 细胞的 CD3 (抗 CD3 Krome Orange) 和 CD8 (抗 CD8 PerCP-Cy5.5) 表达。将 CD3 + / CD8 + T 细胞绘制成直方图,并分析 CFSE 信号强度。CFSE 信号代表具有不同增殖行为的 T 细胞亚群。具有最高 CFSE 信号的 T 细胞被定义为 “非增殖性”。所有显示 CFSE 信号丢失的亚群(由细胞分裂导致信号减半)在不同的峰中被总结为“增殖”。分裂超过 3 次(超过 3 个 CSFE 信号峰)的 T 细胞被定义为“高度增殖”。(B) 作为对照,额外测量仅由预先刺激的 T 细胞和仅预先处理的肿瘤细胞组成的样品。T 细胞和 HSC4 肿瘤细胞可以使用 FSC-A 与大小进行区分。SCC-A 信号。此外,分析未刺激的 CD8 + T 细胞,以基于单独与同种异体肿瘤细胞共培养来检查 T 细胞活化。(C) 作为对照,包括未刺激的 CFSE 染色 T 细胞在共培养的同时孵育 96 小时。(D) 未刺激的 CFSE 染色 T 细胞与预先处理的肿瘤细胞共培养。96 小时后,收获细胞,并使用标准程序测量 CFSE 信号。未刺激的 T 细胞单独或在与预处理的肿瘤细胞共培养后均未显示增殖。 请单击此处查看此图的较大版本。
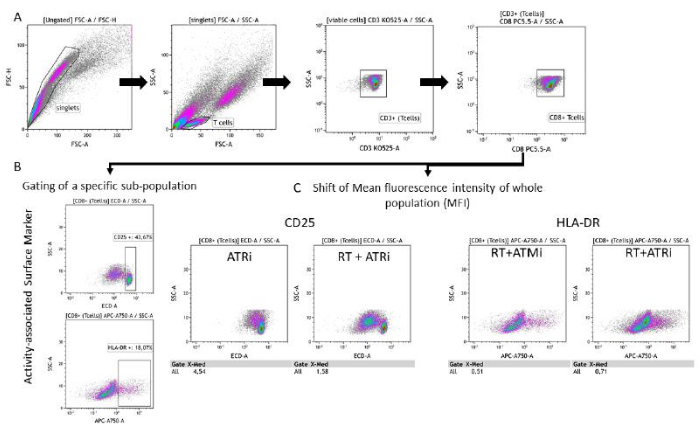
图 3:与预处理的 HNSCC 细胞共培养 96 小时后与 T 细胞活性相关的表面标志物表达(CD25 和 HLA-DR)的门控策略。 (A) 根据双峰的 FSC-A/FSC-H 特性排除双峰,并首先按大小 (FSC-A/SSC-A) 对 T 细胞进行门控。进一步分析 T 细胞的 CD3 (抗 CD3 Krome Orange) 和 CD8 (抗 CD8 PerCP-Cy5.5) 表达。T 细胞表面活性标志物 CD25(抗 CD25 PEDazzle594)和 HLA-DR(抗 HLA-DR APC-Vio770)的门控可以在两种不同的设置中进行。(B) 基于密度图对所有 CD8 + T 细胞的特异性 CD25高 或 HLA-DR高 亚群百分比进行设门。(C) 或者,对两个活性标志物进行整个 CD8 + T 细胞群的 MFI 偏移测量。显示了与 HSC4 肿瘤细胞共培养后 T 细胞表面标志物表达分析的代表性图像。 请单击此处查看此图的较大版本。
结果
接种来源于 HNSCC 的 HSC4 肿瘤细胞并孵育过夜。24 小时后,用激酶抑制剂处理细胞。3 小时后,应用前两剂每分次 5 Gy。24 小时后,应用第二剂,并再次将细胞孵育过夜。同时,在共培养开始前 48 小时,从健康供体的血液中分离 T 细胞。首先,使用密度梯度离心管和无菌分离介质分离 PBMC。使用细胞计数室对 PBMC 进行计数,并使用 CD8+ T 细胞分离试剂盒分离 CD8+ T 细胞。然后用 CFSE (1 μM) 对分离的 CD8+ T 细胞进行染色,随后进行计数。将 T 细胞接种在 CD3/CD28 预包被的孔板中,密度为 1.5 x 106 个细胞/3 mL。刺激 48 小时后,收获 T 细胞,计数,并以 10,000 个细胞/10 μL 的密度重悬。此外,收获接种的肿瘤细胞的代表性孔并计数,并将培养基换成所有剩余的孔。T 细胞以 1:1 的比例添加到肿瘤细胞中。96 小时后收获共培养物,将上清液储存在 -20 °C,对细胞进行染色并通过流式细胞术测量细胞(图 1)。
通过大小排除和 CD3/CD8 阳性鉴定 T 细胞。CD3 + / CD8 + 阳性细胞的 CFSE 信号显示非增殖性 T 细胞 (高 CFSE 信号) 和增殖 T 细胞的不同亚群 (CFSE 信号强度丢失) 的分布。以示例性方式测量了 HSC4 HNSCC 细胞系增殖的 T 细胞的比例(图 4A)。所有显示至少一次分裂的 T 细胞都被定义为“增殖性”。显示超过 3 次分裂的 T 细胞被定义为“高度增殖”(图 4B)。对于 HPV 阴性细胞系 HSC4,当 T 细胞与照射的肿瘤细胞共培养时,检测到增殖速率略有增加。与 RT 加 ATM 抑制处理的 HSC4 细胞与 T 细胞共培养相比,RT 和 RT 加 ATR 抑制导致连续 T 细胞增殖显著增加。关于 T 细胞的“高度增殖”部分,用 RT 加抑制 ATR 对 HSC4 细胞进行预处理在刺激 T 细胞增殖方面最有效(图 4B)。

图 4:用于分析 HSC4 治疗依赖性 T 细胞增殖变化的 CFSE 染色 T 细胞增殖的 T 细胞 增殖。(A) 与预处理的 HPV 阴性 HSC4 肿瘤细胞共培养 96 小时后增殖的 T 细胞的比例。与 RT 或 RT 加 ATRi 治疗相比,与 RT+ATMi 处理的 HSC4 肿瘤细胞共培养后 T 细胞增殖显著降低。(B) HSC4 肿瘤细胞的 RT 诱导了更高比例的高增殖 T 细胞(超过 3 次细胞分裂。RT+ATRi 预处理的 HSC4 肿瘤细胞与 T 细胞共培养后,高度增殖的 T 细胞百分比最高。条形图显示了来自四个独立健康供体 (n = 4;均值 ± SD)。(*p≤ 0.05, **p≤ 0.01, ***p≤ 0.001, ****p≤ 0.0001;通过比较所有实验条件与每个实验条件进行统计显着性检验,使用双尾 Mann-Whitney-U 获取非正态分布的数据)。 请单击此处查看此图的较大版本。
基于增殖的 CFSE 丢失可用于量化 T 细胞增殖率。此外,几种细胞表面标志物被描述为与 T 细胞活性相关,例如 CD25 和 HLADR。因此,通过流式细胞术分析所有 CD3+ 和 CD8+ T 细胞表面的 CD25 和 HLA-DR(图 5)。如果可检测到不同的 CD25高 或 HLA-DR高 亚群,则可以量化表达,并且可以通过门控这些高阳性细胞来区分(图 3B)。如果未检测到明显的亚群,则可以测量整个群体的平均荧光强度 (MFI),并且可以量化 MFI 的基于条件的变化(图 3C)。
例如,在与预处理的 HSC4 肿瘤细胞共培养 96 小时后,分析 CD25 和 HLA-DR 的 MFI 鉴定的表达(图 5)。T 细胞与 RT 处理的 HSC4 肿瘤细胞共培养后,T 细胞上 CD25 的表达强烈下调。值得注意的是,与 ATRi 预处理相比,仅使用 ATMi 对肿瘤细胞进行预处理导致 CD25 表达显著降低。在与 RT 的联合设置中,尽管 RT 导致 T 细胞上 CD25 的表达降低,但与 RT 加 ATRi 相比,RT 与 ATMi 的组合导致 CD25 的表达增加(图 5A)。关于 HLA-DR 在 T 细胞上的表达,RT 通常会导致 HLA-DR 上调,但同样,与 ATMi 或 ATRi 结合时,观察到不同的行为(图 5B)。与单独使用 RT 或 RT+ATMi 相比,与预先用 RT+ATRi 组合预处理的 HSC4 细胞共培养的 T 细胞增加了 HLA-DR 的表达。

图 5:与预处理的 HSC4 肿瘤细胞共培养 96 小时后,T 细胞表面的活化标志物 CD25 和 HLA-DR 的表达。 根据整个 T 细胞群的 MFI 变化分析 CD25 和 HLA-DR 的表达。HSC4 的 RT 导致 T 细胞上 CD25 的表达降低,HLA-DR 的表达增加。与 RT 加 ATRi 相比,RT 与 ATMi 的组合导致表达模式显著不同。箱线图显示了来自四个独立健康供体 (n = 4;均值 ± SD)。通过使用非正态分布数据的双尾 Mann-Whitney-U 检验 (*p≤ 0.050) 将所有实验条件相互比较来分析数据。 请单击此处查看此图的较大版本。
这些数据示例性地表明,肿瘤细胞的治疗,在本例中为 HSC4 HNSCC 细胞,会影响肿瘤细胞的免疫原性。这可以通过肿瘤细胞与预先刺激的 T 细胞共培养来监测,这导致基于应用的肿瘤细胞治疗方案在人 T 细胞上产生多样化的增殖行为和激活标志物的表达。
讨论
这里介绍的方案提供了一种快速简便的方法,可以在与预处理的肿瘤细胞共培养环境中分析 T 细胞的增殖能力及其活化状态。因此,可以很容易地筛选不同治疗方式(如 RT、CT 或 TT)对 T 细胞活性和增殖的影响,为随后对有前途的方法进行更深入的免疫学分析奠定基础。本手稿中显示的代表性结果证明,这种同种异体 T 细胞共培养测定表现良好。在与差异预处理的人 HSC4 (HNSCC) 细胞共培养时,观察到 T 细胞增殖和 T 细胞活性的显著差异(图 4 和 图 5)。研究发现,单独使用 RT 或与 TT 联合治疗 HSC4 导致 T 细胞增殖增加,特别是 T 细胞的高度增殖部分(图 4)。与增殖速率的定量一致,T 细胞的活化状态也受到不同处理方案的不同影响。总之,RT 的应用导致 T 细胞上 CD25 的表达强烈下调,而 HLA-DR 的表达上调。RT 在受照射的肿瘤细胞中诱导 DNA 损伤,进而导致细胞应激反应,包括释放应激和损伤相关分子和细胞因子,以及免疫调节细胞表面配体的表达19。
RT 与 TT 以 DNA 修复抑制剂的形式结合进一步增强和维持了这些作用,因为肿瘤细胞不能有效地修复 RT 诱导的 DNA 损伤。这可能会进一步促进和维持免疫原性因子的分泌和免疫原性细胞表面配体的表达20。据此,我们之前已经证明,用 RT 和 DNA 损伤抑制剂处理肿瘤细胞 (HNSCC) 会改变肿瘤细胞表面的免疫表型。免疫表型的调节包括免疫刺激分子 ICOS-L 和免疫抑制分子 PD-L1的调节 11。为了响应肿瘤细胞免疫表型的这种调节,T 细胞也可能调节其细胞表面激活标志物的表达。此外,众所周知,RT 可刺激促炎细胞因子(如 IFNγ 或 IL-6)的释放,进而影响 T 细胞增殖和活性21。T 细胞上活化标志物的表达是一个高度动态的过程。来自 Zimmerman 等人 22 的数据显示,CD25 在刺激后 24 小时高表达,但在刺激后 96 小时后再次下调。这与我们的调查结果一致。相比之下,HLA-DR 是一种晚期激活标志物,通常在 CD25 和 CD6923 增加之前。值得注意的是,与 RT + ATMi 相比,RT + ATRi 的组合导致 T 细胞上 HLA-DR 的显着上调。这一发现与 Dillion 等人的工作一致,他们证明了 ATRi + RT 在诱导炎症性 TME24 中的协同作用。通过单独使用激酶抑制剂处理肿瘤细胞,实现了不太明显的 T 细胞活性和增殖调节(图 5)。这可能是由于 DNA 修复抑制剂 ATMi 和 ATRi 作为 RT 诱导的 DNA 损伤的增强剂发挥作用,因此作为单一疗法应用时免疫原性不强。我们已经证明了 ATMi 或单独使用 ATRi 的最小毒性11。总之,结果证实了 RT (和带有 DNA 损伤抑制剂的 TT)的免疫原性潜力,并进一步表明该实验系统适用于筛选人头颈癌细胞中不同治疗方式的免疫刺激能力。
尽管这里介绍的方法简单而可靠,但协议中有一些关键步骤必须事先考虑。在分离过程以及 T 细胞的流式细胞术分析过程中,高 EDTA 浓度的存在是必要的。因此,建议将供体血液收集到 EDTA 包被的收集管中,并使用补充有 10 mM EDTA 的 MACS 缓冲液,以确保有效的 T 细胞分离和产生用于流式细胞术评估的均一单细胞悬液。此外,T 细胞培养基的组成对 T 细胞的增殖能力非常重要。在测试了不同的培养基成分后,含有低浓度 L-精氨酸和 L-赖氨酸的培养基可产生最佳的 T 细胞增殖信号,因为 L-精氨酸对 T 细胞代谢和存活至关重要,应以合适的浓度提供25,26。尽管如此,应该记住,L-精氨酸和 L-赖氨酸溶液不能长期稳定,因此需要在 3 个月内使用。为了获得最佳刺激效果,每次 T 细胞培养实验都需要新鲜制备补充有氨基酸的 T 细胞培养基。此外,T 细胞的细胞数量以及肿瘤细胞的细胞数量是需要考虑的关键因素,因为它们会影响实验的读数。
对于肿瘤细胞,一方面,在共培养实验结束时需要 70% 至 80% 的细胞汇合度。肿瘤细胞的过度生长可能会导致分泌抑制细胞生长的因子,随后也会影响 T 细胞增殖速率。由于肿瘤细胞的生长高度依赖于单个细胞系,因此我们建议在不同的孔板和不同的治疗方案中彻底测试相应肿瘤细胞系的生长行为。此外,肿瘤细胞和 T 细胞应以 1:1 的比例共培养。因此,必须为每种治疗条件接种一个额外的肿瘤细胞孔,该孔可用于确定共培养开始当天的细胞计数。因此,可以确保为不同的处理条件接种适当数量的 T 细胞。关于 T 细胞的细胞数量,有必要考虑到可以从健康供体中分离的 T 细胞的数量是非常个体化的。T 细胞约占健康供体 PBMC 的 45% 至 70%27。因此,在采血时应该已经大致估计了所需的 T 细胞量。此外,T 细胞密度对 T 细胞活化的效率及其存活很重要。因此,T 细胞应以 6 孔板每孔至少 150 万个细胞的浓度接种在 3 mL T 细胞培养基中,用于共培养开始前的初始刺激。较高的 T 细胞密度是可能的,但应避免使用较低的 T 细胞密度。T 细胞的活化也可以在显微镜下进行形态学评估,因为活化的 T 细胞往往会形成细胞簇。
由于该方法是研究不同肿瘤细胞系和治疗方式的免疫刺激能力的简化实验系统,因此需要考虑一些局限性。首先,该检测基于同种异体系统,这意味着供体 T 细胞与相应的肿瘤细胞系不进行 HLA 匹配。因此,这种 HLA 错配可能已经诱导了 T 细胞刺激,随后诱导了 T 细胞增殖,而无需肿瘤细胞治疗的进一步刺激28。为了量化这种不需要的影响,将分离的 T 细胞与 HSC4 细胞系共培养,而无需事先使用 CD28 和 CD3 抗体刺激。发现在这种情况下几乎没有诱导增殖,这表明在这种特定的实验环境中,HLA 错配对 T 细胞活化的影响很小。此外,尽管存在同种异体设置,但发现基于肿瘤细胞治疗的 T 细胞增殖和活化存在显着差异。然而,为了建立该测定,应在实验开始时测试和定量一次潜在的同种异体诱导的 T 细胞增殖。推荐的 “only T cell” 和 “only tumor cell” 对照是充分设门所必需的,并且在每次实验复制中都是强制性的。尽管如此,需要记住,同种异体共培养系统缺乏肿瘤特异性抗原识别。因此,该系统可能无法准确反映特异性抗肿瘤反应,因为它会在患者体内发生29,30。为了进一步改进,更复杂的设置将是自体共培养方法。在这种情况下,需要培养患者来源的肿瘤活检,并与从同一患者外周血中分离的 T 细胞一起培养28。然而,这种实验方法可能不仅在培养原代肿瘤细胞方面具有挑战性,而且在患者来源的生物材料的可用性方面也具有挑战性。需要考虑的另一个限制是共培养中肿瘤细胞和 T 细胞的比例。由于推荐的细胞比例为 1:1,因此该比例并不能反映患者 TME 的生理状况31。然而,必须接受这种限制,因为 T 细胞计数较低,增殖速率和活化状态的变化是不可量化的。
在肿瘤免疫学领域,该测定提供了在简单快速的 体外 实验环境中筛选不同治疗方式的免疫原性的机会。因此,不仅可以通过预先筛选免疫原性方面最有前途的方法来节省时间,还可以通过 体内实验来 节省时间。可以减少动物模型,因为只有有前途的治疗方案才能在动物模型中进一步寻求,以反映生物体中整个免疫系统。此外,由于该检测基于人类原代细胞和人类癌细胞系,因此结果可能比基于其他模型系统和物种的检测更容易转化为临床。
将来,该测定可能会被调节和调整以回答更具体的研究问题。例如,可以包括 T 细胞的治疗,以反映更接近患者情况的治疗方案。由于肿瘤反应性 T 细胞主要存在于 TME 中,因此它们同样受到局部疗法(如 RT)的影响,也可能受到全身疗法(如 CT 或 TT32)的影响。该测定的进一步增强是 T 细胞与来自肿瘤细胞系的肿瘤球体的共培养,甚至与患者来源的肿瘤类器官共培养。这些三维培养物更类似于患者28 的肿瘤结构。最后, 通过 流式细胞术的实验读数也可以很容易地进行调整,以便研究 T 细胞表面的更多分子或通过分析肿瘤细胞上免疫检查点分子的表达。除了测定 T 细胞的免疫表型外,还可以使用共培养实验中的细胞培养上清液来定量分泌的细胞因子或趋化因子,以更深入地了解 T 细胞活性。总之,该方案提供了一种全面、稳健且简单的 T 细胞和肿瘤细胞共培养测定,可以筛选不同癌症治疗方式的免疫原性。由于该测定适用于特定的研究问题,因此非常适合在肿瘤免疫学的广泛领域中应用。
披露声明
作者声明没有利益冲突。
致谢
这项研究部分由埃尔朗根临床研究跨学科中心 (IZKF Erlangen) 和巴伐利亚研究中心 (BZKF) 资助。
材料
| Name | Company | Catalog Number | Comments |
| 15 mL Cellstar tubes | Greiner Bio-One GmbH | 188271 | |
| 50 mL Cellstar tubes | Greiner Bio-One GmbH | 227261 | |
| 6 well cell culture plate sterile, with lid | Greiner Bio-One GmbH | 657160 | |
| 96 well cell culture plate sterile, F-bottom, with lid | Greiner Bio-One GmbH | 655180 | |
| AZD0156 | Selleck Chemicals GmbH | S8375 | |
| Berzosertib (VE-822) | Selleck Chemicals GmbH | S7102 | |
| CASYcups | OMNI Life Science GmbH & Co KG | 5651794 | |
| CASYton | OMNI Life Science GmbH & Co KG | 5651808 | |
| CD25a, PE-Dazzle594, Mouse IgG1 | Biolegend | 356126 | |
| CD28-UNLB | Beckmann Coulter, Inc. | IM1376 | |
| CD3a,Krome Orange, Mouse IgG1 | Beckmann Coulter, Inc. | B00068 | |
| CD3e Monoclonal Antibody | Thermo-Fisher Scientific, Inc. | MA1-10176 | |
| CD4, APC, Mouse Anti-Human Mouse IgG1 | BD Pharmingen | 555349 | |
| CD8 MicroBeads, human | Miltenyi Biotec, Inc. | 130-045-201 | |
| CD8a, PerCP-Cy5.5, Mouse IgG1 | Biolegend | 300924 | |
| CellTracker Deep Red Dye | Thermo Fisher Scientific, Inc. | C34565 | |
| CFSE | Merck KGaA (Sigma-Aldrich) | 21888 | |
| DMEM (Dulbecco´s Modified Eagle´s Medium) | PAN-Biotech GmbH | P04-02500 | |
| DxFlex Flow Cytometer (with Auto Loader) | Beckmann Coulter, Inc. | C44326, C02846 | |
| EDTA disodium salt dihydrate | Carl Roth GmbH + Co. KG | 8043.2 | |
| FBS superior | Merck KGaA (Sigma-Aldrich) | S0615-500ML | |
| FBS superior | Merck KGaA (Sigma-Aldrich) | S0615-100ML | For production of heat-inactivated FBS. Heat up for 30 min at 56 °C with mixing to inactivate complement proteins. |
| Graph Pad Prism (version number 9) | GraphPad Software | - | |
| HLA-DR, DP, DQ Antibody, anti-human, APC-Vio770 | Miltenyi Biotec, Inc. | 130-123-550 | |
| Kaluza (version number 2.1) | Beckmann Coulter, Inc. | - | |
| L-Arginin | Merck KGaA (Sigma-Aldrich) | A8094-25G | |
| L-Lysin-monohydrochloride | Merck KGaA (Sigma-Aldrich) | L5626-100G | |
| MACS BSA Stock Solution | Miltenyi Biotec, Inc. | 130-091-376 | |
| MS Columns | Miltenyi Biotec, Inc. | 130-042-201 | |
| Neubauer-improved counting chamber | Paul Marienfeld GmbH & Co. KG | 640010 | |
| PBS | Merck KGaA (Sigma-Aldrich) | D8537-500mL | |
| Penicillin-Streptomycin | Thermo-Fisher Scientific, Inc. | 1514-122 | |
| ROTISep 1077 | Carl Roth GmbH + Co. KG | 0642.2 | |
| RPMI-1640 Medium | Merck KGaA (Sigma-Aldrich) | R1790 | |
| SepMate 50mL tubes | Stemcell Technologies | 85450 | |
| Trypan blue | Merck KGaA (Sigma-Aldrich) | T6146-25G | |
| Trypsin | Thermo-Fisher Scientific, Inc. | 15400054 |
参考文献
- Hiam-Galvez, K. J., Allen, B. M., Spitzer, M. H. Systemic immunity in cancer. Nat Rev Cancer. 21 (6), 345-359 (2021).
- Mantovani, A., Allavena, P., Marchesi, F., Garlanda, C. Macrophages as tools and targets in cancer therapy. Nat Rev Drug Discov. 21 (11), 799-820 (2022).
- Waldman, A. D., Fritz, J. M., Lenardo, M. J. A guide to cancer immunotherapy: From t cell basic science to clinical practice. Nat Rev Immunol. 20 (11), 651-668 (2020).
- Dunn, G. P., Old, L. J., Schreiber, R. D. The immunobiology of cancer immunosurveillance and immunoediting. Immunity. 21 (2), 137-148 (2004).
- Mittal, D., Gubin, M. M., Schreiber, R. D., Smyth, M. J. New insights into cancer immunoediting and its three component phases--elimination, equilibrium and escape. Curr Opin Immunol. 27, 6-25 (2014).
- Irianto, T., Gaipl, U. S., Ruckert, M. Immune modulation during anti-cancer radio(immuno)therapy. Int Rev Cell Mol Biol. 382, 239-277 (2024).
- Burtness, B., et al. Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (keynote-048): A randomized, open-label, phase 3 study. Lancet. 394 (10212), 1915-1928 (2019).
- Hecht, M., et al. Safety and efficacy of single cycle induction treatment with cisplatin/docetaxel/ durvalumab/tremelimumab in locally advanced HNSCC: First results of checkered-CD8. J Immunother Cancer. 8 (2), e001378 (2020).
- Chen, J. A., Ma, W., Yuan, J., Li, T. Translational biomarkers and rationale strategies to overcome resistance to immune checkpoint inhibitors in solid tumors. Cancer Treat Res. 180, 251-279 (2020).
- Solomon, B., Young, R. J., Rischin, D. Head and neck squamous cell carcinoma: Genomics and emerging biomarkers for immunomodulatory cancer treatments. Semin Cancer Biol. 52 (Pt 2), 228-240 (2018).
- Meidenbauer, J., et al. Inhibition of atm or atr in combination with hypo-fractionated radiotherapy leads to a different immunophenotype on transcript and protein level in HNSCC. Front Oncol. 14, 1460150 (2024).
- Kumari, S., et al. Immunomodulatory effects of radiotherapy. Int J Mol Sci. 21 (21), 8151 (2020).
- Wimmer, S., et al. Hypofractionated radiotherapy upregulates several immune checkpoint molecules in head and neck squamous cell carcinoma cells independently of the HPV status while icos-l is upregulated only on HPV-positive cells. Int J Mol Sci. 22 (17), 9114 (2021).
- Derer, A., et al. Chemoradiation increases pd-l1 expression in certain melanoma and glioblastoma cells. Front Immunol. 7, 610 (2016).
- Schatz, J., et al. Normofractionated irradiation and not temozolomide modulates the immunogenic and oncogenic phenotype of human glioblastoma cell lines. Strahlenther Onkol. 199 (12), 1140-1151 (2023).
- Xu, M. M., Pu, Y., Zhang, Y., Fu, Y. X. The role of adaptive immunity in the efficacy of targeted cancer therapies. Trends Immunol. 37 (2), 141-153 (2016).
- Olivo Pimentel, V., Yaromina, A., Marcus, D., Dubois, L. J., Lambin, P. A novel co-culture assay to assess anti-tumor cd8(+) t cell cytotoxicity via luminescence and multicolor flow cytometry. J Immunol Methods. 487, 112899 (2020).
- Kulp, M., Diehl, L., Bonig, H., Marschalek, R. Co-culture of primary human t cells with leukemia cells to measure regulatory t cell expansion. STAR Protoc. 3 (3), 101661 (2022).
- Ruckert, M., et al. Immune modulatory effects of radiotherapy as basis for well-reasoned radioimmunotherapies. Strahlenther Onkol. 194 (6), 509-519 (2018).
- Samstein, R. M., Riaz, N. The DNA damage response in immunotherapy and radiation. Adv Radiat Oncol. 3 (4), 527-533 (2018).
- Meeren, A. V., Bertho, J. M., Vandamme, M., Gaugler, M. H. Ionizing radiation enhances il-6 and il-8 production by human endothelial cells. Mediators Inflamm. 6 (3), 185-193 (1997).
- Zimmerman, M., et al. Ifn-gamma upregulates survivin and ifi202 expression to induce survival and proliferation of tumor-specific T cells. PLoS One. 5 (11), e14076 (2010).
- Saraiva, D. P., et al. Expression of HLA-dr in cytotoxic t lymphocytes: A validated predictive biomarker and a potential therapeutic strategy in breast cancer. Cancers (Basel). 13 (15), (2021).
- Dillon, M. T., et al. Atr inhibition potentiates the radiation-induced inflammatory tumor microenvironment. Clin Cancer Res. 25 (11), 3392-3403 (2019).
- Geiger, R., et al. L-Arginine modulates T cell metabolism and enhances survival and anti-tumor activity. Cell. 167 (3), 829-842.e13 (2016).
- Rodriguez, P. C., Quiceno, D. G., Ochoa, A. C. L-Arginine availability regulates t-lymphocyte cell-cycle progression. Blood. 109 (4), 1568-1573 (2007).
- Lozano-Ojalvo, D., López-Fandiño, R., López-Expósito, I., Verhoeckx, K. . The impact of food bioactives on health: In vitro and ex vivo models. , 169-180 (2015).
- Gronholm, M., et al. Patient-derived organoids for precision cancer immunotherapy. Cancer Res. 81 (12), 3149-3155 (2021).
- Perez, C., Gruber, I., Arber, C. Off-the-shelf allogeneic t cell therapies for cancer: Opportunities and challenges using naturally occurring "universal" donor t cells. Front Immunol. 11, 583716 (2020).
- Martinez Bedoya, D., Dutoit, D., Migliorini, D. Allogeneic car t cells: An alternative to overcome challenges of car t cell therapy in glioblastoma. Front Immunol. 12, 640082 (2021).
- Schnellhardt, S., et al. The prognostic value of FOXP3+ tumor-infiltrating lymphocytes in rectal cancer depends on immune phenotypes defined by CD8+ cytotoxic T cell density. Front Immunol. 13, 781222 (2022).
- Wang, W., Green, M., Rebecca Liu, J., Lawrence, T. S., Zou, W., Zitvogel, L., Kroemer, G. . Oncoimmunology: A practical guide for cancer immunotherapy. , 23-39 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。