Method Article
Dissecção Subtrativa Periférica de Pedículos Glissoneanos na Ressecção Anatômica Minimamente Invasiva do Fígado para Tumores do Lobo Posterior Direito
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
A ressecção anatômica hepática minimamente invasiva (MIALR) envolvendo ligadura do pedículo de Glissonean para o lobo hepático posterior direito pode causar ruptura tumoral, hemorragia e lesão de isquemia-reperfusão (IRI). Este estudo propõe uma nova abordagem cirúrgica, a dissecção periférica subtrativa do pedículo de Glissonean (PSDGP), com o objetivo de mitigar esses riscos.
Resumo
A ressecção anatômica minimamente invasiva do fígado (MIALR) recentemente atraiu atenção significativa e avançou rapidamente no campo da cirurgia hepatobiliar. Em particular, a dissecação do pedículo glissoneano, como na Teoria do Portão de Atsushi Sugioka, representa uma técnica operatória fundamental dentro do MIALR. Esta técnica baseia-se na estrutura anatômica da cápsula de Laennec, promovendo e implementando o MIALR de maneira cientificamente rigorosa. No entanto, riscos potenciais como hemorragia, lesão de isquemia-reperfusão (IRI) e ruptura tumoral podem surgir durante o MIALR na prática clínica, particularmente quando aplicado a tumores localizados no lobo hepático posterior direito próximo à bifurcação dos pedículos glissoneanos (excluindo colangiocarcinoma hilar). Para enfrentar esses desafios, este estudo apresenta uma abordagem cirúrgica única, denominada dissecção subtrativa periférica do pedículo de Glissonean (PSDGP), projetada para mitigar essas complicações potenciais. Durante o procedimento PSDGP no MIALR para tumores hepáticos, a abordagem da placa cística é utilizada para facilitar a dissecção extra-hepática. Inicialmente, uma sutura não absorvível é enfiada do Portão VI ao Portão IV sob a orientação de pinças não traumáticas (ou instrumentos semelhantes). Posteriormente, a pinça não traumática é passada novamente pela Porta V para recuperar a sutura não absorvível da Porta IV. Finalmente, tanto o Portão V quanto o Portão VI são usados para obter a separação do pedículo glissoneano posterior direito. Este método pode melhorar as taxas de sucesso cirúrgico e produzir melhores resultados oncológicos devido à sua estrita adesão aos princípios no-touch e en-bloc da ressecção tumoral.
Introdução
A cirurgia hepática laparoscópica tem sido continuamente explorada e desenvolvida por mais de três décadas, evoluindo de ressecções hepáticas esporádicas para ressecção anatômica hepática minimamente invasiva precisa (MIALR). Tornou-se uma área de destaque dentro da cirurgia hepatobiliar, ganhando considerável atenção nos últimos anos 1,2,3,4,5. Essa técnica oferece várias vantagens, incluindo visualização aprimorada e ampliação do campo cirúrgico, permitindo operações cirúrgicas precisas. A compreensão precisa e o refinamento da abordagem dos pedículos de Glissonean são habilidades fundamentais no MIALR, garantindo segurança, eficiência e precisão 3,4,5. A Teoria do Portão de Atsushi Sugioka, baseada na estrutura anatômica da cápsula de Laennec, fornece uma solução bem estabelecida que ganhou amplo reconhecimento 6,7 (Figura 1A,B). Descreve também o procedimento cirúrgico para MIALR, que inclui o isolamento inicial e a ligadura do pedículo de Glissonean correspondente ao lobo hepático, seguido da ressecção do lobo.
Na prática clínica, a hepatectomia convencional do lobo hepático posterior direito é tipicamente realizada dissecando e ligando o pedículo glissoneano posterior direito no sulco de Rouviere ou acessando diretamente a Porta V e a Porta VI através da porta 7,8. No entanto, limitações cirúrgicas, diminuição da sensibilidade tátil, redução da capacidade de controle visual global e variações anatômicas podem causar confusão intraoperatória na orientação anatômica para tumores localizados próximos à bifurcação do pedículo glissoneano no fígado (excluindo colangiocarcinoma hilar). Esses desafios podem levar a danos inadvertidos aos vasos sanguíneos variantes da veia porta posterior, sangramento subsequente e ruptura da cápsula tumoral 5,9,10,11. Além disso, a hepatectomia convencional do lobo posterior direito do fígado, ou oclusão do ligamento hepatoduodenal ou pedículo glissoneano direito, é frequentemente necessária para minimizar o sangramento intraoperatório 2,3. No entanto, essa oclusão não apenas induz isquemia no lado tumoral do fígado, mas também afeta o lado normal, exacerbando a lesão hepática de isquemia-reperfusão (IRI)1,12.
Takasaki e col. descreveram anteriormente o isolamento extra-hepático do pedículo seccional posterior pelo método de subtração 7,8, enquanto Sugioka e Kato descreveram técnicas de subtração para o isolamento extra-hepático dos pedículos segmentares periféricos13. Essas aplicações se alinham com a ressecção hepática no contexto da dissecção subtrativa periférica do pedículo de Glissonean (PSDGP), com o objetivo principal de mitigar a lesão do pedículo ou a ruptura do tumor durante o isolamento direto do pedículo. Portanto, este estudo propõe o uso da tecnologia PSDGP para tipos específicos de tumores localizados próximos à bifurcação do pedículo glissoneano no fígado (excluindo colangiocarcinoma hilar). O objetivo primário é mitigar o risco de sangramento durante a separação do pedículo hepático posterior direito e prevenir a ruptura da cápsula tumoral, ao mesmo tempo em que reduz a IRI no fígado residual.
Protocolo
1. Seleção de pacientes
- Selecione os pacientes com base nos seguintes critérios de inclusão: tumor no lobo posterior direito (tumores benignos e malignos).
- Excluir pacientes com base nos seguintes critérios de exclusão: colangiocarcinoma hilar e neoplasia hepática sem metástase.
2. Procedimento cirúrgico
- Coloque os pacientes na posição de litotomia após anestesia intravenosa-inalatória combinada (seguindo protocolos aprovados institucionalmente). Insira cinco trocartes na parte superior do abdômen. Mantenha a pressão intra-abdominal em 13 mmHg. Insira uma fita umbilical para circundar o ligamento hepatoduodenal e execute a manobra de Pringle intermitente de maneira intracorpórea.
- Insira um trocarte de 10 mm acima do umbigo para a porta de observação.
- Insira um trocarte de 12 mm abaixo do processo xifóide para a porta do assistente.
- Insira um trocarte de 5 mm no terço superior da linha que conecta o processo xifóide ao umbigo.
- Insira um trocarte de 12 mm na interseção da linha hemiclavicular e na margem costal para a porta do cirurgião.
- Insira um trocarte de 5 mm na interseção da linha axilar anterior e da margem costal para a porta do segundo cirurgião.
- Exponha cuidadosamente a cápsula de Laennec, dissecando ao longo da placa cística através da superfície do pedículo glissoneano direito. Confirme o pedículo de Glissonea direito no fígado identificando a continuação do ligamento hepatoduodenal. Continue a dissecção até atingir as superfícies dos pedículos glissoneanos posterior direito e anterior direito (Figura 1C).
3. Manejo pedicular
- Retraia a base do segmento 4 usando uma pinça laparoscópica longa e curva no lado superior direito. Puxe o ligamento hepatoduodenal para o lado inferior esquerdo usando a manobra de Pringle intracorpórea.
- Exponha o peritônio visceral na base do segmento 4 do hilo hepático (Figura 2A). Usando uma pinça não traumática e um bisturi ultrassônico, disseque cuidadosamente o peritônio visceral entre a cápsula de Laennec que cobre o segmento 4 e a superfície superior da placa hilar. Disseque e ligue pequenos ramos do pedículo glissoneano direito para fornecer espaço suficiente para isolamento. Garantir a dissecção meticulosa de pequenos ramos para evitar vazamento biliar (Figura 2B).
- Retire o lado esquerdo da placa hilar da base do segmento 4. Continue a dissecção para o lado direito da placa umbilical (Figura 2C).
- Ocluir temporariamente o ligamento hepatoduodenal durante a descida da placa hilar para minimizar a hemorragia e evitar a contaminação das cápsulas de Laennec. Isso garante uma visibilidade ideal e facilita a intervenção processual subsequente.
- Prepare uma sutura não absorvível tamanho 0 de 15 cm de comprimento (métrica 3,5) ou uma sutura semelhante, rotulada como 'a' e 'b', com a extremidade 'b' presa antecipadamente.
- Utilizar pinça não traumática para guiar a extremidade 'a' da sutura inabsorvível (3-0) através da porta VI em direção à porta IV, facilitando o acesso ao pedículo glissoneano direito (Figura 3A).
- Utilizar pinça não traumática para direcionar a extremidade 'a' da sutura inabsorvível do portão IV para o portão V do lado direito, resultando na aquisição do pedículo glissoneano anterior direito (Figura 3B).
- Puxe simultaneamente as duas extremidades ('a' e 'b') da sutura inabsorvível para expor o pedículo glissoneano posterior direito (Figura 3C).
- Aplique tensão nas extremidades 'a' e 'b' da sutura não absorvível para ocluir o pedículo glissoneano posterior direito (Figura 4A). Utilizar a manobra de Pringle para ocluir o pedículo de Glissonea direito, reduzindo o sangramento durante a ressecção hepática e minimizando a lesão de isquemia-reperfusão (IRI) (Figura 4B).
NOTA: Essa abordagem garante um resultado ideal, alcançando o MIALR preciso do lobo hepático posterior direito (Figura 4C).
4. Cuidados e monitoramento pós-operatório do paciente
- Monitore o paciente e administre oxigênio de baixo fluxo no1º dia de pós-operatório.
- Inicie o protocolo de Recuperação Aprimorada Após a Cirurgia (ERAS) no primeiro dia pós-operatório, permitindo que os pacientes iniciem dietas líquidas e se envolvam em atividades à beira do leito.
- Administre agentes hepatoprotetores, albumina, anti-inflamatórios, analgésicos e espironolactona em baixas doses para terapia diurética.
- Monitore a função hepática (alanina aminotransferase [ALT], aspartato aminotransferase [AST], bilirrubina total [TBIL], bilirrubina direta [DBIL]) e a função de coagulação (tempo de protrombina [PT], tempo de tromboplastina parcial ativada [APTT], tempo de trombina [TT], fibrinogênio [FIB]) no1º, 3º e5º dias após a operação.
Resultados
A cirurgia foi concluída em 176 min, com sangramento intraoperatório mínimo de 50 mL e sem necessidade de transfusão sanguínea. O pedículo glissoneano direito foi ocluído duas vezes, sendo a primeira oclusão de 15 min e a segunda de 20 min. O ligamento hepatoduodenal não foi ocluído durante o procedimento, e um suprimento sanguíneo adequado para o fígado esquerdo foi mantido, preservando-se a veia hepática direita (Figura 4C). Não ocorreram complicações em curto prazo e a recuperação pós-operatória do paciente foi bem-sucedida. O tempo total de internação foi de 11 dias, com pós-operatório de 9 dias.
No quinto dia de pós-operatório, foi realizada uma tomografia computadorizada aprimorada para avaliar o resultado cirúrgico. Em comparação com a TC pré-operatória, os resultados indicaram que a veia hepática direita (VDS) exibia fluxo sanguíneo liso, sem evidência de estenose ou trombose vascular (Figura 5A,B). A veia porta principal (VP) e seus ramos esquerdo e direito, incluindo a continuação do ramo direito como ramo anterior direito, pareciam normais, sem sinais de estenose vascular ou trombose. Além disso, nenhum hematoma ou derrame foi observado ao redor do fígado (Figura 5C,D).
O nível de alanina aminotransferase (ALT) no 1º dia de pós-operatório era de 354 U/L, mas voltou ao normal no 5º dia. Os níveis de bilirrubina total permaneceram estáveis durante todo o período perioperatório. Os indicadores de função de coagulação, monitorados várias vezes antes e após a cirurgia, permaneceram dentro da faixa de normalidade. Além disso, o nível de alfafetoproteína (AFP) diminuiu de 1.210 ng/mL antes da cirurgia para 36 ng/mL após a cirurgia (Tabela 1).
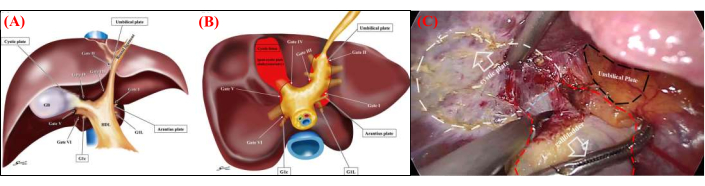
Figura 1: Estrutura anatômica da membrana do fígado. (A) Representação esquemática dos quatro marcos anatômicos e seis portões na vista frontal. O reconhecimento desses pontos de referência e portões é essencial para a padronização do isolamento do pedículo de Glisson extra-hepático. (B) Representação esquemática dos seis portões e da cápsula de Laennec na vista caudal. A relação entre os seis portões e a cápsula de Laennec (indicada pela área vermelha) é mostrada. As lacunas entre a cápsula de Laennec e o pedículo de Glisson (sistema de placas) são acessíveis apenas através dessas seis portas. Portão I: extremidade caudal da placa de Arantius; Portão II: junção entre o ligamento redondo e a placa umbilical; Portão III: borda direita da raiz do pedículo de Glisson da porção umbilical; Portão IV: borda esquerda da extremidade posterior da placa cística ou do pedículo anterior de Glisson; Portão V: bifurcação do pedículo principal de Glisson direito; Portão VI: espaço entre o pedículo de Glisson posterior e G1c. (C) Pinças atraumáticas são usadas para retrair a vesícula biliar, permitindo a dissecção completa da membrana de Laennec ao longo da placa cística para liberar a vesícula biliar até a raiz do triângulo de Calot. Clique aqui para ver uma versão maior desta figura.

Figura 2: Exposição do pedículo de Glisson. (A) A manobra de Pringle é empregada para ocluir a porta hepática inicial, minimizando o dano tecidual. A pinça atraumática é usada para retrair o segmento hepático 4b e a placa hilar, enquanto outra pinça atraumática separa suavemente a cápsula de Laennec. (B) O peritônio visceral na base do segmento 4 do hilo hepático está exposto. (C) A dissecção completa da placa hilar permite a exposição total do pedículo de Glisson direito. Clique aqui para ver uma versão maior desta figura.
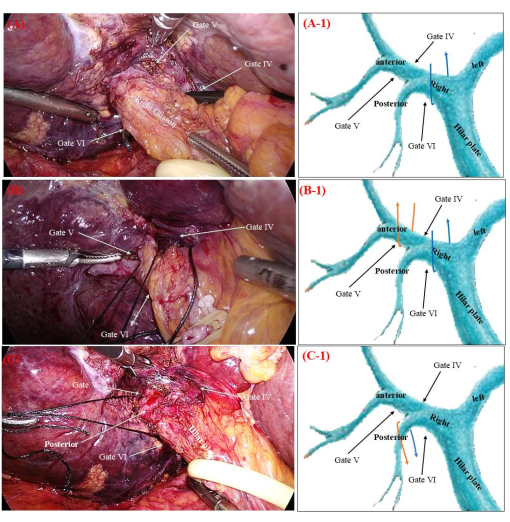
Figura 3: Dissecção periférica subtrativa dos pedículos de Glissonean. (A) O dedo de ouro (ou pinça não danosa) é usado para guiar a extremidade b da sutura não absorvível da Porta VI para a Porta IV. (B) O dedo de ouro é usado para guiar a extremidade b da sutura não absorvível da Porta IV para a Porta V. (C) A manipulação das extremidades a e b da sutura não absorvível permite o acesso preciso ao pedículo de Glisson posterior direito. As setas laranja e azul nas Figuras A-1, B-1, C-1 indicam a trajetória das suturas inabsorvíveis. Clique aqui para ver uma versão maior desta figura.

Figura 4: Ressecção anatômica precisa do fígado. (A) A ligadura do pedículo de Glisson posterior direito resulta em isquemia evidente no lobo posterior direito do fígado (linha tracejada branca indica o limite). (B) A ligadura do pedículo de Glisson direito resulta em isquemia evidente no hemifígado direito (a linha tracejada amarela indica o limite). Dado que o pedículo de Glisson posterior direito já foi ligado, a oclusão do pedículo de Glisson direito equivale a obstruir o pedículo de Glisson anterior direito. (C) É realizada ressecção anatômica precisa do lobo posterior direito do fígado, preservando a veia hepática direita (RHV) durante a cirurgia (linha tracejada azul indica deformação do RHV). Clique aqui para ver uma versão maior desta figura.

Figura 5: Análise comparativa da morfologia hepática pré e pós-cirurgia. (A) Imagens de TC pré-operatórias com realce revelam as estruturas anatômicas das veias hepáticas esquerda, média e direita (linhas pontilhadas indicam o trajeto primário das veias hepáticas). (B) Imagens de TC aprimoradas obtidas no 5º dia de pós-operatório confirmam que as veias hepáticas esquerda, média e direita permanecem intactas. (CD) Imagens de TC aprimoradas pós-operatórias demonstram que os ramos esquerdo e direito da veia porta, bem como a veia hepática direita, seguem seus cursos normais sem evidência de estenose vascular ou trombose. Não há hemorragia ou derrame na região peri-hepática (linhas sólidas indicam o trajeto primário da veia porta). Clique aqui para ver uma versão maior desta figura.
| Itens | Resultados | |
| Tempo de operação (min) | 176 | |
| Volume de sangramento intraoperatório (mL) | 50 | |
| Volume de transfusão de sangue (mL) | 0 | |
| Manobra de Pringle para tempo de oclusão vascular (min) | 35(15+20) | |
| Complicação pós-operatória | Nenhum | |
| Duração da internação (dia) | 11 | |
| Internação pós-operatória (dia) | 9 | |
| Níveis pré-operatórios de ALT e amilase | 19 | |
| Níveis de amilase ALT em POD1 (U/L) | 354 | |
| Níveis de amilase ALT em POD3 (U/L) | 132 | |
| Níveis de amilase ALT em POD5 (U/L) | 31 | |
| Níveis pré-operatórios de AST e amilase | 23 | |
| Níveis de amilase AST em POD1 (U/L) | 381 | |
| Níveis de amilase AST em POD3 (U/L) | 119 | |
| Níveis de amilase AST em POD5 (U/L) | 22 | |
| Nível de Tbil no pré-operatório (ng/mL) | 16.9 | |
| Nível de Tbil em POD1 (ng/mL) | 25.8 | |
| Nível de Tbil em POD3 (ng/mL) | 19.7 | |
| Nível de Tbil em POD5 (ng/mL) | 18.5 | |
| Função de coagulação pré-operatória (TT/APTT/PT/FIB) | normal | |
| Função de coagulação pós-operatória (TT/APTT/PT/FIB) | normal | |
| Nível de AFP no pré-operatório (ng/mL) | 1210 | |
| Nível de AFP no pós-operatório (ng/mL) | 36 | |
Tabela 1: Parâmetros intra e pós-operatórios.
Discussão
O método de dissecção extracorpórea dos pedículos de Glissonean é seguro, eficaz e conveniente, tornando-se uma técnica fundamental para o MIALR 2,3,7,13. Os pedículos de Glissonean e seus ramos fornecem suprimento sanguíneo para os lobos hepáticos e facilitam o fluxo biliar. A dissecção segura e eficiente dos pedículos de Glissonean durante a cirurgia é essencial para a implementação bem-sucedida do MIALR.
De acordo com a "Teoria do Portão" de Atsushi Sugioka, que se baseia na teoria anatômica da cápsula de Laennec, os procedimentos cirúrgicos determinam com precisão a abordagem anatômica e os níveis dos pedículos de Glissonea usando o "portão" como guia e a cápsula de Laennec como limite 1,2,7,14. O principal espaço operacional na aplicação da "Teoria do Portão" está na lacuna entre a cápsula de Laennec e a bainha de Glissonean. O sistema porta do fígado é formado pela cápsula glissoneana espessada e fundida na primeira região do hilo hepático, composta por quatro componentes distintos: placa hepática, placa da vesícula biliar, placa da veia umbilical e placa de Arantius 2,7.
As técnicas cirúrgicas para placas hepáticas e císticas atingiram um estágio relativamente maduro e evoluíram gradualmente para etapas indispensáveis na cirurgia MIALR. A etapa crucial na cirurgia MIALR envolve a ligadura dos pedículos glissoneanos correspondentes com base na localização do tumor, o que requer a abertura do respectivo portão. Por exemplo, a ressecção do hemifígado esquerdo requer passagem pela Porta 1 e Porta 3; a ressecção do corte lateral esquerdo requer passagem pelo Portão 1 e Portão 2; a ressecção da seção medial esquerda envolve a passagem pelo Portão 2 e Portão 3; a ressecção do hemifígado direito requer passagem pela Porta 4 e Porta 6; a ressecção do segmento anterior direito requer passagem pela Porta 4 e Porta 5; e a ressecção do segmento posterior direito requer passagem pela Porta 5.
No entanto, riscos potenciais de sangramento e ruptura da cápsula tumoral podem ocorrer durante a MIALR na prática clínica para tumores localizados no lobo hepático posterior direito próximo à bifurcação do pedículo glissoneano, excluindo hilar-colangiocarcinoma 5,6,13. Para mitigar esses riscos, o pedículo de Glissonean posterior direito é alcançado indiretamente pelo método PSDGP, contornando a passagem direta pela Porta V e Porta VI. O pedículo glissoneano posterior direito obtido por dissecção indireta oferece várias vantagens sobre a dissecção direta.
Primeiro, o controle efetivo do pedículo glissoneano direito pode ser alcançado acessando a Porta 4 à Porta 6, facilitando a oclusão do fluxo sanguíneo durante a ressecção do lobo posterior direito do fígado. A oclusão seletiva do pedículo glissoneano direito pode ser mantida por até 30 min ou mais sem comprometer o fluxo sanguíneo no lobo hepático esquerdo, em comparação com o método convencional de oclusão direta do ligamento hepatoduodenal 15,16,17. Essa abordagem reduz a lesão hepática de isquemia-reperfusão (IRI) e acelera a recuperação da função hepática pós-operatória18. Em segundo lugar, o acesso ao pedículo glissoneano posterior direito representa um desafio cirúrgico significativo devido à sua localização anatômica profunda e à presença de variações anatômicas. Cruzar diretamente do Portão V para o Portão VI para acessar esse pedículo pode levar à negligência não intencional das variações anatômicas, aumentando o risco de danificar as estruturas membranosas circundantes e causar sangramento 5,14,19. Finalmente, existe um risco significativo de ruptura tumoral durante a ressecção de tumores benignos, como malformações vasculares, potencialmente levando a hemorragia substancial ao dissecar os pedículos de Glissone. Se o tumor for maligno, sua ruptura durante a dissecção do pedículo glissoneano não apenas resulta em hemorragia, mas também viola os princípios da ressecção "no touch" e "en bloc". A ressecção cirúrgica torna-se particularmente desafiadora quando o tumor, benigno ou maligno, está localizado no lobo posterior direito do fígado, especialmente se o diâmetro do tumor for igual ou superior a 3 cm e estiver situado no segmento 7 próximo aos principais vasos sanguíneos e ductos biliares. Portanto, a técnica PSDGP pode efetivamente ocluir o pedículo de Glissonean do lobo anterior direito para controlar o sangramento e minimizar o IRI no parênquima hepático esquerdo, atingindo o objetivo do MIALR.
O planejamento pré-operatório da lobectomia hepática envolve o uso de TC, RM e visualização 3D auxiliar para desenvolver um plano cirúrgico preciso 4,8,20. A dissecção dos pedículos glissoneanos durante a cirurgia segue os princípios da Teoria Gate, enquanto o ultrassom intraoperatório e a fluorescência são usados para localizar e orientar com precisão a ressecção hepática. Essas técnicas auxiliam os cirurgiões na realização do MIALR de acordo com o plano pré-operatório.
Este estudo propõe que a implementação da abordagem PSDGP na cápsula de Laennec durante o procedimento cirúrgico permite MIALR preciso ao separar o pedículo glissoneano posterior direito. Em particular, em países ou regiões economicamente subdesenvolvidos com acesso limitado a equipamentos de ultrassom e dispositivos de imagem de fluorescência verde de indocianina em centros médicos, essa técnica fornece controle preciso do pedículo de Glissonean posterior direito e garante que nenhum pedículo seja perdido. Posteriormente, o parênquima hepático é incisado ao longo da linha isquêmica na superfície do fígado, proporcionando uma visualização clara da veia hepática direita subjacente. Uma ressecção meticulosa do lobo posterior direito é então realizada com base na identificação precisa e dissecção completa da veia hepática direita.
O pedículo de Glissonean direito e o pedículo de Glissonean anterior direito foram dissecados ao longo da cápsula de Laennec durante o procedimento de PSDGP, enquanto os pedículos de Glissonean posterior direito foram obtidos por dissecção subtrativa do lado de fora da bainha do pedículo de Glissonean, ligando efetivamente os pedículos e o tecido conjuntivo circundante 7,9,10. Os cirurgiões devem prestar muita atenção aos pedículos caudados que se ramificam do pedículo principal direito durante a dissecção subtrativa do pedículo glissoneano para o pedículo posterior.
A dissecção precisa das portas IV e VI é de extrema importância para o isolamento do pedículo direito como o primeiro passo do PSDGP para o pedículo posterior. Durante esse procedimento, as Portas IV e VI devem ser cuidadosamente dissecadas à direita, fora do ponto de ramificação dos pedículos do processo caudado (G1c) e da porção paracava (G1r). Se G1c ou G1r estiver envolvido na fita de estilingue do isolamento do pedículo direito, esses pedículos caudados permanecem incluídos no pedículo posterior potencial durante a dissecção subtrativa subsequente.
No contexto do procedimento PSDGP, a colecistectomia pode ser realizada simultaneamente para tratar problemas de vesícula biliar em pacientes com condições benignas, como cálculos biliares. No entanto, existem limitações associadas à técnica PSDGP para pacientes com vesícula biliar normal; portanto, o consentimento explícito do paciente deve ser obtido antes de prosseguir com a cirurgia. Além disso, de acordo com o professor Cho A e colegas no Japão 21,22,23, a ligadura de vasos sanguíneos variantes ao redor do ponto de ramificação do pedículo glissoneano pode suprir parte do segmento 5, potencialmente resultando em isquemia hepática localizada na margem de ressecção. Consequentemente, isso pode levar ao aumento do fígado pós-operatório em comparação com a ressecção planejada no pré-operatório. Embora o aumento teórico da dimensão da ressecção hepática na área de drenagem da veia porta não seja significativo, mais pesquisas são necessárias para verificar a viabilidade clínica, a segurança e as limitações do procedimento PSDGP.
A prática clínica revelou que o PSDGP pode ser efetivamente usado em ressecções envolvendo o lobo lateral esquerdo, o lobo medial esquerdo e ambos os lobos do fígado. No entanto, mais investigações são necessárias para determinar sua viabilidade, segurança e limitações em aplicações clínicas. Este estudo é uma análise retrospectiva realizada em um único centro, envolvendo um número limitado de pacientes; metade deles foi diagnosticada com tumores benignos e a outra metade com tumores malignos. Os resultados de acompanhamento de longo prazo não estão disponíveis no momento. Portanto, é necessária uma validação adicional para avaliar os aspectos técnicos, indicações, contraindicações e efeitos terapêuticos de longo prazo do PSDGP em oncologia. Objetivos de pesquisa prospectivos estão em andamento.
Divulgações
Os autores não têm conflitos de interesse ou vínculos financeiros a divulgar.
Agradecimentos
O estudo foi apoiado financeiramente pela Associação de Pesquisa em Inovação em Ciência e Tecnologia Médica de Sichuan (Código do Projeto: YCH-KY-YCZD2024-075)
Materiais
| Name | Company | Catalog Number | Comments |
| Electrocantery | Hangzhou Kangji Medical Instrument Co., Ltd | KJ-SJ0205 | Sterile,dry heat sterilized, reusable |
| Gold finger | Hangzhou Kangji Medical Instrument Co., Ltd | 101.237Φ10*350mm | Sterile,dry heat sterilized, reusable |
| Non-absorbable suture | Johnson & Johnson MEDICAL (CHINA) Ltd | 2-0/W2512 | Sterile, ethylene oxide sterilized, disposable |
| Non-traumatic forceps | Hangzhou Kangji Medical Instrument Co., Ltd | Φ10×260 | Sterile,dry heat sterilized, reusable |
| Soft rubber ureteric catheter | Yangzhou Jinhuan Medical Appliance factory | Type A 5.3mm(16Fr) | Sterile, ethylene oxide sterilized, disposable |
| Trocar | Zhejiang Geyi Medical Instrument Co.,Ltd | GYTR-I Φ5/Φ10/Φ12 | Sterile, ethylene oxide sterilized, disposable |
Referências
- Fujiyama, Y., et al. Latest findings on minimally invasive anatomical liver resection. Cancers (Basel). 15 (8), 2218 (2023).
- Reig, M., et al. Bclc strategy for prognosis prediction and treatment recommendation: The 2022 update. J Hepatol. 76 (3), 681-693 (2022).
- Morimoto, M., et al. Minimally invasive anatomic liver resection: Results of a survey of world experts. J Hepatobiliary Pancreat Sci. 29 (1), 33-40 (2022).
- Yang, J. D., Heimbach, J. K. New advances in the diagnosis and management of hepatocellular carcinoma. Bmj. 371, m3544 (2020).
- Cherqui, D. Laparoscopic liver resection: A new paradigm in the management of hepatocellular carcinoma. J Hepatol. 63 (3), 540-542 (2015).
- Morimoto, M., et al. Glissonean pedicle isolation focusing on the laennec's capsule for minimally invasive anatomical liver resection. J Pers Med. 13 (7), 1154 (2023).
- Sugioka, A., Kato, Y., Tanahashi, Y. Systematic extrahepatic glissonean pedicle isolation for anatomical liver resection based on laennec's capsule: Proposal of a novel comprehensive surgical anatomy of the liver. J Hepatobiliary Pancreat Sci. 24 (1), 17-23 (2017).
- Kato, Y., et al. Laparoscopic isolated liver segmentectomy 8 for malignant tumors: Techniques and comparison of surgical results with the open approach using a propensity score-matched study. Langenbecks Arch Surg. 407 (7), 2881-2892 (2022).
- Kim, J. H., Kim, H. Laparoscopic right hemihepatectomy using the glissonean approach: Detachment of the hilar plate (with video). Ann Surg Oncol. 28 (1), 459-464 (2021).
- Maeda, K., et al. Pure laparoscopic right hemihepatectomy using the caudodorsal side approach (with videos). J Hepatobiliary Pancreat Sci. 25 (7), 335-341 (2018).
- Wakabayashi, G., et al. Recommendations for laparoscopic liver resection: A report from the second international consensus conference held in morioka. Ann Surg. 261 (4), 619-629 (2015).
- Gotohda, N., et al. Expert consensus guidelines: How to safely perform minimally invasive anatomic liver resection. J Hepatobiliary Pancreat Sci. 29 (1), 16-32 (2022).
- Kato, Y., et al. Minimally invasive anatomic liver resection for hepatocellular carcinoma using the extrahepatic glissonian approach: Surgical techniques and comparison of outcomes with the open approach and between the laparoscopic and robotic approaches. Cancers (Basel). 15 (8), 2219 (2023).
- Xi, C., et al. A novel difficulty scoring system of laparoscopic liver resection for liver tumor. Front Oncol. 12, 1019763 (2022).
- Liu, J., et al. The difference in prolonged continuous and intermittent pringle maneuver during complex hepatectomy for hepatocellular carcinoma patients with chronic liver disease: A retrospective cohort study. Cancer Med. 10 (23), 8507-8517 (2021).
- Hu, Y., et al. Laennec's approach for laparoscopic anatomic hepatectomy based on Laennec's capsule. BMC Gastroenterol. 19 (1), 194 (2019).
- Zhang, Y., et al. Intermittent pringle maneuver versus continuous hemihepatic vascular inflow occlusion using extra-glissonian approach in laparoscopic liver resection. Surg Endosc. 30 (3), 961-970 (2016).
- Park, J. B., et al. Effect of intermittent hepatic inflow occlusion with the pringle maneuver during donor hepatectomy in adult living donor liver transplantation with right hemiliver grafts: A prospective, randomized controlled study. Liver Transpl. 18 (1), 129-137 (2012).
- Kawaguchi, Y., Fuks, D., Kokudo, N., Gayet, B. Difficulty of laparoscopic liver resection: Proposal for a new classification. Ann Surg. 267 (1), 13-17 (2018).
- Benson, A. B., et al. Hepatobiliary cancers, version 2.2021, NCCN clinical practice guidelines in oncology. J Natl Compr Canc Netw. 19 (5), 541-565 (2021).
- Cho, A., et al. Relationship between right portal and biliary systems based on reclassification of the liver. Am J Surg. 193 (1), 1-4 (2007).
- Cho, A., et al. Anterior fissure of the right liver--the third door of the liver. J Hepatobiliary Pancreat Surg. 11 (6), 390-396 (2004).
- Cho, A., et al. Relation between hepatic and portal veins in the right paramedian sector: Proposal for anatomical reclassification of the liver. World J Surg. 28 (1), 8-12 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados