Method Article
Dissection soustractive périphérique des pédicules glissonéens dans la résection hépatique anatomique mini-invasive pour les tumeurs du lobe postérieur droit
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
La résection hépatique anatomique mini-invasive (MIALR) impliquant une ligature pédiculaire glissonéenne pour le lobe hépatique postérieur droit peut provoquer une rupture tumorale, une hémorragie et une lésion d’ischémie-reperfusion (IRI). Cette étude propose une nouvelle approche chirurgicale, la dissection soustractive périphérique du pédicule glissonéen (PSDGP), visant à atténuer ces risques.
Résumé
La résection hépatique anatomique mini-invasive (MIALR) a récemment suscité beaucoup d’attention et a rapidement progressé dans le domaine de la chirurgie hépatobiliaire. En particulier, la dissection du pédicule glissonéen, comme dans la théorie des portes d’Atsushi Sugioka, représente une technique opératoire fondamentale au sein de MIALR. Cette technique est basée sur la structure anatomique de la capsule Laennec, favorisant et mettant en œuvre MIALR de manière scientifiquement rigoureuse. Cependant, des risques potentiels tels qu’une hémorragie, une lésion d’ischémie-reperfusion (IRI) et une rupture tumorale peuvent survenir au cours de la MIALR dans la pratique clinique, en particulier lorsqu’elle est appliquée à des tumeurs situées dans le lobe hépatique postérieur droit près de la bifurcation des pédicules glissonéens (à l’exclusion du cholangiocarcinome hilaire). Pour relever ces défis, cette étude introduit une approche chirurgicale unique, appelée dissection soustractive périphérique du pédicule glissonéen (PSDGP), conçue pour atténuer ces complications potentielles. Au cours de la procédure PSDGP dans MIALR pour les tumeurs hépatiques, l’approche de la plaque kystique est utilisée pour faciliter la dissection extrahépatique. Initialement, une suture non résorbable est enfilée de la porte VI à la porte IV sous la direction d’une pince non traumatique (ou d’instruments similaires). Par la suite, les pinces non traumatiques sont à nouveau passées par la porte V pour récupérer la suture non résorbable de la porte IV. Enfin, les portes V et VI sont utilisées pour réaliser la séparation du pédicule glissonéen postérieur droit. Cette méthode peut améliorer les taux de réussite chirurgicale et donner de meilleurs résultats oncologiques en raison de son strict respect des principes sans contact et en bloc de la résection tumorale.
Introduction
La chirurgie hépatique laparoscopique a été continuellement explorée et développée depuis plus de trois décennies, passant de la résection hépatique sporadique à la résection hépatique anatomique mini-invasive (MIALR) précise. Il est devenu un domaine important de la chirurgie hépatobiliaire, attirant une attention considérable ces dernières années 1,2,3,4,5. Cette technique offre plusieurs avantages, notamment une visualisation et un agrandissement améliorés du champ opératoire, permettant des opérations chirurgicales précises. La compréhension précise et le raffinement de l’approche des pédicules glissonéens sont des compétences fondamentales dans MIALR, garantissant la sécurité, l’efficacité et la précision 3,4,5. La théorie de la porte d’Atsushi Sugioka, basée sur la structure anatomique de la capsule de Laennec, fournit une solution bien établie qui a été largement reconnue 6,7 (Figure 1A,B). Il décrit également l’intervention chirurgicale de la MIALR, qui comprend l’isolement initial et la ligature du pédicule glissonéen correspondant au lobe hépatique, suivis de la résection du lobe.
En pratique clinique, l’hépatectomie conventionnelle du lobe hépatique postérieur droit est généralement réalisée en disséquant et en ligaturant le pédicule glissonéen postérieur droit dans le sillon de Rouvière ou en accédant directement à la porte V et à la porte VI par la porte 7,8. Cependant, les limitations chirurgicales, la diminution de la sensibilité tactile, la réduction de la capacité de contrôle visuel global et les variations anatomiques peuvent provoquer une confusion peropératoire dans l’orientation anatomique des tumeurs situées près de la bifurcation du pédicule glissonien dans le foie (à l’exclusion du cholangiocarcinome hilaire). Ces défis peuvent entraîner des dommages par inadvertance à des vaisseaux sanguins variants de la veine porte postérieure, des saignements ultérieurs et la rupture de la capsule tumorale 5,9,10,11. De plus, une hépatectomie conventionnelle du lobe hépatique postérieur droit, ou l’occlusion du ligament hépatoduodénal ou du pédicule glissonéen droit, est souvent nécessaire pour minimiser les saignements peropératoires 2,3. Cependant, cette occlusion induit non seulement une ischémie du côté porteur de la tumeur du foie, mais affecte également le côté normal, exacerbant les lésions hépatiques d’ischémie-reperfusion (IRI)1,12.
Takasaki et al. ont précédemment décrit l’isolement extrahépatique du pédicule sectionnel postérieur en utilisant la méthode de soustraction 7,8, tandis que Sugioka et Kato ont décrit des techniques de soustraction pour l’isolement extrahépatique des pédicules segmentaires périphériques13. Ces applications s’alignent sur la résection hépatique dans le contexte de la dissection soustractive périphérique du pédicule glissonéen (PSDGP), avec pour objectif principal d’atténuer les lésions pédiculaires ou la rupture tumorale lors de l’isolement direct du pédicule. Par conséquent, cette étude propose l’utilisation de la technologie PSDGP pour des types de tumeurs spécifiques situés près de la bifurcation du pédicule glissonéen dans le foie (à l’exclusion du cholangiocarcinome hilaire). L’objectif principal est d’atténuer le risque de saignement lors de la séparation du pédicule hépatique postérieur droit et de prévenir la rupture de la capsule tumorale, tout en réduisant simultanément l’IRI dans le foie résiduel.
Protocole
1. Sélection des patients
- Sélectionner les patients en fonction des critères d’inclusion suivants : tumeur dans le lobe postérieur droit (tumeurs bénignes et malignes).
- Exclure les patients sur la base des critères d’exclusion suivants : cholangiocarcinome hilaire et néoplasme hépatique sans métastases.
2. Intervention chirurgicale
- Placer les patients en position de lithotomie après une anesthésie combinée intraveineuse-inhalation (selon les protocoles approuvés par l’établissement). Insérez cinq trocarts dans la partie supérieure de l’abdomen. Maintenir la pression intra-abdominale à 13 mmHg. Insérez une bande ombilicale pour encercler le ligament hépatoduodénal et effectuez la manœuvre intermittente de Pringle de manière intracorporelle.
- Insérez un trocart de 10 mm au-dessus de l’ombilic pour le port d’observation.
- Insérez un trocart de 12 mm sous le processus xiphoid pour le port de l’assistant.
- Insérez un trocart de 5 mm dans le tiers supérieur de la ligne reliant l’apophyse xiphoïde à l’ombilic.
- Insérez un trocart de 12 mm à l’intersection de la ligne médio-claviculaire et de la marge costale pour le port du chirurgien.
- Insérez un trocart de 5 mm à l’intersection de la ligne axillaire antérieure et de la marge costale pour le port du deuxième chirurgien.
- Exposez soigneusement la capsule de Laennec en disséquant le long de la plaque kystique à travers la surface du pédicule glissonéen droit. Confirmer le pédicule glissonéen droit dans le foie en identifiant la continuation du ligament hépatoduodénal. Poursuivre la dissection jusqu’à ce qu’elle atteigne les surfaces des pédicules glissonéens postérieur droit et antérieur droit (Figure 1C).
3. Gestion des pédicules
- Rétractez la base du segment 4 à l’aide d’une pince laparoscopique longue et incurvée sur le côté supérieur droit. Tirez le ligament hépatoduodénal vers le côté inférieur gauche à l’aide de la manœuvre de Pringle intracorporelle.
- Exposer le péritoine viscéral à la base du segment 4 du hile hépatique (Figure 2A). À l’aide d’une pince non traumatique et d’un scalpel à ultrasons, disséquez soigneusement le péritoine viscéral entre la capsule de Laennec recouvrant le segment 4 et la surface supérieure de la plaque hilaire. Disséquez et ligaturez les petites branches du pédicule glissonéen droit pour fournir suffisamment d’espace pour l’isolation. Assurer une dissection méticuleuse des petites branches pour éviter les fuites biliaires (Figure 2B).
- Détachez le côté gauche de la plaque hilaire de la base du segment 4. Poursuivez la dissection vers le côté droit de la plaque ombilicale (Figure 2C).
- Occlure temporairement le ligament hépatoduodénal pendant la descente de la plaque hilaire pour minimiser l’hémorragie et prévenir la contamination des capsules de Laennec. Cela garantit une visibilité optimale et facilite l’intervention procédurale ultérieure.
- Préparez une suture non résorbable de taille 0 de 15 cm de long (3,5 métriques) ou une suture similaire, étiquetée « a » et « b », avec l’extrémité « b » fixée à l’avance.
- À l’aide d’une pince non traumatique, guider l’extrémité « a » de la suture non résorbable (3-0) à travers la porte VI vers la porte IV, facilitant ainsi l’accès au pédicule glissonéen droit (Figure 3A).
- À l’aide d’une pince non traumatique, dirigez l’extrémité « a » de la suture non résorbable de la porte IV à la porte V du côté droit, ce qui entraîne l’acquisition du pédicule glissonéen antérieur droit (figure 3B).
- Tirez simultanément sur les deux extrémités ('a' et 'b') de la suture non résorbable pour exposer le pédicule glissonéen postérieur droit (Figure 3C).
- Appliquez une tension sur les extrémités « a » et « b » de la suture non résorbable pour obstruer le pédicule glissonéen postérieur droit (figure 4A). Utilisez la manœuvre de Pringle pour occlure le pédicule glissonéen droit, réduisant ainsi les saignements pendant la résection hépatique et minimisant les lésions d’ischémie-reperfusion (IRI) (Figure 4B).
REMARQUE : Cette approche garantit un résultat optimal, permettant finalement d’obtenir une MIALR précise du lobe hépatique postérieur droit (Figure 4C).
4. Soins et suivi postopératoires des patients
- Surveiller le patient et administrer de l’oxygène à faible débit le1er jour après l’opération.
- Amorcer le protocole de récupération améliorée après la chirurgie (RAAC) dès le premier jour postopératoire, permettant aux patients de commencer un régime liquide et de participer à des activités au chevet du patient.
- Administrer des agents hépatoprotecteurs, de l’albumine, des anti-inflammatoires, des analgésiques et de la spironolactone à faible dose pour le traitement diurétique.
- Surveiller la fonction hépatique (alanine aminotransférase [ALT], aspartate aminotransférase [AST], bilirubine totale [TBIL], bilirubine directe [DBIL]) et la fonction de coagulation (temps de prothrombine [PT], temps de thromboplastine partielle activée [APTT], temps de thrombine [TT], fibrinogène [FIB]) les 1er, 3eet 5e jours après l’opération.
Résultats
L’opération a été réalisée en 176 minutes, avec un saignement peropératoire minimal de 50 ml et sans transfusion sanguine. Le pédicule glissonéen droit a été occlus deux fois, la première occlusion durant 15 minutes et la seconde 20 minutes. Le ligament hépatoduodénal n’a pas été occlus pendant l’intervention, et un apport sanguin adéquat au foie gauche a été maintenu tout en préservant la veine hépatique droite (Figure 4C). Aucune complication à court terme n’est survenue et le rétablissement postopératoire du patient a été couronné de succès. Le séjour total à l’hôpital a été de 11 jours, avec un séjour postopératoire de 9 jours.
Le cinquième jour postopératoire, une tomodensitométrie améliorée a été effectuée pour évaluer le résultat chirurgical. Par rapport à la TDM préopératoire, les résultats ont indiqué que la veine hépatique droite (VRS) présentait une circulation sanguine régulière, sans signe de sténose vasculaire ou de thrombose (Figure 5A,B). La veine porte principale (PV) et ses branches gauche et droite, y compris le prolongement de la branche droite en tant que branche antérieure droite, semblaient normales, sans signe de sténose vasculaire ou de thrombose. De plus, aucun hématome ou épanchement n’a été observé autour du foie (figures 5C, D).
Le taux d’alanine aminotransférase (ALT) au jour 1 postopératoire était de 354 U/L, mais est revenu à la normale au jour 5. Les taux de bilirubine totale sont demeurés stables tout au long de la période périopératoire. Les indicateurs de la fonction de coagulation, surveillés à plusieurs reprises avant et après la chirurgie, sont restés dans la plage normale. De plus, le taux d’alpha-fœtoprotéine (AFP) a diminué, passant de 1 210 ng/mL avant la chirurgie à 36 ng/mL après la chirurgie (tableau 1).
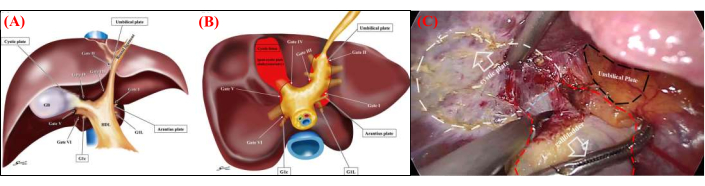
Figure 1 : Structure anatomique de la membrane hépatique. (A) Représentation schématique des quatre repères anatomiques et des six portes en vue frontale. La reconnaissance de ces points de repère et de ces portes est essentielle pour la normalisation de l’isolement pédiculaire extrahépatique de Glisson. (B) Représentation schématique des six portes et de la capsule de Laennec en vue caudale. La relation entre les six portes et la capsule de Laennec (indiquée par la zone rouge) est montrée. Les espaces entre la capsule de Laennec et le pédicule du Glisson (système de plaques) ne sont accessibles que par ces six portes. Porte I : extrémité caudale de la plaque d’Arantius ; Porte II : jonction entre le ligament rond et la plaque ombilicale ; Porte III : bord droit de la racine pédiculaire de Glisson de la partie ombilicale ; Porte IV : bord gauche de l’extrémité postérieure de la plaque kystique ou du pédicule antérieur du Glisson ; Porte V : bifurcation du pédicule principal droit du Glisson ; Porte VI : espace entre le pédicule postérieur du Glisson et G1c. (C) Des forceps atraumatiques sont utilisés pour rétracter la vésicule biliaire, permettant une dissection complète de la membrane de Laennec le long de la plaque kystique pour libérer la vésicule biliaire jusqu’à la racine du triangle de Calot. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Exposition du pédicule du Glisson. (A) La manœuvre de Pringle est utilisée pour occlure la porte hépatique initiale, minimisant ainsi les lésions tissulaires. Les pinces atraumatiques sont utilisées pour rétracter le segment hépatique 4b et la plaque hilaire, tandis qu’une autre pince atraumatique sépare doucement la capsule de Laennec. (B) Le péritoine viscéral à la base du segment 4 du hile hépatique est exposé. (C) La dissection complète de la plaque hilaire permet une exposition complète du pédicule du Glisson droit. Veuillez cliquer ici pour voir une version agrandie de cette figure.
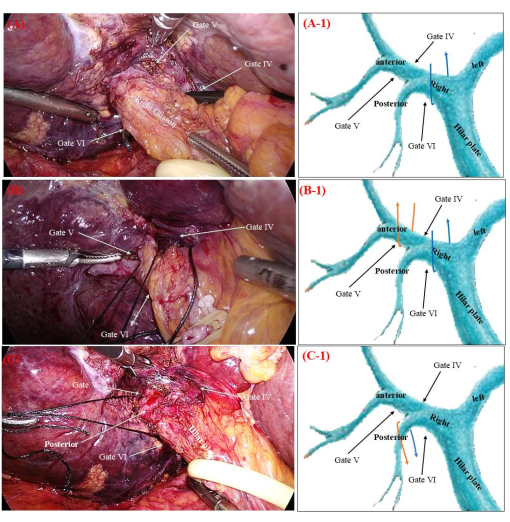
Figure 3 : Dissection soustractive périphérique des pédicules glissonéens. (A) Le doigt en or (ou pince non dommageable) est utilisé pour guider l’extrémité b de la suture non résorbable de la porte VI à la porte IV. (B) Le doigt en or est utilisé pour guider l’extrémité b de la suture non résorbable de la porte IV à la porte V. (C) La manipulation des extrémités a et b de la suture non résorbable permet un accès précis au pédicule Glisson postérieur droit. Les flèches orange et bleue des figures A-1, B-1, C-1 indiquent la trajectoire des sutures non résorbables. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Résection anatomique précise du foie. (A) La ligature du pédicule postérieur droit du Glisson entraîne une ischémie évidente dans le lobe hépatique postérieur droit (la ligne pointillée blanche indique la limite). (B) La ligature du pédicule droit du Glisson entraîne une ischémie évidente dans l’hémiliver droit (la ligne pointillée jaune indique la limite). Étant donné que le pédicule Glisson postérieur droit a déjà été ligaturé, l’occlusion du pédicule Glisson droit équivaut à obstruer le pédicule Glisson antérieur droit. (C) Une résection anatomique précise du lobe hépatique postérieur droit est effectuée, préservant la veine hépatique droite (VRS) pendant l’intervention chirurgicale (la ligne pointillée bleue indique la déformation du VHR). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Analyse comparative de la morphologie hépatique avant et après l’opération. (A) Les images de TDM améliorées préopératoires révèlent les structures anatomiques des veines hépatiques gauche, moyenne et droite (les lignes pointillées indiquent le parcours primaire des veines hépatiques). (B) Les images TDM améliorées obtenues le 5e jour postopératoire confirment que les veines hépatiques gauche, moyenne et droite restent intactes. (C-D) Les images de TDM améliorées postopératoires montrent que les branches gauche et droite de la veine porte, ainsi que la veine hépatique droite, suivent leur cours normal sans signe de sténose vasculaire ou de thrombose. Aucune hémorragie ou épanchement n’est observé dans la région périhépatique (les lignes pleines indiquent le trajet primaire de la veine porte). Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Articles | Résultats | |
| Temps de fonctionnement (min) | 176 | |
| Volume de saignement peropératoire (mL) | 50 | |
| Volume de transfusion sanguine (mL) | 0 | |
| Manœuvre de Pringle pour le temps d’occlusion vasculaire (min) | 35(15+20) | |
| Complication postopératoire | Aucun | |
| Durée du séjour à l’hôpital (jour) | 11 | |
| Séjour hospitalier postopératoire (jour) | 9 | |
| Niveaux préopératoires d’ALT et d’amylase | 19 | |
| Taux d’ALT amylase sur POD1 (U/L) | 354 | |
| Taux d’amylase ALT sur POD3 (U/L) | 132 | |
| Taux d’amylase ALT sur POD5 (U/L) | 31 | |
| Niveaux préopératoires d’ASAT et d’amylase | 23 | |
| Niveaux d’amylase AST sur POD1 (U/L) | 381 | |
| Niveaux d’amylase AST sur POD3 (U/L) | 119 | |
| Niveaux d’amylase AST sur POD5 (U/L) | 22 | |
| Taux de Tbil avant l’opération (ng/mL) | 16.9 | |
| Niveau de Tbil sur POD1 (ng/mL) | 25.8 | |
| Niveau de Tbil sur POD3 (ng/mL) | 19.7 | |
| Niveau de Tbil sur la POD5 (ng/mL) | 18.5 | |
| Fonction de coagulation préopératoire (TT/APTT/PT/FIB) | normal | |
| Fonction de coagulation post-périsative (TT/APTT/PT/FIB) | normal | |
| Taux d’AFP préopératoire (ng/mL) | 1210 | |
| Taux d’AFP postopératoire (ng/mL) | 36 | |
Tableau 1 : Paramètres peropératoires et postopératoires.
Discussion
La méthode de dissection extracorporelle des pédicules glissonéens est sûre, efficace et rapide, ce qui en fait une technique fondamentale pour MIALR 2,3,7,13. Les pédicules glissonéens et leurs branches fournissent l’apport sanguin aux lobes hépatiques et facilitent l’écoulement de la bile. Une dissection sûre et efficace des pédicules glissonéens pendant l’opération est essentielle pour la mise en œuvre réussie de MIALR.
Selon la « théorie de la porte » d’Atsushi Sugioka, qui est basée sur la théorie anatomique de la capsule de Laennec, les procédures chirurgicales déterminent avec précision l’approche anatomique et les niveaux des pédicules glissonéens en utilisant la « porte » comme guide et la capsule de Laennec comme limite 1,2,7,14. Le principal espace opérationnel dans l’application de la « théorie de la porte » réside dans l’espace entre la capsule de Laennec et la gaine glissonienne. Le système porte du foie est formé par la capsule glissonéenne épaissie et fusionnée dans la première région du hile hépatique, composée de quatre composants distincts : la plaque hépatique, la plaque de la vésicule biliaire, la plaque de la veine ombilicale et la plaque d’Arantius 2,7.
Les techniques chirurgicales pour les plaques hépatiques et kystiques ont maintenant atteint un stade relativement mature et ont progressivement évolué pour devenir des étapes indispensables de la chirurgie MIALR. L’étape cruciale de la chirurgie MIALR consiste à ligaturer les pédicules glissonéens correspondants en fonction de l’emplacement de la tumeur, ce qui nécessite l’ouverture de la porte correspondante. Par exemple, la résection de l’hémiliver gauche nécessite le passage par la porte 1 et la porte 3 ; la résection de la section latérale gauche nécessite le passage par les portes 1 et 2 ; la résection de la section médiale gauche implique le passage par les portes 2 et 3 ; la résection de l’hémiliver droit nécessite le passage par les portes 4 et 6 ; la résection du segment antérieur droit nécessite le passage par la porte 4 et la porte 5 ; et la résection du segment postérieur droit nécessite le passage par la porte 5.
Cependant, des risques potentiels de saignement et de rupture de la capsule tumorale peuvent survenir au cours de la MIALR en pratique clinique pour les tumeurs situées dans le lobe hépatique postérieur droit près de la bifurcation du pédicule glissonéen, à l’exclusion du cholangiocarcinome hilaire 5,6,13. Pour atténuer ces risques, le pédicule glissonien postérieur droit est atteint indirectement par la méthode PSDGP, contournant ainsi le passage direct par les portes V et VI. Le pédicule glissonéen postérieur droit obtenu par dissection indirecte offre plusieurs avantages par rapport à la dissection directe.
Tout d’abord, un contrôle efficace du pédicule glissonéen droit peut être obtenu en accédant à la porte 4 à la porte 6, facilitant l’occlusion du flux sanguin lors de la résection du lobe hépatique postérieur droit. L’occlusion sélective du pédicule glissonien droit peut être maintenue jusqu’à 30 minutes ou plus sans compromettre le flux sanguin dans le lobe hépatique gauche, par rapport à la méthode conventionnelle d’occlusion directe du ligament hépatoduodénal 15,16,17. Cette approche réduit les lésions d’ischémie-reperfusion hépatique (IRI) et accélère la récupération postopératoire de la fonction hépatique18. Deuxièmement, l’accès au pédicule glissonéen postérieur droit pose un défi chirurgical important en raison de sa position anatomique profonde et de la présence de variations anatomiques. Le passage direct de la porte V à la porte VI pour accéder à ce pédicule peut entraîner une négligence involontaire des variations anatomiques, augmentant le risque d’endommager les structures membraneuses environnantes et de provoquer des saignements 5,14,19. Enfin, il existe un risque important de rupture tumorale lors de la résection de tumeurs bénignes, telles que des malformations vasculaires, pouvant entraîner une hémorragie importante lors de la dissection des pédicules glissonéens. Si la tumeur est maligne, sa rupture lors de la dissection pédiculaire glissonéenne entraîne non seulement une hémorragie, mais viole également les principes de la résection « sans contact » et « en bloc ». La résection chirurgicale devient particulièrement difficile lorsque la tumeur, qu’elle soit bénigne ou maligne, est située dans le lobe postérieur droit du foie, en particulier si le diamètre de la tumeur est égal ou supérieur à 3 cm et est situé dans le segment 7 près des principaux vaisseaux sanguins et des voies biliaires. Par conséquent, la technique PSDGP peut occlure efficacement le pédicule glissonéen du lobe antérieur droit pour contrôler les saignements et minimiser l’IRI dans le parenchyme hépatique gauche, atteignant ainsi l’objectif de MIALR.
La planification préopératoire de la lobectomie hépatique implique l’utilisation de la tomodensitométrie, de l’IRM et de la visualisation 3D auxiliaire pour élaborer un plan chirurgical précis 4,8,20. La dissection des pédicules glissonéens pendant la chirurgie suit les principes de la théorie des portes, tandis que l’échographie peropératoire et l’imagerie par fluorescence sont utilisées pour localiser et guider avec précision la résection hépatique. Ces techniques aident les chirurgiens à réaliser la MIALR selon le plan préopératoire.
Cette étude propose que la mise en œuvre de l’approche PSDGP dans la capsule de Laennec lors de l’intervention chirurgicale permet une MIALR précise tout en séparant le pédicule glissonéen postérieur droit. En particulier, dans les pays ou les régions économiquement sous-développés ayant un accès limité aux équipements d’échographie et aux appareils d’imagerie par fluorescence vert d’indocyanine dans les centres médicaux, cette technique permet un contrôle précis du pédicule glissonéen postérieur droit et garantit qu’aucun pédicule n’est manqué. Par la suite, le parenchyme hépatique est incisé le long de la ligne ischémique à la surface du foie, ce qui permet de visualiser clairement la veine hépatique droite sous-jacente. Une résection méticuleuse du lobe postérieur droit est ensuite réalisée sur la base de l’identification précise et de la dissection complète de la veine hépatique droite.
Le pédicule glissonien droit et le pédicule glissonien antérieur droit ont été disséqués le long de la capsule de Laennec au cours de la procédure PSDGP, tandis que les pédicules glissonéens postérieurs droits ont été obtenus par dissection soustractive de l’extérieur de la gaine pédiculaire glissonéen, ligaturant efficacement à la fois les pédicules et le tissu conjonctif environnant 7,9,10. Les chirurgiens doivent porter une attention particulière aux pédicules caudés qui se ramifient à partir du pédicule principal droit lors de la dissection soustractive du pédicule glissonéen pour le pédicule postérieur.
Une dissection précise des portes IV et VI est de la plus haute importance pour l’isolation du pédicule droit en tant que première étape de la PSDGP pour le pédicule postérieur. Au cours de cette procédure, les portes IV et VI doivent être soigneusement disséquées à droite, à l’extérieur du point de ramification des pédicules de l’apophyse caudée (G1c) et de la partie paracavale (G1r). Si G1c ou G1r est impliqué dans le ruban adhésif de l’isolation du pédicule droit, ces pédicules caudés restent inclus dans le pédicule postérieur potentiel lors de la dissection soustractive ultérieure.
Dans le cadre de la procédure PSDGP, la cholécystectomie peut être réalisée simultanément pour traiter les problèmes de vésicule biliaire chez les patients atteints d’affections bénignes telles que les calculs biliaires. Cependant, il existe des limites associées à la technique PSDGP pour les patients ayant une vésicule biliaire normale ; Par conséquent, le consentement explicite du patient doit être obtenu avant de procéder à la chirurgie. De plus, selon le professeur Cho A et ses collègues au Japon 21,22,23, la ligature des vaisseaux sanguins variants entourant le point de ramification du pédicule glissonéen peut alimenter une partie du segment 5, entraînant potentiellement une ischémie hépatique localisée à la marge de résection. Par conséquent, cela peut entraîner une hypertrophie hépatique postopératoire par rapport à la résection préopératoire planifiée. Bien que l’augmentation théorique de la dimension de la résection hépatique dans la zone de drainage de la veine porte ne soit pas significative, des recherches supplémentaires sont nécessaires pour déterminer la faisabilité clinique, l’innocuité et les limites de la procédure PSDGP.
La pratique clinique a révélé que le PSDGP peut être utilisé efficacement dans les résections impliquant le lobe latéral gauche, le lobe médial gauche et les deux lobes du foie. Cependant, des recherches plus approfondies sont nécessaires pour déterminer sa faisabilité, son innocuité et ses limites dans les applications cliniques. Cette étude est une analyse rétrospective réalisée dans un seul centre, impliquant un nombre limité de patients ; La moitié d’entre eux ont été diagnostiqués avec des tumeurs bénignes et l’autre moitié avec des tumeurs malignes. Les résultats du suivi à long terme ne sont pas disponibles pour le moment. Par conséquent, une validation supplémentaire est nécessaire pour évaluer les aspects techniques, les indications, les contre-indications et les effets thérapeutiques à long terme du PSDGP en oncologie. Des objectifs de recherche prospectifs sont actuellement en cours.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts ou lien financier à divulguer.
Remerciements
L’étude a été soutenue financièrement par l’Association de recherche sur l’innovation en sciences et technologies médicales du Sichuan (Code du projet : YCH-KY-YCZD2024-075)
matériels
| Name | Company | Catalog Number | Comments |
| Electrocantery | Hangzhou Kangji Medical Instrument Co., Ltd | KJ-SJ0205 | Sterile,dry heat sterilized, reusable |
| Gold finger | Hangzhou Kangji Medical Instrument Co., Ltd | 101.237Φ10*350mm | Sterile,dry heat sterilized, reusable |
| Non-absorbable suture | Johnson & Johnson MEDICAL (CHINA) Ltd | 2-0/W2512 | Sterile, ethylene oxide sterilized, disposable |
| Non-traumatic forceps | Hangzhou Kangji Medical Instrument Co., Ltd | Φ10×260 | Sterile,dry heat sterilized, reusable |
| Soft rubber ureteric catheter | Yangzhou Jinhuan Medical Appliance factory | Type A 5.3mm(16Fr) | Sterile, ethylene oxide sterilized, disposable |
| Trocar | Zhejiang Geyi Medical Instrument Co.,Ltd | GYTR-I Φ5/Φ10/Φ12 | Sterile, ethylene oxide sterilized, disposable |
Références
- Fujiyama, Y., et al. Latest findings on minimally invasive anatomical liver resection. Cancers (Basel). 15 (8), 2218 (2023).
- Reig, M., et al. Bclc strategy for prognosis prediction and treatment recommendation: The 2022 update. J Hepatol. 76 (3), 681-693 (2022).
- Morimoto, M., et al. Minimally invasive anatomic liver resection: Results of a survey of world experts. J Hepatobiliary Pancreat Sci. 29 (1), 33-40 (2022).
- Yang, J. D., Heimbach, J. K. New advances in the diagnosis and management of hepatocellular carcinoma. Bmj. 371, m3544 (2020).
- Cherqui, D. Laparoscopic liver resection: A new paradigm in the management of hepatocellular carcinoma. J Hepatol. 63 (3), 540-542 (2015).
- Morimoto, M., et al. Glissonean pedicle isolation focusing on the laennec's capsule for minimally invasive anatomical liver resection. J Pers Med. 13 (7), 1154 (2023).
- Sugioka, A., Kato, Y., Tanahashi, Y. Systematic extrahepatic glissonean pedicle isolation for anatomical liver resection based on laennec's capsule: Proposal of a novel comprehensive surgical anatomy of the liver. J Hepatobiliary Pancreat Sci. 24 (1), 17-23 (2017).
- Kato, Y., et al. Laparoscopic isolated liver segmentectomy 8 for malignant tumors: Techniques and comparison of surgical results with the open approach using a propensity score-matched study. Langenbecks Arch Surg. 407 (7), 2881-2892 (2022).
- Kim, J. H., Kim, H. Laparoscopic right hemihepatectomy using the glissonean approach: Detachment of the hilar plate (with video). Ann Surg Oncol. 28 (1), 459-464 (2021).
- Maeda, K., et al. Pure laparoscopic right hemihepatectomy using the caudodorsal side approach (with videos). J Hepatobiliary Pancreat Sci. 25 (7), 335-341 (2018).
- Wakabayashi, G., et al. Recommendations for laparoscopic liver resection: A report from the second international consensus conference held in morioka. Ann Surg. 261 (4), 619-629 (2015).
- Gotohda, N., et al. Expert consensus guidelines: How to safely perform minimally invasive anatomic liver resection. J Hepatobiliary Pancreat Sci. 29 (1), 16-32 (2022).
- Kato, Y., et al. Minimally invasive anatomic liver resection for hepatocellular carcinoma using the extrahepatic glissonian approach: Surgical techniques and comparison of outcomes with the open approach and between the laparoscopic and robotic approaches. Cancers (Basel). 15 (8), 2219 (2023).
- Xi, C., et al. A novel difficulty scoring system of laparoscopic liver resection for liver tumor. Front Oncol. 12, 1019763 (2022).
- Liu, J., et al. The difference in prolonged continuous and intermittent pringle maneuver during complex hepatectomy for hepatocellular carcinoma patients with chronic liver disease: A retrospective cohort study. Cancer Med. 10 (23), 8507-8517 (2021).
- Hu, Y., et al. Laennec's approach for laparoscopic anatomic hepatectomy based on Laennec's capsule. BMC Gastroenterol. 19 (1), 194 (2019).
- Zhang, Y., et al. Intermittent pringle maneuver versus continuous hemihepatic vascular inflow occlusion using extra-glissonian approach in laparoscopic liver resection. Surg Endosc. 30 (3), 961-970 (2016).
- Park, J. B., et al. Effect of intermittent hepatic inflow occlusion with the pringle maneuver during donor hepatectomy in adult living donor liver transplantation with right hemiliver grafts: A prospective, randomized controlled study. Liver Transpl. 18 (1), 129-137 (2012).
- Kawaguchi, Y., Fuks, D., Kokudo, N., Gayet, B. Difficulty of laparoscopic liver resection: Proposal for a new classification. Ann Surg. 267 (1), 13-17 (2018).
- Benson, A. B., et al. Hepatobiliary cancers, version 2.2021, NCCN clinical practice guidelines in oncology. J Natl Compr Canc Netw. 19 (5), 541-565 (2021).
- Cho, A., et al. Relationship between right portal and biliary systems based on reclassification of the liver. Am J Surg. 193 (1), 1-4 (2007).
- Cho, A., et al. Anterior fissure of the right liver--the third door of the liver. J Hepatobiliary Pancreat Surg. 11 (6), 390-396 (2004).
- Cho, A., et al. Relation between hepatic and portal veins in the right paramedian sector: Proposal for anatomical reclassification of the liver. World J Surg. 28 (1), 8-12 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon