Method Article
Imagem de cálcio dos gânglios da raiz dorsal torácica (DRG) in vivo e registro de ECG para estudar a estimulação de nervos periféricos
Neste Artigo
Resumo
Este estudo apresenta uma manipulação cirúrgica para expor o T-DRG em camundongos anestesiados para imagens de cálcio in vivo , juntamente com registros de ECG síncronos. Este método representa uma ferramenta de ponta para estudar a estimulação elétrica nervosa periférica e as entradas de órgãos viscerais torácicos, bem como suas interações no nível sensorial primário.
Resumo
Os gânglios da raiz dorsal (DRG), que abrigam neurônios sensoriais primários, transmitem entradas aferentes somatossensoriais e viscerais para o corno dorsal da medula espinhal. Eles desempenham um papel fundamental em estados fisiológicos e patológicos, incluindo dor neuropática e visceral. A imagem de cálcio in vivo do DRG permite a observação em tempo real de transientes de cálcio em unidades únicas ou conjuntos de neurônios. Evidências acumuladas indicam que as atividades neuronais do DRG induzidas pela estimulação somática afetam significativamente as funções autonômicas e viscerais. Embora a imagem de cálcio DRG lombar tenha sido extensivamente estudada, a imagem de cálcio DRG do segmento torácico tem sido menos explorada devido à exposição cirúrgica e aos desafios de fixação estereotáxica. Aqui, utilizamos imagens de cálcio in vivo no gânglio da raiz dorsal torácica1 (T1-DRG) para investigar alterações na atividade neuronal resultantes de estímulos somáticos do membro anterior. Essa abordagem é crucial para a compreensão do reflexo somatocardíaco desencadeado por estímulos de nervos periféricos (PENS), como a acupuntura. Notavelmente, a sincronização da função cardíaca foi observada e medida por eletrocardiograma (ECG), com atividades neuronais T-DRG, potencialmente estabelecendo um novo paradigma para o reflexo somato-visceral nos segmentos torácicos.
Introdução
Os neurônios dos gânglios da raiz dorsal (DRG) processam informações sensoriais aferentes de receptores somáticos e viscerais. A regulação da função cardíaca envolve não apenas aferentes sensoriais primários das vísceras, mas também neurônios somatossensoriais dentro do mesmo segmento DRG torácico (T-DRG). Uma pesquisa publicada recentemente na 'Circulation' indicou que o T-DRG desempenha um papel na regulação da função cardíaca. O bloqueio de Piezo1/IL-6 no T-DRG inibiu a sinalização inflamatória de IL-6/STAT3, atenuando assim o remodelamento ventricular pós-infarto do miocárdio (IM)1. Além disso, Cui et al.2 encontraram em ratos com IM que a germinação simpática e o acoplamento simpato-sensorial ocorreram em DRGs T1-5 e na pele dos membros superiores, contribuindo para a dor referida relacionada ao coração. A estimulação somática na área de dor referida aumentou a descarga simpática e regulou a função cardíaca. No entanto, devido a limitações técnicas, alterações no T-DRG de entradas cardíacas e somáticas pré e pós-IM ou estimulação somática foram observadas somente após o sacrifício do animal. Portanto, observar as atividades neurais dentro do T-DRG é crucial para entender sua intrincada relação com as alterações da função visceral.
Nos últimos anos, os avanços nos indicadores sensíveis de cálcio geneticamente codificados (GECIs)3, juntamente com a microscopia confocal e a tecnologia de imagem multifóton, permitiram aos cientistas não apenas descrever a atividade e o diâmetro neuronal, mas também combinar técnicas de marcação genética, como Pirt4 e rastreamento neural para observar neurônios específicos durante a imagem5. Essa abordagem integrada ajuda a descobrir princípios científicos mais profundos. No entanto, até recentemente, os métodos para estudar imagens de cálcio in vivo do DRG eram predominantemente limitados aos segmentos lombares6.
O T-DRG em camundongos é relativamente pequeno e circular, localizado anterior e medial ao forame intervertebral, com um total de 13 pares. Devido à curvatura fisiológica das vértebras torácicas, o espaço entre os segmentos vertebrais torácicos adjacentes, especialmente T1-5, é muito estreito, aumentando a dificuldade de exposição. A fixação apresenta outro desafio para a imagem estável de cálcio do DRG em um único plano. Cada lado do T-DRG é adjacente a duas superfícies de costela, e cada superfície de costela da vértebra está presa à costela correspondente, complicando ainda mais o espaço já apertado. Com base nos primeiros métodos de imagem de cálcio para DRGlombar 7, esta equipe de pesquisa desenvolveu um método de imagem de cálcio in vivo para T-DRG usando uma pinça espinhal feita sob medida. Além disso, vários estudos demonstraram que a estimulação elétrica nervosa periférica, como a acupuntura, pode induzir a atividade neural do DRG e regular a função visceral 8,9,10. Para entender melhor a relação entre o DRG e a regulação da função cardíaca mediada por acupuntura, o registro síncrono da função cardíaca durante a imagem de cálcio DRG foi implementado, oferecendo novos insights de pesquisa sobre como a atividade neuronal induzida por estimulação somática no T-DRG influencia a regulação da função visceral.
Esta pesquisa exclusiva detalha a exposição e fixação do T-DRG de camundongo, garantindo imagens de cálcio estáveis juntamente com o registro da função cardíaca. Isso fornece uma ferramenta científica de ponta para estudar os mecanismos periféricos das alterações funcionais viscerais torácicas e explorar ainda mais as entradas aferentes visceral-somáticas.
Protocolo
Todos os procedimentos seguiram as diretrizes dos Institutos Nacionais de Saúde para o cuidado e uso de animais de laboratório e foram aprovados pelo Comitê de Ética em Cuidados e Uso de Animais do Instituto de Acupuntura e Moxabustão, Academia Chinesa de Ciências Médicas Chinesas. Para imagens de cálcio in vivo de neurônios DRG, foram usados camundongos Pirt-GCaMP6s adultos (20-25 g, ambos os sexos). Esses camundongos foram gerados pelo cruzamento de camundongos Pirt-Cre com camundongos Rosa26-loxP-STOP-loxP-GCaMP6s (ver Tabela de Materiais). Eles foram alojados no biotério do Instituto de Acupuntura e Moxabustão, Academia Chinesa de Ciências Médicas Chinesas, sob condições controladas (temperatura ambiente: 22-24 °C, umidade: 50%-60%, ciclo claro-escuro de 12 horas), com acesso ad libitum a comida e água. Os animais foram submetidos a uma semana de aclimatização antes da experimentação. Durante os experimentos, os animais foram anestesiados, mantidos em temperatura quente e monitorados quanto à resposta à dor para garantir a profundidade adequada da anestesia. Após os experimentos, os animais foram eutanasiados sob anestesia profunda (isoflurano a 5%). Os detalhes dos reagentes e do equipamento utilizado estão listados na Tabela de Materiais.
1. Preparo pré-operatório
- Verifique o funcionamento adequado do dispositivo de ventilação anestésica, do sistema de imagem e do monitor de eletrocardiograma e ative-os sequencialmente.
- Administre uma injeção intraperitoneal de tribromoetanol a 1,25% (0,2 mL por 10 g de peso corporal) para anestesiar o camundongo). Avalie a profundidade da anestesia beliscando firmemente a pata traseira do camundongo para garantir que não haja resposta.
- Se ocorrerem sinais de dor durante o procedimento cirúrgico, administre uma injeção intraperitoneal adicional de 0,2 mL de solução de tribromoetanol ou use uma máquina de anestesia para fornecer isoflurano a 0,5% a 1% para evitar espasmos musculares e garantir a profundidade adequada da anestesia.
- Remova o cabelo da parte anterior do pescoço e posterior das costas dos camundongos.
- Posicione o mouse em decúbito dorsal em um cobertor de aquecimento e aplique pomada oftálmica nos olhos do mouse para evitar o ressecamento.
2. Traqueotomia
- Desinfete a pele do pescoço com iodo. Faça uma incisão vertical de 1 cm no centro da pele anterior à traqueia.
- Expanda a incisão da pele e desloque as glândulas na frente da traqueia. Exponha o músculo digástrico, separe-o sem rodeios e exponha a traqueia. Separe suavemente a traqueia dos tecidos circundantes.
- Use uma tesoura de mola para criar uma incisão transversal na traqueia. Insira um tubo endotraqueal na traqueia, direcionando-o para os pulmões (Figura 1A). Prenda a traqueia com sutura cirúrgica 3-0 para evitar vazamento de ar e remoção acidental do cateter.
- Substitua os músculos e glândulas paratraqueais sobre a traqueia. Feche a pele do pescoço usando suturas 6-0.
3. Exposição das vértebras torácicas
- Coloque o mouse em uma posição de bruços em uma almofada aquecida. Faça uma incisão longitudinal de 2 cm no centro da nuca, estendendo-se das vértebras C6 a T3.
- Separe cuidadosamente as glândulas gordurosas e hibernantes na face anterior das vértebras torácicas do camundongo, tomando cuidado para evitar os vasos sanguíneos sob as glândulas. Use uma tesoura de mola para cortar a pele e as camadas musculares, incluindo o músculo trapézio. Insira um afastador entre os músculos para ajudar na exposição adicional.
- Remova os músculos ligados ao grampo de cabeça e a porção reta dos músculos longos do pescoço, expondo os processos espinhosos de T2.
- Desloque os músculos semiespinhal e espinhal para expor o arco vertebral de C6 a T3 (ver Figura 1B).
NOTA: Durante o processo de exposição das vértebras torácicas, certifique-se de que atenção especial seja dada à preservação do processo espinhoso de T2, pois ele serve como o principal ponto de aplicação de força para exposição subsequente de T1-DRG.
4. Exposição de T1-DRG
- Corte a conexão entre a placa do arco vertebral e o processo articular de T1. Use pinças finas para remover meticulosamente os processos articulares esquerdo e direito e os processos mamilares de T1.
- Depois de limpar o tecido conjuntivo sobrejacente, exponha cuidadosamente o DRG T1 esquerdo ou direito, garantindo a integridade do epineuro no lado escolhido.
- Coloque uma pequena bola de algodão embebida em solução salina morna sobre a área exposta do DRG para manter a umidade (consulte a Figura 1C).
NOTA: Os tecidos circundantes do DRG podem ser cobertos com uma esponja hemostática para evitar vazamento de sangue durante a cirurgia. Troque as bolas de algodão umedecidas conforme necessário para manter uma visão clara da área cirúrgica quando embebida em derrames hemorrágicos.
5. Fixação de vértebras torácicas e detecção de ECG
- Coloque o mouse no stage do grampo espinhal personalizado com uma almofada de aquecimento (consulte a Figura 1D).
- Prenda o mouse usando dois clipes presos aos processos articulares de C6 e T3 para minimizar o movimento devido à estimulação nervosa (ver Figura 1E).
- Conecte o monitor de ECG com o pólo negativo no membro superior direito, o fio terra no membro inferior direito e o pólo positivo no membro inferior esquerdo (consulte a Figura 1F).
- Substitua continuamente as bolas de algodão embebidas em solução salina até que a área cirúrgica esteja suficientemente limpa.
NOTA: Garanta a limpeza completa dos músculos e tecidos ao redor dos processos articulares de C6 e T3, especialmente na região onde a pinça espinhal personalizada é aplicada para fixação da coluna vertebral, para evitar o deslocamento durante os experimentos subsequentes.
6. Configuração de hardware e software para imagens
- Posicione a braçadeira espinhal com o mouse preso sob o microscópio confocal (consulte a Figura 1G).
- Conecte a máquina de anestesia respiratória (0,5%-1% de isoflurano) e a almofada de aquecimento e ajuste os parâmetros relevantes com base na condição física do mouse para garantir o bem-estar animal.
- Coloque a objetiva de ar de longa distância de trabalho de 10x/0.32 do microscópio confocal sobre o T1-DRG exposto para aquisição de imagens (consulte a Figura 1H).
- Capture todo o T1-DRG ajustando o eixo z da platina para cima e para baixo, com um tamanho de passo de 25 μm e uma resolução de 512 x 512 ou 1024 x 1024 pixels.
- Execute a varredura XYZT do DRG com 8 pilhas compreendendo 1-2 estados de linha de base, 3-6 estímulos de pincel ou PENS e 7-8 estados pós-estímulos.
NOTA: Para garantir uma visão abrangente e clara da morfologia do DRG, posicione o DRG perpendicularmente à lente. Ajuste o ângulo de inclinação de cada mouse usando o estágio personalizado de acordo com os requisitos práticos.
7. Estímulos somáticos e imagem
- Aplique estimulação com escova no membro superior do camundongo para avaliar a capacidade de resposta dos neurônios DRG imageados (ver Figura 1H).
- Realize a estimulação PENS-PC6 usando um estimulador (ver Figura 1F).
NOTA: O PC6 está localizado 1-2 mm proximal à prega palmar do punho, entre o tendão do flexor ulnar do carpo e o tendão do flexor superficial dos dedos. Os parâmetros de estimulação são definidos para 15 Hz e 1 mA para 3-6 pilhas.
8. Análise e tratamento dos dados
- No software de microscopia confocal, avalie as respostas de cálcio evocadas por vários estímulos, comparando o aumento na intensidade da fluorescência verde quando os neurônios são estimulados por GCaMP após a ligação do cálcio dentro da célula (ver Figura 2A-C).
- Use o software Fiji para rastrear manualmente as células visíveis e medir seu tamanho e intensidade relativa de fluorescência (consulte a Figura 2D).
- Expresse a intensidade de fluorescência como a razão entre o aumento máximo de fluorescência evocada e o nível basal (Ft/F0), onde a linha de base (F0) representa a intensidade máxima de fluorescência medida durante o período basal.
- Defina a ativação celular como um aumento na intensidade de fluorescência (Ft/F0) ≥130% de F0 (ver Figura 2E,F).
- Classifique os neurônios DRG em neurônios de pequeno porte (<20 μm), neurônios de tamanho médio (20-30 μm) e neurônios de grande porte (>30 μm) com base em seu diâmetro11 (ver Figura 2G).
- Observe as alterações na frequência cardíaca causadas pela estimulação somática usando o software de registro de ECG (ver Figura 2H).
NOTA: A frequência cardíaca de camundongos é facilmente influenciada por estímulos externos e anestesia respiratória. Ao observar a resposta da frequência cardíaca a um estímulo, espere que a frequência cardíaca se estabilize antes de administrar o estímulo.
Resultados
Seguindo o protocolo descrito, o T1-DRG de camundongos transgênicos Pirt-GCaMP6s foi exposto a vários estímulos somáticos. O objetivo deste experimento foi observar mudanças no número e tipo de neurônios e na função cardíaca induzidas por diferentes estímulos.
Conforme ilustrado na Figura 2A, sob condições basais, a maioria dos neurônios no T1-DRG não exibiu fluorescência GFP. Essa fluorescência basal pode ser influenciada por dois fatores: o nível de expressão de GCaMP e o dano potencial ao DRG durante a cirurgia. A estimulação somática resultou em um aumento rápido e transitório na fluorescência do GCaMP, juntamente com um aumento no número e intensidade da GFP, conforme ilustrado na Figura 2B. Alterações semelhantes foram observadas quando o PENS-PC6 foi aplicado, conforme mostrado na Figura 2C. A Figura 2D destaca as células selecionadas e numeradas circuladas usando software de imagem na Figura 2C.
Como mencionado anteriormente, mudanças na intensidade de fluorescência que excedam 130% do nível limite F0 são consideradas respostas positivas. O mapa de calor e o gráfico de linhas na Figura 2E, F exibem as respostas de todos os neurônios circulados no software de imagem à estimulação PENS-PC6. A Figura 2G apresenta um histograma dos diferentes diâmetros dos neurônios responsivos ao PENS-PC6, enquanto a Figura 2H ilustra um diagrama esquemático do aumento da frequência cardíaca com o PENS-PC6.
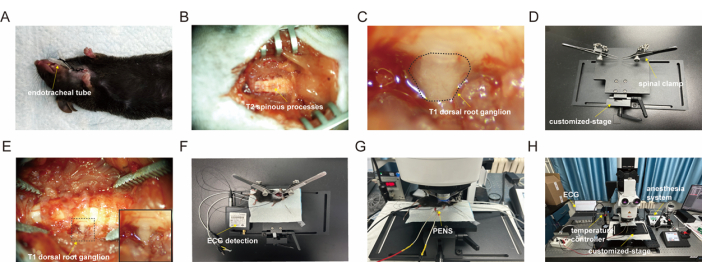
Figura 1: Procedimento cirúrgico do T1-DRG. (A) Intubação da traqueia em camundongo. (B) Vértebras torácicas após a remoção dos tecidos circundantes. (C) T1-DRG exposto. (D) Estágio personalizado, este estágio pode ser inclinado em diferentes ângulos e o grampo espinhal com contas universais é instalado. (E) Fixação local da pinça espinhal. (F) Conexão do monitor de ECG. (G) Imagem de cálcio usando microscopia confocal. (H) Configuração experimental para imagens de cálcio de T1-DRG. Clique aqui para ver uma versão maior desta figura.
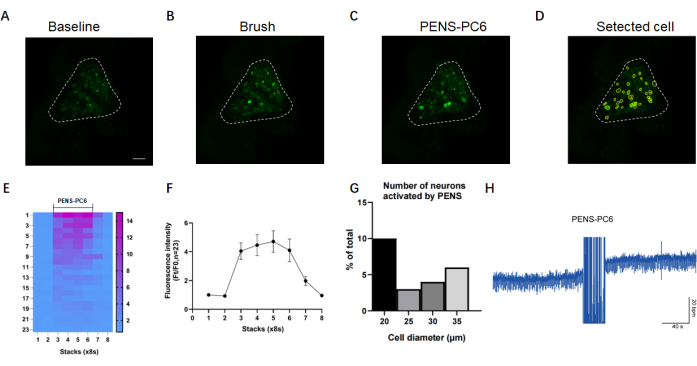
Figura 2: Imagens representativas e análise de imagens de cálcio in vivo dos neurônios T1-DRG. Imagens representativas em (A-C) mostram neurônios T1-DRG na linha de base, Brush e estimulação PENS. (D) As células marcadas e numeradas dentro de um único T1-DRG após o rastreamento com software de imagem. Barras de escala: 100 μm. (E,F) Mapa de calor e gráfico de linhas que descreve as mudanças na intensidade de fluorescência de células traçadas sob estimulação PENS-PC6. (G) Descrição do número de células responsivas a diferentes tamanhos de estimulação PENS-PC6. As barras de erro representam a média ± EPM (N = 1). (H) O aumento da frequência cardíaca durante a estimulação PENS do PC6. Clique aqui para ver uma versão maior desta figura.
Discussão
Neste estudo, é descrito um método para imagem de cálcio do DRG do segmento torácico T1, que tem valor significativo para estudar a transmissão aferente de neurônios sensoriais viscerais cardiopulmonares e a comunicação somato-visceral. Além disso, uma abordagem geral é apresentada para monitorar a atividade do cálcio nos neurônios DRG e as alterações na função cardíaca simultaneamente, permitindo a análise de correlação da atividade neural e das respostas cardíacas.
As técnicas de imagem de cálcio, usando corantes sensíveis a Ca2+ ou indicadores de Ca2+ geneticamente codificados para obter imagens intracelulares de Ca2+ como uma medida indireta do disparo do potencial de ação, permitem a observação em tempo real de neurônios individuais ou respostas de clusters neuronais a vários estímulos. Atualmente, a maioria dos estudos de imagem de cálcio na DRG tem se limitado aos segmentos lombares12. Em comparação com o DRG lombar, o DRG torácico é menor, situado próximo às costelas e vértebras torácicas, e apresenta um risco aumentado de pneumotórax durante procedimentos cirúrgicos. Portanto, duas questões principais devem ser superadas para realizar imagens de cálcio no T-DRG.
A primeira questão é a exposição do T-DRG. Usando T1-DRG como exemplo, T1-DRG está localizado abaixo do arco vertebral de T1. Quando o osso é removido das vértebras da lâmina arcosa e do processo articular, ele é propenso a sangramento e requer manuseio cuidadoso. Como a imagem de cálcio requer o rastreamento de mudanças na atividade do íon cálcio nos neurônios antes e depois da estimulação, é necessário garantir que o DRG esteja fixado de forma estável no lugar. No entanto, devido à curvatura fisiológica das vértebras cervicais e torácicas, o espaço entre as vértebras T1-T3 é estreito, tornando a fixação do DRG torácico a segunda questão crítica a ser abordada.
A pinça espinhal destinada aos segmentos lombares foi modificada triturando a extremidade frontal das pinças jacaré com uma lixa até uma espessura de 1 mm para fixação7. Enquanto isso, os músculos e tecidos conjuntivos ao redor dos segmentos fixos foram removidos de forma limpa, evitando danos aos vasos sanguíneos. A pinça espinhal da extremidade da cabeça foi fixada ao processo articular de C6, e a pinça espinhal da extremidade da cauda foi fixada ao processo articular de T3.
A implementação da imagem de cálcio levou a inúmeros avanços na compreensão dos mecanismos neuronais do DRG relacionados a doenças viscerais 13,14. Recentemente, Sun et al. demonstraram que Piezo1 ou seu efetor a jusante IL-6 em neurônios T-DRG mediaram uma cascata inflamatória neurogênica após IM usando abordagens celulares e moleculares. No entanto, a relação funcional entre os neurônios DRG e as funções cardíacas permanece desconhecida devido a dificuldades técnicas. Foram realizados registros sincronizados da função cardíaca e dos neurônios T-DRG ativados, proporcionando uma compreensão mais intuitiva da correlação entre a atividade neuronal e as alterações na função cardíaca. Durante esses experimentos, foram observadas alterações na frequência cardíaca em camundongos usando PENS no PC6, com imagens simultâneas de cálcio sendo realizadas. Os resultados mostraram que o PENS-PC6 pode aumentar a atividade de cálcio no T1-DRG e elevar a frequência cardíaca. Essa abordagem não apenas abre caminho para estudos in vivo de distúrbios cardíacos relacionados aos gânglios sensoriais, mas também fornece uma ferramenta importante para investigar o envolvimento dos neurônios sensoriais primários nos efeitos benéficos do PENS na função cardíaca.
Esse paradigma de pesquisa também pode ser combinado com outros métodos de pesquisa, como a optogenética15,16 e as intervenções farmacológicas17. Por exemplo, Takuya Okada et al.14,15 geraram padrões holográficos de estimulação optogenética usando um modulador de luz espacial (SLM) e, posteriormente, integraram essa estimulação holográfica com imagens de dois fótons. Eles conduziram experimentos para estimular neurônios individuais e combinaram imagens de cálcio in vivo para observar as respostas dos neurônios circundantes, com o objetivo de investigar a conectividade funcional entre as células. Como o acoplamento neuronal representa uma forma importante de plasticidade neuronal no DRG, a combinação de estimulação holográfica e imagem de cálcio pode elucidar as interações entre os subtipos de neurônios nos gânglios sensoriais. As interações neurônio-célula glial satélite (SGC) DRG podem afetar a transmissão nociceptiva18. Os receptores P2-purinérgicos (P2Rs) são elementos-chave nas interações bidirecionais entre os neurônios DRG e o SGC19. Chen et al.17 realizaram imagens de cálcio in vivo utilizando α,β-MeATP (um agonista seletivo de P2R) no DRG e observaram que o α,β-MeATP provocou ativação robusta de pequenos neurônios, presumivelmente nociceptores. Eles combinaram imagens de cálcio com técnicas farmacológicas no DRG para investigar o papel da sinalização P2R dentro do DRG, que desempenha um papel significativo na excitabilidade e na transmissão da dor dos neurônios nociceptivos. Assim, esta metodologia de pesquisa, que incorpora abordagens optogenéticas e farmacológicas, servirá como uma ferramenta valiosa para o estudo de neurônios sensoriais viscerais que transmitem entradas cardiorrespiratórias, bem como comunicações somático-viscerais.
Uma limitação técnica deste estudo é a incapacidade de realizar imagens crônicas de cálcio DRG em camundongos durante seus estados comportamentais acordados. A anestesia tem o potencial de diminuir os sinais de propriocepção e sensação visceral, deixando a atividade dos neurônios T-DRG em contextos de sensação natural para ser mais investigada. Como Chen et al. desenvolveram um método de fusão intervertebral para imagens de DRG lombar em resolução celular e subcelular ao longo de semanas em camundongos acordados, estudos futuros devem considerar a abordagem de monitoramento longitudinal da atividade dos neurônios no T-DRG20.
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Este estudo foi financiado pela Fundação Nacional de Ciências Naturais da China (nº 82174518, 82074561, 82105029).
Materiais
| Name | Company | Catalog Number | Comments |
| Acupuncture Needle | ZhongYanTianHe | 0.25/13s | |
| Anesthesia System | Kent Scientific | SomnoSuite | |
| Animal Bio Amp | ADInstruments | NSW | |
| Confocal Microscope | Leica | STELLARIS 8 | |
| DC Temperature Controller | FHC | 40-90-8D | |
| DC Temperature Controller Heating Pad | FHC | 40-90-2-05 | |
| Fiji | National Institute of Health | N/A | |
| Fine Forceps | RWD | F11028-13 | |
| Fine Ophthalmic Forceps | Jinzhong | JD1060 | |
| Gelatin Sponges | Coltene | 274-007 | |
| Intubation Cannula | Harward Apparatus | 73-2737 | |
| Isoflurane | RWD | R510 | |
| LabChart Professional Software | ADInstruments | Version 8.0 | |
| LAS X | Leica | N/A | |
| Pirt-cre mice | Johns Hopkins University | N/A | |
| Retractor | Fine Science Tools | 16G212 | |
| Rosa-GCaMP6s mice (AI96) | Jax Laboratory | 28866 | |
| Spinal Clamp | N/A | N/A | Custom made |
| Spring Scissors | Jinzhong | YBC040 | |
| Stimulator | AMPI | Master-8 | |
| Tribromoethanol | Sigma | T48402 | |
| Wireless Biological Acquisition System | Kardiotek Biomedical Technologie | KLB-1 |
Referências
- Sun, M., et al. Piezo1-mediated neurogenic inflammatory cascade exacerbates ventricular remodeling after myocardial infarction. Circulation. 149 (19), 1516-1533 (2024).
- Cui, X., et al. Referred somatic hyperalgesia mediates cardiac regulation by the activation of sympathetic nerves in a rat model of myocardial ischemia. Neurosci Bull. 38 (4), 386-402 (2022).
- Zhang, Y., et al. Fast and sensitive GCaMP calcium indicators for imaging neural populations. Nature. 615 (7954), 884-891 (2023).
- Kim, S. H., et al. Mapping of sensory nerve subsets within the vagal ganglia and the brainstem using reporter mice for Pirt, TRPV1, 5-HT3, and Tac1 expression. eNeuro. 7 (2), (2020).
- Rothermel, M., et al. Advanced tracing tools: Functional neuronal expression of virally encoded fluorescent calcium indicator proteins. J Neurovirol. 15 (5-6), 458-464 (2009).
- Shannonhouse, J., Gomez, R., Son, H., Zhang, Y., Kim, Y. S. In vivo calcium imaging of neuronal ensembles in networks of primary sensory neurons in intact dorsal root ganglia. J Vis Exp. (192), e64826 (2023).
- Liu, K., et al. In vivo calcium imaging of dorsal root ganglia neurons' response to somatic and visceral stimuli. J Vis Exp. (205), e65975 (2024).
- Feng, J. T., Hu, C. P., Li, X. Z. Dorsal root ganglion: The target of acupuncture in the treatment of asthma. Adv Ther. 24 (3), 598-602 (2007).
- Guo, Z. L., et al. Role of TRPV1 in acupuncture modulation of reflex excitatory cardiovascular responses. Am J Physiol Regul Integr Comp Physiol. 314 (5), R655-R666 (2018).
- Li, S., et al. Perspective of calcium imaging technology applied to acupuncture research. Chin J Integr Med. 30 (1), 3-9 (2024).
- Kim, Y. S., et al. Coupled activation of primary sensory neurons contributes to chronic pain. Neuron. 91 (5), 1085-1096 (2016).
- Zheng, Q., et al. Synchronized cluster firing, a distinct form of sensory neuron activation, drives spontaneous pain. Neuron. 110 (2), 209-220.e206 (2022).
- Gao, X., et al. Calcium imaging in population of dorsal root ganglion neurons unravels novel mechanisms of visceral pain sensitization and referred somatic hypersensitivity. Pain. 162 (4), 1068-1081 (2021).
- Caldwell, A., et al. TGR5 agonists induce peripheral and central hypersensitivity to bladder distension. Sci Rep. 12 (1), 9920 (2022).
- Okada, T., et al. Pain induces stable, active microcircuits in the somatosensory cortex that provide a therapeutic target. Sci Adv. 7 (12), 8261 (2021).
- Malik, R., Li, Y., Schamiloglu, S., Sohal, V. S. Top-down control of hippocampal signal-to-noise by prefrontal long-range inhibition. Cell. 185 (9), 1602-1617.e17 (2022).
- Chen, Z., et al. Purinergic signaling between neurons and satellite glial cells of mouse dorsal root ganglia modulates neuronal excitability in vivo. Pain. 163 (8), 1636-1647 (2022).
- Hanani, M., Spray, D. C. Emerging importance of satellite glia in nervous system function and dysfunction. Nat Rev Neurosci. 21 (9), 485-498 (2020).
- Serrano, A., et al. Differential expression and pharmacology of native P2X receptors in rat and primate sensory neurons. J Neurosci. 32 (34), 11890-11896 (2012).
- Chen, C., et al. Long-term imaging of dorsal root ganglia in awake behaving mice. Nat Commun. 10 (1), 3087 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados