Method Article
Imaging del calcio dei gangli della radice dorsale toracica (DRG) in vivo e registrazione ECG per lo studio della stimolazione dei nervi periferici
In questo articolo
Riepilogo
Questo studio presenta una manipolazione chirurgica per esporre il T-DRG in topi anestetizzati per l'imaging del calcio in vivo , insieme a registrazioni ECG sincrone. Questo metodo rappresenta uno strumento all'avanguardia per lo studio della stimolazione elettrica dei nervi periferici e degli input degli organi viscerali toracici, nonché delle loro interazioni a livello sensoriale primario.
Abstract
I gangli della radice dorsale (DRG), che ospitano i neuroni sensoriali primari, trasmettono input afferenti somatosensoriali e viscerali al corno dorsale del midollo spinale. Svolgono un ruolo fondamentale sia negli stati fisiologici che in quelli patologici, tra cui il dolore neuropatico e viscerale. L'imaging in vivo del calcio DRG consente l'osservazione in tempo reale dei transitori del calcio in singole unità o insiemi di neuroni. Prove crescenti indicano che le attività neuronali DRG indotte dalla stimolazione somatica influenzano significativamente le funzioni autonomiche e viscerali. Mentre l'imaging del calcio DRG lombare è stato ampiamente studiato, l'imaging del calcio DRG del segmento toracico è stato meno esplorato a causa dell'esposizione chirurgica e delle sfide di fissazione stereotassica. Qui, abbiamo utilizzato l'imaging del calcio in vivo al ganglio della radice dorsale toracica1 (T1-DRG) per studiare i cambiamenti nell'attività neuronale derivanti da stimolazioni somatiche dell'arto anteriore. Questo approccio è fondamentale per comprendere il riflesso somato-cardiaco innescato dalle stimolazioni dei nervi periferici (PENS), come l'agopuntura. In particolare, la sincronizzazione della funzione cardiaca è stata osservata e misurata mediante elettrocardiogramma (ECG), con le attività neuronali T-DRG, stabilendo potenzialmente un nuovo paradigma per il riflesso somato-viscerale nei segmenti toracici.
Introduzione
I neuroni dei gangli della radice dorsale (DRG) elaborano le informazioni sensoriali afferenti provenienti sia dai recettori somatici che da quelli viscerali. La regolazione della funzione cardiaca coinvolge non solo le afferenze sensoriali primarie dei visceri, ma anche i neuroni somatosensoriali all'interno dello stesso segmento DRG toracico (T-DRG). Una ricerca pubblicata di recente su «Circulation» ha indicato che il T-DRG svolge un ruolo nella regolazione della funzione cardiaca. Il blocco di Piezo1/IL-6 nel T-DRG ha inibito la segnalazione infiammatoria di IL-6/STAT3, attenuando così il rimodellamento ventricolare post-infarto del miocardio (MI)1. Inoltre, Cui et al.2 hanno scoperto nei ratti con MI che la germinazione simpatica e l'accoppiamento simpatico-sensoriale si sono verificati nei DRG T1-5 e nella pelle degli arti superiori, contribuendo al dolore riferito al cuore. La stimolazione somatica nell'area del dolore riferito ha aumentato la secrezione simpatica e regolato la funzione cardiaca. Tuttavia, a causa di limitazioni tecniche, i cambiamenti nel T-DRG da input cardiaci e somatici pre e post infarto miocardico o stimolazione somatica sono stati osservati solo dopo il sacrificio animale. Pertanto, l'osservazione delle attività neurali all'interno del T-DRG è fondamentale per comprendere la sua intricata relazione con le alterazioni della funzione viscerale.
Negli ultimi anni, i progressi negli indicatori di calcio geneticamente codificati (GECI)3 sensibili, insieme alla microscopia confocale e alla tecnologia di imaging multi-fotone, hanno permesso agli scienziati non solo di descrivere l'attività e il diametro neuronale, ma anche di combinare tecniche di marcatura genetica come Pirt4 e il tracciamento neurale per osservare neuroni specifici durante l'imaging5. Questo approccio integrato aiuta a scoprire principi scientifici più profondi. Tuttavia, fino a poco tempo fa, i metodi per lo studio dell'imaging del calcio in vivo del DRG erano prevalentemente limitati ai segmenti lombari6.
I T-DRG nei topi sono relativamente piccoli e circolari, situati anteriormente e medialmente al forame intervertebrale, con un totale di 13 paia. A causa della fisiologica curvatura delle vertebre toraciche, lo spazio tra i segmenti vertebrali toracici adiacenti, soprattutto T1-5, è molto stretto, aumentando la difficoltà di esposizione. La fissazione rappresenta un'altra sfida per l'imaging stabile del calcio DRG su un singolo piano. Ogni lato del T-DRG è adiacente a due superfici costali e ogni superficie costale della vertebra è attaccata alla costola corrispondente, complicando ulteriormente lo spazio già angusto. Basandosi sui primi metodi di imaging del calcio per il DRG7 lombare, questo team di ricerca ha sviluppato un metodo di imaging del calcio in vivo per il T-DRG utilizzando un morsetto spinale su misura. Inoltre, numerosi studi hanno dimostrato che la stimolazione del nervo elettrico periferico, come l'agopuntura, può indurre l'attività neurale DRG e regolare la funzione viscerale 8,9,10. Per comprendere meglio la relazione tra DRG e regolazione della funzione cardiaca mediata dall'agopuntura, è stata implementata la registrazione sincrona della funzione cardiaca durante l'imaging del calcio DRG, offrendo nuove intuizioni di ricerca su come l'attività neuronale indotta dalla stimolazione somatica nel T-DRG influenzi la regolazione della funzione viscerale.
Questa ricerca unica nel suo genere descrive in dettaglio l'esposizione e la fissazione del T-DRG di topo, garantendo un'imaging stabile del calcio insieme alla registrazione della funzione cardiaca. Ciò fornisce uno strumento scientifico all'avanguardia per studiare i meccanismi periferici delle modificazioni funzionali viscerali toraciche e per esplorare ulteriormente gli input afferenti viscerali-somatici.
Protocollo
Tutte le procedure hanno seguito le linee guida del National Institutes of Health per la cura e l'uso degli animali da laboratorio e sono state approvate dal Comitato Etico per la Cura e l'Uso degli Animali dell'Istituto di Agopuntura e Moxibustione, China Academy of Chinese Medical Sciences. Per l'imaging in vivo del calcio dei neuroni DRG, sono stati utilizzati topi adulti Pirt-GCaMP6s (20-25 g, entrambi i sessi). Questi topi sono stati generati incrociando topi Pirt-Cre con topi Rosa26-loxP-STOP-loxP-GCaMP6s (vedi Tabella dei materiali). Sono stati ospitati nella struttura per animali dell'Istituto di Agopuntura e Moxibustione, Accademia Cinese delle Scienze Mediche Cinesi, in condizioni controllate (temperatura ambiente: 22-24 °C, umidità: 50%-60%, ciclo luce-buio di 12 ore), con accesso ad libitum a cibo e acqua. Gli animali sono stati sottoposti a una settimana di acclimatazione prima della sperimentazione. Durante gli esperimenti, gli animali sono stati anestetizzati, mantenuti a una temperatura calda e monitorati per la risposta al dolore per garantire un'adeguata profondità dell'anestesia. Dopo gli esperimenti, gli animali sono stati soppressi in anestesia profonda (isoflurano al 5%). I dettagli dei reagenti e delle attrezzature utilizzate sono elencati nella Tabella dei Materiali.
1. Preparazione preoperatoria
- Verificare il corretto funzionamento del dispositivo di ventilazione per anestesia, del sistema di imaging e del monitor dell'elettrocardiogramma e attivarli in sequenza.
- Somministrare un'iniezione intraperitoneale di tribromoetanolo all'1,25% (0,2 ml per 10 g di peso corporeo) per anestetizzare il topo). Valutare la profondità dell'anestesia pizzicando con decisione la zampa posteriore del topo per assicurarsi che non ci sia risposta.
- Se si verificano segni di dolore durante la procedura chirurgica, somministrare un'ulteriore iniezione intraperitoneale di 0,2 ml di soluzione di tribromoetanolo o utilizzare una macchina per anestesia per erogare isoflurano allo 0,5%-1% per prevenire gli spasmi muscolari e garantire un'adeguata profondità di anestesia.
- Rimuovi i peli dalla parte anteriore del collo e dalla parte posteriore dei topi.
- Posizionare il mouse in posizione supina su una coperta riscaldante e applicare un unguento oftalmico sugli occhi del topo per evitare che si secchi.
2. Tracheotomia
- Disinfettare la pelle del collo con iodio. Praticare un'incisione verticale di 1 cm al centro della pelle anteriormente alla trachea.
- Espandere l'incisione cutanea e spostare le ghiandole davanti alla trachea. Esporre il muscolo digastrico, separarlo senza mezzi termini ed esporre la trachea. Separare delicatamente la trachea dai tessuti circostanti.
- Usa le forbici a molla per creare un'incisione trasversale nella trachea. Inserire un tubo endotracheale nella trachea, dirigendolo verso i polmoni (Figura 1A). Fissare la trachea con una sutura chirurgica 3-0 per evitare perdite d'aria e la rimozione accidentale del catetere.
- Sostituire i muscoli paratracheali e le ghiandole sopra la trachea. Chiudere la pelle del collo utilizzando suture 6-0.
3. Esposizione delle vertebre toraciche
- Metti il mouse in posizione prona su un tappetino riscaldato. Praticare un'incisione longitudinale di 2 cm al centro della nuca, che si estende dalle vertebre C6 a T3.
- Separare accuratamente il grasso e le ghiandole ibernate nella parte anteriore delle vertebre toraciche del topo, facendo attenzione a evitare i vasi sanguigni sotto le ghiandole. Usa le forbici a molla per tagliare la pelle e gli strati muscolari, compreso il muscolo trapezio. Inserire un divaricatore tra i muscoli per facilitare l'ulteriore esposizione.
- Rimuovere i muscoli che si attaccano al morsetto per la testa e la parte diritta dei muscoli lunghi del collo, esponendo i processi spinosi di T2.
- Spostare i muscoli semispinali e spinali per esporre l'arco vertebrale da C6 a T3 (vedi Figura 1B).
NOTA: Durante il processo di esposizione delle vertebre toraciche, assicurarsi che venga prestata particolare attenzione alla conservazione del processo spinoso di T2, poiché funge da punto di applicazione della forza principale per la successiva esposizione di T1-DRG.
4. Esposizione al T1-DRG
- Recidere la connessione tra la placca dell'arco vertebrale e il processo articolare di T1. Usa una pinza fine per rimuovere meticolosamente i processi articolari sinistro e destro e i processi mammillari di T1.
- Dopo aver eliminato il tessuto connettivo sovrastante, esporre con cura il DRG T1 sinistro o destro, assicurandosi dell'integrità dell'epinevrio sul lato scelto.
- Posizionare un batuffolo di cotone imbevuto di soluzione salina calda sull'area DRG esposta per mantenere l'umidità (vedere la Figura 1C).
NOTA: I tessuti circostanti del DRG possono essere coperti con una spugna emostatica per evitare perdite di sangue durante l'intervento chirurgico. Sostituire i batuffoli di cotone inumiditi secondo necessità per mantenere una visione chiara dell'area chirurgica quando è intrisa di versamenti emorragici.
5. Fissazione delle vertebre toraciche e rilevamento ECG
- Posizionare il mouse sul tavolino del morsetto spinale personalizzato con un termoforo (vedere la Figura 1D).
- Fissare il mouse utilizzando due clip attaccate ai processi articolari di C6 e T3 per ridurre al minimo il movimento dovuto alla stimolazione nervosa (vedere la Figura 1E).
- Collegare il monitor ECG con il polo negativo sull'arto superiore destro, il filo di terra sull'arto inferiore destro e il polo positivo sull'arto inferiore sinistro (vedere la Figura 1F).
- Sostituire continuamente i batuffoli di cotone imbevuti di soluzione fisiologica fino a quando l'area chirurgica non è sufficientemente pulita.
NOTA: Garantire l'eliminazione completa dei muscoli e dei tessuti che circondano i processi articolari di C6 e T3, specialmente nella regione in cui viene applicato il morsetto spinale personalizzato per la fissazione spinale, per prevenire lo spostamento durante gli esperimenti successivi.
6. Configurazione hardware e software per l'imaging
- Posizionare la pinza spinale con il mouse fissato sotto il microscopio confocale (vedere Figura 1G).
- Collegare la macchina per l'anestesia respiratoria (isoflurano 0,5%-1%) e il termoforo e regolare i parametri pertinenti in base alle condizioni fisiche del mouse per garantire il benessere degli animali.
- Posizionare l'obiettivo pneumatico a lunga distanza di lavoro 10x/0,32 del microscopio confocale sul T1-DRG esposto per l'imaging (vedere la Figura 1H).
- Cattura l'intero T1-DRG regolando l'asse z del tavolino su e giù, con una dimensione del passo di 25 μm e una risoluzione di 512 x 512 o 1024 x 1024 pixel.
- Eseguire la scansione XYZT del DRG con 8 stack comprendenti 1-2 stati di base, 3-6 stimoli brush o PENS e 7-8 stati post-stimoli.
NOTA: Per garantire una visione completa e chiara della morfologia del DRG, posizionare il DRG perpendicolarmente alla lente. Regola l'angolo di inclinazione di ciascun mouse utilizzando il tavolino personalizzato in base alle esigenze pratiche.
7. Stimoli somatici e imaging
- Applicare la stimolazione a pennello sull'arto superiore del topo per valutare la reattività dei neuroni DRG ripresi (vedi Figura 1H).
- Eseguire la stimolazione PENS-PC6 utilizzando uno stimolatore (vedere Figura 1F).
NOTA: PC6 si trova 1-2 mm prossimalmente alla piega palmare del polso, tra il tendine flessore ulnare del carpo e il tendine flessore superficiale delle dita. I parametri di stimolazione sono impostati su 15 Hz e 1 mA per 3-6 stack.
8. Analisi ed elaborazione dei dati
- Nel software di microscopia confocale, valutare le risposte al calcio evocate da vari stimoli confrontando l'aumento dell'intensità della fluorescenza verde quando i neuroni vengono stimolati da GCaMP dopo il legame del calcio all'interno della cellula (vedi Figura 2A-C).
- Utilizzare il software Fiji per tracciare manualmente le cellule visibili e misurarne le dimensioni e l'intensità relativa della fluorescenza (vedere la Figura 2D).
- Esprimere l'intensità di fluorescenza come il rapporto tra l'aumento massimo della fluorescenza evocata e il livello basale (Ft/F0), dove il basale (F0) rappresenta l'intensità massima di fluorescenza misurata durante il periodo basale.
- Definire l'attivazione cellulare come un aumento dell'intensità della fluorescenza (Ft/F0) ≥130% di F0 (vedi Figura 2E,F).
- Classificare i neuroni DRG in neuroni di piccole dimensioni (<20 μm), neuroni di medie dimensioni (20-30 μm) e neuroni di grandi dimensioni (>30 μm) in base al loro diametro11 (vedi Figura 2G).
- Osservare le variazioni della frequenza cardiaca causate dalla stimolazione somatica utilizzando il software di registrazione ECG (vedere la Figura 2H).
NOTA: La frequenza cardiaca dei topi è facilmente influenzata da stimoli esterni e dall'anestesia respiratoria. Quando si osserva la risposta della frequenza cardiaca a uno stimolo, attendere che la frequenza cardiaca si stabilizzi prima di somministrare lo stimolo.
Risultati
Seguendo il protocollo descritto, il T1-DRG di topi transgenici Pirt-GCaMP6s è stato esposto a vari stimoli somatici. Lo scopo di questo esperimento è stato quello di osservare i cambiamenti nel numero e nel tipo di neuroni e nella funzione cardiaca indotti da diversi stimoli.
Come illustrato nella Figura 2A, in condizioni di base, la maggior parte dei neuroni nel T1-DRG non mostrava fluorescenza GFP. Questa fluorescenza basale potrebbe essere influenzata da due fattori: il livello di espressione di GCaMP e il potenziale danno al DRG durante l'intervento chirurgico. La stimolazione somatica ha determinato un aumento rapido e transitorio della fluorescenza GCaMP, insieme a un aumento del numero e dell'intensità della GFP, come illustrato nella Figura 2B. Cambiamenti simili sono stati osservati quando è stato applicato PENS-PC6, come mostrato nella Figura 2C. La Figura 2D evidenzia le celle selezionate e numerate cerchiate utilizzando il software di imaging nella Figura 2C.
Come accennato in precedenza, le variazioni dell'intensità della fluorescenza superiori al 130% del livello di soglia F0 sono considerate risposte positive. La mappa di calore e il grafico a linee nella Figura 2E, F mostrano le risposte di tutti i neuroni cerchiati nel software di imaging alla stimolazione PENS-PC6. La Figura 2G presenta un istogramma dei diversi diametri dei neuroni sensibili a PENS-PC6, mentre la Figura 2H illustra un diagramma schematico dell'aumento della frequenza cardiaca con PENS-PC6.
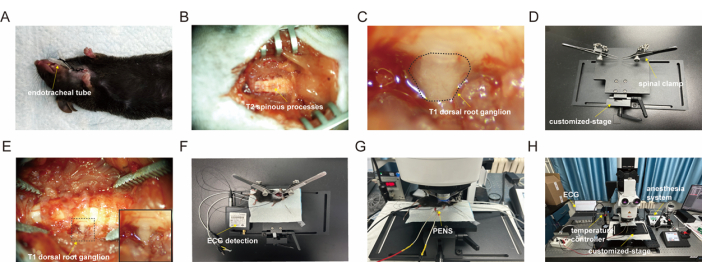
Figura 1: Procedura chirurgica del T1-DRG. (A) Intubazione della trachea nel topo. (B) Vertebre toraciche dopo la rimozione dei tessuti circostanti. (c) T1-DRG esposto. (D) Tavolino personalizzato, questo palco può essere inclinato a diverse angolazioni ed è installato il morsetto spinale con perline universali. (E) Fissazione locale del morsetto spinale. (F) Connessione al monitor ECG. (G) Imaging del calcio mediante microscopia confocale. (H) Configurazione sperimentale per l'imaging del calcio di T1-DRG. Clicca qui per visualizzare una versione più grande di questa figura.
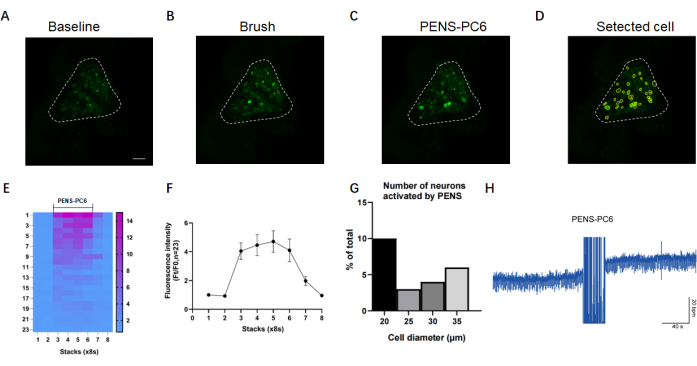
Figura 2: Immagini rappresentative e analisi dell'imaging del calcio in vivo dei neuroni T1-DRG. Le immagini rappresentative in (A-C) mostrano neuroni T1-DRG alla stimolazione basale, a pennello e PENS. (D) Le cellule contrassegnate e numerate all'interno di un singolo T1-DRG dopo il tracciamento con software di imaging. Barre della scala: 100 μm. (E,F) Mappa di calore e grafico a linee che raffigura le variazioni dell'intensità di fluorescenza delle cellule tracciate sotto stimolazione PENS-PC6. (G) Descrizione del numero di cellule sensibili a diverse dimensioni di stimolazione PENS-PC6. Le barre di errore rappresentano la media ± SEM (N = 1). (H) L'aumento della frequenza cardiaca durante la stimolazione PENS di PC6. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
In questo studio, viene descritto un metodo per l'imaging del calcio del segmento toracico T1 DRG, che ha un valore significativo per lo studio della trasmissione afferente dei neuroni sensoriali viscerali cardiopolmonari e della comunicazione somato-viscerale. Inoltre, viene presentato un approccio generale per il monitoraggio dell'attività del calcio nei neuroni DRG e dei cambiamenti nella funzione cardiaca contemporaneamente, consentendo l'analisi della correlazione dell'attività neurale e delle risposte cardiache.
Le tecniche di imaging del calcio, che utilizzano coloranti sensibili al Ca2+ o indicatori di Ca2+ geneticamente codificati per visualizzare il Ca2+ intracellulare come misura indiretta dell'attivazione del potenziale d'azione, consentono l'osservazione in tempo reale delle risposte dei singoli neuroni o dei cluster neuronali a vari stimoli. Attualmente, la maggior parte degli studi di imaging del calcio sul DRG sono stati limitati ai segmenti lombari12. Rispetto al DRG lombare, i DRG toracici sono più piccoli, situati vicino alle costole e alle vertebre toraciche e rappresentano un aumentato rischio di pneumotorace durante le procedure chirurgiche. Pertanto, è necessario superare due problemi principali per condurre l'imaging del calcio nel T-DRG.
Il primo problema è l'esposizione del T-DRG. Usando il T1-DRG come esempio, il T1-DRG si trova sotto l'arco vertebrale del T1. Quando l'osso viene rimosso dalle vertebre della lamina arcus e dal processo articolare, è soggetto a sanguinamento e richiede un'attenta manipolazione. Poiché l'imaging del calcio richiede il monitoraggio dei cambiamenti nell'attività degli ioni calcio nei neuroni prima e dopo la stimolazione, è necessario assicurarsi che i DRG siano fissati stabilmente in posizione. Tuttavia, a causa della fisiologica curvatura delle vertebre cervicali e toraciche, lo spazio tra le vertebre T1-T3 è ristretto, rendendo la fissazione del DRG toracico il secondo problema critico da affrontare.
Il morsetto spinale destinato ai segmenti lombari è stato modificato rettificando l'estremità anteriore delle clip a coccodrillo con carta vetrata a uno spessore di 1 mm per il fissaggio7. Nel frattempo, i muscoli e i tessuti connettivi attorno ai segmenti fissi sono stati rimossi in modo pulito, evitando danni ai vasi sanguigni. Il morsetto spinale testa-estremità è stato fissato al processo articolare di C6 e il morsetto spinale coda-estremità è stato fissato al processo articolare di T3.
L'implementazione dell'imaging del calcio ha portato a numerosi progressi nella comprensione dei meccanismi neuronali del DRG correlati alle malattie viscerali13,14. Recentemente, Sun et al. hanno dimostrato che Piezo1 o il suo effettore a valle IL-6 nei neuroni T-DRG mediano una cascata infiammatoria neurogena dopo l'infarto miocardico utilizzando approcci cellulari e molecolari. Tuttavia, la relazione funzionale tra i neuroni DRG e le funzioni cardiache rimane sconosciuta a causa di difficoltà tecniche. Sono state effettuate registrazioni sincronizzate della funzione cardiaca e dei neuroni T-DRG attivati, fornendo una comprensione più intuitiva della correlazione tra attività neuronale e alterazioni della funzione cardiaca. Durante questi esperimenti, sono stati osservati cambiamenti nella frequenza cardiaca nei topi utilizzando PENS a PC6, con l'esecuzione concomitante dell'imaging del calcio. I risultati hanno mostrato che PENS-PC6 può aumentare l'attività del calcio in T1-DRG e aumentare la frequenza cardiaca. Questo approccio non solo apre la strada a studi in vivo sui disturbi cardiaci correlati ai gangli sensoriali, ma fornisce anche uno strumento importante per studiare il coinvolgimento dei neuroni sensoriali primari negli effetti benefici della PENS sulla funzione cardiaca.
Questo paradigma di ricerca può anche essere combinato con altri metodi di ricerca, come l'optogenetica15,16 e gli interventi farmacologici17. Ad esempio, Takuya Okada et al.14,15 hanno generato modelli olografici di stimolazione optogenetica utilizzando un modulatore di luce spaziale (SLM) e successivamente hanno integrato questa stimolazione olografica con l'imaging a due fotoni. Hanno condotto esperimenti per stimolare i singoli neuroni e combinato l'imaging del calcio in vivo per osservare le risposte dei neuroni circostanti, con l'obiettivo di studiare la connettività funzionale tra le cellule. Poiché l'accoppiamento neuronale rappresenta un'importante forma di plasticità neuronale nel DRG, la combinazione di stimolazione olografica e imaging del calcio può chiarire le interazioni tra i sottotipi di neuroni all'interno dei gangli sensoriali. Le interazioni tra neurone e cellule gliali satelliti (SGC) DRG possono influenzare la trasmissione nocicettiva18. I recettori P2-purinergici (P2R) sono elementi chiave nelle interazioni bidirezionali tra i neuroni DRG e SGC19. Chen et al.17 hanno eseguito l'imaging del calcio in vivo utilizzando il α,β-MeATP (un agonista selettivo del P2R) nel DRG e hanno osservato che il α,β-MeATP ha suscitato una robusta attivazione di piccoli neuroni, presumibilmente nocicettori. Hanno combinato l'imaging del calcio con tecniche farmacologiche nel DRG per studiare il ruolo della segnalazione P2R all'interno del DRG, che svolge un ruolo significativo nell'eccitabilità e nella trasmissione del dolore dei neuroni nocicettivi. Pertanto, questa metodologia di ricerca, che incorpora approcci optogenetici e farmacologici, servirà come strumento prezioso per lo studio dei neuroni sensoriali viscerali che trasmettono input cardiorespiratori e comunicazioni somatico-viscerali.
Un limite tecnico di questo studio è l'incapacità di condurre l'imaging cronico del calcio DRG nei topi durante i loro stati comportamentali di veglia. L'anestesia ha il potenziale di diminuire la propriocezione e i segnali di sensazione viscerale, lasciando l'attività dei neuroni T-DRG in contesti di sensazioni naturali da indagare ulteriormente. Poiché Chen et al. hanno sviluppato un metodo di fusione intervertebrale per l'imaging del DRG lombare a risoluzione cellulare e subcellulare per settimane in topi svegli, gli studi futuri dovrebbero prendere in considerazione l'approccio del monitoraggio longitudinale dell'attività dei neuroni in T-DRG20.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Questo studio è stato finanziato dalla National Natural Science Foundation of China (n. 82174518, 82074561, 82105029).
Materiali
| Name | Company | Catalog Number | Comments |
| Acupuncture Needle | ZhongYanTianHe | 0.25/13s | |
| Anesthesia System | Kent Scientific | SomnoSuite | |
| Animal Bio Amp | ADInstruments | NSW | |
| Confocal Microscope | Leica | STELLARIS 8 | |
| DC Temperature Controller | FHC | 40-90-8D | |
| DC Temperature Controller Heating Pad | FHC | 40-90-2-05 | |
| Fiji | National Institute of Health | N/A | |
| Fine Forceps | RWD | F11028-13 | |
| Fine Ophthalmic Forceps | Jinzhong | JD1060 | |
| Gelatin Sponges | Coltene | 274-007 | |
| Intubation Cannula | Harward Apparatus | 73-2737 | |
| Isoflurane | RWD | R510 | |
| LabChart Professional Software | ADInstruments | Version 8.0 | |
| LAS X | Leica | N/A | |
| Pirt-cre mice | Johns Hopkins University | N/A | |
| Retractor | Fine Science Tools | 16G212 | |
| Rosa-GCaMP6s mice (AI96) | Jax Laboratory | 28866 | |
| Spinal Clamp | N/A | N/A | Custom made |
| Spring Scissors | Jinzhong | YBC040 | |
| Stimulator | AMPI | Master-8 | |
| Tribromoethanol | Sigma | T48402 | |
| Wireless Biological Acquisition System | Kardiotek Biomedical Technologie | KLB-1 |
Riferimenti
- Sun, M., et al. Piezo1-mediated neurogenic inflammatory cascade exacerbates ventricular remodeling after myocardial infarction. Circulation. 149 (19), 1516-1533 (2024).
- Cui, X., et al. Referred somatic hyperalgesia mediates cardiac regulation by the activation of sympathetic nerves in a rat model of myocardial ischemia. Neurosci Bull. 38 (4), 386-402 (2022).
- Zhang, Y., et al. Fast and sensitive GCaMP calcium indicators for imaging neural populations. Nature. 615 (7954), 884-891 (2023).
- Kim, S. H., et al. Mapping of sensory nerve subsets within the vagal ganglia and the brainstem using reporter mice for Pirt, TRPV1, 5-HT3, and Tac1 expression. eNeuro. 7 (2), (2020).
- Rothermel, M., et al. Advanced tracing tools: Functional neuronal expression of virally encoded fluorescent calcium indicator proteins. J Neurovirol. 15 (5-6), 458-464 (2009).
- Shannonhouse, J., Gomez, R., Son, H., Zhang, Y., Kim, Y. S. In vivo calcium imaging of neuronal ensembles in networks of primary sensory neurons in intact dorsal root ganglia. J Vis Exp. (192), e64826 (2023).
- Liu, K., et al. In vivo calcium imaging of dorsal root ganglia neurons' response to somatic and visceral stimuli. J Vis Exp. (205), e65975 (2024).
- Feng, J. T., Hu, C. P., Li, X. Z. Dorsal root ganglion: The target of acupuncture in the treatment of asthma. Adv Ther. 24 (3), 598-602 (2007).
- Guo, Z. L., et al. Role of TRPV1 in acupuncture modulation of reflex excitatory cardiovascular responses. Am J Physiol Regul Integr Comp Physiol. 314 (5), R655-R666 (2018).
- Li, S., et al. Perspective of calcium imaging technology applied to acupuncture research. Chin J Integr Med. 30 (1), 3-9 (2024).
- Kim, Y. S., et al. Coupled activation of primary sensory neurons contributes to chronic pain. Neuron. 91 (5), 1085-1096 (2016).
- Zheng, Q., et al. Synchronized cluster firing, a distinct form of sensory neuron activation, drives spontaneous pain. Neuron. 110 (2), 209-220.e206 (2022).
- Gao, X., et al. Calcium imaging in population of dorsal root ganglion neurons unravels novel mechanisms of visceral pain sensitization and referred somatic hypersensitivity. Pain. 162 (4), 1068-1081 (2021).
- Caldwell, A., et al. TGR5 agonists induce peripheral and central hypersensitivity to bladder distension. Sci Rep. 12 (1), 9920 (2022).
- Okada, T., et al. Pain induces stable, active microcircuits in the somatosensory cortex that provide a therapeutic target. Sci Adv. 7 (12), 8261 (2021).
- Malik, R., Li, Y., Schamiloglu, S., Sohal, V. S. Top-down control of hippocampal signal-to-noise by prefrontal long-range inhibition. Cell. 185 (9), 1602-1617.e17 (2022).
- Chen, Z., et al. Purinergic signaling between neurons and satellite glial cells of mouse dorsal root ganglia modulates neuronal excitability in vivo. Pain. 163 (8), 1636-1647 (2022).
- Hanani, M., Spray, D. C. Emerging importance of satellite glia in nervous system function and dysfunction. Nat Rev Neurosci. 21 (9), 485-498 (2020).
- Serrano, A., et al. Differential expression and pharmacology of native P2X receptors in rat and primate sensory neurons. J Neurosci. 32 (34), 11890-11896 (2012).
- Chen, C., et al. Long-term imaging of dorsal root ganglia in awake behaving mice. Nat Commun. 10 (1), 3087 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon