Method Article
Aquisição e Análise Semiautomatizada de Eletromiografia de Superfície Muscular Respiratória
Neste Artigo
Resumo
Aqui, descrevemos um protocolo para registrar e analisar sinais de eletromiografia respiratória (EMG). Inclui as referências anatômicas para colocar os eletrodos EMG sobre vários músculos respiratórios, remover o ruído eletrocardiográfico dos sinais EMG e adquirir a raiz quadrada média (RMS) EMG e o tempo de início da atividade.
Resumo
A avaliação do drive respiratório apresenta desafios devido à intrusão e impraticabilidade dos métodos atuais, como a ressonância magnética funcional (fMRI). A eletromiografia (EMG) oferece uma medida substituta do impulso respiratório para os músculos, permitindo a determinação da magnitude e do tempo de ativação muscular. A magnitude reflete o nível de ativação muscular, enquanto o tempo indica o início e o deslocamento da atividade muscular em relação a eventos específicos, como fluxo inspiratório e ativação de outros músculos. Essas métricas são críticas para entender a coordenação e o controle respiratório, especialmente sob cargas variáveis ou na presença de fisiopatologia respiratória. Este estudo descreve um protocolo para aquisição e análise de sinais EMG dos músculos respiratórios em adultos saudáveis e pacientes com problemas de saúde respiratória. A aprovação ética foi obtida para os estudos, que incluíram preparação dos participantes, colocação dos eletrodos, aquisição de sinais, pré-processamento e pós-processamento. As principais etapas envolvem a limpeza da pele, a localização dos músculos por meio de palpação e ultrassom e a aplicação de eletrodos para minimizar a contaminação por eletrocardiografia (ECG). Os dados são adquiridos a uma alta taxa de amostragem e ganho, com ECG sincronizado e registros de fluxo respiratório. O pré-processamento inclui filtrar e transformar o sinal EMG, enquanto o pós-processamento envolve o cálculo das diferenças de início e deslocamento em relação ao fluxo inspiratório. Dados representativos de um participante saudável do sexo masculino realizando carga de limiar inspiratório incremental (ITL) ilustram a aplicação do protocolo. Os resultados mostraram ativação mais precoce e duração prolongada dos músculos extradiafragmáticos sob cargas mais altas, correlacionando-se com o aumento da magnitude EMG. Este protocolo facilita uma avaliação detalhada da ativação da musculatura respiratória, fornecendo informações sobre as estratégias de controle motor normal e fisiopatológico.
Introdução
O impulso respiratório (ou seja, a saída dos centros respiratórios para os músculos respiratórios) é difícil de avaliar devido à natureza intrusiva e muitas vezes impraticável dos métodos avaliativos, como a ressonância magnética funcional (fMRI). Além disso, o pequeno tamanho dos centros respiratórios localizados no tronco encefálico é difícil de localizar e sensível a alterações por ruído fisiológico 1,2. As medidas do estímulo respiratório são importantes devido à sua associação com desfechos clínicos importantes, como dispneia, uma indicação de desconforto respiratório. A eletromiografia (EMG) é um substituto do impulso respiratório para os músculos respiratórios3. A EMG do músculo respiratório permite a determinação da atividade muscular e sua intensidade por meio da raiz quadrada média (RMS) do sinal EMG. Além disso, o momento da ativação muscular pode ser avaliado identificando o início e o deslocamento de sua atividade (EMG, onset e EMG, offset, respectivamente)1,2,3,4,5,6,7,8,9,10,11.
A magnitude do sinal EMG refere-se ao potencial elétrico gerado pelas células musculares quando elas se contraem, indicando seu nível de ativação muscular12. A magnitude do sinal EMG pode variar dependendo de fatores como a intensidade da contração muscular, o número de unidades motoras recrutadas, a colocação do eletrodo, o movimento dos tecidos muscular e subcutâneo e as características específicas do músculo que está sendo medido12.
O tempo do sinal EMG refere-se a quando a atividade elétrica ocorre em relação a um evento ou ação específica (por exemplo, em relação ao fluxo inspiratório para a respiração)13. O tempo de início indica quando a ativação muscular começa, enquanto o tempo de deslocamento indica quando a atividade muscular diminui, cessa ou está na fase de relaxamento13. O tempo entre a ativação de vários músculos respiratórios facilitará a compreensão dos mecanismos de coordenação e controle durante a respiração. Avaliar a consistência ou variabilidade dos padrões de tempo ao longo do tempo ou em indivíduos pode ajudar a identificar estratégias fisiológicas e fisiopatológicas de controle motor associadas à insuficiência ventilatória aguda ou crônica.
Tanto a magnitude quanto o momento da EMG do músculo respiratório têm sido associados a importantes desfechos clínicos 12,13,14. O diafragma gera a maior parte da ventilação em repouso15. Quando a demanda respiratória aumenta, como durante o exercício ou aumento da carga inspiratória associada a doenças pulmonares (por exemplo, doença pulmonar obstrutiva crônica, doença pulmonar intersticial ou síndrome do desconforto respiratório agudo), os músculos respiratórios extradiafragmáticos aumentam a ventilação, o que pode aumentar ou compensar as necessidades contráteis do diafragma15. Assim, além do aumento da magnitude da EMG do diafragma, a magnitude da EMG do músculo extradiafragmático também aumentará.
A ativação dos músculos respiratórios extradiafragmáticos pode proteger o diafragma do desenvolvimento de fadiga16. No entanto, a ativação precoce (onset) e a ativação prolongada têm sido associadas à insuficiência ventilatória aguda e crônica 14,17,18. O objetivo aqui é descrever um protocolo para adquirir e analisar o tempo e a magnitude dos sinais EMG dos músculos respiratórios em adultos saudáveis e pacientes com fisiopatologia respiratória suspeita ou confirmada. Este protocolo inclui etapas previamente validadas desde a aquisição de dados para quantificar o tempo e a magnitude da atividade EMG13,19.
Protocolo
Os estudos que empregam essa técnica receberam aprovação ética da Universidade de Toronto e do Hospital St. Michael, localizado em Toronto, Canadá, e do Hospital Universitário Gasthuisberg, Leuven, Bélgica. Um protocolo específico é descrito aqui. A discussão geral sobre várias abordagens alternativas de EMG de superfície (sEMG) foi proposta para os músculos respiratórios e é relatada em outros lugares12.
1. Preparação dos participantes e colocação dos eletrodos EMGs
- Para garantir uma visualização adequada, peça aos homens que não usem camisa e às mulheres que usem sutiã esportivo ou camiseta. Use uma bata hospitalar com abertura frontal para fornecer acesso adequado e manter a modéstia.
- Se o participante tiver cabelo comprido, amarre-o para trás e prenda-o fora do lugar para que o escaleno e o esternocleidomastóideo possam ser avaliados.
- Posicione o participante na posição sentada ou semi-deitada.
- Se for encontrado excesso de pelos no peito ou pescoço, raspe a área para colocação do eletrodo para sEMG.
- Para reduzir a impedância da pele, limpe a pele de óleo e pele morta.
- Faça isso esfregando com um pano embebido em álcool e permitindo que o álcool evapore (ou seja, seque ao ar) antes de aplicar o eletrodo.
- Se a pele for mais clara, pode parecer ligeiramente vermelha, mas o mais importante, certifique-se de que nenhuma sujeira, óleo ou pele seca óbvia seja aparente onde os eletrodos serão colocados. No entanto, evite esfregar excessivamente para evitar danos à pele. Evite a aplicação de eletrodos em áreas de pele quebrada ou outras lesões cutâneas.
- Localize os músculos de interesse por meio de marcos, palpação e/ou ultrassom.
NOTA: O ultrassom pode ser útil na marcação do diafragma costal20. A Figura 1 mostra exemplos de locais onde os eletrodos podem ser colocados para EMGs dos músculos respiratórios. - Coloque eletrodos de EMG no lado direito do tórax, mais longe do coração, para diminuir a amplitude do sinal de ECG e minimizar sua contaminação.
- Aplique eletrodos EMG emparelhados com uma distância entre eletrodos de 2 cm no centro da barriga muscular ao longo do alinhamento longitudinal das fibras musculares.
- Para o diafragma costal/intercostais, marque a linha axilar anterior e a linha hemiclavicular e coloque os eletrodos emparelhados verticalmente entre essas duas linhas no nível do sétimo ou oitavo espaço intercostal.
- Para o escaleno, marque o triângulo posterior do pescoço e coloque os eletrodos emparelhados ao longo do eixo longitudinal do músculo no nível do processo cricóide.
- Para os intercostais paraesternais, marque o segundo espaço intercostal 1-2 cm lateral ao lado direito do esterno e coloque os eletrodos emparelhados ao longo do eixo longitudinal do músculo.
- Para o esternocleidomastóideo, marque a incisura supraesternal e o processo mastóideo. Acentue o ventre do músculo esternocleidomastóideo direito colocando a mão do operador no lado esquerdo do queixo do participante e pedindo ao participante que execute suavemente a rotação isométrica à esquerda contra a mão. Coloque os eletrodos emparelhados no ponto médio da barriga muscular ao longo de seu eixo longitudinal.
- Alguns sistemas EMG podem exigir um sensor de aterramento. Se necessário, coloque o sensor de solo em uma estrutura óssea próxima aos músculos respiratórios (por exemplo, clavícula, processo espinhoso cervical C7).
- Prenda os clipes do sensor EMG aos eletrodos EMG. Certifique-se de que os fios dos sensores EMG de dois músculos diferentes (mesmo que sem fio) não se sobreponham e contaminem ou forneçam diafonia entre os dois músculos.
NOTA: Os fios do mesmo sensor podem se sobrepor, mas os fios de dois sensores diferentes não devem. - Aplique fixação adicional de eletrodos e sensores EMG usando fitas dupla-face que prendem a parte inferior do sensor à pele.
- Aplique fita hipoalergênica de grau médico por cima dos sensores para prender ainda mais cada sensor à pele. Evite aplicar pressão excessiva e, conforme mencionado acima, certifique-se de que os fios de diferentes sensores não se sobreponham.
2. Aquisição de sinal
- Selecione o modelo predefinido no software de aquisição de dados e pressione Abrir. O modelo terá os seguintes parâmetros predefinidos: Um filtro passa-alta (0,5-20 Hz) no sinal EMG para reduzir artefatos de baixa frequência para facilitar a visualização em tempo real.
- Defina a taxa de amostragem do sinal EMG de pelo menos 1 kHz.
- Defina o ganho do sinal EMG para 1000.
- Defina o modelo para adquirir um registro sincronizado do ECG e do fluxo respiratório.
- Adquira dados de sEMG e ECG de acordo com o protocolo, por exemplo, durante um teste de respiração espontânea em um paciente de ventilação mecânica.
- Após a conclusão do protocolo, pare a gravação e salve o arquivo de dados.
NOTA: A Figura 2 mostra capturas de tela do software mostrando a filtragem aplicada.
3. Pré-processamento após a aquisição de dados
- Abra o software e confirme os parâmetros a serem usados para análise do sinal EMG (um filtro passa-alta bidirecional de 5 Hz, o filtro adaptativo Least Mean Square (LMS) para remover a contaminação do ECG, transformação quadrada média com uma janela móvel por 0.02 s) e pressione Continuar.
- Selecione o arquivo a ser analisado e pressione OK.
- Defina o intervalo de tempo a ser analisado (se a duração total do arquivo for analisado, será de 0 s ao tempo máximo), pressione Selecionar o intervalo e continuar e, em seguida, pressione Condicionamento.
- Pressione o botão Analisar para aplicar os parâmetros pré-selecionados (consulte a etapa 3.1). Visualize o sinal EMG analisado. Pressione o botão Redimensionado em 1 para mostrar o sinal EMG normalizado por seu valor máximo durante o período gravado.
- Pressione o botão Continuar para calcular On Off . Com base na função derivada do sinal EMG, ele detectará o tempo de início da atividade EMG. Pressione o botão On e Off .
- Selecione o sinal EMG do músculo que precisa ser visualizado. A visualização pode ser alternada entre os músculos para permitir a inspeção visual de todos os sinais EMG registrados. Pressione o botão PARAR de procurar e ir para salvar . Pressione Salvando.
- Selecione os dados a serem salvos. É possível reduzir os sinais antes de salvar (por exemplo, de 1000Hz para 100Hz). Pressione Salvar dados processados, selecione a pasta do computador na qual o arquivo deve ser salvo e dê um nome a ele. Pressione Salvar novamente para confirmar.
4. Pós-processamento
- Abra o arquivo salvo usando um software que fornece a capacidade de calcular cálculos (por exemplo, Excel, R, Phyton, Matlab). Determine cada respiração pelo tempo ligado e desligado do sinal de fluxo e calcule o pico EMG RMS e o EMG RMS médio para cada respiração.
- Para o início da EMG, calcule a diferença absoluta (em milissegundos) entre o início da EMG e o início do fluxo inspiratório (INSP, onset):
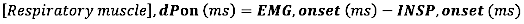
- Para deslocamento EMG, calcule a diferença absoluta (em milissegundos) entre o deslocamento EMG e o final do fluxo inspiratório (INSP, offset)
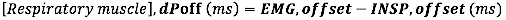
- Para o início da EMG em relação à duração do tempo inspiratório, calcule a diferença relativa (para a duração do Ti) entre o início da EMG e o início da INSP:
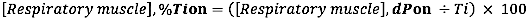
- Para o deslocamento EMG em relação à duração do tempo inspiratório, calcule a diferença relativa (para a duração do Ti) entre o deslocamento EMG e o INSP, deslocamento:
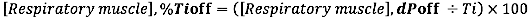
onde dP é a diferença de tempo entre o EMG, início e início do fluxo inspiratório (INSP,onset) ou entre EMG,offset e deslocamento do fluxo inspiratório (INSP,offset).)
Resultados
Os dados são fornecidos para um participante do sexo masculino (22 anos; peso: 100 kg; altura: 185 cm; IMC: 29 kg/m2) com espirometria e força muscular inspiratória normais (VEF1: 4,89 L/s [97% do previsto]; pressão inspiratória máxima: 151 cmH2O [136% do previsto]). Ele realizou uma carga de limiar inspiratório incremental (ITL) até a falha da tarefa usando um protocolo descrito anteriormente 21,22,23. Uma visão geral do sistema de aquisição de dados é representada na Figura 1. O participante sentou-se confortavelmente em uma cadeira com clipes nasais, antebraços apoiados em uma mesa ajustável e a cabeça apoiada em ponto morto em um apoio de cabeça. O participante respirou através de um bocal conectado a uma válvula bidirecional sem reinalação, que foi conectada a um pneumotacômetro aquecido e a um dispositivo ITL. Este dispositivo ITL impôs uma carga durante a inspiração, mas nenhuma durante a expiração. O teste ITL iniciou-se com uma carga de aquecimento (-12 cmH2O), seguida de incrementos de carga do êmbolo em 50 g a cada 2 min até a falha da tarefa. A falha na tarefa foi definida como o ponto em que o participante retirou a boca do bocal ou quando não conseguiu mais gerar pressão inspiratória suficiente para levantar o êmbolo em três respirações consecutivas. Para este participante, a falha da tarefa foi alcançada em -120 cmH2O.
A Figura 3 mostra os sinais EMG do diafragma brutos e filtrados, além dos sinais de ECG e fluxo inspiratório durante o ITL. Notavelmente, os artefatos de ECG representados no EMG bruto do diafragma (traçado superior) não estão presentes (ou menos presentes) no EMG filtrado pelo diafragma (traçado inferior). Além disso, a linha de base errante que pode ser observada na EMG bruta do diafragma não aparece após a aplicação da filtragem.
A Figura 4 mostra o momento de início da EMG do músculo respiratório em cargas baixas e altas. Em baixa carga, apenas a atividade de início intercostal escaleno e paraesternal é detectada antes do início do fluxo inspiratório, enquanto a atividade de início do diafragma e esternocleidomastóideo foi detectada após o início do fluxo inspiratório. No entanto, ao respirar para superar cargas mais altas durante a ITL, observa-se ativação precoce (em relação ao fluxo) do diafragma, intercostal paraesternal, escaleno e esternocleidomastóideo.
A Figura 5 mostra o tempo de duração da atividade EMG da musculatura respiratória em cargas baixas e altas. A duração da atividade EMG do diafragma, intercostal paraesternal e escaleno é semelhante em cargas baixas e altas. No entanto, a duração da atividade esternocleidomastóidea foi maior na carga alta em comparação com a carga baixa.
A Figura 6 mostra o EMG RMS do diafragma, intercostal paraesternal, escaleno e esternocleidomastóideo. Em cargas elevadas, o EMG RMS de todos esses músculos foi maior em comparação com cargas baixas, representando a maior atividade muscular necessária para superar as cargas aumentadas.
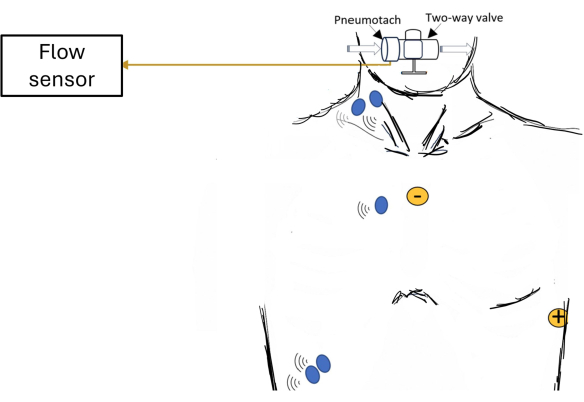
Figura 1: Esquema da configuração do participante mostrando uma visão geral da aquisição de dados. Exemplos de colocações de eletrodos são mostrados para eletromiografia de superfície (EMG; pontos azuis) dos músculos respiratórios e eletrocardiograma (ECG; pontos amarelos). Clique aqui para ver uma versão maior desta figura.

Figura 2: Exemplo de telas de trabalho do software mostrando a filtragem aplicada. (A) Tela inicial mostrando sinais gravados e parâmetros de filtragem. (B) Tela mostrando o RMS do EMG após aplicações de filtros (traçado verde). O fluxo é mostrado em branco. As linhas horizontais demonstraram o início da atividade EMG (amarelo), o início do fluxo inspiratório (linha verde), o deslocamento da atividade EMG (linha amarela tracejada) e o fim do fluxo inspiratório (linha vermelha). Abreviaturas: SCM: esternocleidomastóideo. RMS: raiz quadrada média. Clique aqui para ver uma versão maior desta figura.
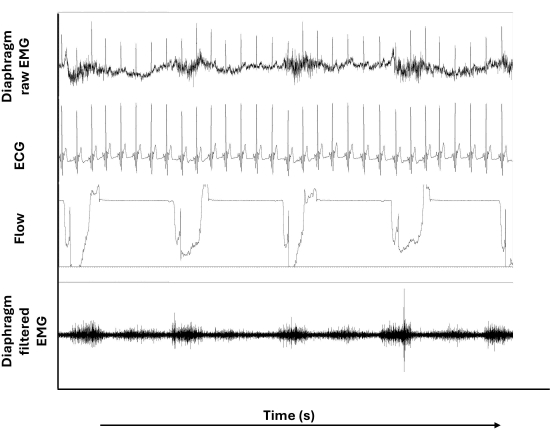
Figura 3: EMG da superfície do diafragma cru e filtrado. De cima para baixo, os painéis mostram o sinal EMG bruto do diafragma, o sinal do eletrocardiograma (ECG), o sinal de fluxo inspiratório e o sinal EMG filtrado do diafragma. Clique aqui para ver uma versão maior desta figura.

Figura 4: Tempo de início do sinal EMG do músculo respiratório durante cargas baixas (-12 cmH2O) vs. altas cargas (-120 cmH2O) durante a carga do limiar inspiratório incremental até a falha da tarefa. Os dados são de um participante do sexo masculino. Os eixos Y representam a diferença de tempo entre o tempo de início da EMG de superfície e o fluxo inspiratório em segundos, onde zero é o início do fluxo inspiratório. Valores negativos indicam que o início da EMG ocorreu antes do início do fluxo inspiratório, enquanto valores positivos indicam que o início da EMG ocorreu após o início do fluxo inspiratório. Os painéis mostram o tempo de início da atividade EMG do músculo respiratório do diafragma (A), (B) intercostal paraesternal, (C) escalenos e (D) esternocleidomastóideo. Clique aqui para ver uma versão maior desta figura.
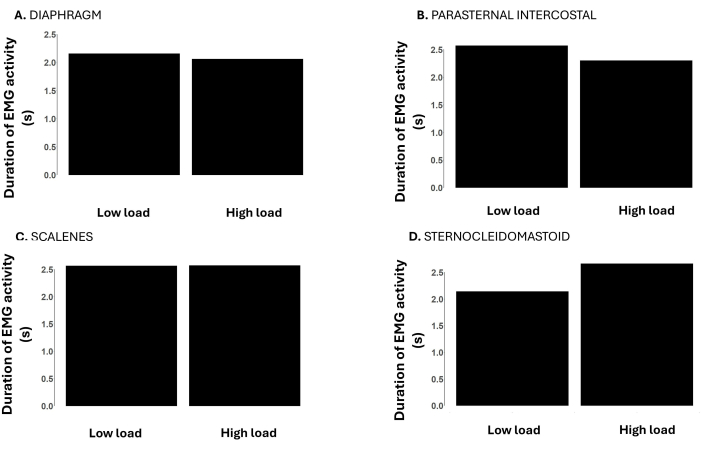
Figura 5: Tempo de duração do sinal EMG do músculo respiratório durante cargas baixas (-12 cmH2O) vs. altas (-120 cmH2O) durante uma carga de limiar inspiratório incremental até a falha da tarefa. Os dados são de um participante do sexo masculino. Os eixos Y representam a duração da atividade EMG (do início ao deslocamento da EMG) em segundos. Os painéis mostram a duração da atividade EMG do músculo respiratório do diafragma (A), (B) intercostal paraesternal, (C) escalenos e (D) esternocleidomastóideo. Clique aqui para ver uma versão maior desta figura.
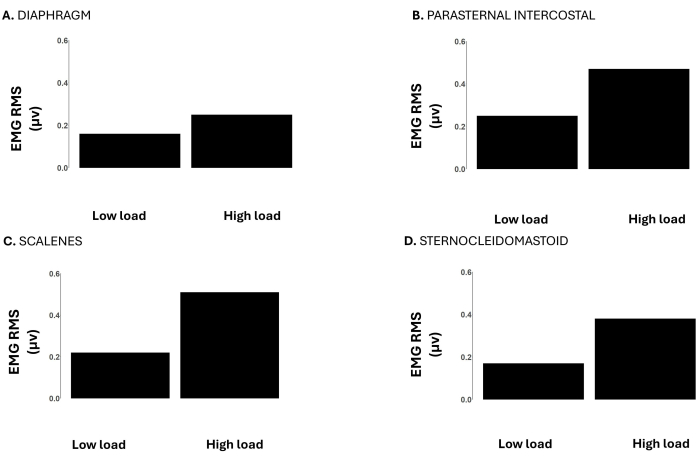
Figura 6: RMS do sinal EMG do músculo respiratório durante cargas baixas (-12 cmH2O) vs. altas (-120 cmH2O) durante uma carga de limiar inspiratório incremental até a falha da tarefa. Os dados são de um participante do sexo masculino. Os eixos Y representam o EMG RMS em microvolts. Os painéis mostram o EMG RMS do (A) diafragma, (B) paraesternal intercostal, (C) escalenos e (D) esternocleidomastóideo. Clique aqui para ver uma versão maior desta figura.
Discussão
A remoção de artefatos de atividade cardíaca do sinal EMG é complexa devido à sobreposição de seus espectros de largura de banda. A maior parte do espectro de frequência EMG está entre 20 e 250 Hz, enquanto o espectro de frequência ECG está entre 0 Hz e 100 Hz. Para algumas análises (ou seja, temporização), é essencial derivar o sinal EMG sem contaminação por ECG para obter precisão e interpretabilidade da magnitude e tempo EMG. O filtro adaptativo do mínimo quadrado médio (LMS), utilizando frequências, é um algoritmo que reconhece um padrão. Nesse caso, o algoritmo remove o conteúdo da frequência de ECG do sinal combinado de ECG-EMG. Foi determinado que um comprimento de filtro de 70 e um tamanho de passo de 0,01 são coeficientes ótimos que fornecem o menor erro e os melhores resultados gerais24. O ECG gravado em sincronia com o EMG é usado para ajustar os coeficientes do filtro de Resposta ao Impulso Finito (FIR) continuamente. Assim, a remoção é muito precisa e pode acomodar um ritmo cardíaco variável, que pode ocorrer durante o teste. O algoritmo de filtragem de ECG é predefinido e o canal de ECG é reconhecido automaticamente. A filtragem bidirecional minimiza a mudança de tempo na detecção do tempo de início do sinal EMG. É usado para eliminar a distorção de fase, que pode ser comum com métodos de filtragem padrão (unidirecionais).
A primeira função derivada de cada músculo EMG RMS é calculada. Uma derivada positiva ou negativa indica um aumento ou diminuição do EMG RMS, respectivamente. A aplicação da função derivada para determinar as fases crescente e decrescente do EMG RMS permite que o algoritmo funcione com precisão, apesar das variações de "linhas de base" que não retornam a zero. Devido à variabilidade da linha de base entre as rajadas de ativação, um algoritmo utilizando os valores absolutos EMG RMS não conseguiu identificar consistentemente os inícios e deslocamentos EMG.
Para detectar o início da EMG, o início da fase inspiratória de cada respiração é determinado com precisão de ±1 milissegundo a partir do sinal de fluxo (INSP,onset). Em primeiro lugar, o aumento máximo do EMG RMS em uma base respiração a respiração é determinado como uma referência para detectar o tempo de início da atividade EMG (EMG,onset). Para levar em conta a linha de base da EMG variável, EMG,onset é definido como o ponto de tempo em que atinge 5% de sua amplitude máxima (±1 ms). A consideração desse limite de 5% evita identificar inadvertidamente a variabilidade EMG RMS basal como ativações. A filtragem EMG simultânea e a detecção EMG, onset são aplicadas a vários músculos. A Figura 2B mostra a detecção de EMG, início para o esternocleidomastóideo em uma respiração representativa.
O software permite a modificação de parâmetros predefinidos. Diferentes níveis de filtros passa-alta ou baixa podem ser usados e a suavização pode ser aplicada, se necessário. O aumento do sinal EMG para detectar o início EMG é pré-definido em 5%, mas esse valor limite também pode ser modificado. Ao avaliar a carga ventilatória, a pressão bucal pode ser medida adicionalmente como um índice de carga. Da mesma forma, o CO2 expirado pode ser monitorado, por meio do qual são feitos esforços para mantê-lo próximo à faixa normal, treinando o participante para ajustar seu nível de ventilação ou alterando o CO2 inspirado.
O protocolo descrito segue recomendações internacionais para aquisição e processamento de sinais e o algoritmo desenvolvido para filtragem foi validado25. No entanto, é necessária uma inspeção visual cuidadosa do sinal EMG em cada etapa para garantir que apenas sinais de boa qualidade sejam analisados. Outras abordagens têm sido usadas na literatura para filtrar artefatos de ECG dos sinais EMG, incluindo filtros passa-alta com altas frequências de corte (por exemplo, até 200 Hz), gating e redução de ruído wavelet. Filtros passa-alta com altas frequências de corte também excluirão grande parte do sinal EMG, modificando seu espectro de frequência e amplitude26. O gating detecta artefatos de ECG fortes e exclui o sinal EMG contaminado, bem como os sinais EMG ao seu redor, causando perda de informações temporais e afetando a detecção do tempo EMG (por exemplo, início e deslocamento)27,28. A redução de ruído de wavelet é bem equilibrada entre complexidade e desempenho; no entanto, pode cortar grandes atividades de EMG29. Um filtro adaptativo de mínimos quadrados médios no domínio da frequência foi usado aqui, que remove apenas as frequências do sinal associado ao ECG do próprio paciente 13,19. Embora permita medidas confiáveis do tempo e amplitude do EMG, requer registros contínuos e simultâneos de ECG.
Até o momento, essa abordagem só pode ser aplicada na análise de dados offline. O desenvolvimento adicional do software e o estabelecimento da comunicação em tempo real dos sistemas EMG disponíveis com o software forneceriam visualização e análise em tempo real da EMG dos músculos respiratórios. Isso ofereceria o potencial de utilização da EMG dos músculos respiratórios para apoiar a tomada de decisões clínicas em tempo real.
A EMG do músculo respiratório pode fornecer informações sobre a atividade muscular e o impulso respiratório. É uma técnica relativamente complexa que engloba várias etapas para garantir uma boa qualidade de sinal. Este protocolo descreve etapas para garantir uma boa preparação, aquisição e processamento de sinais e fornece informações relativas à magnitude e ao momento da atividade dos músculos respiratórios, ambos associados a desfechos clínicos. Este protocolo recebeu Autorização de Ética em Pesquisa de várias instituições internacionais.
Divulgações
Os autores declaram não ter conflito de interesses a divulgar.
Agradecimentos
A AR é apoiada por uma bolsa de estudos do Canadian Institutes of Health Research (CIHR) (# 187900) e a UM foi financiada pela Mitacs (IT178-9 -FR101644).
Materiais
| Name | Company | Catalog Number | Comments |
| Adjustable table | Amazon | VIVO Electric Height Adjustable 102 cm x 61 cm Stand Up Desk | Enables fine adjustment for trunk and mouthpiece position |
| Air filters | Cardinal | https://cardinalfilters.com/ | |
| Analog output cable | A-Tech Instruments Ltd. | 25 pin D-sub Female to 16xBNC male; 16xRG-174 -16 x 3ft cable | To connect EMG (Noroxan) to data acquisition system (PowerLab) |
| Bioamp for ECG | ADInstruments | ML138 | |
| Desktop or Laptop | N/A | N/A | Capacity for data acquisition system including EMG |
| Double sticks for EMG probes | Noraxon | https://shop.noraxon.com/products/dual-emg-electrodes | |
| Electromyography | Noraxon | Noraxon Ultium Myomuscle with 8 smart leads. https://www.noraxon.com/our-products/ultium-emg/ | |
| EMG electrodes | Duotrode | N/A | |
| Gas analyzer | ADInstruments | ML206 | |
| Gloves | Medline | https://www.medline.com/jump/category/x/cat1790003 | |
| Metricide or protocol to disinfect valves & mouthpieces | Medline | https://www.medline.com/product/MetriCide-28-Disinfectant/Disinfectants/Z05-PF27961?question=metricide | |
| Oximeter pod | ADInstruments | ML320/F | https://www.adinstruments.com/products/oximeter-pods |
| Pneumotach | ADInstruments | MLT3813H-V | https://www.adinstruments.com/products/heated-pneumotach-800-l-heater-controller |
| Powerlab and Labchart Data Acquisition System | ADInstruments, Inc. | https://m-cdn.adinstruments.com/brochures/Research_PowerLab _Brochure_V2-1.pdf | Acquires mouth pressure, ECG, end-tidal CO2, flow (to derive respiratory rate, tidal volume, minute ventilation) and EMG. |
| Pressure transducer with single or dual channel demodulator | Validyne.com | Www.Validyne.Com/Product/Dp45_Low_Pressure_ Variable_Reluctance_Sensor/ | Range depends on population being tested i.e. patients or healthy (Www.Validyne.Com/Product/Cd280_Multi_Channel_Carrier_ Demodulator/; www.Validyne.Com/Product/Cd15_General_Purpose_Basic _Carrier_Demodulator/) |
| Silicone mouthpieces | Hans Rudolph | https://www.rudolphkc.com/ | Small bite size |
| Table model chin rest | Sacor Inc. | Model 600700 | https://sacor.ca/products/head-chin-rest-table-model-with-white-chin-rest-cup |
| Two-way t-piece nonrebreathing valve with sampling port | Hans Rudolph | 1410 Small | |
| Ultrasound | GE Healthcare | Vivid i BT12 Cardiac system with Respiration and 12L-RS Linear Array Transducer | Requires resolution to landmark respiratory muscles including appositional region of diaphragm |
Referências
- Vaporidi, K., et al. Respiratory drive in critically ill patients. Pathophysiology and clinical implications. Am J Respir Crit Care Med. 201 (1), 20-32 (2020).
- Ciumas, C., Rheims, S., Ryvlin, P. fMRI studies evaluating central respiratory control in humans. Front Neural Circuits. 16, 982963 (2022).
- Domnik, N. J., Walsted, E. S., Langer, D. Clinical utility of measuring inspiratory neural drive during cardiopulmonary exercise testing (CPET). Front Med (Lausanne). 7, 483 (2020).
- Hudson, A. L., et al. Activation of human inspiratory muscles in an upside-down posture. Respir Physiol Neurobiol. 226, 152-159 (2016).
- Hodges, P. W., Gandevia, S. C. Pitfalls of intramuscular electromyographic recordings from the human costal diaphragm. Clin Neurophysiol. 111 (8), 1420-1424 (2000).
- Nguyen, D. a. T., et al. Differential activation of the human costal and crural diaphragm during voluntary and involuntary breaths. J Appl Physiol (1985). 128 (5), 1262-1270 (2020).
- Hudson, A. L., Gandevia, S. C., Butler, J. E. Common rostrocaudal gradient of output from human intercostal motoneurones during voluntary and automatic breathing. Respir Physiol Neurobiol. 175 (1), 20-28 (2011).
- Epiu, I., et al. Inspiratory muscle responses to sudden airway occlusion in chronic obstructive pulmonary disease. J Appl Physiol (1985). 131 (1), 36-44 (2021).
- Sinderby, C., et al. An automated and standardized neural index to quantify patient-ventilator interaction. Crit Care. 17 (5), R239 (2013).
- Estrada, L., Sarlabous, L., Lozano-Garcia, M., Jane, R., Torres, A. Neural offset time evaluation in surface respiratory signals during controlled respiration. 2019, 2344-2347 (2019).
- Luo, Y. M., Moxham, J. Measurement of neural respiratory drive in patients with COPD. Respir Physiol Neurobiol. 146 (2-3), 165-174 (2005).
- Jonkman, A. H., et al. Analysis and applications of respiratory surface EMG: Report of a round table meeting. Crit Care. 28 (1), 2 (2024).
- Rodrigues, A., et al. Semi-automated detection of the timing of respiratory muscle activity: Validation and first application. Front Physiol. 12, 794598 (2021).
- Parthasarathy, S., Jubran, A., Tobin, M. J. Cycling of inspiratory and expiratory muscle groups with the ventilator in airflow limitation. Am J Respir Crit Care Med. 158 (5 Pt 1), 1471-1478 (1998).
- De Troyer, A., Boriek, A. M. Mechanics of the respiratory muscles. Compr Physiol. 1 (3), 1273-1300 (2011).
- Laghi, F., et al. Diaphragmatic neuromechanical coupling and mechanisms of hypercapnia during inspiratory loading. Respir Physiol Neurobiol. 198, 32-41 (2014).
- Parthasarathy, S., Jubran, A., Laghi, F., Tobin, M. J. Sternomastoid, rib cage, and expiratory muscle activity during weaning failure. J Appl Physiol (1985). 103 (1), 140-147 (2007).
- Parthasarathy, S., Jubran, A., Tobin, M. J. Assessment of neural inspiratory time in ventilator-supported patients. Am J Respir Crit Care Med. 162 (2 Pt 1), 546-552 (2000).
- Dacha, S. R. A., Louvaris, Z., Janssens, L., Janssens, W., Gosselink, R., Langer, D. Effects of inspiratory muscle training (IMT) on dyspnea, respiratory muscle function and respiratory muscle activation in patients with COPD during endurance cycling. Eur Respir J. 54 (Suppl 63), PA2199 (2019).
- Bellissimo, C. A., Morris, I. S., Wong, J., Goligher, E. C. Measuring diaphragm thickness and function using point-of-care ultrasound. J Vis Exp. 201, e65431 (2023).
- Basoudan, N., et al. Scalene and sternocleidomastoid activation during normoxic and hypoxic incremental inspiratory loading. Physiol Rep. 8 (14), e14522 (2020).
- Basoudan, N., Shadgan, B., Guenette, J. A., Road, J., Reid, W. D. Effect of acute hypoxia on inspiratory muscle oxygenation during incremental inspiratory loading in healthy adults. Eur J Appl Physiol. 116 (4), 841-850 (2016).
- Melo, L. T., et al. Prefrontal cortex activation during incremental inspiratory loading in healthy participants. Respir Physiol Neurobiol. 296, 103827 (2022).
- Dacha, S., et al. Comparison between manual and (semi-)automated analyses of esophageal diaphragm electromyography during endurance cycling in patients with COPD. Front Physiol. 10, 885 (2019).
- Hermens, H. J., Freriks, B., Disselhorst-Klug, C., Rau, G. Development of recommendations for SEMG sensors and sensor placement procedures. J Electromyogr Kinesiol. 10 (5), 361-374 (2000).
- Petersen, E., Sauer, J., Graßhoff, J., Rostalski, P. Removing cardiac artifacts from single-channel respiratory electromyograms. IEEE Access. 8, 30905-30917 (2020).
- Hutten, G. J., van Thuijl, H. F., van Bellegem, A. C., van Eykern, L. A., van Aalderen, W. M. A literature review of the methodology of EMG recordings of the diaphragm. J Electromyogr Kinesiol. 20 (2), 185-190 (2010).
- van Leuteren, R. W., Hutten, G. J., de Waal, C. G., Dixon, P., van Kaam, A. H., de Jongh, F. H. Processing transcutaneous electromyography measurements of respiratory muscles, a review of analysis techniques. J Electromyogr Kinesiol. 48, 176-186 (2019).
- Jonkman, A. H., Juffermans, R., Doorduin, J., Heunks, L. M. A., Harlaar, J. Estimated ECG subtraction method for removing ECG artifacts in esophageal recordings of diaphragm EMG. Biomed Signal Process Control. 69, 102861 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados