Method Article
Isolando células imunes do cérebro e crânio de camundongos
Neste Artigo
Resumo
Para investigar a resposta imune a distúrbios cerebrais, uma abordagem comum é analisar as mudanças nas células imunológicas. Aqui, dois protocolos simples e eficazes são fornecidos para isolar células imunes do tecido cerebral murino e da medula óssea do crânio.
Resumo
Evidências crescentes indicam que a resposta imune desencadeada por distúrbios cerebrais (por exemplo, isquemia cerebral e encefalomielite autoimune) ocorre não apenas no cérebro, mas também no crânio. Um passo fundamental para analisar as mudanças nas populações de células imunes no cérebro e na medula óssea do crânio após danos cerebrais (por exemplo, acidente vascular cerebral) é obter um número suficiente de células imunes de alta qualidade para análises posteriores. Aqui, dois protocolos otimizados são fornecidos para isolar células imunes do cérebro e da medula óssea do crânio. As vantagens de ambos os protocolos se refletem em sua simplicidade, velocidade e eficácia na produção de uma grande quantidade de células imunes viáveis. Essas células podem ser adequadas para uma variedade de aplicações downstream, como classificação de células, citometria de fluxo e análise transcriptômica. Para demonstrar a eficácia dos protocolos, experimentos de imunofenotipagem foram realizados em cérebros de AVC e medula óssea de crânio cerebral normal usando análise de citometria de fluxo, e os resultados se alinharam com os achados de estudos publicados.
Introdução
O cérebro, o centro do sistema nervoso, é protegido pelo crânio. Abaixo do crânio estão três camadas de tecido conjuntivo conhecidas como meninges - dura-máter, aracnóide e pia-máter. O líquido cefalorraquidiano (LCR) circula no espaço subaracnóideo entre a aracnóide e a pia-máter, amortecendo o cérebro e também removendo os resíduos pelo sistema glinfático 1,2. Juntos, essa arquitetura exclusiva fornece um ambiente seguro e de suporte que mantém a estabilidade do cérebro e o protege de possíveis lesões.
O cérebro há muito é considerado imunoprivilegiado. No entanto, essa noção foi parcialmente abandonada, pois evidências crescentes indicam que, além da micróglia residente no parênquima, as bordas do cérebro, incluindo o plexo coróide e as meninges, hospedam uma gama diversificada de células imunes3. Essas células desempenham papéis críticos na manutenção da homeostase, na vigilância da saúde do cérebro e no início da resposta imune à lesão cerebral. Notavelmente, descobertas recentes indicam que o crânio está envolvido na imunidade das meninges e pode contribuir para a resposta imune no cérebro após a lesão. Em 2018, Herisson et al. fizeram uma descoberta seminal de canais vasculares diretos que ligam a medula óssea do crânio às meninges, estabelecendo assim uma rota anatômica para a migração de leucócitos 4,5. Posteriormente, Cugurra e col. demonstraram que muitas células mieloides (por exemplo, monócitos e neutrófilos) e células B nas meninges não se originam do sangue6. Usando técnicas como transplante de retalho ósseo da calvária e regimes de irradiação seletiva, os autores forneceram evidências convincentes de que a medula óssea do crânio serve como fonte local de células mieloides nas meninges, bem como no parênquima do SNC após lesão do SNC6. Além disso, outro estudo propôs que as células B meníngeas são constantemente supridas pela medula óssea do crânio7. Mais recentemente, uma nova estrutura, denominada saída do manguito aracnóide (ECA), foi identificada como uma porta de entrada direta entre a dura-máter e o cérebro para o tráfego de células imunes8.
Essas descobertas empolgantes têm implicações importantes para a origem da infiltração de células imunes no cérebro lesionado (por exemplo, após acidente vascular cerebral isquêmico). Um grande corpo de evidências indicou que, após o AVC, muitas células imunológicas se infiltram no cérebro, contribuindo tanto para danos cerebrais agudos quanto para a recuperação crônica do cérebro. A noção convencional é que essas células são leucócitos circulantes no sangue que se infiltram no cérebro, o que é amplamente facilitado por danos na barreira hematoencefálica induzidos por derrame. No entanto, essa noção foi contestada. Em um estudo, as células imunes no crânio e na tíbia de camundongos foram rotuladas de forma diferente e, 6 h após o AVC, uma diminuição significativamente maior de neutrófilos e monócitos foi encontrada no crânio vs. a tíbia e mais neutrófilos derivados do crânio estavam presentes no cérebro isquêmico. Esses dados sugerem que, na fase aguda do AVC, os neutrófilos no cérebro isquêmico se originam principalmente da medula óssea do crânio4. Curiosamente, o LCR pode orientar essa migração. De fato, dois relatórios recentes demonstraram que o LCR pode transmitir diretamente sinais de sinalização do cérebro para a medula óssea do crânio através dos canais do crânio e instruir a migração celular e a hematopoiese na medula óssea do crânio após lesão do SNC 9,10.
À luz dessas descobertas recentes, tornou-se importante analisar as mudanças nas células imunes no cérebro e na medula óssea do crânio, ao estudar a resposta imune a distúrbios cerebrais. Em tais investigações, um número suficiente de células imunes de alta qualidade é necessário para análises a jusante, como classificação de células, análise de citometria de fluxo e sequenciamento de RNA de célula única (scRNA-seq). Aqui, o objetivo geral é apresentar dois procedimentos otimizados para a preparação de suspensões unicelulares a partir do tecido cerebral e da medula óssea do crânio. É importante notar que a calvária (osso frontal, osso occipital e ossos parietais) do crânio é normalmente usada para extrair medula óssea, e essa medula óssea é especificamente referida como medula óssea do crânio ao longo deste estudo.
Protocolo
O protocolo foi aprovado pelo Comitê de Cuidados e Uso de Animais do Duke Institute (IACUC). Camundongos C57Bl/6 machos (3-4 meses de idade; 22-28 g) foram usados no presente estudo. Os detalhes dos reagentes e do equipamento utilizado estão listados na Tabela de Materiais.
1. Suspensão unicelular do cérebro do camundongo
NOTA: A Figura 1 ilustra a visão geral do protocolo de isolamento de células cerebrais.
- Anestesiar, intubar e prender o mouse, conforme demonstrado anteriormente11.
- Faça uma incisão abdominal superior através da pele e das camadas musculares subjacentes e corte cuidadosamente o diafragma e as costelas para criar a abertura na cavidade torácica.
- Encha uma seringa de 30 mL com PBS frio e conecte-a à agulha de perfusão romba por meio de um tubo de silicone. Insira cuidadosamente a agulha de perfusão no ventrículo esquerdo.
- Faça um pequeno corte no átrio direito para permitir a drenagem do sangue e, em seguida, perfunda12 o mouse a uma taxa de fluxo de ~ 10 mL / min por 3-4 min.
NOTA: Para melhorar a depuração do sangue no cérebro, pode-se considerar o aumento do volume da solução de perfusão e a adição de heparina. - Decapite o camundongo e faça uma incisão na linha média através da pele no topo da cabeça para expor o crânio.
- Raspe cuidadosamente qualquer tecido conjuntivo que recobre o crânio usando uma pinça romba.
- Use uma tesoura de dissecção afiada para cortar cuidadosamente as suturas do crânio ao longo da linha média e em ambos os lados, criando uma aba.
- Levante suavemente a aba do crânio para expor o cérebro e use uma pinça romba para remover cuidadosamente o cérebro da cavidade craniana.
- Mergulhe o cérebro em uma placa de Petri contendo PBS gelado e remova todos os tecidos meninges restantes.
NOTA: Para melhor preservar a viabilidade celular, recomenda-se realizar todas as etapas a seguir no gelo ou a 4 ° C. - Coloque o cérebro em um homogeneizador Dounce de vidro pré-resfriado de 15 mL contendo 20 mL (cérebro inteiro) ou 12 mL (meio cérebro) de tampão HBSS antigo.
- Use o pilão Dounce solto para dissociar suave e lentamente o tecido cerebral com cerca de 100-120 golpes no gelo.
NOTA: Esta etapa é fundamental para obter uma grande quantidade de células cerebrais saudáveis. Esta etapa leva aproximadamente 10 min. Pare a homogeneização quando nenhum pedaço substancial de tecido cerebral for visível na suspensão. Neste ponto, o pilão pode facilmente se mover para baixo sem qualquer força. - Filtrar a suspensão de tecido cerebral resultante através de um filtro de células de 70 μm num tubo de centrifugação de 50 ml.
- Enxágue o tubo Dounce com 5 mL de HBSS e prossiga com a filtração para maximizar a coleta de células.
- Centrifugar a suspensão de tecido filtrado a 550 x g durante 6 min a 4 °C.
- Remova o sobrenadante usando um aspirador a vácuo e ressuspenda o pellet celular em 1 mL de solução de gradiente de densidade isotônica a 30%.
NOTA: Para fazer 15 mL de solução de gradiente de densidade isotônica a 30%, misture 4,5 mL de meio de gradiente de densidade de estoque a 100%, 1,5 mL de 10× PBS e 9 mL de ddH2O. - Transfira a suspensão celular para um tubo de centrífuga de 15 mL e adicione 9 mL (cérebro inteiro) ou 6 mL (meio cérebro) de solução de gradiente de densidade a 30%.
- Inverta suavemente o tubo para garantir uma mistura completa.
- Centrifugar imediatamente o tubo a 845 x g com aceleração e travão regulados para o nível 3, durante 20 min a 4 °C.
- Remova suavemente o tubo da centrífuga sem agitar e aspire cuidadosamente a camada superior de mielina usando uma ponta de 1 mL conectada ao vácuo.
NOTA: É extremamente importante não perturbar esta camada. Qualquer mielina remanescente pode afetar negativamente a saúde celular e comprometer as análises a jusante. - Aspire o sobrenadante, deixando 1-2 mL para trás, e ressuspenda o pellet celular com um mínimo de 10 mL de HBSS frio.
- Centrifugue a 550 x g durante 6 min a 4 °C.
- Lave mais uma vez com um mínimo de 7 mL de HBSS frio.
- Remova o máximo possível do sobrenadante e ressuspenda as células para análise de citometria de fluxo usando 100-200 μL de tampão de citometria de fluxo.
NOTA: O tampão FACS de citometria de fluxo usado para este estudo contém 0,5% de BSA e 2 mM de EDTA em 1× PBS. Recomenda-se uma placa de fundo em V de 96 poços para coloração celular para minimizar a perda de células durante as etapas de lavagem. - Realizar análise de citometria de fluxo usando um protocolo padrão estabelecido em laboratórios individuais13.
- Resumidamente, misturar 80 μl de suspensão celular com 20 μl da mistura de anticorpos numa placa de fundo em V de 96 poços e incubar durante 25 min a 4 °C.
- Lave com 200 μL de tampão FACS e, em seguida, ressuspenda as células com 100 μL de HBSS mais reagente de coloração de viabilidade celular.
- Após uma incubação de 15 minutos a 4 °C, lavar com tampão FACS e ressuspender as células em 200 μL de tampão FACS para análise por citometria de fluxo.
2. Preparação da suspensão unicelular da medula óssea a partir da calvária de camundongo
NOTA: A Figura 2 mostra a visão geral do procedimento de isolamento da medula óssea do crânio.
- Perfunda o mouse conforme descrito na etapa 1.4.
- Decapite o camundongo e faça uma incisão na linha média da pele no couro cabeludo para expor o crânio.
- Corte o crânio, começando pelo forame magno e avançando ao longo dos lados laterais da calvária usando uma tesoura afiada. Em seguida, levante e remova a calvária.
NOTA: O cérebro pode ser colhido do mesmo camundongo e processado usando a etapa 1, permitindo a análise de células imunes do cérebro e da medula óssea do crânio. - Retire cuidadosamente a dura-máter do crânio sob um microscópio de dissecação usando uma pinça romba.
NOTA: É mais fácil começar nas bordas do osso occipital, desprender-se lentamente e progredir de forma constante em direção à área frontal, trabalhando para dentro. - Coloque a calvária no prato sobre gelo e use uma pipeta de 1 mL para enxaguar a calvária, garantindo a remoção de resíduos de sangue de sua superfície.
- Transfira a calvária para um novo prato com PBS fresco e frio, suficiente para mergulhar a calvária.
- Use uma tesoura estéril para cortar a calvária em fragmentos de aproximadamente 3 mm x 3 mm em PBS frio.
NOTA: Os métodos de corte podem afetar a eficiência da extração da medula óssea da calvária. Recomenda-se que o mesmo método de corte seja usado para minimizar a variabilidade. Também é importante abrir as suturas. A Figura 2B ilustra uma abordagem. - Faça um furo no fundo de um tubo de microcentrífuga de 500 μL usando uma agulha de 18 G.
- Insira este tubo em um tubo de microcentrífuga de 1,5 mL contendo 20 μL de PBS frio.
- Transferir os fragmentos da calvária para o tubo de 500 μL.
NOTA: Os fragmentos ósseos devem ser compactados frouxamente para aumentar a eficiência da extração. - Centrifugar a 10.000 x g durante 30 s a 4 °C.
NOTA: Para maximizar a recuperação celular, use uma agulha de 18 G para mexer suavemente os fragmentos da calvária e repita esta etapa mais 1-2 vezes. - Ressuspenda as células da medula óssea da calvária coletadas em 500 μL de tampão de lise de glóbulos vermelhos e incube em temperatura ambiente por 30 s.
- Transfira a suspensão para um tubo de centrífuga de 15 mL contendo 4 mL de PBS frio.
- Centrifugue a 400 x g por 6 min a 4 °C.
- Lave mais uma vez com 5 mL de PBS frio.
- Ressuspenda o pellet celular em um tampão apropriado. Para citometria de fluxo, normalmente usamos 500 μL de tampão FACS.
- Para análise de citometria de fluxo, realize a contagem de células e use aproximadamente 1 x 106 células para coloração de anticorpos.
NOTA: Certifique-se de incluir a etapa do bloqueio Fc antes da coloração do anticorpo13.
Resultados
Para preparar células imunes a partir do tecido cerebral do camundongo, o protocolo geralmente produz células com alta viabilidade (84,1% ± 2,3% [média ± DP]). Aproximadamente 70% -80% dessas células são CD45 positivas. No cérebro normal de camundongos, quase todas as células CD45+ são microglia (CD45 CD11b+ baixo), como esperado. Este protocolo tem sido usado em laboratório para várias aplicações, incluindo análise de citometria de fluxo, classificação de células ativadas por fluorescência (FACS) e análise de scRNA-seq. Como exemplo, uma análise de citometria de fluxo foi realizada em um modelo de AVC (Figura 3). Os camundongos foram submetidos a um modelo de AVC transitório, oclusão da artéria cerebral média por filamento de 30 min (MCAO)14. No dia 3 após o AVC, as células foram preparadas a partir de cérebros de camundongos e coradas com marcadores comuns de superfície de células imunes. A estratégia de gating é representada na Figura 3A. Consistente com pesquisas anteriores13,15, foi observado um aumento acentuado nas célulasCD45 High no hemisfério ipsilateral (Figura 3B,C), indicando infiltração da célula imune no cérebro.
Para o protocolo de medula óssea do crânio, um rendimento substancial de células da medula óssea do crânio (cerca de 2 x 106 células) foi consistentemente alcançado com excelente viabilidade (93,8% ± 1,8% [média ± DP]). Como esperado, a maioria dessas células é CD45 positiva. Para ilustrar a utilidade desse protocolo, foi realizado um estudo comparativo para caracterizar a composição de células imunes no fêmur e na medula óssea do crânio de camundongos virgens (Figura 4). Conforme ilustrado nos gráficos representativos, a composição das células imunes era semelhante entre o fêmur e a medula óssea do crânio (Figura 4A, B). Curiosamente, a frequência de neutrófilos parece ser maior no fêmur do que no osso do crânio (Figura 4C). No entanto, esse achado requer validação adicional, pois o tamanho da amostra foi pequeno para este estudo piloto.

Figura 1: Visão geral do protocolo de isolamento de células cerebrais. Clique aqui para ver uma versão maior desta figura.

Figura 2: O protocolo de isolamento de células da medula óssea do crânio. (A) Visão geral do procedimento. (B) O padrão recomendado para o corte do crânio. Clique aqui para ver uma versão maior desta figura.
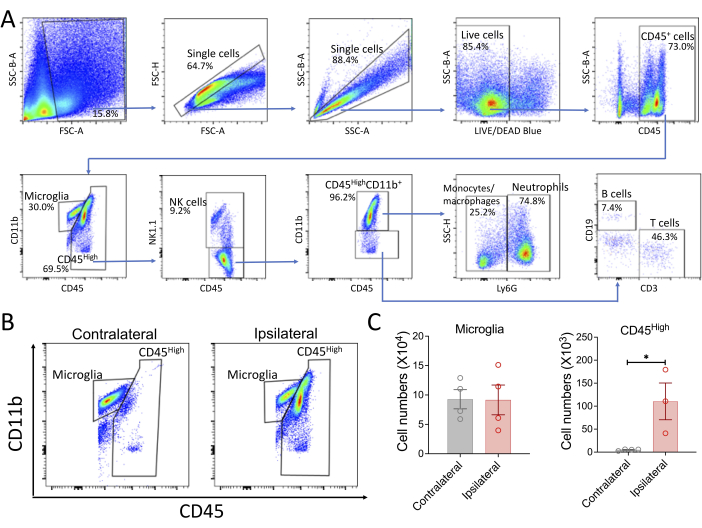
Figura 3: Análise de citometria de fluxo representativa das células imunes no cérebro do AVC. (A) Um exemplo da estratégia de gating. Os gráficos descrevem as seguintes populações de células imunes: microglia (CD45LowCD11b+), células NK (CD45HighNK1.1+), neutrófilos (CD45HighLy6G+), células T (CD45HighCD11b-CD3+) e células B (CD45HighCD11b-CD19+). Este exemplo representa uma análise das células imunes cerebrais no hemisfério ipsilateral no dia 3 após o AVC. (B, C) Infiltrando células imunes no cérebro do derrame. Camundongos machos jovens foram submetidos à oclusão transitória da artéria cerebral média (MCAO). No dia 3, os cérebros foram coletados e divididos em hemisférios esquerdo (contralateral) e direito (ipsilateral). As células cerebrais foram preparadas de acordo com o protocolo descrito e, em seguida, submetidas à análise por citometria de fluxo. Gráficos representativos ilustram o aumento da infiltração de células imunes no hemisfério ipsilateral (célulasCD45 altas; Os dados quantitativos são mostrados nos gráficos de barras (C). O número de células foi calculado com base na contagem de células e no volume registrados nos dados de citometria de fluxo. Os dados são apresentados como média ± EPM. *p < 0,05. Clique aqui para ver uma versão maior desta figura.

Figura 4: Análise de citometria de fluxo representativa das células da medula óssea do crânio. Para comparação, foi incluída a análise de células da medula óssea do fêmur. Os gráficos descrevem as seguintes populações de células imunes: células NK (CD45 + NK1.1 +), neutrófilos (CD45 + CD11b + Ly6G +), células T (CD45 + CD11b-CD3 +) e células B (CD45 + CD11b-CD19 +). (A) Parcelas representativas para a medula óssea do fêmur. (B) Parcelas representativas para a medula óssea do crânio. (C) Comparação da composição das células imunes entre o fêmur e a medula óssea do crânio. Os dados são apresentados como média ± EPM. *p < 0,05. Clique aqui para ver uma versão maior desta figura.
Discussão
Aqui, dois protocolos simples, mas eficazes, são apresentados para isolar células imunes do cérebro e da medula óssea do crânio. Esses protocolos podem produzir de forma confiável uma grande quantidade de células imunes viáveis que podem ser adequadas para diversas aplicações a jusante, em particular para citometria de fluxo.
Para estudar a neuroinflamação em vários distúrbios cerebrais, muitos protocolos para preparações de células imunes do cérebro foram estabelecidos e usados em diferentes laboratórios 15,16,17. As abordagens comuns envolvem dissociação celular baseada em enzimas seguida de separação de gradiente. Normalmente, nesses protocolos, o tecido cerebral é picado e depois incubado em uma solução de digestão enzimática contendo colagenase e DNase por 30-60 min a 37 ° C com agitação suave. Após a digestão, as células sofrem dissociação adicional usando um método mecânico, como pipetagem ou homogeneização Dounce. Depois de passar por um filtro de células (por exemplo, filtro de 70 μm), as células são submetidas à centrifugação de gradiente (geralmente solução de gradiente de densidade de 30%/70%) para remover mielina, glóbulos vermelhos e detritos e enriquecer leucócitos. No entanto, essa abordagem requer uma incubação enzimática prolongada a 37 ° C que pode alterar substancialmente o transcriptoma e o proteoma das células imunes cerebrais. De fato, uma investigação sistemática sugeriu que a abordagem enzimática introduz alterações profundas no transcriptoma e no proteótipo de células cerebrais específicas18. Isso pode levar a artefatos em análises transcriptômicas subsequentes, como scRNA-seq. Em contraste, o protocolo relatado aqui usa uma abordagem de dissociação mecânica em temperaturas frias durante todo o procedimento, suprimindo assim o metabolismo celular. Isso garante uma melhor preservação do estado transcricional e proteômico, minimizando possíveis artefatos. Durante o desenvolvimento do protocolo, notamos que o uso de um grande homogeneizador Dounce para homogeneizar o tecido cerebral é fundamental para alcançar contagens de células mais altas com menor morte celular. É provável que durante a homogeneização de Dounce, a presença maciça de matrizes extracelulares, detritos celulares e componentes citoplasmáticos seja tóxica para as células. O uso de uma quantidade excessiva de tampão ajuda a diluir essas substâncias tóxicas e, assim, mitiga seus efeitos nocivos, levando a uma melhor viabilidade celular. Os dados de citometria de fluxo confirmaram uma taxa de viabilidade aproximada de 85% das células imunes preparadas com este protocolo. Além disso, é notável que a centrifugação com apenas uma solução de gradiente de densidade de 30% enriquece efetivamente as células imunológicas do cérebro e remove a mielina. Isso também pode reduzir o custo da preparação da célula.
Os estudos sobre células imunes na medula óssea do crânio ainda são limitados. Um método comumente usado para isolar células da calvária do crânio do camundongo envolve cortar o crânio em pequenos pedaços e, em seguida, esmagar mecanicamente os pedaços com um pilão6. No protocolo atual, a centrifugação breve é usada. Esse método é adaptado de um protocolo publicado para preparação de medula óssea de fêmures e tíbias19. Para esses ossos longos, basta cortar uma extremidade do osso para coletar a medula óssea por centrifugação. Para o crânio, esta etapa é modificada cortando-o em vários pedaços pequenos para abrir a cavidade da medula. Recomenda-se o uso de um padrão consistente para cortar o crânio, a fim de obter contagens de células reprodutíveis. Além disso, para maximizar a recuperação das células da medula óssea, os pedaços do crânio podem passar por 2-3 rodadas de centrifugação com mistura entre cada centrifugação.
Ambos os protocolos têm limitações. Primeiro, o uso de centrifugação de solução de gradiente de densidade de 30% pode não remover efetivamente os glóbulos vermelhos restantes no cérebro, o que pode ocorrer devido à perfusão incompleta. Além disso, se a estrutura da mielina for modulada sob certas condições, uma solução de gradiente de densidade de 30% pode não ser uma concentração ideal para sua remoção. Neste caso, outra concentração de trabalho da solução de gradiente de densidade precisa ser estabelecida. Em segundo lugar, embora a análise por citometria de fluxo indique boa viabilidade celular das células imunes cerebrais usando o protocolo descrito, ela ainda precisa ser avaliada para outras aplicações, como a análise transcriptômica na qual a actinomicina D pode ser usada. Terceiro, a calvária é usada para preparar a medula óssea do crânio. No entanto, deve-se notar que as células imunológicas existem em muitas outras partes do crânio. Por fim, as meninges, especialmente a dura-máter, abrigam diversas células imunológicas e desempenham papéis na homeostase e disfunção cerebral20. Para análise imunológica das meninges, um protocolo publicado em outro lugar pode ser adotado 17,21,22,23.
Em resumo, dois protocolos robustos para isolar células imunes do cérebro e do crânio de camundongos são descritos. Espera-se que esses protocolos sejam úteis para obter uma grande quantidade de células de alta qualidade, adequadas para várias aplicações a jusante.
Divulgações
Nenhum.
Agradecimentos
Agradecemos a Kathy Gage por sua excelente contribuição editorial. As figuras ilustrativas foram criadas com BioRender.com. Este estudo foi apoiado por fundos do Departamento de Anestesiologia (Duke University Medical Center) e bolsas do NIH NS099590, HL157354 e NS127163.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.5 mL microcentrifuge tubes | VWR | 76332-066 | |
| 1.5 mL microcentrifuge tubes | VWR | 76332-068 | |
| 15 mL conical tubes | Thermo Fisher Scientific | 339651 | |
| 18 G x 1 in BD PrecisionGlide Needle | BD Biosciences | 305195 | |
| 1x HBSS | Gibco | 14175-095 | |
| 50 mL conical tubes | Thermo Fisher Scientific | 339653 | |
| 96-well V-bottom microplate | SARSTEDT | 82.1583 | |
| AURORA flow cytometer | Cytek bioscience | ||
| BSA | Fisher | BP9706-100 | |
| CD11b-AF594 | BioLegend | 101254 | 1:500 dilution |
| CD19-BV785 | BioLegend | 115543 | 1:500 dilution |
| CD19-FITC | BioLegend | 115506 | 1:500 dilution |
| CD3-APC | BioLegend | 100312 | 1:500 dilution |
| CD3-PE | BioLegend | 100206 | 1:500 dilution |
| CD45-Alex 700 | BioLegend | 103128 | 1:500 dilution |
| CD45-BV421 | Biolegend | 103133 | 1:500 dilution |
| Cell Strainer 70 um | Avantor | 732-2758 | |
| Dressing Forceps | V. Mueller | NL1410 | |
| EDTA | Invitrogen | 15575-038 | |
| Fc Block | Biolegend | 101320 | 1:100 dilution |
| Forceps | Roboz | RS-5047 | |
| LIVE/DEAD Fixable Blue Dead Cell Stain Kit | Thermo Fisher Scientific | N7167 | 1:500 dilution |
| Ly6G-BV421 | BioLegend | 127628 | 1:500 dilution |
| Ly6G-PerCp-cy5.5 | BioLegend | 127615 | 1:500 dilution |
| NK1.1-APC-cy7 | BioLegend | 108723 | 1:500 dilution |
| Percoll (density gradient medium) | Cytiva | 17089101 | |
| Phosphate buffer saline (10x) | Gibco | 70011-044 | |
| RBC Lysis Buffer (10x) | BioLegend | 420302 | |
| Scissors | SKLAR | 64-1250 | |
| WHEATON Dounce Tissue, 15 mL Size | DWK Life Sciences | 357544 |
Referências
- Bohr, T., et al. The glymphatic system: Current understanding and modeling. iScience. 25 (9), 104987 (2022).
- Jiang-Xie, L. F., et al. Neuronal dynamics direct cerebrospinal fluid perfusion and brain clearance. Nature. 627 (8002), 157-164 (2024).
- Goertz, J. E., Garcia-Bonilla, L., Iadecola, C., Anrather, J. Immune compartments at the brain's borders in health and neurovascular diseases. Semin Immunopathol. 45 (3), 437-449 (2023).
- Herisson, F., et al. Direct vascular channels connect skull bone marrow and the brain surface enabling myeloid cell migration. Nat Neurosci. 21 (9), 1209-1217 (2018).
- Mazzitelli, J. A., et al. Skull bone marrow channels as immune gateways to the central nervous system. Nat Neurosci. 26 (12), 2052-2062 (2023).
- Cugurra, A., et al. Skull and vertebral bone marrow are myeloid cell reservoirs for the meninges and CNS parenchyma. Science. 373 (6553), 7844 (2021).
- Brioschi, S., et al. Heterogeneity of meningeal b cells reveals a lymphopoietic niche at the CNS borders. Science. 373 (6553), 9277 (2021).
- Smyth, L. C. D., et al. Identification of direct connections between the dura and the brain. Nature. 627, 165-173 (2024).
- Mazzitelli, J. A., et al. Cerebrospinal fluid regulates skull bone marrow niches via direct access through dural channels. Nat Neurosci. 25 (5), 555-560 (2022).
- Pulous, F. E., et al. Cerebrospinal fluid can exit into the skull bone marrow and instruct cranial hematopoiesis in mice with bacterial meningitis. Nat Neurosci. 25 (5), 567-576 (2022).
- Li, R., et al. Mouse cardiac arrest model for brain imaging and brain physiology monitoring during ischemia and resuscitation. J Vis Exp. (194), e65340 (2023).
- Wang, W., et al. Development and evaluation of a novel mouse model of asphyxial cardiac arrest revealed severely impaired lymphopoiesis after resuscitation. J Am Heart Assoc. 10 (11), e019142 (2021).
- Li, X., et al. Single-cell transcriptomic analysis of the immune cell landscape in the aged mouse brain after ischemic stroke. J Neuroinflammation. 19 (1), 83 (2022).
- Wang, Y. C., et al. Perk (protein kinase RNA-like er kinase) branch of the unfolded protein response confers neuroprotection in ischemic stroke by suppressing protein synthesis. Stroke. 51 (5), 1570-1577 (2020).
- Posel, C., Moller, K., Boltze, J., Wagner, D. C., Weise, G. Isolation and flow cytometric analysis of immune cells from the ischemic mouse brain. J Vis Exp. (108), e53658 (2016).
- Srakocic, S., et al. Proposed practical protocol for flow cytometry analysis of microglia from the healthy adult mouse brain: Systematic review and isolation methods' evaluation. Front Cell Neurosci. 16, 1017976 (2022).
- Disano, K. D., et al. Isolating central nervous system tissues and associated meninges for the downstream analysis of immune cells. J Vis Exp. (159), e61166 (2020).
- Mattei, D., et al. Enzymatic dissociation induces transcriptional and proteotype bias in brain cell populations. Int J Mol Sci. 21 (21), (2020).
- Mcgill, C. J., Lu, R. J., Benayoun, B. A. Protocol for analysis of mouse neutrophil netosis by flow cytometry. STAR Protoc. 2 (4), 100948 (2021).
- Su, Y., et al. Meningeal immunity and neurological diseases: New approaches, new insights. J Neuroinflammation. 20 (1), 125 (2023).
- Niu, C., et al. Mechanical isolation of neonatal and adult mouse dura leukocytes for flow cytometry analysis. STAR Protoc. 4 (2), 102272 (2023).
- Roussel-Queval, A., Rebejac, J., Eme-Scolan, E., Paroutaud, L. A., Rua, R. Flow cytometry and immunohistochemistry of the mouse dural meninges for immunological and virological assessments. STAR Protoc. 4 (1), 102119 (2023).
- Louveau, A., Filiano, A. J., Kipnis, J. Meningeal whole mount preparation and characterization of neural cells by flow cytometry. Curr Protoc Immunol. 121 (1), e50 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados