Method Article
マウスの脳と頭蓋骨からの免疫細胞の単離
要約
脳疾患に対する免疫応答を調べるために、免疫細胞の変化を解析するアプローチが一般的です。ここでは、マウスの脳組織と頭蓋骨骨髄から免疫細胞を単離するための2つの簡単で効果的なプロトコルが提供されています。
要約
脳の障害(脳虚血や自己免疫性脳脊髄炎など)によって引き起こされる免疫応答は、脳だけでなく頭蓋骨でも起こるという証拠が増えています。脳損傷(脳卒中など)後の脳と頭蓋骨骨髄の両方の免疫細胞集団の変化を解析するための重要なステップは、ダウンストリーム解析に十分な数の高品質の免疫細胞を取得することです。ここでは、脳と頭蓋骨骨髄から免疫細胞を単離するために、2つの最適化されたプロトコルが提供されています。両方のプロトコルの利点は、その簡便性、速度、および大量の生存免疫細胞の生成における有効性に反映されています。これらの細胞は、細胞ソーティング、フローサイトメトリー、トランスクリプトーム解析など、さまざまなダウンストリームアプリケーションに適している可能性があります。プロトコールの有効性を実証するために、フローサイトメトリー解析を用いて脳卒中脳と正常脳頭蓋骨髄のイムノフェノタイピング実験を行い、その結果は発表された研究結果と一致しました。
概要
神経系の中枢である脳は、頭蓋骨によって保護されています。頭蓋骨の下には、髄膜として知られる結合組織の3つの層(硬膜、くも膜、軟膜)があります。脳脊髄液(CSF)は、くも膜母と軟膜の間のくも膜下腔を循環し、脳を緩衝し、またリンパ系を介して老廃物を取り除きます1,2。このユニークなアーキテクチャは、脳の安定性を維持し、潜在的な損傷から脳を保護する安全で支援的な環境を提供します。
脳は長い間、免疫特権があると考えられてきました。しかし、実質に常在するミクログリアに加えて、脈絡叢や髄膜を含む脳の境界には多様な免疫細胞が宿主であるという証拠が増えているため、この概念は部分的に放棄されています3。これらの細胞は、恒常性の維持、脳の健康の監視、および脳損傷に対する免疫応答の開始に重要な役割を果たします。特に、最近の知見では、頭蓋骨が髄膜免疫に関与しており、損傷後の脳内の免疫応答に寄与している可能性が示されています。2018年、Herissonらは、頭蓋骨骨髄と髄膜をつなぐ直接的な血管チャネルの独創的な発見をし、それによって白血球の移動の解剖学的経路を確立しました4,5。その後、Cugurraらは、髄膜の多くの骨髄細胞(単球や好中球など)とB細胞が血液に由来しないことを実証しました6。著者らは、頭蓋骨骨移植や選択的照射レジメンなどの技術を用いて、頭蓋骨骨髄が髄膜の骨髄細胞の局所供給源として、また中枢神経系損傷後の中枢神経系実質の局所供給源として機能するという説得力のある証拠を提供した6。さらに、別の研究では、髄膜B細胞が頭蓋骨骨髄7によって常に供給されていることが提唱された。最近では、くも膜下カフ出口(ACE)と呼ばれる新しい構造が、免疫細胞の輸送のための硬膜と脳との間の直接のゲートウェイとして特定されています8。
これらの興味深い知見は、損傷した脳への免疫細胞の浸潤の起源(虚血性脳卒中後など)に重要な意味を持っています。脳卒中後、多くの免疫細胞が脳に浸潤し、急性脳損傷と慢性脳回復の両方に寄与することが、多くの証拠で示されています。従来の考え方では、これらの細胞は血液中の白血球を循環させ、脳に浸潤していると考えられていましたが、これは主に脳卒中による血液脳関門の損傷によって促進されます。しかし、この概念は挑戦されています。ある研究では、マウスの頭蓋骨と脛骨の免疫細胞に異なる方法で標識され、脳卒中後6時間で、頭蓋骨と好中球と単球の有意に大きな減少が見られました。脛骨、およびより多くの頭蓋骨由来の好中球が虚血性脳に存在していました。これらのデータは、急性脳卒中期において、虚血性脳の好中球は主に頭蓋骨骨髄に由来することを示唆しています4。興味深いことに、CSFはこの移行を導くかもしれません。実際、最近の2つの報告では、CSFが脳からのシグナル伝達の手がかりを頭蓋骨チャネルを介して頭蓋骨骨髄に直接中継し、CNS損傷後の頭蓋骨骨髄の細胞移動と造血を指示できることが示されました9,10。
これらの最近の知見を踏まえて、脳疾患に対する免疫応答を研究する際には、脳と頭蓋骨骨髄の免疫細胞の変化を解析することが重要になってきています。このような研究では、細胞ソーティング、フローサイトメトリー解析、シングルセルRNAシーケンシング(scRNA-seq)などのダウンストリーム解析に十分な数の高品質な免疫細胞が必要です。ここでは、全体的な目標は、脳組織と頭蓋骨骨髄から単一細胞懸濁液を調製するための 2 つの最適化された手順を提示することです。頭蓋骨の頭蓋骨(前頭骨、後頭骨、頭頂骨)は通常、骨髄の抽出に使用され、この骨髄は、この研究全体で特に頭蓋骨骨髄と呼ばれることに注意することが重要です。
プロトコル
このプロトコルは、デューク研究所の動物管理および使用委員会(IACUC)によって承認されました。本研究では、雄のC57Bl/6マウス(生後3-4ヶ月;22-28g)を用いた。試薬や使用した機器の詳細は、 資料表に記載されています。
1. マウス脳からのシングルセル懸濁液
注: 図1 は、脳細胞単離プロトコルの概要を示しています。
- 前に示したように、マウスに麻酔をかけ、挿管し、固定します11.
- 皮膚とその下の筋肉層を上腹部に切開し、横隔膜と肋骨を慎重に切り込んで胸腔への開口部を作ります。
- 30mLのシリンジに冷たいPBSを入れ、シリコンチューブ を介して 鈍灌流針に取り付けます。灌流針を左心室に慎重に挿入します。
- 右心房に小さな切り込みを入れて血液を排出し、その後、~10mL/minの流速でマウス12 を3〜4分間灌流します。
注:脳内の血液クリアランスを改善するために、灌流溶液の量を増やし、ヘパリンを追加することを検討することができます。 - マウスの首を切り、頭頂部の皮膚に正中線を切開して頭蓋骨を露出させます。
- 鈍い鉗子を使用して、頭蓋骨を覆っている結合組織を慎重にこすり落とします。
- 鋭利な解剖ハサミを使用して、正中線に沿って両側で頭蓋骨の縫合糸を慎重に切り込み、フラップを作成します。
- 頭蓋骨フラップをそっと持ち上げて脳を露出させ、鈍い鉗子を使用して頭蓋腔から脳を慎重に取り出します。
- 氷のように冷たいPBSが入ったシャーレに脳を浸し、残っている髄膜組織をすべて取り除きます。
注:細胞の生存率をより良く保持するために、以下のすべてのステップを氷上または4°Cで実行することをお勧めします。 - 20 mL(全脳)または12 mL(半脳)の氷の古いHBSSバッファーを含む、事前に冷却された15 mLガラス製ドンスホモジナイザーに脳を置きます。.
- ルーズなDounce Pestleを使用して、氷上で約100〜120回のストロークで脳組織を穏やかにゆっくりと解離させます。
注:このステップは、健康な脳細胞を大量に取得するために重要です。このステップには約10分かかります。懸濁液中に実質的な脳組織の塊が見えない場合は、均質化を停止します。この時点で、乳棒は力を入れなくても簡単に下降できます。 - 得られた脳組織懸濁液を、50 mLの遠心チューブ内の70 μmの細胞ストレーナーでろ過します。
- Dounceチューブを5mLのHBSSですすぎ、細胞コレクションを最大化するためにろ過を進めます。
- ろ過した組織懸濁液を550 x g で4°Cで6分間遠心分離します。
- 真空吸引器を使用して上清を除去し、細胞ペレットを30%等張密度勾配溶液1mLに再懸濁します。
注:15 mLの30%等張密度勾配溶液を作るには、4.5 mLの100%ストック密度勾配培地、1.5 mLの10× PBS、および9 mLのddH2Oを混合します。 - 細胞懸濁液を15 mLの遠心チューブに移し、9 mL(全脳)または6 mL(半脳)の30%密度勾配溶液を加えます。
- チューブを静かに反転させて、完全に混合します。
- 加速とブレーキをレベル3に設定した状態で、チューブを直ちに845 x g で遠心分離し、4°Cで20分間遠心分離します。
- チューブを振らずに遠心分離機から静かに取り外し、真空に接続された1 mLチップを使用して上部ミエリン層を慎重に吸引します。
注:この層を乱さないことが非常に重要です。ミエリンが残っていると、細胞の健康に悪影響を及ぼし、下流の分析に支障をきたす可能性があります。 - 上清を吸引し、1〜2 mLを残し、細胞ペレットを最低10 mLの冷たいHBSSで再懸濁します。
- 550 x g で4°Cで6分間遠心分離します。
- 最低7mLの冷たいHBSSでもう一度洗います。
- 上清をできるだけ多く取り除き、100-200 μLのフローサイトメトリーバッファーを使用して、フローサイトメトリー解析のために細胞を再懸濁します。
注:この研究に使用したフローサイトメトリーFACSバッファーには、1×PBS中に0.5%BSAと2mM EDTAが含まれています。細胞染色用の96ウェルV底プレートは、洗浄ステップ中の細胞損失を最小限に抑えるために推奨されます。 - 個々のラボで確立された標準プロトコルを使用してフローサイトメトリー分析を実行します13。
- 簡単に説明すると、80 μLの細胞懸濁液と20 μLの抗体混合物を96ウェルV底プレートで混合し、4 °Cで25分間インキュベートします。
- 200 μLのFACSバッファーで洗浄し、100 μLのHBSSと細胞生存率染色試薬で細胞を再懸濁します。
- 4°Cで15分間インキュベートした後、FACSバッファーで洗浄し、フローサイトメトリー分析のために細胞を200μLのFACSバッファーに再懸濁します。
2. マウスカルバリア由来骨髄単細胞懸濁液の調製
注: 図2 は、頭蓋骨骨髄分離手順の概要を示しています。
- 手順1.4の説明に従ってマウスを灌流します。
- マウスの首を切り、頭皮に正中線の皮膚切開を行い、頭蓋骨を露出させます。
- 大孔から始まり、鋭いハサミを使用して頭蓋骨の外側に沿って前進して、頭蓋骨を切り取ります。次に、カルバリアを持ち上げて取り外します。
注:脳は同じマウスから採取し、ステップ1を使用して処理することができ、脳と頭蓋骨骨髄の両方からの免疫細胞の分析が可能になります。 - 鈍い鉗子を使用して解剖顕微鏡で頭蓋骨から硬膜を慎重に剥がします。
注:後頭骨の端から始めて、ゆっくりと剥がし、内側に向かって前頭部に向かって着実に進行する方が簡単です。 - カルバリアを氷の上の皿に置き、1 mLのピペットを使用してカルバリアをすすぎ、表面から血液の残留物を確実に除去します。
- カルバリアを新しい皿に移し、カルバリアを浸すのに十分な新鮮で冷たいPBSを入れます。
- 滅菌ハサミを使用して、冷たいPBSでカルバリアを約3 mm x 3 mmの断片に切断します。
注:トリミング方法は、カルバリア骨髄抽出の効率に影響を与える可能性があります。ばらつきを最小限に抑えるために、同じトリミング方法を使用することをお勧めします。縫合糸を切り開くことも重要です。 図 2B は、1 つのアプローチを示しています。 - 18Gの針を使用して、500μLの微量遠心チューブの底に穴を開けます。
- このチューブを、20 μLの冷たいPBSが入った1.5 mLの微量遠心チューブに挿入します。
- 頭蓋骨の断片を500 μLチューブに移します。
注:骨片は、抽出効率を高めるために緩くパックする必要があります。 - 10,000 x g で4°Cで30秒間遠心分離します。
注:細胞回収率を最大化するには、18Gの針を使用して頭蓋骨の断片を穏やかに攪拌し、この手順をさらに1〜2回繰り返します。 - 採取した頭蓋骨髄細胞を500 μLの赤血球溶解バッファーに再懸濁し、室温で30秒間インキュベートします。
- 懸濁液を4mLの冷たいPBSが入った15mLの遠心分離チューブに移します。
- 400 x g で4°Cで6分間遠心分離します。
- 5mLの冷たいPBSでもう一度洗います。
- 細胞ペレットを適切な緩衝液に再懸濁します。フローサイトメトリーには、通常、500μLのFACSバッファーを使用します。
- フローサイトメトリー解析では、細胞計数を行い、抗体染色に約1 x 106 細胞を使用します。
注:抗体染色13の前にFcブロックステップを含めるようにしてください。
結果
マウス脳組織から免疫細胞を調製するために、プロトコルは一般に高い生存率(84.1%±2.3%[平均±SD])を有する細胞を産生する。これらの細胞の約70%〜80%はCD45陽性です。正常なマウスの脳では、予想通り、ほぼすべてのCD45+細胞がミクログリア(CD45LowCD11b+)です。このプロトコルは、フローサイトメトリー解析、蛍光活性化セルソーティング(FACS)、scRNA-seq解析など、さまざまなアプリケーションで研究室で使用されています。一例として、脳卒中モデルでフローサイトメトリー解析を行いました(図3)。マウスに一過性脳卒中モデル、30分フィラメント中大脳動脈閉塞(MCAO)14を施した。脳卒中後3日目に、マウスの脳から細胞を調製し、一般的な免疫細胞表面マーカーで染色しました。ゲーティング戦略を図 3A に示します。先行研究13,15と一致して、同側半球におけるCD45高細胞の顕著な増加が観察され(図3B、C)、免疫細胞の脳への浸潤を示している。
頭蓋骨骨髄プロトコルでは、頭蓋骨骨髄細胞(約2 x 106 細胞)のかなりの収量が一貫して達成され、優れた生存率(93.8%±1.8%[平均±SD])が得られました。予想通り、これらの細胞のほとんどはCD45陽性です。このプロトコルの有用性を説明するために、ナイーブマウスの大腿骨と頭蓋骨骨髄の両方における免疫細胞組成を特徴付けるための比較研究を実施しました(図4)。代表的なプロットに示されているように、免疫細胞の組成は大腿骨と頭蓋骨骨髄の間で類似していました(図4A、B)。興味深いことに、好中球の頻度は頭蓋骨よりも大腿骨の方が高いようです(図4C)。ただし、このパイロット研究ではサンプルサイズが小さかったため、この発見にはさらなる検証が必要です。

図1:脳細胞分離プロトコルの概要。この図の拡大版を見るには、ここをクリックしてください。

図2:頭蓋骨骨髄細胞の単離プロトコル (A)手順の概要。(B)頭蓋骨の切断に推奨されるパターン。 この図の拡大版を表示するには、ここをクリックしてください。
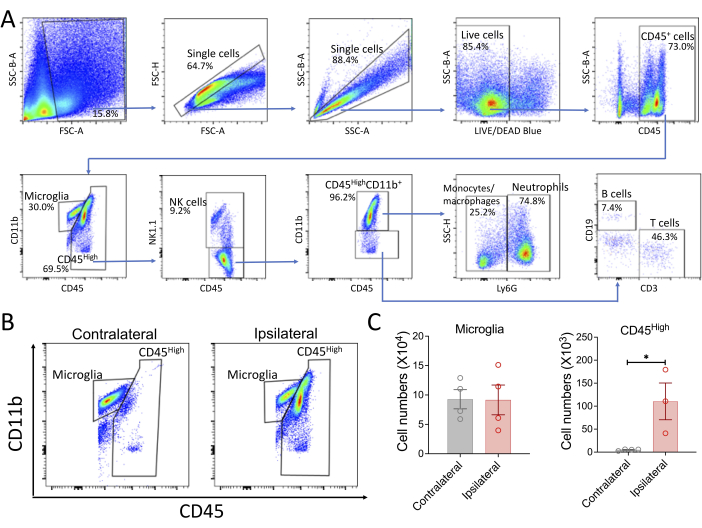
図3:脳卒中脳内の免疫細胞の代表的なフローサイトメトリー解析。 (A)ゲーティング戦略の一例。プロットは、ミクログリア(CD45LowCD11b+)、NK細胞(CD45HighNK1.1+)、好中球(CD45HighLy6G+)、T細胞(CD45HighCD11b-CD3+)、およびB細胞(CD45HighCD11b-CD19+)の免疫細胞集団を示しています。この例は、脳卒中後 3 日目の同側半球の脳免疫細胞の分析を表しています。(B,C)脳卒中脳への免疫細胞の浸潤。若い雄マウスに一過性中大脳動脈閉塞(MCAO)を施しました。3日目に、脳を採取し、左半球(対側)と右半球(同側)に分割しました。脳細胞を記載のプロトコルに従って調製し、次いでフローサイトメトリー分析を行った。代表的なプロットは、同側半球への免疫細胞の浸潤の増加を示しています(CD45High細胞;定量データは棒グラフ(C)で示されています。細胞数は、フローサイトメトリーデータに記録された細胞数と細胞量に基づいて計算しました。データは平均±SEMとして示されています。 *p < 0.05。この図の拡大版を表示するには、ここをクリックしてください。

図4:頭蓋骨骨髄細胞の代表的なフローサイトメトリー解析。比較のために、大腿骨からの骨髄細胞の分析が含まれていました。プロットは、NK細胞(CD45+NK1.1+)、好中球(CD45+CD11b+Ly6G+)、T細胞(CD45+CD11b-CD3+)、およびB細胞(CD45+CD11b-CD19+)の免疫細胞集団を示しています。(A)大腿骨骨髄の代表的なプロット。(B)頭蓋骨骨髄の代表的なプロット。(C)大腿骨と頭蓋骨骨髄の間の免疫細胞組成の比較。データは平均±SEMとして示されています。 *p < 0.05。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
ここでは、脳と頭蓋骨骨髄から免疫細胞を分離するための2つのシンプルかつ効果的なプロトコルを紹介します。これらのプロトコルは、多様なダウンストリームアプリケーション、特にフローサイトメトリーに適した大量の生存免疫細胞を確実に生成できます。
様々な脳障害における神経炎症を研究するために、脳からの免疫細胞調製のための多くのプロトコルが確立され、異なる研究室で使用されてきた15,16,17。一般的なアプローチには、酵素ベースの細胞解離とそれに続く勾配分離が含まれます。通常、これらのプロトコルでは、脳組織を細かく刻み、コラゲナーゼとDNaseの両方を含む酵素消化溶液で37°Cで30〜60分間、穏やかに振とうしながらインキュベートします。消化後、細胞はピペッティングやDounceホモジナイズなどの機械的方法を使用してさらに解離します。細胞ストレーナー(70 μmストレーナーなど)を通過した後、細胞を勾配遠心分離(多くの場合、30%/70%密度勾配溶液)にかけ、ミエリン、赤血球、破片を除去し、白血球を濃縮します。しかし、このアプローチでは、37°Cでの長時間の酵素インキュベーションが必要であり、脳免疫細胞のトランスクリプトームとプロテオームを大幅に変化させる可能性があります。実際、系統的な研究は、酵素的アプローチが特定の脳細胞のトランスクリプトームとプロテオタイプに重大な変化をもたらすことを示唆した18。これは、scRNA-seqなどのその後のトランスクリプトーム解析でアーティファクトにつながる可能性があります。対照的に、ここで報告されているプロトコルは、手順全体を通して低温での機械的解離アプローチを使用しているため、細胞代謝が抑制されます。これにより、転写状態とプロテオミクス状態の保存が容易になり、潜在的なアーティファクトが最小限に抑えられます。プロトコールの開発中に、脳組織の均質化に大型のDounceホモジナイザーを使用することが、細胞死を抑えて細胞数を増やすために重要であることに気づきました。Dounceの均質化中に、細胞外マトリックス、細胞破片、および細胞質成分が大量に存在すると、細胞に対して毒性が生じる可能性があります。バッファーを過剰に使用すると、これらの有毒物質を希釈し、有害な影響を軽減し、細胞の生存率を向上させるのに役立ちます。フローサイトメトリーのデータは、このプロトコルで調製した免疫細胞の約85%の生存率を確認しました。さらに、わずか30%の密度勾配溶液を用いた遠心分離により、脳免疫細胞が効果的に濃縮され、ミエリンが除去されることは注目に値します。これにより、細胞調製のコストも削減できます。
頭蓋骨骨髄の免疫細胞に関する研究はまだ限られています。マウスの頭蓋骨から細胞を単離するために一般的に使用される方法は、頭蓋骨を小さな断片に切断し、次に乳棒6で機械的に粉砕することを含む。現在のプロトコルでは、短時間の遠心分離が使用されます。この方法は、大腿骨および脛骨19から骨髄を調製するための公開されたプロトコルから適応されています。これらの長い骨の場合、骨の一方の端を切り取るだけで、遠心分離によって骨髄を採取できます。頭蓋骨の場合、このステップは、骨髄腔を開くためにいくつかの小さな部分に切断することによって変更されます。再現性のある細胞数を得るために、頭蓋骨の切断に一貫したパターンを使用することをお勧めします。さらに、骨髄細胞の回収を最大化するために、頭蓋骨片は、各遠心分離の間に混合して2〜3ラウンドの遠心分離を受けることができます。
どちらのプロトコルにも制限があります。まず、30%密度勾配溶液遠心分離を使用すると、脳内に残っている赤血球が効果的に除去されない可能性があり、これは不完全な灌流が原因で発生する可能性があります。さらに、ミエリン構造が特定の条件下で調節されると、30%密度勾配溶液はそれらの除去に最適な濃度ではない可能性があります。この場合、密度勾配溶液の別の作業濃度を確立する必要があります。第二に、フローサイトメトリー解析は、記載されたプロトコルを用いた脳免疫細胞の良好な細胞生存率を示していますが、アクチノマイシンDが使用できるトランスクリプトーム解析など、他のアプリケーションについても評価する必要があります。第三に、頭蓋骨骨髄の準備に頭蓋骨が使用されます。ただし、免疫細胞は頭蓋骨の他の多くの部分に存在することに注意する必要があります。最後に、髄膜、特に硬膜は多様な免疫細胞を保有し、脳の恒常性と機能障害に関与している20。髄膜の免疫分析のために、他の場所で発表されたプロトコルが採用され得る17,21,22,23。
要約すると、マウスの脳と頭蓋骨の両方から免疫細胞を単離するための2つの堅牢なプロトコルについて説明します。これらのプロトコールは、さまざまなダウンストリームアプリケーションに適した高品質の細胞を大量に得るのに役立つと期待されています。
開示事項
何一つ。
謝辞
Kathy Gageの優れた編集貢献に感謝します。イラストフィギュアは BioRender.com で作成しました。この研究は、麻酔科(デューク大学医療センター)からの資金とNIHの助成金NS099590、HL157354、およびNS127163によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 0.5 mL microcentrifuge tubes | VWR | 76332-066 | |
| 1.5 mL microcentrifuge tubes | VWR | 76332-068 | |
| 15 mL conical tubes | Thermo Fisher Scientific | 339651 | |
| 18 G x 1 in BD PrecisionGlide Needle | BD Biosciences | 305195 | |
| 1x HBSS | Gibco | 14175-095 | |
| 50 mL conical tubes | Thermo Fisher Scientific | 339653 | |
| 96-well V-bottom microplate | SARSTEDT | 82.1583 | |
| AURORA flow cytometer | Cytek bioscience | ||
| BSA | Fisher | BP9706-100 | |
| CD11b-AF594 | BioLegend | 101254 | 1:500 dilution |
| CD19-BV785 | BioLegend | 115543 | 1:500 dilution |
| CD19-FITC | BioLegend | 115506 | 1:500 dilution |
| CD3-APC | BioLegend | 100312 | 1:500 dilution |
| CD3-PE | BioLegend | 100206 | 1:500 dilution |
| CD45-Alex 700 | BioLegend | 103128 | 1:500 dilution |
| CD45-BV421 | Biolegend | 103133 | 1:500 dilution |
| Cell Strainer 70 um | Avantor | 732-2758 | |
| Dressing Forceps | V. Mueller | NL1410 | |
| EDTA | Invitrogen | 15575-038 | |
| Fc Block | Biolegend | 101320 | 1:100 dilution |
| Forceps | Roboz | RS-5047 | |
| LIVE/DEAD Fixable Blue Dead Cell Stain Kit | Thermo Fisher Scientific | N7167 | 1:500 dilution |
| Ly6G-BV421 | BioLegend | 127628 | 1:500 dilution |
| Ly6G-PerCp-cy5.5 | BioLegend | 127615 | 1:500 dilution |
| NK1.1-APC-cy7 | BioLegend | 108723 | 1:500 dilution |
| Percoll (density gradient medium) | Cytiva | 17089101 | |
| Phosphate buffer saline (10x) | Gibco | 70011-044 | |
| RBC Lysis Buffer (10x) | BioLegend | 420302 | |
| Scissors | SKLAR | 64-1250 | |
| WHEATON Dounce Tissue, 15 mL Size | DWK Life Sciences | 357544 |
参考文献
- Bohr, T., et al. The glymphatic system: Current understanding and modeling. iScience. 25 (9), 104987 (2022).
- Jiang-Xie, L. F., et al. Neuronal dynamics direct cerebrospinal fluid perfusion and brain clearance. Nature. 627 (8002), 157-164 (2024).
- Goertz, J. E., Garcia-Bonilla, L., Iadecola, C., Anrather, J. Immune compartments at the brain's borders in health and neurovascular diseases. Semin Immunopathol. 45 (3), 437-449 (2023).
- Herisson, F., et al. Direct vascular channels connect skull bone marrow and the brain surface enabling myeloid cell migration. Nat Neurosci. 21 (9), 1209-1217 (2018).
- Mazzitelli, J. A., et al. Skull bone marrow channels as immune gateways to the central nervous system. Nat Neurosci. 26 (12), 2052-2062 (2023).
- Cugurra, A., et al. Skull and vertebral bone marrow are myeloid cell reservoirs for the meninges and CNS parenchyma. Science. 373 (6553), 7844 (2021).
- Brioschi, S., et al. Heterogeneity of meningeal b cells reveals a lymphopoietic niche at the CNS borders. Science. 373 (6553), 9277 (2021).
- Smyth, L. C. D., et al. Identification of direct connections between the dura and the brain. Nature. 627, 165-173 (2024).
- Mazzitelli, J. A., et al. Cerebrospinal fluid regulates skull bone marrow niches via direct access through dural channels. Nat Neurosci. 25 (5), 555-560 (2022).
- Pulous, F. E., et al. Cerebrospinal fluid can exit into the skull bone marrow and instruct cranial hematopoiesis in mice with bacterial meningitis. Nat Neurosci. 25 (5), 567-576 (2022).
- Li, R., et al. Mouse cardiac arrest model for brain imaging and brain physiology monitoring during ischemia and resuscitation. J Vis Exp. (194), e65340 (2023).
- Wang, W., et al. Development and evaluation of a novel mouse model of asphyxial cardiac arrest revealed severely impaired lymphopoiesis after resuscitation. J Am Heart Assoc. 10 (11), e019142 (2021).
- Li, X., et al. Single-cell transcriptomic analysis of the immune cell landscape in the aged mouse brain after ischemic stroke. J Neuroinflammation. 19 (1), 83 (2022).
- Wang, Y. C., et al. Perk (protein kinase RNA-like er kinase) branch of the unfolded protein response confers neuroprotection in ischemic stroke by suppressing protein synthesis. Stroke. 51 (5), 1570-1577 (2020).
- Posel, C., Moller, K., Boltze, J., Wagner, D. C., Weise, G. Isolation and flow cytometric analysis of immune cells from the ischemic mouse brain. J Vis Exp. (108), e53658 (2016).
- Srakocic, S., et al. Proposed practical protocol for flow cytometry analysis of microglia from the healthy adult mouse brain: Systematic review and isolation methods' evaluation. Front Cell Neurosci. 16, 1017976 (2022).
- Disano, K. D., et al. Isolating central nervous system tissues and associated meninges for the downstream analysis of immune cells. J Vis Exp. (159), e61166 (2020).
- Mattei, D., et al. Enzymatic dissociation induces transcriptional and proteotype bias in brain cell populations. Int J Mol Sci. 21 (21), (2020).
- Mcgill, C. J., Lu, R. J., Benayoun, B. A. Protocol for analysis of mouse neutrophil netosis by flow cytometry. STAR Protoc. 2 (4), 100948 (2021).
- Su, Y., et al. Meningeal immunity and neurological diseases: New approaches, new insights. J Neuroinflammation. 20 (1), 125 (2023).
- Niu, C., et al. Mechanical isolation of neonatal and adult mouse dura leukocytes for flow cytometry analysis. STAR Protoc. 4 (2), 102272 (2023).
- Roussel-Queval, A., Rebejac, J., Eme-Scolan, E., Paroutaud, L. A., Rua, R. Flow cytometry and immunohistochemistry of the mouse dural meninges for immunological and virological assessments. STAR Protoc. 4 (1), 102119 (2023).
- Louveau, A., Filiano, A. J., Kipnis, J. Meningeal whole mount preparation and characterization of neural cells by flow cytometry. Curr Protoc Immunol. 121 (1), e50 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved