Method Article
Transplante de Traqueia Intrapulmonar Purino: Modelo para Investigação de Doença Obliterativa das Vias Aéreas Após Transplante Pulmonar
Neste Artigo
Resumo
O modelo de transplante traqueal intrapulmonar murino (TTPI) é valioso para o estudo da doença obliterativa das vias aéreas (DAO) após o transplante pulmonar. Oferece informações sobre o comportamento imunológico e angiogênico pulmão-específico na obliteração das vias aéreas após alotransplante com alta reprodutibilidade. Descrevemos aqui o procedimento do IPTT e seus resultados esperados.
Resumo
O transplante traqueal intrapulmonar murino (TTPI) é usado como modelo de doença obliterativa das vias aéreas (DAO) após transplante pulmonar. Inicialmente relatado por nossa equipe, esse modelo tem ganhado uso no estudo da DAO devido à sua alta reprodutibilidade técnica e adequação para investigação de comportamentos imunológicos e intervenções terapêuticas.
No modelo IPTT, um enxerto traqueal de roedor é inserido diretamente no pulmão do receptor através da pleura. Esse modelo é distinto do transplante traqueal heterotópico (TCTH), em que os enxertos são transplantados para sítios subcutâneos ou omentais, e do transplante traqueal ortotópico (TTO), no qual a traqueia do doador substitui a traqueia do receptor.
O sucesso da implementação do modelo IPTT requer habilidades anestésicas e cirúrgicas avançadas. As habilidades anestésicas incluem intubação endotraqueal do receptor, ajuste de parâmetros ventilatórios apropriados e extubação adequadamente cronometrada após a recuperação da anestesia. As habilidades cirúrgicas são essenciais para a colocação precisa do enxerto dentro do pulmão e para garantir o selamento eficaz da pleura visceral para evitar vazamento de ar e sangramento. Em geral, o processo de aprendizagem leva aproximadamente 2 meses.
Em contraste com os modelos HTT e OTT, no modelo IPTT, a via aérea do aloenxerto desenvolve obliteração das vias aéreas no microambiente pulmonar relevante. Isso permite que os investigadores estudem os processos imunológicos e angiogênicos específicos do pulmão envolvidos na obliteração das vias aéreas após o transplante pulmonar. Além disso, esse modelo também é único por exibir órgãos linfoides terciários (TLOs), que também são vistos em aloenxertos pulmonares humanos. Os TLOs são compostos por populações de células T e B e caracterizados pela presença de vênulas endoteliais elevadas que direcionam o recrutamento de células imunes; portanto, é provável que desempenhem um papel crucial na aceitação e rejeição do enxerto. Concluímos que o modelo IPTT é uma ferramenta útil para estudar as vias imunes e pró-fibróticas intrapulmonares envolvidas no desenvolvimento da obliteração das vias aéreas no aloenxerto de transplante pulmonar.
Introdução
O transplante pulmonar tem sido estabelecido como um tratamento eficaz para pacientes com doenças respiratórias em estágio terminal. Entretanto, a sobrevida mediana dos receptores de transplante pulmonar humano é de apenas aproximadamente 6 anos, sendo o desenvolvimento de bronquiolite obliterante (BO), um tipo de doença obstrutiva das vias aéreas (DAO), uma das principais causas de morte após o primeiro ano pós-transplante1.
Vários modelos animais têm sido utilizados para investigar o mecanismo subjacente à DAO. Um desses modelos é o transplante traqueal heterotópico (TCT)2. Nesse modelo, os enxertos traqueais são implantados no tecido subcutâneo ou no omento do receptor. Ocorre perda de células epiteliais do enxerto traqueal induzida por isquemia, seguida de infiltração linfocitária aloreativa e apoptose de células epiteliais doadoras. Fibroblastos e miofibroblastos migram ao redor da traqueia, produzindo uma matriz extracelular. Finalmente, ocorre obliteração fibrosa completa da luz das vias aéreas. O modelo HTT é tecnicamente simples, proporciona um ambiente in vivo e oferece alta reprodutibilidade.
Outro modelo para o estudo da DAO é o transplante traqueal ortotópico de ratos (TTO), em que enxertos traqueais são interpostos na traqueia do receptor para manter a ventilação fisiológica3. Nesse modelo, a depleção induzida por isquemia das células epiteliais do doador resulta na sua substituição por células epiteliais receptoras dentro da traqueia, formando uma via aérea desobstruída acompanhada de fibrose moderada. Embora esses modelos tenham contribuído para o entendimento da obliteração das vias aéreas após o transplante pulmonar, eles apresentam limitações em termos de recapitulação do microambiente do parênquima pulmonar.
Nosso grupo de pesquisa introduziu o modelo de transplante traqueal intrapulmonar (TTPI) de ratos, no qual enxertos traqueais são implantadosno pulmão receptor4 (Figura 1). O modelo IPTT exibe obliteração fibrosa da luz das vias aéreas ocorrendo dentro do microambiente pulmonar. Além disso, tem sido aplicado com sucesso em camundongos tecnicamente mais desafiadores que o IPTTde ratos5,6,7,8,9,10. Essa adaptação do modelo murino IPTT nos permitiu aprofundar os intrincados detalhes do ambiente imunológico pulmonar da DAO após transplante pulmonar usando camundongos transgênicos.
O modelo IPTT possui algumas características únicas. Uma delas é a neoangiogênese, que é facilitada pela circulação pulmonar e desempenha papel crucial na obliteração das vias aéreas 4,10. Além disso, o modelo IPTT exibe agregados linfoides, alguns dos quais com vênulas endoteliais elevadas expressando endereçina linfonodal periférica, indicando que são órgãos linfoides terciários (TLOs)7,8. Os TLOs assemelham-se a linfonodos e consistem de células T, células B e, frequentemente, um centro germinativo acompanhado de células dendríticas foliculares11,12. TLOs têm sido relatados em várias doenças inflamatórias crônicas, incluindo a obliteração das vias aéreas, tornando o modelo IPTT adequado para investigar o papel das OTTs na obliteração das vias aéreas 7,8,11,12,13. Este artigo apresenta a metodologia do modelo murino IPTT, com o objetivo de familiarizar os pesquisadores com esse modelo e facilitar investigações adicionais sobre a obliteração das vias aéreas após o transplante pulmonar.
Protocolo
Todos os animais foram tratados de acordo com as diretrizes estabelecidas pelo Conselho Canadense de Cuidados com Animais no Guide to the Care and Use of Experimental Animals. O protocolo experimental foi aprovado pelo Comitê de Cuidados com Animais do Toronto General Hospital Research Institute, University Health Network.
1. Cirurgia do doador
NOTA: Camundongos BALB/c são usados como exemplo de doadores para o experimento. Todos os procedimentos devem ser realizados utilizando técnica estéril.
- Antes do procedimento, registre o peso de cada mouse.
- Eutanásia do rato utilizando uma câmara de CO2 .
- Uma vez confirmada a morte, posicione o camundongo em decúbito dorsal e fixe os membros com fita adesiva.
- Preparar a área cirúrgica esterilizando-a com álcool isopropílico 70%.
NOTA: Se necessário e conforme recomendado pelo comitê de ética animal local, pare o pelo do local da incisão. - Faça uma incisão mediana na pele, começando pelo abdome médio e estendendo-se até a região cervical anterior.
- Acesse a traqueia retraindo cuidadosamente os coxins de gordura, movendo lateralmente os músculos da cinta e separando a traqueia do tecido conjuntivo circundante. Use pinças para criar espaço entre a traqueia e o esôfago.
- Levante o xifoide e corte o diafragma.
- Eleve o esterno, garantindo um caminho livre do esterno até a região do pescoço, inserindo um hemostático. Aperte a caixa torácica em ambos os lados e corte o esterno, estendendo-se até os músculos do pescoço.
- Remova o timo e qualquer gordura ou músculo que obstrua a traqueia para expor a bifurcação traqueal.
- Corte ambos os brônquios principais e separe cuidadosamente as vias aéreas do esôfago.
- Corte a laringe e remova-a.
- Borrifar a traqueia dissecada com soro fisiológico estéril ou solução de preservação com gaze estéril embebida em soro fisiológico estéril ou solução de preservação e colocá-la sobre gelo para preservar sua viabilidade.
2. Cirurgia do receptor
NOTA: Camundongos C57BL/6 são usados como exemplo de receptores para o experimento.
- Administrar buprenorfina de libertação sustentada por via subcutânea na dose de 1 mg/kg na manhã do dia da cirurgia.
- Induzir anestesia em câmara de indução com isoflurano a 5%.
- Uma vez que o camundongo esteja levemente anestesiado, injete intraperitonealmente um coquetel composto por (0,1 mg/g) de xilazina e (0,01 mg/g) de cetamina.
- Retornar o camundongo à câmara de indução com isoflurano a 2-3% mantido.
- Faça a barba no local da cirurgia. Administrar também bupivacaína em forma de bloqueio por via subcutânea ao longo do local planejado para insicião na dose de 7 mg/kg.
- Confirmar a ausência de resposta reflexa a uma pinça do pododáctilo antes da intubação orotraqueal. Intubar o camundongo orotraquealmente usando um cateter intravenoso de 20 G e conectá-lo a um ventilador com volume corrente de 500 μL, frequência respiratória de 120 bpm, oxigênio a 100% e isoflurano a 2%. Utilize um suporte com pinça aplicada na língua, segurando o animal em posição vertical com o pescoço estendido, para facilitar esse procedimento.
- Acione uma almofada de aquecimento e posicione o mouse em posição lateral direita sobre a almofada, com a cabeça afastada do cirurgião e a cauda voltada para o cirurgião (Figura 2). Fixe os membros com fita adesiva. Coloque pomada veterinária nos olhos para evitar o ressecamento enquanto estiver sob anestesia.
- Esfregar a área cirúrgica com iodopovidona a 7,5%, esterilizar com álcool isopropílico a 70% e esfregar novamente com iodopovidona a 10%. Aplicar campos cirúrgicos estéreis para cobrir a área cirúrgica.
- Carregar a traqueia do doador em cateter intravenoso de 16 G durante esse tempo (Figura 3C,D).
- Use bisturi para fazer uma incisão na pele do receptor e cauterizar o músculo e o tecido conjuntivo.
- Abra o quinto ou sexto espaço intercostal e mantenha a caixa torácica aberta com dois afastadores.
- Dissecar o ligamento pulmonar inferior com cotonetes e tesouras.
- Simular a criação do trajeto para a traqueia doadora (Figura 3G,H).
- Fixe o tubo de saída do ventilador ocluindo-o parcialmente com uma torneira de três vias para facilitar a insuflação do pulmão esquerdo.
- Crie um caminho puncionando o pulmão esquerdo com uma agulha de 20 G. Garantir que a profundidade da punção seja aproximadamente equivalente ao comprimento do aloenxerto traqueal. Selecione o local da punção na borda do pulmão (conforme indicado na Figura 3I), garantindo que o trajeto corra paralelo ao tampo da mesa (conforme marcado por um círculo azul na Figura 3J).
NOTA: Um ângulo de inserção para cima resultará em penetração da camada pleural, enquanto um ângulo mais profundo pode levar a sangramento dos grandes vasos (como marcado por cruzes vermelhas na Figura 3J). - Insira o cateter intravenoso 16 G no pulmão esquerdo e extruda a traqueia do doador no pulmão esquerdo. Após a inserção do aloenxerto traqueal, solte a torneira de três vias para permitir o fluxo expiratório desobstruído através do tubo de saída.
- Fechar o local da injeção pleural com um clipe (Figura 3K,L). Posicione o clipe precisamente sobre o local da punção, com sua borda alinhada para combinar com o contorno da borda do pulmão (indicado pelo círculo azul na Figura 3L).
NOTA: Um local incorreto para o local do clipe pode resultar em vedação ineficaz e vazamento de ar, enquanto a profundidade insuficiente do clipe pode levar ao descolamento do clipe após a cirurgia (como mostrado pelas cruzes vermelhas na Figura 3L). - Preencha a cavidade torácica com solução salina e absorva o soro fisiológico com uma gaze.
- Reinsuflar o pulmão esquerdo e fechar as costelas usando uma técnica de sutura contínua.
- Fechar o músculo e a pele com suturas interrompidas.
- Administrar analgésico meloxicam por via subcutânea na dose de 5 mg/kg no final da cirurgia.
- Observe o mouse receptor até que ele esteja acordado. Em seguida, retire o tubo traqueal e coloque o mouse receptor em uma gaiola.
NOTA: Os ratos receptores devem ser alojados individualmente. - Administrar meloxicam (5 mg/kg) uma vez ao dia por injeção subcutânea, iniciando 24 h após a cirurgia e continuando por 3 dias no pós-operatório.
3. Recolha de amostras de ratinhos receptores
- Induzir anestesia em câmara de indução com isoflurano a 5%.
- Confirmar a ausência de resposta reflexa ao pinçamento do pododáctilo antes da intubação orotraqueal. O método de intubação e o ajuste do respirador são os mesmos da cirurgia do receptor.
- Posicione o mouse em decúbito dorsal e fixe os membros.
- Preparar a área cirúrgica esterilizando-a com álcool isopropílico 70%.
- Faça uma incisão mediana na pele, começando pelo abdome médio e estendendo-se até a região cervical anterior.
- Exsanguinar o rato através da veia cava inferior utilizando uma seringa de 1 ml ligada a uma agulha de 25 G, resultando em eutanásia.
- Abra o tórax e acesse a traqueia da mesma forma que um camundongo doador. Amarre a traqueia ao redor do tubo de intubação com seda 7-0.
- Remova o timo, a gordura e os músculos para expor o coração.
- Cortar o átrio esquerdo, átrio direito e veia cava inferior. Perfundir os pulmões com 3 mL de solução salina estéril através do ventrículo direito.
- Para análise histológica, inflar os pulmões com formalina a 10% através de um tubo de intubação.
- Extubar o tubo de ventilação e amarrar a traqueia com seda 7-0.
- Divida a laringe e o esôfago. Puxe-os em uma direção inferior e, em seguida, extraia o bloqueio cardíaco e pulmonar, colocando-o em formalina a 10%.
Resultados
Com base em nossa experiência, a proficiência neste modelo normalmente requer aproximadamente 2 meses de treinamento. Uma vez alcançada a proficiência, os procedimentos do doador normalmente requerem 15 min, enquanto os procedimentos do receptor requerem aproximadamente 30 min. A taxa de mortalidade esperada para um operador treinado é de 0%.
Na Figura 4A, um aloenxerto traqueal exibe obstrução completa com tecido fibroblástico, e as células epiteliais estão visivelmente destruídas. Por outro lado, na Figura 4B, um isoenxerto traqueal permanece patente, e as células epiteliais estão preservadas.
A Figura 5 ilustra um pulmão no qual o aloenxerto traqueal foi transplantado, mostrando a presença de agregados linfoides.

Figura 1: Diagrama do modelo de transplante traqueal intrapulmonar murino. Um aloenxerto traqueal é extraído de um camundongo doador. O aloenxerto traqueal é carregado em um cateter. O aloenxerto traqueal é transplantado para o pulmão de um receptor. Clique aqui para ver uma versão maior desta figura.

Figura 2: Posição do receptor durante a cirurgia. O mouse é posicionado em decúbito lateral direito. A cabeça do camundongo receptor é orientada para longe do cirurgião e a cauda está voltada para o cirurgião. Clique aqui para ver uma versão maior desta figura.
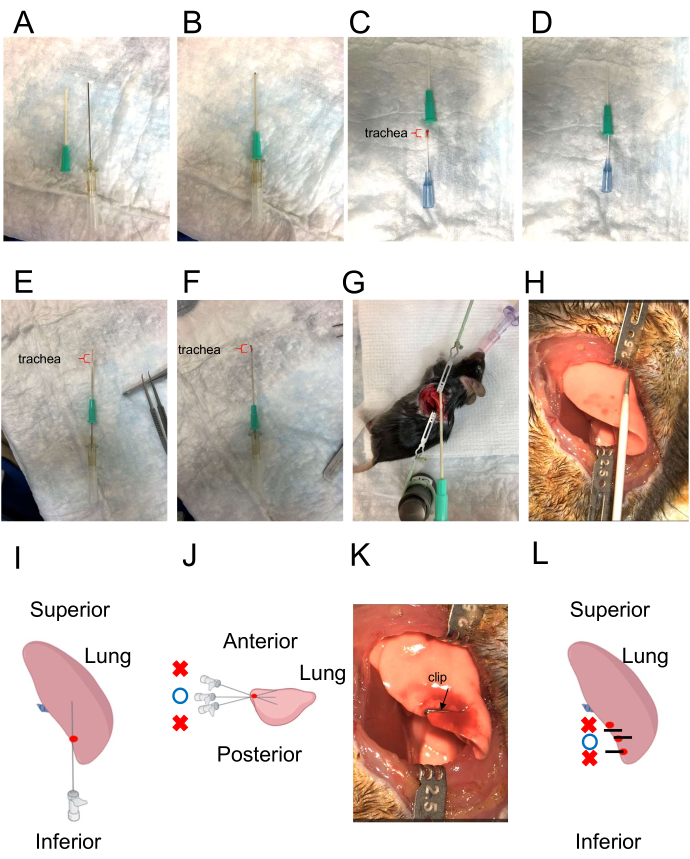
Figura 3: Cateter para inserção traqueal e ilustração da direção da inserção do enxerto traqueal. (A) O cateter para inserção traqueal. O cateter externo tem uma ponta afiada (esquerda), enquanto o cateter interno tem uma ponta romba (direita). (B) Combinação de cateteres externos e internos. O cateter interno se projeta ligeiramente do cateter externo. (C,D) Carregar a traqueia do doador no cateter. O braquete vermelho indica o enxerto traqueal. (E) Enxerto traqueal no interior do cateter. O braquete vermelho indica o enxerto traqueal. (F) Extrusão do enxerto traqueal interno utilizando o cateter interno como "empurrador". O braquete vermelho indica o enxerto traqueal. (G, H) Simulação da direção para colocação do enxerto traqueal. (I,J) Criando o caminho usando uma agulha de 22 G. A profundidade deve coincidir com o comprimento de um aloenxerto traqueal. A direção da agulha deve ser oposta à do cirurgião e paralela à mesa. O local correto da punção é indicado pelo ponto vermelho. O ângulo de inserção apropriado é indicado pelo círculo azul. Ângulos incorretos são indicados por cruzes vermelhas. (K,L) Fechar o local de injeção pleural com um clipe. As linhas pretas representam clipes. O ponto vermelho representa o local da punção. O círculo azul indica o ponto de recorte correto. As cruzes vermelhas indicam pontos de corte incorretos. Clique aqui para ver uma versão maior desta figura.
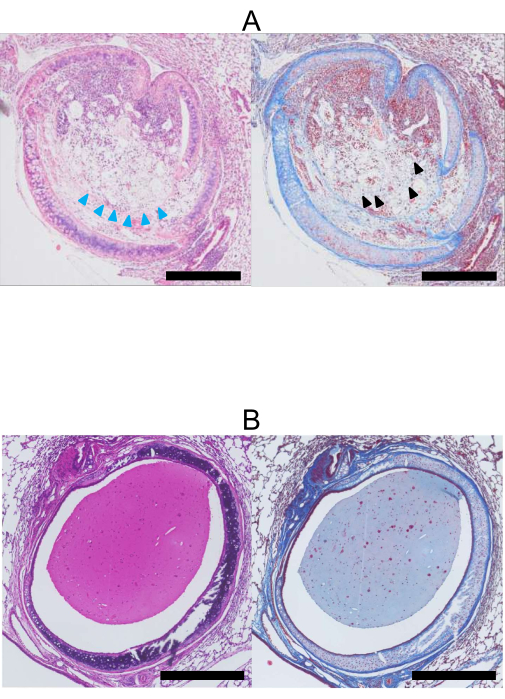
Figura 4: Histopatologia aos 28 dias pós-transplante pulmonar. (A) Imagens coradas pelo H&E (esquerda) e Tricrômico de Masson (direita) de um aloenxerto traqueal (Doador: BALB/c, Receptor: C57BL/6). O lúmen do aloenxerto é ocluído com colágeno e tecido fibroso corados de azul pelo Tricrômico de Masson (cabeça de seta preta). Além disso, as células epiteliais foram perdidas (cabeças de setas azuis). (B) H&E (esquerda) e Tricrômico de Masson (direita) corados por isoenxerto traqueal. Em contraste com o aloenxerto, o lúmen do isoenxerto (Doador, Receptor: C57BL/6) permanece aberto, e as células epiteliais são preservadas. O tecido manchado é muco. Barras de escala = 500 μm. Abreviação: H&E = hematoxilina e eosina. Clique aqui para ver uma versão maior desta figura.

Figura 5: Agregados linfoides no pulmão com o aloenxerto traqueal transplantado. (A) Imagem corada pela H&E de um pulmão com aloenxerto traqueal transplantado in situ. Agregados linfoides (setas pretas) são observados no interior do tecido pulmonar. Barra de escala = 500 μm. (B) Imagem de imunofluorescência de um agregado linfoide, destacando a presença de células B (B220, vermelho), células T (CD3, verde) e núcleos (DAPI, azul). Barra de escala = 100 μm. Abreviações: H&E = hematoxilina e eosina; DAPI = 4',6-diamidino-2-fenilindol. Clique aqui para ver uma versão maior desta figura.
Discussão
O procedimento murino IPTT inclui etapas críticas. Em relação à anestesia, o primeiro passo crucial é a intubação endotraqueal. É essencial segurar o rato a uma altura adequada com as pernas sobre a mesa para visualizar as cordas vocais e facilitar a intubação imediata. Além disso, é necessário um ajuste cuidadoso do volume respiratório e da pressão expiratória final positiva (PEEP). Normalmente, um volume respiratório de 500 μL e uma PEEP de 2 cmH2O são suficientes para camundongos pesando 25-30 g. No entanto, camundongos receptores maiores podem apresentar episódios de "soluço", indicando deficiência de oxigênio. Nesses casos, pode ser necessário aumentar o volume respiratório, a PEEP e pinçar temporariamente o tubo expiratório para recrutar o pulmão. Se os soluços persistirem, a profundidade do tubo traqueal deve ser ajustada. Por fim, o momento da extubação do tubo traqueal é crítico, e a confirmação da frequência respiratória do receptor é essencial para garantir uma recuperação suficiente. Se isso não for feito, pode resultar em mortalidade pós-extubação.
Em relação ao procedimento cirúrgico, o posicionamento adequado da traqueia transplantada é fundamental. A simulação do direcionamento adequado da agulha é necessária para o posicionamento preciso do enxerto traqueal (Figura 3G). Se o trajeto for muito raso, o enxerto traqueal pode penetrar na pleura, enquanto inseri-lo muito profundo pode levar à perfuração do vaso pulmonar e sangramento grave. Outro passo fundamental é garantir o selamento preciso do ponto de inserção, fixando com segurança a incisão pleural na qual o aloenxerto traqueal foi inserido com um clipe de aço inoxidável (Figura 3H). A vedação insuficiente pode causar vazamento de ar, potencialmente resultando em mortalidade do receptor após o fechamento do tórax.
Embora o modelo IPTT ofereça algumas vantagens, como relativa simplicidade, alta reprodutibilidade e um ambiente imunológico semelhante ao observado no transplante pulmonar, ele tem algumas limitações. Os aloenxertos traqueais no modelo de TTPI diferem da situação clínica, em que a OB ocorre nas pequenas vias aéreas. Além disso, neste modelo de IPTT de desajuste do complexo principal de histocompatibilidade (MHC), o aloenxerto traqueal é completamente ocluído com tecido fibroblástico, o que contrasta com a DAO clínica, onde a oclusão do tecido fibroblástico é geralmente parcial. Para resolver esse problema, outra combinação de cepas (menor ou diferente incompatibilidade maior) pode ser usada para IPTT (dependendo do estudo pretendido), pois poderia resultar em uma resposta aloimune mais branda e oclusão tecidual fibroblástica mais leve em comparação com a combinação BALB/c-to-C57BL/6. Não temos conhecimento de nenhum estudo publicado examinando diferentes combinações de cepas, então essa possibilidade precisaria ser testada empiricamente.
Finalmente, trata-se de um enxerto não vascularizado, semelhante aos modelos HTT e OTT. Para suprir essa limitação, o transplante pulmonar ortotópico (TOF) pode ser utilizado14. No entanto, o desenvolvimento de patologia semelhante à DAO tem sido variável no modelo OLT de camundongos 15,16,17. Dada a relativa simplicidade e reprodutibilidade do modelo IPTT em comparação com o TOF, ele continua sendo um modelo razoável para estudar os mecanismos de DAO relacionados ao transplante. Em conclusão, o modelo IPTT serve como um modelo de pesquisa útil para estudar as vias imunes e pró-fibróticas intrapulmonares envolvidas no desenvolvimento da obliteração das vias aéreas após o transplante pulmonar.
Divulgações
Os autores deste manuscrito não têm conflitos de interesse a declarar.
Agradecimentos
Os autores gostariam de agradecer a Jerome Valero pela edição deste manuscrito. A Figura 1 e a Figura 3I,J,L foram criadas com BioRender.com.
Materiais
| Name | Company | Catalog Number | Comments |
| BALB/cJ | The Jackson Laboratory | 8-10 weeks 25-30 g | Male, Donor |
| BD 1 mL Syringe | Becton Dickinson | 309659 | |
| BD PrecisionGlide Needle Aiguile BD PrecisionGlide | Becton Dickinson | 305122 | |
| Bovie Change-A-Tip Deluxe High-Temperture | Bovie | DEL1 | |
| C57BL/6J | The Jackson Laboratory | 8-10 weeks 25-30 g | Male, Recipient |
| Dumont #5/45 Forceps | F·S·T | 11251-35 | |
| Ethicon Ligaclip Multiple -Clip Appliers- | Ethicon | LX107 | |
| Extra Fine Graefe Forceps | F·S·T | 11150-10 | |
| Glover Bulldog Clamp | Integra | 320-127 | |
| Halsted-Mosquito Hemostats | F·S·T | 13009-12 | |
| Horizon Titanium Ligating Clips | Teleflex | 001201 | |
| Leica M651 Manual surgical microscope for microsurgical procedures | Leica | ||
| Magnetix Fixator with spring lock | CD+ LABS | ACD-001 | |
| Microsurgical Scissor | Jarit | 277-051 | |
| Mouse and Perinatal Rat Ventilator Model 687 | Harvard | 55-0001 | |
| Perfadex Plus | XVIVO | 19850 | |
| Retractor Tip Blunt - 2.5 mm | CD+ LABS | ACD-011 | |
| small animal table | CD+ LABS | ACD-003 | |
| Surgipro Blue 24" CV-1 Taper, Double Armed | Covidien | VP702X | |
| Systane ointment | Alconn | 1444062 | |
| System Elastomer | CD+ LABS | ACD-007 | |
| Terumo Surflo IV Catheter, 20 G x 1 in | Terumo Medical Corporation | SR-OX2025CA | |
| VMT table Top | benson | 91803300 |
Referências
- Chambers, D. C., et al. The International Thoracic Organ Transplant Registry of the International Society for Heart and Lung Transplantation: Thirty-fifth adult lung and heart-lung transplant report-2018; Focus theme: Multiorgan Transplantation. J Heart Lung Transplant. 37 (10), 1169-1183 (2018).
- Hertz, M. I., Jessurun, J., King, M. B., Savik, S. K., Murray, J. J. Reproduction of the obliterative bronchiolitis lesion after heterotopic transplantation of mouse airways. American J Pathol. 142 (6), 1945-1951 (1993).
- Ikonen, T. S., Brazelton, T. R., Berry, G. J., Shorthouse, R. S., Morris, R. E. Epithelial re-growth is associated with inhibition of obliterative airway disease in orthotopic tracheal allografts in non-immunosuppressed rats. Transplantation. 70 (6), 857 (2000).
- Dutly, A. E., et al. A novel model for post-transplant obliterative airway disease reveals angiogenesis from the pulmonary circulation. Am J Transplant. 5 (2), 248-254 (2005).
- Wagnetz, D., et al. Rejection of tracheal allograft by intrapulmonary lymphoid neogenesis in the absence of secondary lymphoid organs. Transplantation. 93 (12), 1212-1220 (2012).
- Hirayama, S., et al. Local long-term expression of lentivirally delivered IL-10 in the lung attenuates obliteration of intrapulmonary allograft airways. Hum Gene Ther. 22 (11), 1453-1460 (2011).
- Watanabe, T., et al. Recipient bone marrow-derived IL-17 receptor A-positive cells drive allograft fibrosis in a mouse intrapulmonary tracheal transplantation model. Transpl Immunol. 69, 101467 (2021).
- Matsuda, Y., et al. Spleen tyrosine kinase modulates fibrous airway obliteration and associated lymphoid neogenesis after transplantation. Am J Transplant. 16 (1), 342-352 (2016).
- Suzuki, Y., et al. Effect of CTLA4-Ig on Obliterative bronchiolitis in a mouse intrapulmonary tracheal transplantation model. Ann Thorac Cardiovasc Surg. 27 (6), 355-365 (2021).
- Watanabe, T., et al. A potent anti-angiogenic factor, vasohibin-1, ameliorates experimental bronchiolitis obliterans. Transplant Proc. 44 (4), 1155-1157 (2012).
- Aloisi, F., Pujol-Borrell, R. Lymphoid neogenesis in chronic inflammatory diseases. Nat Rev Immunol. 6 (3), 205-217 (2006).
- Cupedo, T., Jansen, W., Kraal, G., Mebius, R. E. Induction of secondary and tertiary lymphoid structures in the skin. Immunity. 21 (5), 655-667 (2004).
- Sato, M., et al. The role of intrapulmonary de novo lymphoid tissue in obliterative bronchiolitis after lung transplantation. J Immunol. 182 (11), 7307-7316 (2009).
- Okazaki, M., et al. Maintenance of airway epithelium in acutely rejection orthotopic vascularized mouse lung transplants. A J Resp Cell Mol Biol. 37 (6), 625-630 (2007).
- Yamada, Y., et al. Chronic airway fibrosis in orthotopic mouse lung transplantation models-an experimental reappraisal. Transplantation. 102 (2), e49-e58 (2018).
- Watanabe, T., et al. A B cell-dependent pathway drives chronic lung allograft rejection after ischemia-reperfusion injury in mice. Am J Transplant. 19 (12), 3377-3389 (2019).
- Guo, Y., et al. Vendor-specific microbiome controls both acute and chronic murine lung allograft rejection by altering CD4+Foxp3+ regulatory T cell levels. Am J Transplant. 19 (10), 2705-2718 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados