Method Article
השתלת קנה נשימה תוך ריאתי: מודל לחקר מחלת דרכי הנשימה לאחר השתלת ריאות
In This Article
Summary
מודל השתלת קנה הנשימה התוך-ריאתי (IPTT) הוא בעל ערך לחקר מחלת דרכי הנשימה לאחר השתלת ריאות. הוא מציע תובנות לגבי התנהגות אימונולוגית ואנגיוגנית ספציפית לריאות במחיקת דרכי הנשימה לאחר השתלה עם יכולת שחזור גבוהה. כאן, אנו מתארים את הליך IPTT ואת התוצאות הצפויות שלו.
Abstract
השתלת קנה נשימה תוך ריאתי (IPTT) משמשת כמודל של מחלת דרכי נשימה מוחקת (OAD) לאחר השתלת ריאות. מודל זה, שדווח לראשונה על ידי הצוות שלנו, זכה לשימוש במחקר של OAD בשל יכולת השחזור הטכנית הגבוהה שלו והתאמתו לחקר התנהגויות אימונולוגיות והתערבויות טיפוליות.
במודל IPTT, שתל קנה הנשימה של מכרסם מוכנס ישירות לריאה של המקבל דרך הצדר. מודל זה שונה ממודל השתלת קנה הנשימה ההטרוטופית (HTT), שבו השתלים מושתלים באתרים תת-עוריים או אומנטאליים, וממודל השתלת קנה הנשימה האורתוטופית (OTT) שבו קנה הנשימה התורם מחליף את קנה הנשימה של המושתל.
יישום מוצלח של מודל IPTT דורש מיומנויות הרדמה וכירורגיה מתקדמות. מיומנויות ההרדמה כוללות אינטובציה אנדוטרכאלית של המושתל, הגדרת פרמטרים מתאימים להנשמה ואקסטובציה מתוזמנת כראוי לאחר התאוששות מהרדמה. מיומנויות כירורגיות חיוניות למיקום מדויק של השתל בתוך הריאה ולהבטחת איטום יעיל של הצדר הקרבי למניעת דליפת אוויר ודימום. באופן כללי, תהליך הלמידה אורך כחודשיים.
בניגוד למודלים HTT ו-OTT, במודל IPTT, נתיב האוויר allograft מפתח מחיקה של דרכי הנשימה במיקרו-סביבה הריאה הרלוונטית. זה מאפשר לחוקרים לחקור תהליכים אימונולוגיים ואנגיוגניים ספציפיים לריאות המעורבים במחיקת דרכי הנשימה לאחר השתלת ריאות. יתר על כן, מודל זה ייחודי גם בכך שהוא מציג איברי לימפה שלישוניים (TLOs), אשר נראים גם allografts ריאות האדם. TLOs מורכבים מאוכלוסיות תאי T ו- B ומאופיינים בנוכחות של ורידי אנדותל גבוהים המכוונים את גיוס תאי החיסון; לכן, הם עשויים לשחק תפקיד מכריע בקבלה ודחייה של השתל. אנו מסיקים כי מודל IPTT הוא כלי שימושי לחקר מסלולים חיסוניים ופרופברוטיים תוך ריאתיים המעורבים בהתפתחות של מחיקת דרכי הנשימה באלוגרפט השתלת ריאות.
Introduction
השתלת ריאות נקבעה כטיפול יעיל לחולים עם מחלות נשימה סופניות. עם זאת, שיעור ההישרדות החציוני של מושתלי ריאות אנושיים הוא רק כ -6 שנים, עם התפתחות של ברונכיוליטיס מוחק (OB), סוג של מחלת דרכי נשימה חסימתית (OAD), להיות הגורם העיקרי למוות לאחר השנה הראשונה לאחר ההשתלה1.
מספר מודלים של בעלי חיים שימשו כדי לחקור את המנגנון העומד בבסיס OAD. מודל אחד כזה הוא מודל2 להשתלת קנה נשימה הטרוטופית (HTT). במודל זה, שתלי קנה הנשימה מושתלים ברקמה התת עורית או באומנטום של הנמען. איבוד איסכמי של תאי אפיתל שתל קנה הנשימה מתרחש, ואחריו הסננה לימפוציטים alloreactive ואפופטוזיס של תאי אפיתל תורם. פיברובלסטים ומיופיברובלסטים נודדים סביב קנה הנשימה ומייצרים מטריצה חוץ-תאית. לבסוף, מחיקה סיבית מלאה של לומן דרכי הנשימה מתרחשת. דגם HTT הוא פשוט מבחינה טכנית, מספק סביבת in vivo ומציע יכולת שחזור גבוהה.
מודל נוסף לחקר OAD הוא מודל השתלת קנה הנשימה האורתוטופית של חולדה (OTT), שבו השתלות קנה הנשימה משולבות בקנה הנשימה של המושתל כדי לשמור על אוורור פיזיולוגי3. במודל זה, דלדול תאי אפיתל מתורם כתוצאה מאיסכמיה גורם להחלפתם בתאי אפיתל מושתלים בתוך קנה הנשימה, ויוצר נתיב אוויר ללא הפרעה המלווה בפיברוזיס מתון. למרות שמודלים אלה תרמו להבנת מחיקת דרכי הנשימה לאחר השתלת ריאות, יש להם מגבלות במונחים של שחזור של מיקרו-סביבה פרנכימלית של הריאה.
קבוצת המחקר שלנו הציגה את מודל השתלת קנה הנשימה התוך-ריאתי של חולדה (IPTT), שבו השתלות קנה הנשימה מושתלות בריאה4 של המושתל (איור 1). מודל IPTT מציג מחיקה סיבית של לומן דרכי הנשימה המתרחשת בתוך מיקרו-סביבת הריאה. יתר על כן, הוא יושם בהצלחה על עכברים שהם מאתגרים יותר מבחינה טכנית מאשר חולדה IPTT 5,6,7,8,9,10. התאמה זו של מודל ה- IPTT של מורין אפשרה לנו להעמיק בפרטים המורכבים של הסביבה החיסונית הריאה של OAD לאחר השתלת ריאות באמצעות עכברים טרנסגניים.
מודל IPTT בעל כמה תכונות ייחודיות. האחת היא ניאואנגיוגנזה, אשר מתאפשרת על ידי מחזור הדם הריאתי וממלאת תפקיד מכריע במחיקת דרכי הנשימה 4,10. בנוסף, מודל IPTT מציג אגרגטים לימפואידים, שלחלקם יש ורידי אנדותל גבוהים המבטאים כתובת קשרית היקפית, מה שמצביע על כך שהם איברי לימפה שלישוניים (TLOs)7,8. TLOs דומים לבלוטות לימפה ומורכבים מתאי T, תאי B, ולעתים קרובות, מרכז נבט המלווה בתאים דנדריטיים פוליקולריים11,12. TLOs דווחו במחלות דלקתיות כרוניות שונות, כולל מחיקת דרכי הנשימה, מה שהופך את מודל IPTT מתאים לחקר התפקיד של TLOs בהשמדת דרכי הנשימה 7,8,11,12,13. מאמר זה מציג את המתודולוגיה של מודל ה-IPTT של מורין, במטרה להכיר לחוקרים מודל זה ולאפשר מחקרים נוספים על מחיקת דרכי הנשימה לאחר השתלת ריאות.
Protocol
כל בעלי החיים טופלו בהתאם להנחיות שנקבעו על ידי המועצה הקנדית לטיפול בבעלי חיים במדריך לטיפול ושימוש בחיות ניסוי. פרוטוקול הניסוי אושר על ידי ועדת הטיפול בבעלי חיים של מכון המחקר של בית החולים הכללי בטורונטו, רשת הבריאות האוניברסיטאית.
1. ניתוח תורם
הערה: עכברי BALB/c משמשים כדוגמה לתורמים לניסוי. כל ההליכים חייבים להתבצע תוך שימוש בטכניקה סטרילית.
- לפני ההליך, רשום את המשקל של כל עכבר.
- הרדימו את העכבר באמצעות תא CO2 .
- לאחר אישור המוות, מקם את העכבר במצב שכיבה ואבטח את הגפיים בנייר דבק.
- הכינו את אזור הניתוח על ידי עיקור שלו עם 70% אלכוהול איזופרופיל.
הערה: במידת הצורך ובהתאם להמלצת ועדת האתיקה המקומית לבעלי חיים, יש לגזור את הפרווה מאתר החתך. - בצע חתך קו אמצע על העור, החל מאמצע הבטן ומתרחב לאזור צוואר הרחם הקדמי.
- גישה לקנה הנשימה על ידי נסיגה זהירה של כריות השומן, הזזת שרירי הרצועה לרוחב והפרדת קנה הנשימה מרקמת החיבור שמסביב. השתמש במלקחיים כדי ליצור רווח בין קנה הנשימה לוושט.
- הרימו את הקסיפואיד וחתכו את הסרעפת.
- הרם את עצם החזה, הבטחת נתיב ברור מן החזה לאזור הצוואר על ידי החדרת hemostat. מהדקים את כלוב הצלעות משני הצדדים וחותכים דרך עצם החזה, המשתרע דרך שרירי הצוואר.
- הסר את בלוטת התימוס וכל שומן או שריר החוסמים את קנה הנשימה כדי לחשוף את התפצלות קנה הנשימה.
- חותכים את הסמפונות הראשיים ומפרידים בזהירות את דרכי הנשימה מהוושט.
- חותכים את הגרון ומסירים אותו.
- רססו את קנה הנשימה המנותח בתמיסת מלח סטרילית או בתמיסת שימור בגזה סטרילית ספוגה במי מלח סטריליים או בתמיסת שימור והניחו אותה על קרח כדי לשמר את יכולת הקיום שלה.
2. ניתוח מושתל
הערה: עכברי C57BL/6 משמשים כדוגמה למושתלים עבור הניסוי.
- יש לתת בופרנורפין בשחרור מושהה במינון של 1 מ"ג/ק"ג בבוקר יום הניתוח.
- יש להשרות הרדמה בתא אינדוקציה באמצעות איזופלורן 5%.
- לאחר שהעכבר מורדם קלות, יש להזריק קוקטייל המורכב (0.1 מ"ג/גרם) מקסילזין וקטמין (0.01 מ"ג/גרם).
- החזר את העכבר לתא האינדוקציה עם 2-3% isoflurane נשמר.
- יש לגלח את הפרווה באתר הניתוח. כמו כן, יש לתת bupivacaine כגוש קו תת עורי לאורך אתר החניכה המתוכנן במינון של 7 מ"ג/ק"ג.
- אשר את היעדר תגובת רפלקס לצביטה בבוהן לפני אינטובציה orotracheal. יש לבצע אינטובציה לעכבר באמצעות צנתר תוך ורידי 20 G ולחבר אותו למכונת הנשמה בעלת נפח גאות של 500 מיקרוליטר, קצב נשימה של 120 פעימות לדקה, 100% חמצן ו-2% איזופלורן. השתמש מעמד עם מהדק מוחל על הלשון, מחזיק את החיה במצב אנכי עם הצוואר מורחב, כדי להקל על הליך זה.
- הפעילו כרית חימום ומקמו את העכבר במצב צדדי ימני על גבי הפד, כשהראש רחוק מהמנתח והזנב פונה למנתח (איור 2). אבטחו את הגפיים בעזרת נייר דבק. יש לשים משחה וטרינרית על העיניים כדי למנוע יובש בזמן הרדמה.
- לקרצף את אזור הניתוח עם 7.5% יוד פובידון, לעקר עם 70% אלכוהול איזופרופיל, ולקרצף מחדש עם 10% יוד פובידון. יש למרוח וילונות כירורגיים סטריליים לכיסוי אזור הניתוח.
- העמיסו את קנה הנשימה של התורם לתוך צנתר תוך-ורידי של 16G במהלך הזמן הזה (איור 3C,D).
- השתמש באזמל כדי לבצע חתך בעור הנמען ולצרוב את השריר ורקמת החיבור.
- פתח את החלל הבין-קוסטלי החמישי או השישי והחזק את כלוב הצלעות פתוח באמצעות שני נשלפים.
- לנתח את הרצועה הריאתית התחתונה באמצעות צמר גפן מספריים.
- הדימו את יצירת המסלול עבור קנה הנשימה של התורם (איור 3G,H).
- אבטח את צינור זרימת ההנשמה על ידי סגירה חלקית שלו עם סטופקוק משולש כדי להקל על ניפוח הריאה השמאלית.
- צור מסלול על ידי ניקוב הריאה השמאלית עם מחט 20 גרם. הקפדה על כך שעומק הנקב שווה בערך לאורך האלוגרפט של קנה הנשימה. בחרו את אתר הניקוב בקצה הריאה (כפי שמצוין באיור 3I), וודאו שהמסלול עובר במקביל למשטח העליון (כפי שמסומן בעיגול כחול באיור 3J).
הערה: זווית החדרה כלפי מעלה תגרום לחדירה של השכבה הפלאורלית, בעוד שזווית עמוקה יותר עלולה להוביל לדימום מכלי דם עיקריים (כפי שמסומן בצלבים אדומים באיור 3J). - הכנס את הצנתר התוך-ורידי 16 G לריאה השמאלית והוציא את קנה הנשימה התורם לריאה השמאלית. לאחר החדרת אלוגרפט קנה הנשימה, שחררו את הסטופקוק התלת-כיווני כדי לאפשר זרימה פקועה ללא הפרעה דרך צינור היציאה.
- סגור את אתר ההזרקה הפלאורלית בעזרת קליפס (איור 3K,L). מקמו את הקליפ במדויק על אתר הניקוב, כשהקצה שלו מיושר כך שיתאים לקווי המתאר של קצה הריאה (מסומן על-ידי העיגול הכחול באיור 3L).
הערה: מיקום שגוי של אתר החיתוך עלול לגרום לאיטום לא יעיל ולדליפת אוויר, בעוד שעומק קליפס לא מספיק עלול להוביל לניתוק הקליפ לאחר הניתוח (כפי שמוצג על ידי הצלבים האדומים באיור 3L). - ממלאים את חלל החזה בתמיסת מלח וסופגים את המלח בגזה.
- מנפחים מחדש את הריאה השמאלית וסוגרים את הצלעות בטכניקת תפר ריצה.
- סגור את השריר והעור עם תפרים קטועים.
- מתן משכך כאבים meloxicam תת עורית במינון של 5 מ"ג / ק"ג בסוף הניתוח.
- התבונן בעכבר הנמען עד שהוא ער. לאחר מכן, הסר את צינור קנה הנשימה והכניס את העכבר המקבל לכלוב.
הערה: יש לשכן עכברים מקבלים בנפרד. - מתן meloxicam (5 מ"ג / ק"ג) פעם ביום באמצעות הזרקה תת עורית, החל 24 שעות לאחר הניתוח ולהמשיך במשך 3 ימים לאחר הניתוח.
3. איסוף דגימות מעכברים מושתלים
- יש להשרות הרדמה בתא אינדוקציה באמצעות איזופלורן 5%.
- אשר את היעדר תגובת הרפלקס לצביטה בבוהן לפני אינטובציה orotracheal. שיטת האינטובציה והגדרת מכונת ההנשמה זהות לזו של ניתוח מושתל.
- מקם את העכבר במצב שכיבה ואבטח את הגפיים.
- הכינו את אזור הניתוח על ידי עיקור שלו עם 70% אלכוהול איזופרופיל.
- בצע חתך קו אמצע על העור, החל מאמצע הבטן ומתרחב לאזור צוואר הרחם הקדמי.
- להוציא את העכבר דרך הווריד קאווה התחתון באמצעות מזרק 1 מ"ל מחובר למחט 25 גרם, וכתוצאה מכך המתת חסד.
- פתח את החזה וגש לקנה הנשימה באותו אופן כמו עכבר תורם. קשרו את קנה הנשימה סביב צינור האינטובציה עם משי 7-0.
- הסירו את בלוטת התימוס, השומן והשרירים כדי לחשוף את הלב.
- חותכים את האטריום השמאלי, אטריום ימין, ואת הווריד הנבוב הנחות. לנקב את הריאות עם 3 מ"ל של מלוחים סטריליים דרך החדר הימני.
- לניתוח היסטולוגי, לנפח את הריאות עם 10% פורמלין באמצעות צינור אינטובציה.
- להוציא את צינור האוורור ולקשור את קנה הנשימה עם משי 7-0.
- לחלק את הגרון ואת הוושט. משוך אותם לכיוון נחות, ולאחר מכן לחלץ את בלוק הלב והריאות, הצבת אותו לתוך 10% פורמלין.
תוצאות
בהתבסס על הניסיון שלנו, מיומנות במודל זה דורשת בדרך כלל כחודשיים של הכשרה. לאחר השגת מיומנות, הליכי התורם דורשים בדרך כלל 15 דקות, בעוד שהליכי המקבל דורשים כ -30 דקות. שיעור התמותה הצפוי למפעיל מיומן הוא 0%.
באיור 4A, אלוגרפט קנה הנשימה מציג חסימה מוחלטת עם רקמה פיברובלסטית, ותאי האפיתל נהרסים באופן גלוי. לעומת זאת, באיור 4B, איזוגרפט קנה הנשימה נשאר פטנט, ותאי האפיתל נשמרים.
איור 5 מדגים ריאה שבה הושתל אלוגרפט קנה הנשימה, מה שמראה נוכחות של אגרגטים לימפואידים.

איור 1: דיאגרמה של מודל השתלת קנה הנשימה התוך-ריאתי של מורין. אלוגרפט קנה הנשימה מופק מעכבר תורם. אלוגרפט קנה הנשימה נטען לתוך קטטר. אלוגרפט קנה הנשימה מושתל בריאה של מושתל. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: מיקום המושתל במהלך הניתוח. העכבר ממוקם במצב decubitus לרוחב ימין. ראשו של העכבר המושתל מופנה הרחק מהמנתח והזנב פונה למנתח. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
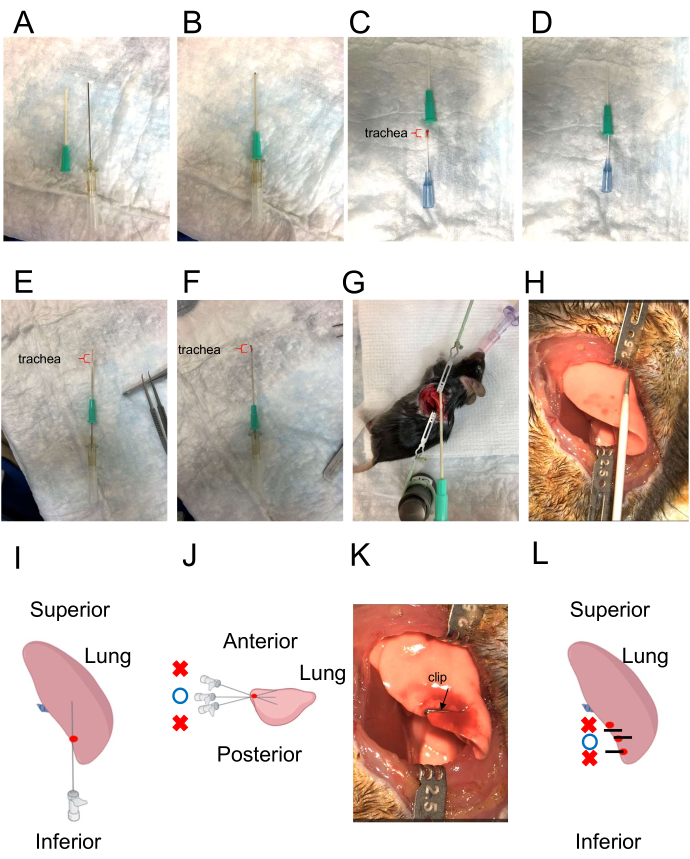
איור 3: צנתר להחדרת קנה הנשימה והמחשת כיוון החדרת שתל קנה הנשימה. (A) הצנתר להחדרת קנה הנשימה. לצנתר החיצוני יש קצה חד (שמאל), ואילו לצנתר הפנימי יש קצה קהה (מימין). (B) שילוב של צנתרים חיצוניים ופנימיים. הצנתר הפנימי בולט מעט מהקטטר החיצוני. (ג,ד) העמסת קנה הנשימה התורם לתוך הצנתר. הסוגר האדום מציין את השתל קנה הנשימה. (E) השתלת קנה הנשימה בתוך הצנתר. הסוגר האדום מציין את השתל קנה הנשימה. (F) הוצאת שתל קנה הנשימה הפנימי באמצעות הצנתר הפנימי כ"דוחף". הסוגר האדום מציין את השתל קנה הנשימה. (ז, ח) סימולציה של כיוון מיקום השתל קנה הנשימה. (ט,י) יצירת המסלול באמצעות מחט 22 גרם. העומק צריך להתאים מאוד לאורך של allograft קנה הנשימה. כיוון המחט צריך להיות הפוך מהמנתח ומקביל למשטח השולחן. אתר הניקוב הנכון מסומן בנקודה האדומה. זווית ההכנסה המתאימה מסומנת על ידי העיגול הכחול. זוויות שגויות מסומנות על ידי צלבים אדומים. (יא,ל) סגירת אתר ההזרקה pleural עם קליפ. קווים שחורים מייצגים קליפים. נקודה אדומה מייצגת את אתר הניקוב. העיגול הכחול מציין את נקודת החיתוך הנכונה. צלבים אדומים מציינים נקודות חיתוך שגויות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
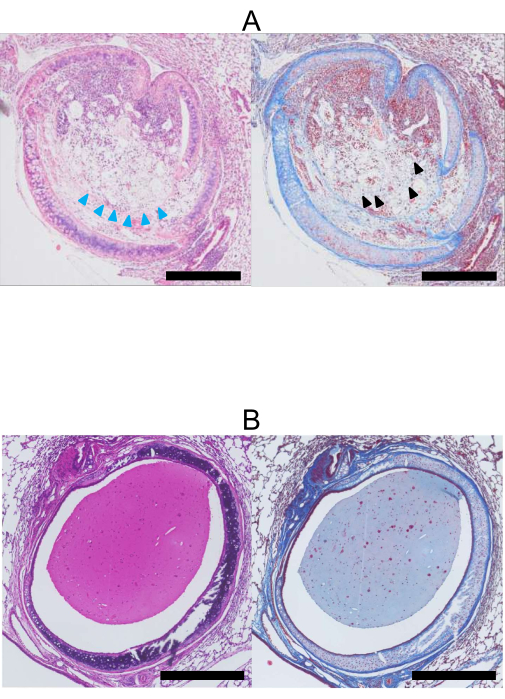
איור 4: היסטופתולוגיה 28 יום לאחר השתלת ריאות. (A) H&E (משמאל) ו-Masson's Trichrome (מימין) תמונות מוכתמות של אלוגרפט קנה הנשימה (תורם: BALB/c, מושתל: C57BL/6). לומן האלוגרפט מוסתר בקולגן וברקמה סיבית המוכתמת בכחול על ידי ראש חץ שחור של מאסון. בנוסף, תאי האפיתל אבדו (ראשי חץ כחולים). (B) H&E (משמאל) ו-Masson's Trichrome (מימין) תמונות מוכתמות של איזוגרפט קנה הנשימה. בניגוד לאלוגרפט, לומן האיזוגרפט (תורם, מקבל: C57BL/6) נשאר פתוח, ותאי האפיתל נשמרים. רקמה מוכתמת היא ריר. פסי קנה מידה = 500 מיקרומטר. קיצור: H&E = המטוקסילין ואוזין. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 5: אגרגטים לימפואידים בריאה עם אלוגרפט קנה הנשימה המושתל. (A) תמונה מוכתמת H&E של ריאה עם אלוגרפט קנה נשימה מושתל באתרו. אגרגטים לימפואידים (חצים שחורים) נצפים בתוך רקמת הריאה. סרגל קנה מידה = 500 מיקרומטר. (B) תמונת אימונופלואורסנציה של צבר לימפה, המדגישה את נוכחותם של תאי B (B220, אדום), תאי T (CD3, ירוק) וגרעינים (DAPI, כחול). סרגל קנה מידה = 100 מיקרומטר. קיצורים: H&E = hematoxylin ו eosin; DAPI = 4',6-diamidino-2-phenylindole. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
הליך IPTT murine כולל שלבים קריטיים. לגבי הרדמה, השלב המכריע הראשון הוא אינטובציה אנדוטרכאלית. זה חיוני להחזיק את העכבר בגובה מתאים עם רגליו על השולחן כדי לדמיין את מיתרי הקול להקל על אינטובציה מיידית. בנוסף, יש צורך בנפח נשימה זהיר ובהתאמת לחץ סוף תפוגה חיובי (PEEP). בדרך כלל, נפח נשימה של 500 μL ו- PEEP של 2 cmH2O מספיקים לעכברים במשקל 25-30 גרם. עם זאת, עכברים מושתלים גדולים יותר עשויים לחוות אפיזודות "שיהוק", המעידות על מחסור בחמצן. במקרים כאלה, ייתכן שיהיה צורך להגדיל את נפח הנשימה, PEEP, ולהדק באופן זמני את צינור התפוגה כדי לגייס את הריאה. אם השיהוקים נמשכים, יש להתאים את עומק צינור קנה הנשימה. לבסוף, העיתוי של אקסטובציה של צינור קנה הנשימה הוא קריטי, ואישור קצב הנשימה של המקבל חיוני כדי להבטיח התאוששות מספקת. כישלון בכך עלול לגרום לתמותה לאחר אקסטובציה.
לגבי ההליך הכירורגי, מיקום נכון של קנה הנשימה המושתל הוא קריטי. יש צורך בהדמיה של כיוון המחט המתאים כדי למקם במדויק את שתל קנה הנשימה (איור 3G). אם הנתיב רדוד מדי, שתל קנה הנשימה עלול לחדור לצדר, בעוד החדרתו עמוק מדי עלולה להוביל לניקוב כלי הריאה ולדימום חמור. שלב קריטי נוסף הוא הבטחת איטום מדויק של נקודת ההחדרה על-ידי קיבוע מאובטח של החתך הפלאורלי שלתוכו הוכנס האלוגרפט של קנה הנשימה באמצעות תפס נירוסטה (איור 3H). איטום לא מספיק עלול לגרום לדליפת אוויר, מה שעלול לגרום לתמותה של מושתל לאחר סגירת החזה.
בעוד מודל IPTT מציע כמה יתרונות, כגון פשטות יחסית, יכולת שחזור גבוהה, וסביבה אימונולוגית דומה לזו שנצפתה בהשתלות ריאה, יש לו כמה מגבלות. allografts קנה הנשימה במודל IPTT שונים מהמצב הקליני, שבו OB מתרחשת בדרכי הנשימה הקטנות. יתר על כן, במודל IPTT אי-התאמה גדול זה של קומפלקס היסטו-תאימות (MHC), אלוגרפט קנה הנשימה חסום לחלוטין עם רקמה פיברובלסטית, בניגוד ל- OAD קליני שבו חסימת רקמות פיברובלסטיות היא בדרך כלל חלקית. כדי לטפל בבעיה זו, שילוב זנים אחר (אי התאמה מינורית או גדולה שונה) עשוי לשמש עבור IPTT (בהתאם למחקר המיועד), מכיוון שהוא עלול לגרום לתגובה אלואימונית מתונה יותר ולחסימת רקמות פיברובלסטיות מתונה יותר בהשוואה לשילוב BALB/c-to-C57BL/6. לא ידוע לנו על מחקרים שפורסמו הבוחנים שילובי זנים שונים, ולכן אפשרות זו תצטרך להיבחן אמפירית.
לבסוף, זהו שתל לא וסקולרי, בדומה לדגמי HTT ו- OTT. כדי להתמודד עם מגבלה זו, ניתן להשתמש בהשתלת ריאות אורתוטופית (OLT)14. עם זאת, התפתחות פתולוגיה דמוית OAD השתנתה במודל OLT העכבר 15,16,17. בהתחשב בפשטות היחסית של מודל IPTT וביכולת השחזור שלו בהשוואה ל-OLT, זה עדיין מודל סביר לחקור את המנגנונים של OAD הקשור להשתלה. לסיכום, מודל IPTT משמש כמודל מחקרי שימושי לחקר מסלולים חיסוניים ופרופברוטיים תוך ריאתיים המעורבים בהתפתחות מחיקת דרכי הנשימה לאחר השתלת ריאות.
Disclosures
למחברי כתב היד הזה אין ניגודי עניינים לחשוף.
Acknowledgements
המחברים רוצים להודות לג'רום ואלרו על עריכת כתב היד הזה. איור 1 ואיור 3I,J,L נוצרו עם BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| BALB/cJ | The Jackson Laboratory | 8-10 weeks 25-30 g | Male, Donor |
| BD 1 mL Syringe | Becton Dickinson | 309659 | |
| BD PrecisionGlide Needle Aiguile BD PrecisionGlide | Becton Dickinson | 305122 | |
| Bovie Change-A-Tip Deluxe High-Temperture | Bovie | DEL1 | |
| C57BL/6J | The Jackson Laboratory | 8-10 weeks 25-30 g | Male, Recipient |
| Dumont #5/45 Forceps | F·S·T | 11251-35 | |
| Ethicon Ligaclip Multiple -Clip Appliers- | Ethicon | LX107 | |
| Extra Fine Graefe Forceps | F·S·T | 11150-10 | |
| Glover Bulldog Clamp | Integra | 320-127 | |
| Halsted-Mosquito Hemostats | F·S·T | 13009-12 | |
| Horizon Titanium Ligating Clips | Teleflex | 001201 | |
| Leica M651 Manual surgical microscope for microsurgical procedures | Leica | ||
| Magnetix Fixator with spring lock | CD+ LABS | ACD-001 | |
| Microsurgical Scissor | Jarit | 277-051 | |
| Mouse and Perinatal Rat Ventilator Model 687 | Harvard | 55-0001 | |
| Perfadex Plus | XVIVO | 19850 | |
| Retractor Tip Blunt - 2.5 mm | CD+ LABS | ACD-011 | |
| small animal table | CD+ LABS | ACD-003 | |
| Surgipro Blue 24" CV-1 Taper, Double Armed | Covidien | VP702X | |
| Systane ointment | Alconn | 1444062 | |
| System Elastomer | CD+ LABS | ACD-007 | |
| Terumo Surflo IV Catheter, 20 G x 1 in | Terumo Medical Corporation | SR-OX2025CA | |
| VMT table Top | benson | 91803300 |
References
- Chambers, D. C., et al. The International Thoracic Organ Transplant Registry of the International Society for Heart and Lung Transplantation: Thirty-fifth adult lung and heart-lung transplant report-2018; Focus theme: Multiorgan Transplantation. J Heart Lung Transplant. 37 (10), 1169-1183 (2018).
- Hertz, M. I., Jessurun, J., King, M. B., Savik, S. K., Murray, J. J. Reproduction of the obliterative bronchiolitis lesion after heterotopic transplantation of mouse airways. American J Pathol. 142 (6), 1945-1951 (1993).
- Ikonen, T. S., Brazelton, T. R., Berry, G. J., Shorthouse, R. S., Morris, R. E. Epithelial re-growth is associated with inhibition of obliterative airway disease in orthotopic tracheal allografts in non-immunosuppressed rats. Transplantation. 70 (6), 857 (2000).
- Dutly, A. E., et al. A novel model for post-transplant obliterative airway disease reveals angiogenesis from the pulmonary circulation. Am J Transplant. 5 (2), 248-254 (2005).
- Wagnetz, D., et al. Rejection of tracheal allograft by intrapulmonary lymphoid neogenesis in the absence of secondary lymphoid organs. Transplantation. 93 (12), 1212-1220 (2012).
- Hirayama, S., et al. Local long-term expression of lentivirally delivered IL-10 in the lung attenuates obliteration of intrapulmonary allograft airways. Hum Gene Ther. 22 (11), 1453-1460 (2011).
- Watanabe, T., et al. Recipient bone marrow-derived IL-17 receptor A-positive cells drive allograft fibrosis in a mouse intrapulmonary tracheal transplantation model. Transpl Immunol. 69, 101467 (2021).
- Matsuda, Y., et al. Spleen tyrosine kinase modulates fibrous airway obliteration and associated lymphoid neogenesis after transplantation. Am J Transplant. 16 (1), 342-352 (2016).
- Suzuki, Y., et al. Effect of CTLA4-Ig on Obliterative bronchiolitis in a mouse intrapulmonary tracheal transplantation model. Ann Thorac Cardiovasc Surg. 27 (6), 355-365 (2021).
- Watanabe, T., et al. A potent anti-angiogenic factor, vasohibin-1, ameliorates experimental bronchiolitis obliterans. Transplant Proc. 44 (4), 1155-1157 (2012).
- Aloisi, F., Pujol-Borrell, R. Lymphoid neogenesis in chronic inflammatory diseases. Nat Rev Immunol. 6 (3), 205-217 (2006).
- Cupedo, T., Jansen, W., Kraal, G., Mebius, R. E. Induction of secondary and tertiary lymphoid structures in the skin. Immunity. 21 (5), 655-667 (2004).
- Sato, M., et al. The role of intrapulmonary de novo lymphoid tissue in obliterative bronchiolitis after lung transplantation. J Immunol. 182 (11), 7307-7316 (2009).
- Okazaki, M., et al. Maintenance of airway epithelium in acutely rejection orthotopic vascularized mouse lung transplants. A J Resp Cell Mol Biol. 37 (6), 625-630 (2007).
- Yamada, Y., et al. Chronic airway fibrosis in orthotopic mouse lung transplantation models-an experimental reappraisal. Transplantation. 102 (2), e49-e58 (2018).
- Watanabe, T., et al. A B cell-dependent pathway drives chronic lung allograft rejection after ischemia-reperfusion injury in mice. Am J Transplant. 19 (12), 3377-3389 (2019).
- Guo, Y., et al. Vendor-specific microbiome controls both acute and chronic murine lung allograft rejection by altering CD4+Foxp3+ regulatory T cell levels. Am J Transplant. 19 (10), 2705-2718 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved