Method Article
Melhorando a osteoartrite em camundongos usando nanopartículas de prata
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Apresentamos aqui um protocolo para o uso de nanopartículas de prata para melhorar efetivamente os sintomas agudos de camundongos com osteoartrite induzida por colagenase tipo II, incluindo inflamação sinovial, hiperplasia sinovial, hiperplasia vascular, etc.
Resumo
A osteoartrite do joelho (KOA) é uma das doenças degenerativas das articulações mais comumente encontradas em pessoas com mais de 45 anos de idade. Atualmente, não há nenhuma terapêutica eficaz para OA de joelho, e a única estratégia de desfecho é a artroplastia total do joelho (ATJ); portanto, a KOA está associada a encargos econômicos e custos sociais. A resposta imune inflamatória está envolvida na ocorrência e desenvolvimento de KOA. Nós previamente estabelecemos um modelo de camundongo de KOA usando colágeno tipo II. Hiperplasia do tecido sinovial estava presente no modelo, ao lado de um grande número de células inflamatórias infiltradas. As nanopartículas de prata têm efeitos anti-inflamatórios substanciais e têm sido amplamente utilizadas na terapia tumoral e na liberação cirúrgica de fármacos. Portanto, avaliamos os efeitos terapêuticos das nanopartículas de prata em um modelo de KOA induzido por colagenase II. Os resultados experimentais mostraram que as nanopartículas de prata reduziram significativamente a hiperplasia sinovial e a infiltração de neutrófilos no tecido sinovial. Assim, este trabalho demonstra a identificação de uma nova estratégia para AT e fornece uma base teórica para prevenir o progresso de OA.
Introdução
A osteoartrite do joelho (OA) é uma das formas mais frequentes de osteoartrite e envolve um complexo processo patológico em toda a articulaçãosinovial1. À medida que a população mundial está envelhecendo gradualmente, a incidência de OA está aumentando substancialmente. A dor consistente na articulação do joelho geralmente leva os pacientes com OA a procurar tratamento médico. A etiologia da dor na OA pode estar relacionada à resposta inflamatória, hiperplasia sinovial e degeneração da cartilagem2. Os tecidos da sinóvia são compostos por dois tipos de células: fibroblastos sinoviais e macrófagos 3,4,5. Os fibroblastos sinoviais produzem líquido sinovial. Os macrófagos sinoviais são normalmente dormentes e ativados pela resposta inflamatória. A inflamação inicial da sinóvia causa dor articular no joelho6.
A resposta imune inflamatória tecidual da sinóvia desempenha um papel crucial na patogênese da OA. Estudos prévios confirmaram que há respostas inflamatórias nos tecidos da sinóvia na OA de joelho, conhecida como sinovite, e que o grau de sinovite da OA está intimamente relacionado à infiltração de células inflamatórias dos tecidos sinóvios 7,8,9. A sinovite é uma reação inflamatória da sinóvia, e suas características patológicas são a proliferação de células sinoviais, a formação de novos vasos e a infiltração de células inflamatórias5,10,11.
O objetivo do tratamento com OA é aliviar a reação inflamatória da sinóvia e retardar a progressão da doença. Atualmente, as principais drogas clínicas para o tratamento da OA são os anti-inflamatórios não esteroidais (AINEs); entretanto, apresentam efeitos colaterais significativos, como nefrotoxicidade12,13. Injeções intra-articulares de glicocorticoides são outra opção para o tratamento de OA hospitalar; no entanto, o glicocorticoide se espalha rapidamente e pode ser rapidamente metabolizado pelo derrame articular. Enquanto isso, pacientes diabéticos com hiperglicemia subjacente devem ser cautelosos quanto às injeções contínuas de esteroides14. Em resumo, não há estratégia terapêutica medicamentosa disponível para OA de joelho. Portanto, a exploração de novas drogas para o tratamento de OA é extremamente urgente.
O tamanho das nanopartículas de prata é inferior a 100 nm. Devido aos seus proeminentes efeitos anti-inflamatórios, antibacterianos e antioxidantes, têm sido amplamente utilizados em vários aspectos da saúde e da medicina, como cicatrização de feridas e queimaduras 15,16. Também são utilizados na liberação de fármacos direcionados, exames de imagem e diagnóstico molecular17. A prata (Ag) tem maior ação anti-inflamatória e antibacteriana do que outras nanopartículas metálicas, como cobre (), zinco (Zn) e ferro (Fe)15. As nanopartículas de prata, um novo tipo de nanomaterial, têm propriedades antimicrobianas potentes e de amplo espectro. Um estudo anterior verificou que, em modelos de queimaduras e peritonites18,19, as nanopartículas de prata poderiam efetivamente inibir a produção de fatores inflamatórios e promover a cicatrização de feridas. Estudo anterior também demonstrou que nanopartículas de prata melhoraram a cicatrização de feridas diabéticas por promoverem a síntese de fatores de crescimento e deposição de colágeno20.
Com base nos efeitos anti-inflamatórios das nanopartículas de prata, nosso objetivo foi usar nanopartículas de prata para tratar KOA induzido por colágeno tipo II em camundongos. Os resultados sugeriram que o número de células de infiltração inflamatória da articulação sinovial em camundongos foi significativamente reduzido com este tratamento. Os resultados também sugeriram que as nanopartículas de prata poderiam aliviar significativamente os sintomas de KOA em camundongos. Portanto, a aplicação de nanopartículas de prata pode subsidiar o desenvolvimento de novas opções de tratamento para OA clínica.
Protocolo
Todo o trabalho com animais foi aprovado pelo Comitê de Ética e Bem-Estar Animal (AEWC) do Guangzhou Forevergen Medical Laboratory Animal Center (2018-0186).
1. Estabelecimento do modelo de mouse KOA
- Manter camundongos BALB/c (18-24 g; 12-14 semanas de idade) em ambiente com 70% de umidade e a 26 °C com ciclo claro/escuro de 12 h. Para este experimento, os animais foram mantidos no Guangzhou Forevergen Medical Laboratory Animal Center.
- Use colágeno tipo II para estabelecer um modelo de camundongo KOA como descrito anteriormente21. Realizar a injeção intra-articular conforme descrito abaixo.
- Aplicar pentobarbital sódico a 2% (40 mg/kg) para anestesia e buprenorfina (0,05 mg/kg, injeção subcutânea) para analgesia. Em seguida, fixe os membros do rato com a fita, retire os pelos com a navalha e desinfete com uma esfoliação alternada de iodóforo a 0,1% e álcool três vezes.
- Usar luvas estéreis e tesouras estéreis para expor sequencialmente a pele, o tecido subcutâneo e o ligamento infrapatelar. Manter a área da incisão abaixo de 0,5 cm.
NOTA: Uma manta térmica foi usada para manter a temperatura corporal dos camundongos durante a operação. - Utilizar seringa de insulina de 1 mL para injetar 10 U de colagenase tipo II 30 mg/kg (0,4 mg/mL) na cavidade articular (abaixo do ligamento infrapatelar)22.
NOTA: O ângulo entre a agulha e a pele deve ser de aproximadamente 15°; Em seguida, a direção da agulha deve ser alterada e a agulha deve ser retirada completamente. - Após a injeção, suture primeiro o tecido subcutâneo e, em seguida, a pele. Esterilizar a área de sutura com iodóforo a 0,1%. Coloque os ratos nas gaiolas ventiladas individualmente (IVCs) separadamente depois de acordarem da anestesia.
2. Síntese de nanopartículas de prata
NOTA: A preparação de nanopartículas de prata foi descrita anteriormente em detalhes19. Todo o processo de formulação é realizado em gelo. Após a preparação, a mistura é armazenada a 4 °C; caso contrário, a mistura solidifica-se facilmente à temperatura ambiente.
- Adicionar um total de 400 μL de colágeno tipo I (4 mg/mL) a um tubo de microcentrífuga de 1,5 mL e colocar no gelo.
- Adicione um total de 200 μL de solução salina tamponada com fosfato (PBS) ao colágeno acima, misture bem a solução e coloque-a no gelo.
- Finalmente, adicione 400 μL de nanopartículas de prata à solução acima e, em seguida, misture suficientemente. A concentração final da solução nanoparticulada é de 1 mM.
NOTA: O diâmetro médio das nanopartículas de prata varia de 5 nm a 15 nm23. Isso foi confirmado por microscopia eletrônica.
3. Tratamento com nanopartículas de prata em camundongos KOA induzidos por colagenase tipo II
- Remova os camundongos KOA induzidos por colagenase tipo II de suas gaiolas 1 semana depois e injete-os com nanopartículas de prata. Injetar as nanopartículas de prata uma vez por semana e coletar os espécimes 30 dias depois.
- Injetar um total de pentobarbital sódico a 2% (dose: 2 mL/kg) para anestesia através de uma injeção intraperitoneal e, em seguida, fixar, preparar a pele e esterilizar conforme descrito nas etapas 1.2.
- Use luvas estéreis e tesouras estéreis para expor sequencialmente a pele, o tecido subcutâneo e os ligamentos do joelho.
- Use uma seringa de insulina de 1 mL e entre na cavidade articular em um ângulo de 15° com a agulha. Injetar lentamente cerca de 20 μL da mistura de colágeno nanoparticulado de prata e retirar lentamente a agulha24.
- Sutura do tecido subcutâneo e da pele, por sua vez, e esterilizar. Coloque os ratos em gaiolas ventiladas individualmente (VCI) separadamente depois de acordarem da anestesia.
- Realizar esta injeção da mistura de colágeno nanoparticulado de prata (20 μL) quatro vezes com frequência de uma vez por semana.
NOTA: Os ratos tratados com a mistura de colagénio de nanopartículas de prata devem ser mantidos em gaiolas individuais. Camundongos podem lutar quando são mantidos juntos, e isso afetaria os resultados experimentais. Durante a injeção, haverá uma sensação de tensão quando a agulha atinge a cavidade articular, e ocorre inchaço na articulação do joelho após a injeção. A combinação desses dois métodos permite ao pesquisador garantir que a droga tenha sido injetada com sucesso na articulação do joelho.
4. Coleta da articulação do joelho e tecido sinovial
- Sacrificar os ratos com asfixia por dióxido de carbono ou qualquer outro protocolo aprovado pelo comité de ética animal relevante.
- Esterilizar e dissecar a pele e o tecido subcutâneo sequencialmente, e expor totalmente a articulação do joelho.
- Colher as articulações do joelho, incluindo o fêmur e a tíbia, e remover os tecidos da musculatura.
- Coletar os tecidos articulares do joelho, incluindo fêmur, tíbia e tecidos moles adjacentes (ligamento e cápsula), em formalina a 10% para preservação e fixação.
5. Coloração hematoxilina-eosina
- Após a fixação durante a noite, os cortes embutem em parafina e usam um micrótomo para cortar o tecido embebido em parafina em 0,4 μm de espessura. Use os cortes preparados para coloração adicional (coloração hematoxilina-eosina, Safranin O/Fast Green e coloração imunohistoquímica (IHQ).
- Desparafinizar os cortes duas vezes com xileno, mergulhar em etanol 100%, 95%, 80% e 70% em sequência por 5 min cada, e reidratar.
- Manchar os cortes com hematoxilina (0,1 g/100 mL) por 5 min e, em seguida, colocar diretamente em HCl a 1% por 10 s e eosina (0,5 g/100 mL) por 1 min.
- Observe as alterações histopatológicas da sinóvia ao microscópio.
6. Safranin O/Verde Rápido
- Embutir o tecido em parafina e preparar os cortes histológicos conforme descrito na etapa 5.1.
- Desparafinizar as seções duas vezes com xileno e reidratá-las com uma série de etanol (como etanol 100%, 95%, 80% e 70% em água destilada, cada uma por 5 min).
- Manchar os cortes preparados com a hematoxilina e lavá-los com PBS três vezes por 2 min cada.
- Diferenciar os cortes com álcool clorídrico e lavá-los com PBS três vezes por 2 min cada.
- Imergir os cortes em solução de coloração Fast Green a 0,02% por 5-10 min, seguida de coloração de Safranin O a 0,1% por 1-2 min.
- Diferenciar os cortes com ácido acético a 1%, seguido de lavagem com PBS.
- Detectar e analisar a formação de fibrocartilagem nas seções.
7. Coloração imunoistoquímica (IHQ)
- Incluir o tecido em parafina e preparar os cortes histológicos conforme descrito no passo 5.1.
- Desparafinizar as seções duas vezes com xileno e reidratá-las com uma série de etanol (como etanol 100%, 95%, 80% e 70% em água destilada, cada uma por 5 min). Imergir as seções em tampão Tris-EDTA (base de Tris 10 mM, solução de EDTA 1 mM; pH 9,0) e aquecer em forno de micro-ondas a 95 °C por 10 min para realizar a recuperação do antígeno.
- Expor as secções a uma solução de peróxido de hidrogénio a 3% durante 10 minutos para remover a peroxidase endógena.
- Tratar as secções com 5% de soro de cabra para bloquear a ligação inespecífica.
- Adicione os anticorpos primários diluídos (diluição 1:1.000) contra CD177 e incube durante a noite a 4°C. Em seguida, lave as seções com PBS três vezes.
- Mergulhe as seções com PBS e incube as seções com o anticorpo secundário apropriado (HRP-conjugated polymer anti-rabbit system) por 30 min à temperatura ambiente.
- Realizar a visualização da coloração IHQ utilizando 3,3'-diaminobenzidina (DAB) como cromógeno.
- Visualize os cortes ao microscópio e analise as imagens adquiridas.
Resultados
O modelo de camundongo KOA foi induzido usando colagenase tipo II. A partir de 1 semana após a indução do modelo, a mistura preparada de colágeno de nanopartículas de prata foi injetada na cavidade articular uma vez por semana durante 4 semanas (Figura 1). Os pesos dos camundongos em cada grupo foram observados e registrados diariamente. Os resultados mostraram que o peso corporal médio dos camundongos KOA foi significativamente menor do que o dos camundongos do grupo controle normal. Entretanto, o peso corporal médio dos camundongos do grupo colagenase tipo II + AgNPs foi maior em relação aos camundongos KOA, embora essa diferença não tenha sido estatisticamente significativa (Figura 2). Após 30 dias, os tecidos sinoviais das articulações do joelho foram coletados dos camundongos e submetidos ao exame anatomopatológico. Foram analisados a hiperplasia, proliferação vascular, infiltrado inflamatório da sinóvia e dano cartilaginoso 5,10,11. Os resultados mostraram que a espessura sinovial dos camundongos do grupo OA foi significativamente maior em comparação com o grupo controle normal. No grupo tratado com a mistura de colágeno nanoparticulado de prata, a espessura da membrana sinovial foi reduzida em relação ao grupo KOA (Figura 3). Houve hiperplasia vascular na sinóvia dos camundongos KOA em relação ao grupo controle normal, e a hiperplasia vascular foi significativamente reduzida na sinóvia dos camundongos tratados com a mistura de colágeno nanoparticulado de prata (Figura 4). Os resultados da coloração Safranina-O mostraram que a matriz cartilaginosa dos camundongos KOA foi destruída, enquanto os camundongos tratados com a mistura de colágeno nanoparticulado de prata apresentaram uma matriz cartilaginosa significativamente melhor (Figura 5). Os escores de características morfológicas em cada grupo foram avaliados conforme descrito anteriormente22. Os resultados foram 0 ± 0 para o grupo salina, 7 ± 0,63 para o grupo colágeno tipo II e 4,2 ± 1,17 para o grupo colagenase tipo II + AgNPs (Figura 6). CD177 é um importante marcador neutrofílico25. CD177 é expresso em 40%-60% dos neutrófilos em condições normais. No entanto, a expressão de CD177 em neutrófilos aumenta significativamente durante a inflamação aguda. Os resultados da coloração por IHQ demonstraram que os neutrófilos infiltrados na região sinovial foram significativamente reduzidos no grupo tratado com AgNPs em comparação com o grupo KOA (Figura 7), o que sugere que o tratamento com AgNPs poderia melhorar os sintomas de OA de joelho.
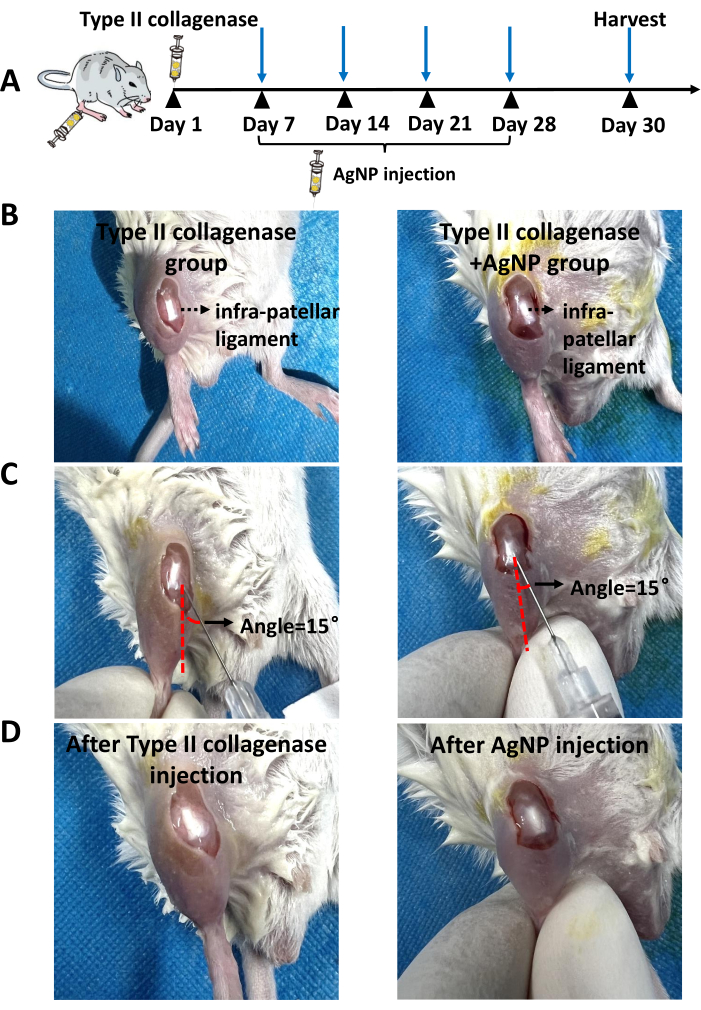
Figura 1: Local de injeção. (A) Imagens representativas da injeção de colagenase tipo II. (B) Imagens representativas após a injeção de colagenase tipo II. (C) Imagens representativas da injeção da mistura de colágeno nanoparticulado de prata no modelo de camundongo KOA. (D) Imagens representativas após a injeção da mistura de colágeno de nanopartículas de prata em camundongos modelo KOA. A linha pontilhada vermelha representa a linha paralela aos ligamentos do joelho do rato. A seta preta representa o ângulo entre a agulha da seringa de insulina e a pele. Clique aqui para ver uma versão maior desta figura.

Figura 2: Alterações do peso corporal dos camundongos em cada grupo. Este painel mostra o peso médio dos camundongos em cada grupo em diferentes pontos de tempo; o eixo x indica o número de dias após a injeção da colagenase tipo II e o eixo y indica a mudança de dobra no peso corporal. Grupo salina (n = 7), grupo colagenase tipo II (n = 5), grupo colagenase tipo II + AgNPs (n = 5). *p < 0,05. Clique aqui para ver uma versão maior desta figura.
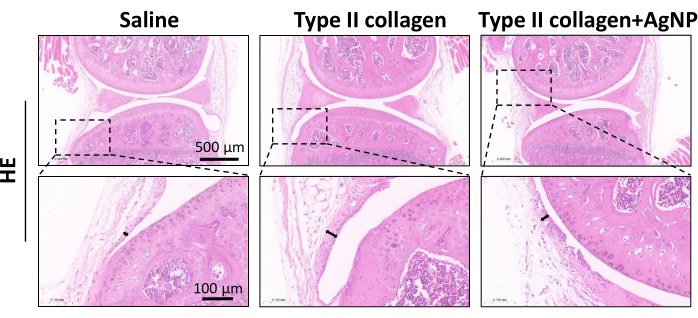
Figura 3: Coloração hematoxilina-eosina (H&E) representando hiperplasia sinovial. Os tecidos sinoviais de cada grupo de camundongos foram coletados, fixados, seccionados e corados com H&E aos 30 dias após a cirurgia. As setas duplas representam a espessura sinovial detectada. Barra de escala = 0,1 mm. Clique aqui para ver uma versão maior desta figura.

Figura 4: Imagem representativa da hiperplasia vascular perissinovial. As setas indicam os vasos. Barra de escala = 0,05 mm. Clique aqui para ver uma versão maior desta figura.
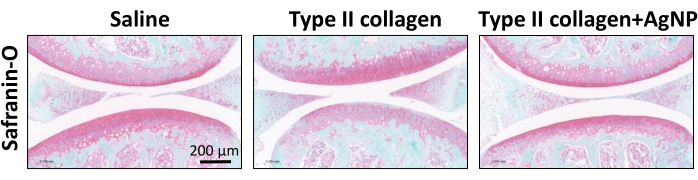
Figura 5: Coloração de safranina O da articulação do joelho em cada grupo de camundongos. Barra de escala = 0,2 mm. Clique aqui para ver uma versão maior desta figura.

Figura 6: Escores das características morfológicas em cada grupo. O tecido sinovial foi utilizado para medir o escore de características morfológicas dos camundongos de cada grupo. Cinco cortes teciduais em cada grupo foram selecionados para analisar o grau de hiperplasia/alargamento da camada celular de revestimento sinovial, o grau de infiltração neutrofílica no tecido sinovial e o grau de ativação do estroma sinovial (Tabela 1). O valor médio foi utilizado como escore final. **p < 0,01 e ***p < 0,001 com um teste t de Student para cada coorte em comparação com o grupo KOA não tratado. Clique aqui para ver uma versão maior desta figura.
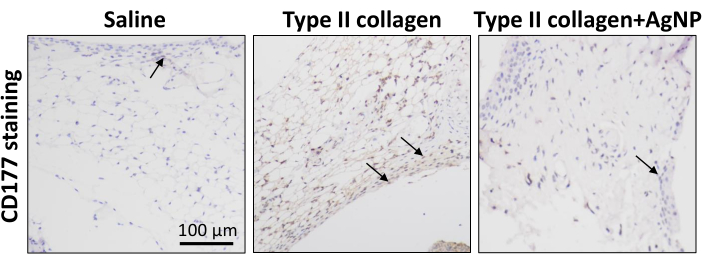
Figura 7: Coloração imunoistoquímica para um marcador neutrofílico no tecido sinovial em cada grupo de camundongos. A coloração imunoistoquímica foi utilizada para detectar a expressão do marcador neutrófilo CD177 no tecido sinovial dos camundongos de cada grupo. As setas indicam neutrófilos. Barra de escala = 100 μm. Clique aqui para ver uma versão maior desta figura.
Tabela 1: Características morfológicas de pontuação. Clique aqui para baixar esta tabela.
Discussão
As nanopartículas de prata exibem efeitos anti-inflamatórios, antibacterianos, antioxidantes e imunomoduladores, o que significa que poderiam proteger células e tecidos de danos, reduzindo a produção de espécies reativas de oxigênio26. Alguns pesquisadores estão preocupados com a toxicidade das nanopartículas de prata27. A toxicidade das nanopartículas de prata está diretamente relacionada à presença de íons de prata livre. Devido ao tamanho nanométrico das nanopartículas de prata, elas poderiam facilmente interferir em biomoléculas, células e órgãos humanos 15,28,29. Vários estudos têm relatado que nanopartículas de prata podem induzir estresse oxidativo e prejudicar a função mitocondrial em células humanas30. Além disso, o Ag pode ser detectado em órgãos humanos, especialmente no fígado e baço, após o uso de grandes quantidades de nanopartículas de prata. Pesquisadores também relataram que nanopartículas de prata têm a capacidade de atravessar a barreira hematoencefálica via transporte transsináptico e se acumular no cérebro31. Um relato sistemático da biotoxicidade das nanopartículas de prata não foi realizado, embora alguns pesquisadores reconheçam a segurança das nanopartículas de prata32.
Neste estudo, preparamos uma mistura de colágeno nanoparticulado de prata. De fato, o período de duração das nanopartículas de prata em tecidos humanos é breve, mas o período de duração das nanopartículas de prata pode ser prolongado quando aplicado com uma mistura de colágeno; Isso não só reduz o trauma, mas também a dose das drogas. Considerando a toxicidade das nanopartículas de prata, a dose de nanopartículas de prata aplicada neste estudo foi de 30 mg/kg, em consonância com pesquisas anteriores33.
Algumas considerações vitais da operação experimental são as seguintes. A colagenase tipo II deve ser armazenada a -20 °C após a preparação para evitar a degradação devido à clivagem enzimática. A preparação da mistura de colágeno de nanopartículas de prata deve ser realizada no gelo continuamente à temperatura ambiente, porque a mistura de colágeno de nanopartículas de prata torna-se um gel semissólido rapidamente e, em seguida, não pode ser usada para injeção. A solução deve ser conservada a 4 °C após a preparação. Uma seringa de insulina de 1 mL com uma agulha menor deve ser escolhida para administração intra-articular, o que poderia efetivamente evitar o vazamento dos medicamentos injetáveis. A agulha deve ser inserida em um ângulo de 15° para injetar a mistura de colágeno de nanopartículas de prata. Quando a agulha não é resistente, isso indica que a agulha atingiu a cavidade articular do joelho. Após a injeção, o ângulo da injeção deve ser alterado e a agulha deve ser retirada lentamente para evitar vazamento do medicamento injetado.
Neste estudo, as nanopartículas de prata efetivamente melhoraram os sintomas de KOA induzida pela colagenase tipo II em camundongos, demonstrando o efeito anti-inflamatório das nanopartículas de prata. Vários estudos têm relatado a presença de apoptose em células incubadas in vitro com nanopartículas de prata 34,35,36. A redução da hiperplasia sinovial pode ter sido causada pelas nanopartículas de prata devido ao seu envolvimento no comprometimento da função mitocondrial, ou esses desfechos podem ter sido mediados por espécies reativas de oxigênio. Hiperplasia vascular foi observada na sinóvia de camundongos do grupo modelo KOA. Foi possível que as quimiocinas tenham levado os neutrófilos dos vasos sanguíneos para o tecido sinovial durante esse processo e que a explosão da inflamação fez com que as células consumissem mais oxigênio, levando à hiperplasia vascular. Assim, novos experimentos são necessários para comprovar a confiabilidade dessa hipótese. Este estudo fornece benefícios teóricos para a pesquisa no tratamento clínico da OA clínica. Em estudos futuros, pretendemos combinar o método do ligamento cruzado anterior (LCA) com o método do modelo de KOA quimicamente induzido para observar o efeito das nanopartículas de prata. Os resultados experimentais mostram que as nanopartículas de prata podem diminuir significativamente a infiltração de células inflamatórias na sinóvia em camundongos KOA, mas os mecanismos desse efeito ainda necessitam de mais estudos, o que pode desvendar a patogênese da KOA.
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
Este trabalho foi financiado pela Fundação de Ciências Naturais da Província de Guangdong (Número: 2019A1515010209) e pelo Projeto de Ciência e Tecnologia da Cidade de Guangzhou, China (Número: 202102010164).
Materiais
| Name | Company | Catalog Number | Comments |
| 1 mL insulin syringe | BD | 305932 | None |
| CD177 Polyclonal Antibody | ThermoFisher Scientific | PA5-98759 | None |
| Chloral hydrate | Sigma-Aldrich | 302-17-0 | None |
| DAB | MCE | HY-15912 | None |
| Eosin | Beyotime Biotechnology | C0109 | None |
| Formalin | Sigma-Aldrich | HT501128 | None |
| Hematoxylin | Beyotime Biotechnology | C0107 | None |
| Light Microscopy | Leica | DM500 | None |
| Silver nanoparticle | Wolcacvi | S-10-20 | Store product in the dark at 4°C |
| Safranine O-Fast Green FCF Cartilage Stain Kit | Solarbio | 90-15-3 | None |
| Type II collagen | Sigma-Aldrich | C6885-500mg | None |
Referências
- Kuyinu, E. L., Narayanan, G., Nair, L. S., Laurencin, C. T. Animal models of osteoarthritis: Classification, update, and measurement of outcomes. Journal of Orthopaedic Surgery and Research. 11, 19(2016).
- Kraus, V. B., Blanco, F. J., Englund, M., Karsdal, M. A., Lohmander, L. S. Call for standardized definitions of osteoarthritis and risk stratification for clinical trials and clinical use. Osteoarthritis and Cartilage. 23 (8), 1233-1241 (2015).
- Smith, M. D. The normal synovium. Open Rheumatology Journal. 5, 100-106 (2011).
- de Sousa, E. B., Casado, P. L., Moura, N. V., Duarte, M. E., Aguiar, D. P. Synovial fluid and synovial membrane mesenchymal stem cells: Latest discoveries and therapeutic perspectives. Stem Cell Research and Therapy. 5 (5), 112(2014).
- Scanzello, C. R., Goldring, S. R. The role of synovitis in osteoarthritis pathogenesis. Bone. 51 (2), 249-257 (2012).
- Glyn-Jones, S., et al. Osteoarthritis. Lancet. 386 (9991), 376-387 (2015).
- Roemer, F. W., et al. Presence of MRI-detected joint effusion and synovitis increases the risk of cartilage loss in knees without osteoarthritis at 30-month follow-up: The MOST study. Annals of Rheumatic Diseases. 70 (10), 1804-1809 (2011).
- Furman, B. D., et al. Articular ankle fracture results in increased synovitis, synovial macrophage infiltration, and synovial fluid concentrations of inflammatory cytokines and chemokines. Arthritis and Rheumatology. 67 (5), 1234-1239 (2015).
- Ayral, X., Pickering, E. H., Woodworth, T. G., Mackillop, N., Dougados, M. Synovitis: A potential predictive factor of structural progression of medial tibiofemoral knee osteoarthritis -- Results of a 1 year longitudinal arthroscopic study in 422 patients. Osteoarthritis and Cartilage. 13 (5), 361-367 (2005).
- Henrotin, Y., Lambert, C., Richette, P. Importance of synovitis in osteoarthritis: Evidence for the use of glycosaminoglycans against synovial inflammation. Seminars in Arthritis and Rheumatism. 43 (5), 579-587 (2014).
- Liu-Bryan, R. Synovium and the innate inflammatory network in osteoarthritis progression. Current Rheumatology Reports. 15 (5), 323(2013).
- Towheed, T., Shea, B., Wells, G., Hochberg, M. Analgesia and non-aspirin, non-steroidal anti-inflammatory drugs for osteoarthritis of the hip. Cochrane Database of Systematic Reviews. (2), (2000).
- Co, C. M., et al. Click chemistry-based pre-targeting cell delivery for cartilage regeneration. Regenerative Biomaterials. 8 (3), (2021).
- Oo, W. M., Liu, X., Hunter, D. J. Pharmacodynamics, efficacy, safety and administration of intra-articular therapies for knee osteoarthritis. Expert Opinion on Drug Metabolism and Toxicology. 15 (12), 1021-1032 (2019).
- Morozova, O. V. Silver nanostructures: Limited sensitivity of detection, toxicity and anti-inflammation effects. International Journal of Molecular Sciences. 22 (18), 9928(2021).
- He, M., et al. A pH-responsive mesoporous silica nanoparticles-based drug delivery system with controlled release of andrographolide for OA treatment. Regenerative Biomaterials. 8 (4), (2021).
- Samuel, M. S., Jose, S., Selvarajan, E., Mathimani, T., Pugazhendhi, A. Biosynthesized silver nanoparticles using Bacillus amyloliquefaciens; Application for cytotoxicity effect on A549 cell line and photocatalytic degradation of p-nitrophenol. Journal of Photochemistry and Photobiology B. 202, 111642(2020).
- Liu, X., et al. Silver nanoparticles mediate differential responses in keratinocytes and fibroblasts during skin wound healing. ChemMedChem. 5 (3), 468-475 (2010).
- Tian, J., et al. Topical delivery of silver nanoparticles promotes wound healing. ChemMedChem. 2 (1), 129-136 (2007).
- Vendidandala, N. R., et al. Gallocatechin-silver nanoparticle impregnated cotton gauze patches enhance wound healing in diabetic rats by suppressing oxidative stress and inflammation via modulating the Nrf2/HO-1 and TLR4/NF-kappaB pathways. Life Sciences. 286, 120019(2021).
- Kikuchi, T., Sakuta, T., Yamaguchi, T. Intra-articular injection of collagenase induces experimental osteoarthritis in mature rabbits. Osteoarthritis and Cartilage. 6 (3), 177-186 (1998).
- Lorenz, J., Grässel, S. Experimental osteoarthritis models in mice. Methods in Molecular Biology. 1194, 401-419 (2014).
- Zhao, Z., et al. Design and synthesis of Ag NPs/chitosan-starch nano-biocomposite as a modern anti-human malignant melanoma drug. International Journal of Biological Macromolecules. 236, 123823(2023).
- Ahmed, E., et al. Decellularized extracellular matrix-rich hydrogel-silver nanoparticle mixture as a potential treatment for acute liver failure model. Journal of Biomedical Materials Research Part A. 108 (12), 2351-2367 (2020).
- Bai, M., et al. CD177 modulates human neutrophil migration through activation-mediated integrin and chemoreceptor regulation. Blood. 130 (19), 2092-2100 (2017).
- Singh, D., Chaudhary, D., Kumar, V., Verma, A. Amelioration of diethylnitrosamine (DEN) induced renal oxidative stress and inflammation by Carissa carandas embedded silver nanoparticles in rodents. Toxicology Reports. 8, 636-645 (2021).
- Singh, N., et al. NanoGenotoxicology: The DNA damaging potential of engineered nanomaterials. Biomaterials. 30 (23-24), 3891-3914 (2009).
- Noronha, V. T., et al. Silver nanoparticles in dentistry. Dental Materials. 33 (10), 1110-1126 (2017).
- Ahamed, M., Alsalhi, M. S., Siddiqui, M. K. Silver nanoparticle applications and human health. Clinica Chimica Acta. 411 (23-24), 1841-1848 (2010).
- Palacios-Hernandez, T., et al. cellular uptake and apoptotic responses in human coronary artery endothelial cells exposed to ultrasmall superparamagnetic iron oxide nanoparticles. Journal of Applied Toxicology. 40 (7), 918-930 (2020).
- Lebda, M. A., et al. Potential role of alpha-lipoic acid and Ginkgo biloba against silver nanoparticles-induced neuronal apoptosis and blood-brain barrier impairments in rats. Life Sciences. 212, 251-260 (2018).
- Yin, I. X., et al. The antibacterial mechanism of silver nanoparticles and its application in dentistry. International Journal of Nanomedicine. 15, 2555-2562 (2020).
- Kim, Y. S., et al. Subchronic oral toxicity of silver nanoparticles. Particle and Fibre Toxicology. 7, 20(2010).
- Pascarelli, N. A., et al. Effects of gold and silver nanoparticles in cultured human osteoarthritic chondrocytes. Journal of Applied Toxicology. 33 (12), 1506-1513 (2013).
- Braydich-Stolle, L. K., et al. Silver nanoparticles disrupt GDNF/Fyn kinase signaling in spermatogonial stem cells. Toxicological Sciences. 116 (2), 577-589 (2010).
- Eom, H. J., Choi, J. p38 MAPK activation, DNA damage, cell cycle arrest and apoptosis as mechanisms of toxicity of silver nanoparticles in Jurkat T cells. Environmental Science and Technology. 44 (21), 8337-8342 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados