Method Article
تحسين هشاشة العظام في الفئران باستخدام جسيمات الفضة النانوية
In This Article
Summary
يظهر هنا بروتوكول لاستخدام جسيمات الفضة النانوية لتحسين الأعراض الحادة للفئران المصابة بالتهاب المفاصل الناجم عن الكولاجين من النوع الثاني بشكل فعال ، بما في ذلك الالتهاب الزليلي ، وتضخم الغشاء الزليلي ، وتضخم الأوعية الدموية ، وما إلى ذلك.
Abstract
هشاشة العظام في الركبة (KOA) هي واحدة من الأمراض التنكسية الأكثر شيوعا في المفاصل لدى الأشخاص الذين تزيد أعمارهم عن 45 عاما. حاليا ، لا توجد أي علاجات فعالة ل KOA،واستراتيجية نقطة النهاية الوحيدة هي رأب مفاصل الركبة الكلي (TKA). لذلك ، يرتبط KOA بالأعباء الاقتصادية والتكاليف المجتمعية. وتشارك الاستجابة الالتهابية المناعية في حدوث وتطور KOA. لقد أنشأنا سابقا نموذجا للماوس من KOA باستخدام الكولاجين من النوع الثاني. كان تضخم النسيج الزليلي موجودا في النموذج ، إلى جانب عدد كبير من الخلايا الالتهابية المتسللة. جسيمات الفضة النانوية لها تأثيرات كبيرة مضادة للالتهابات وقد استخدمت على نطاق واسع في علاج الأورام وتوصيل الأدوية الجراحية. لذلك ، قمنا بتقييم الآثار العلاجية لجسيمات الفضة النانوية في نموذج KOA الناجم عن كولاجيناز II. أظهرت النتائج التجريبية أن الجسيمات النانوية الفضية قللت بشكل كبير من تضخم الغشاء الزليلي وتسلل العدلات في النسيج الزليلي. ومن ثم، فإن هذا العمل يبين تحديد استراتيجية جديدة للنفاذ المفتوح ويوفر أساسا نظريا لمنع تقدم عملية الوصول المفتوح.
Introduction
هشاشة العظام في الركبة (KOA) هي واحدة من أكثر أشكال هشاشة العظام شيوعا وتنطوي على عملية مرضية معقدة في المفصل الزليلي بأكمله1. مع شيخوخة سكان العالم تدريجيا ، يتزايد معدل الإصابة ب KOA بشكل كبير. عادة ما يدفع الألم المستمر في مفصل الركبة المرضى الذين يعانون من KOA إلى طلب العلاج الطبي. قد تكون مسببات الألم في KOA مرتبطة بالاستجابة الالتهابية ، وتضخم الغشاء الزليلي ، وتنكس الغضروف2. تتكون الأنسجة الزليلية من نوعين من الخلايا: الخلايا الليفية الزليلية والبلاعم3،4،5. تنتج الخلايا الليفية الزليلية السائل الزليلي. عادة ما تكون الضامة الزليلية نائمة ويتم تنشيطها عن طريق الاستجابة الالتهابية. الالتهاب الأولي للالغشاء الزليلي يسبب آلام مفصل الركبة6.
تلعب الاستجابة المناعية الالتهابية للنسيج الزليلي دورا حاسما في التسبب في KOA. أكدت الدراسات السابقة أن هناك استجابات التهابية في الأنسجة الزليلية في KOA، والمعروفة باسم التهاب الغشاء المفصلي، وترتبط درجة التهاب الغشاء المفصلي ل KOA ارتباطا وثيقا بتسلل الخلايا الالتهابية للأنسجة الزليلية7،8،9. التهاب الغشاء الزليلي هو رد فعل التهابي للغشاء الزليلي ، وخصائصه المرضية هي تكاثر الخلايا الزليلية ، وتشكيل الأوعية الدموية الجديدة ، وتسلل الخلايا الالتهابية5،10،11.
الهدف من علاج KOA هو تخفيف التفاعل الالتهابي للالغشاء الزليلي وتأخير تطور المرض. حاليا ، الأدوية السريرية الرئيسية لعلاج KOA هي العقاقير المضادة للالتهابات غير الستيرويدية (مضادات الالتهاب غير الستيروئيدية). ومع ذلك ، فإنها تظهر آثارا جانبية كبيرة ، مثل السمية الكلوية 12,13. حقن الجلوكوكورتيكويد داخل المفصل هي خيار آخر لعلاج KOA. ومع ذلك ، ينتشر الجلوكوكورتيكويد بسرعة ويمكن استقلابه بسرعة عن طريق الانصباب المشترك. وفي الوقت نفسه ، يجب على مرضى السكري الذين يعانون من ارتفاع السكر في الدم الأساسي توخي الحذر بشأن حقن الستيرويد المستمرة14. باختصار ، لا توجد استراتيجية علاجية دوائية متاحة ل KOA. لذلك ، فإن استكشاف أدوية جديدة لعلاج KOA أمر ملح للغاية.
حجم الجسيمات النانوية الفضية أقل من 100 نانومتر. نظرا لآثارها البارزة المضادة للالتهابات والمضادة للبكتيريا ومضادات الأكسدة ، فقد تم استخدامها على نطاق واسع في جوانب مختلفة من الرعاية الصحية والطب ، مثل التئام الجروح وإصابةالحروق 15,16. كما أنها تستخدم في توصيل الأدوية المستهدفة والتصوير الطبي والتشخيص الجزيئي17. الفضة (Ag) لها تأثير مضاد للالتهابات ومضاد للبكتيريا أكبر من الجسيمات النانوية المعدنية الأخرى ، مثل النحاس (Cu) والزنك (Zn) والحديد (Fe) 15. الجسيمات النانوية الفضية ، وهي نوع جديد من المواد النانوية ، لها خصائص مضادة للميكروبات واسعة الطيف وقوية. وجدت دراسة سابقة أنه في إصابات الحروق والتهاب الصفاقنماذجالفئران 18,19 ، يمكن للجسيمات النانوية الفضية أن تمنع بشكل فعال إنتاج العوامل الالتهابية وتعزز التئام الجروح. أظهرت دراسة سابقة أيضا أن جسيمات الفضة النانوية حسنت التئام جروح مرضى السكري من خلال تعزيز تخليق عوامل النمو وترسب الكولاجين20.
استنادا إلى التأثيرات المضادة للالتهابات لجسيمات الفضة النانوية ، كنا نهدف إلى استخدام جسيمات الفضة النانوية لعلاج النوع الثاني من KOA الناجم عن الكولاجين في الفئران. أشارت النتائج إلى أن عدد خلايا التسلل الالتهابية للمفصل الزليلي في الفئران قد انخفض بشكل كبير مع هذا العلاج. أشارت النتائج أيضا إلى أن جسيمات الفضة النانوية يمكن أن تخفف بشكل كبير من أعراض KOA في الفئران. لذلك ، قد يدعم تطبيق جسيمات الفضة النانوية تطوير خيارات علاجية جديدة ل KOA.
Protocol
تمت الموافقة على جميع الأعمال الحيوانية من قبل لجنة أخلاقيات ورعاية (AEWC) التابعة لمركز قوانغتشو للأبد الطبي لحيوانات المختبرات (2018-0186).
1. إنشاء نموذج الماوس KOA
- الحفاظ على الفئران BALB / c (18-24 جم ؛ 12-14 أسبوعا) في بيئة ذات رطوبة 70٪ وعند 26 درجة مئوية مع دورة ضوء / مظلمة تبلغ 12 ساعة. لهذه التجربة ، تم الحفاظ على في مركز قوانغتشو للأبد الطبي للحيوانات الحيوانية.
- استخدم الكولاجين من النوع الثاني لإنشاء نموذج ماوس KOA كما هو موضح سابقا21. قم بإجراء الحقن داخل المفصل كما هو موضح أدناه.
- تطبيق 2٪ بنتوباربيتال الصوديوم (40 ملغ/كغ) للتخدير والبوبرينورفين (0.05 ملغ/كغ، الحقن تحت الجلد) لتسكين العجوز. بعد ذلك ، قم بإصلاح أطراف الماوس بالشريط ، وإزالة الشعر باستخدام ماكينة الحلاقة ، وتطهيرها باستخدام فرك متناوب بنسبة 0.1٪ من اليودوفور والكحول ثلاث مرات.
- ارتد قفازات معقمة واستخدم مقصا معقما لكشف الجلد والأنسجة تحت الجلد والرباط تحت الرضفة بالتتابع. حافظ على منطقة الشق أقل من 0.5 سم.
ملاحظة: تم استخدام بطانية تدفئة للحفاظ على درجة حرارة جسم الفئران أثناء العملية. - استخدم حقنة أنسولين سعة 1 مل لحقن 10 وحدة من كولاجيناز من النوع الثاني من 30 ملغ/كغ (0.4 ملغ/مل) في تجويف المفصل (تحت الرباط تحت الرباط)22.
ملاحظة: يجب أن تكون الزاوية بين الإبرة والجلد حوالي 15 درجة ؛ بعد ذلك ، يجب تغيير اتجاه الإبرة ، ويجب سحب الإبرة تماما. - بعد الحقن ، خياطة الأنسجة تحت الجلد أولا ، ثم الجلد. تعقيم منطقة خياطة مع 0.1 ٪ اليودوفور. ضع الفئران في أقفاص جيدة التهوية (IVCs) بشكل منفصل بعد استيقاظها من التخدير.
2. تخليق الجسيمات النانوية الفضية
ملاحظة: تم وصف تحضير جسيمات الفضة النانوية سابقا بالتفصيل19. تتم عملية الصياغة بأكملها على الجليد. بعد التحضير ، يتم تخزين الخليط عند 4 درجات مئوية ؛ خلاف ذلك ، يصلب الخليط بسهولة في درجة حرارة الغرفة.
- أضف ما مجموعه 400 ميكرولتر من الكولاجين من النوع الأول (4 مجم / مل) إلى أنبوب طرد مركزي دقيق سعة 1.5 مل ، وضعه على الثلج.
- أضف ما مجموعه 200 ميكرولتر من محلول ملحي مخزن بالفوسفات (PBS) إلى الكولاجين أعلاه ، وامزج المحلول جيدا ، وضعه على الجليد.
- أخيرا ، أضف 400 ميكرولتر من جسيمات الفضة النانوية إلى المحلول أعلاه ، ثم اخلطها بشكل كاف. التركيز النهائي لمحلول الجسيمات النانوية هو 1 mM.
ملاحظة: يتراوح متوسط قطر جسيمات الفضة النانوية من 5 نانومتر إلى 15 نانومتر23. تم تأكيد ذلك بواسطة المجهر الإلكتروني.
3. معالجة الجسيمات النانوية الفضية لفئران KOA من النوع الثاني التي يسببها كولاجيناز
- إزالة الفئران KOA التي يسببها الكولاجين من النوع الثاني من أقفاصها 1 أسبوع في وقت لاحق ، وحقنها بالجسيمات النانوية الفضية. حقن الجسيمات النانوية الفضية مرة واحدة في الأسبوع ، وجمع العينات بعد 30 يوما.
- حقن ما مجموعه 2٪ بنتوباربيتال الصوديوم (الجرعة: 2 مل / كجم) للتخدير عن طريق الحقن داخل الصفاق ، ثم إصلاح الجلد وإعداده وتعقيمه كما هو موضح في الخطوات 1.2.
- ارتد قفازات معقمة واستخدم مقصا معقما لكشف الجلد والأنسجة تحت الجلد وأربطة الركبة بالتتابع.
- استخدم حقنة أنسولين سعة 1 مل ، وأدخل تجويف المفصل بزاوية 15 درجة بالإبرة. حقن ببطء ما يقرب من 20 ميكرولتر من خليط الكولاجين بالجسيمات النانوية الفضية ، وسحب الإبرة ببطء24.
- خياطة الأنسجة تحت الجلد والجلد بدوره ، وتعقيمها. ضع الفئران في أقفاص جيدة التهوية (IVC) بشكل منفصل بعد استيقاظها من التخدير.
- قم بإجراء هذا الحقن من خليط الكولاجين بالجسيمات النانوية الفضية (20 ميكرولتر) أربع مرات بمعدل مرة واحدة في الأسبوع.
ملاحظة: يجب حفظ الفئران المعالجة بخليط الكولاجين من الجسيمات النانوية الفضية في أقفاص فردية. قد يحدث قتال الفئران عندما يتم الحفاظ عليها معا ، وهذا من شأنه أن يؤثر على النتائج التجريبية. أثناء الحقن ، سيكون هناك شعور بالتوتر عندما تصل الإبرة إلى تجويف المفصل ، ويحدث تورم في مفصل الركبة بعد الحقن. يسمح الجمع بين هاتين الطريقتين للباحث بالتأكد من حقن الدواء بنجاح في مفصل الركبة.
4. جمع مفصل الركبة والأنسجة الزليلية
- التضحية بالفئران مع اختناق ثاني أكسيد الكربون أو أي بروتوكول آخر معتمد من قبل لجنة أخلاقيات ذات الصلة.
- تعقيم وتشريح الجلد والأنسجة تحت الجلد بالتتابع ، وكشف مفصل الركبة بالكامل.
- حصاد مفاصل الركبة ، بما في ذلك عظم الفخذ والساق ، وإزالة الأنسجة العضلية.
- اجمع أنسجة مفصل الركبة ، بما في ذلك عظم الفخذ والساق والأنسجة الرخوة المحيطة (الرباط والكبسولة) ، في 10٪ فورمالين للحفظ والتثبيت.
5. تلطيخ الهيماتوكسيلين يوزين
- بعد التثبيت بين عشية وضحاها ، قم بتضمين البارافين في الأقسام ، واستخدم ميكروتوم لقطع الأنسجة المضمنة في البارافين إلى سمك 0.4 ميكرومتر. استخدم الأقسام المعدة لمزيد من التلوين (تلطيخ الهيماتوكسيلين-يوزين ، Safranin O / Fast Green ، والتلوين المناعي الكيميائي (IHC)).
- قم بإزالة المقاطع مرتين باستخدام الزيلين ، ثم انقعها في 100٪ و 95٪ و 80٪ و 70٪ من الإيثانول بالتسلسل لمدة 5 دقائق لكل منها ، وأعد ترطيبها.
- تلطيخ المقاطع بالهيماتوكسيلين (0.1 جم / 100 مل) لمدة 5 دقائق ، ثم ضعها مباشرة في 1٪ حمض الهيدروكلوريك لمدة 10 ثوان ويوزين (0.5 جم / 100 مل) لمدة دقيقة واحدة.
- مراقبة التغيرات النسيجية المرضية للالغشاء الزليلي تحت المجهر.
6. سافرانين أو / فاست جرين
- قم بتضمين الأنسجة في البارافين ، وقم بإعداد الأقسام النسيجية كما هو موضح في الخطوة 5.1.
- قم بإزالة المقاطع مرتين باستخدام الزيلين ، وأعد ترطيبها بسلسلة إيثانول (مثل 100٪ و 95٪ و 80٪ و 70٪ إيثانول في الماء المقطر ، كل منها لمدة 5 دقائق).
- وصمة عار الأقسام المعدة مع الهيماتوكسيلين ، وغسلها مع برنامج تلفزيوني ثلاث مرات لمدة 2 دقيقة لكل منهما.
- فرق بين الأقسام مع الكحول حمض الهيدروكلوريك ، وغسلها مع برنامج تلفزيوني ثلاث مرات لمدة 2 دقيقة لكل منهما.
- اغمر الأقسام في محلول تلطيخ أخضر سريع بنسبة 0.02٪ لمدة 5-10 دقائق ، متبوعا بتلطيخ Safranin O بنسبة 0.1٪ لمدة 1-2 دقيقة.
- فرق بين الأقسام التي تحتوي على حمض الخليك بنسبة 1٪ ، متبوعا بغسل PBS.
- كشف وتحليل تكوين الغضروف الليفي في الأقسام.
7. تلطيخ كيميائي مناعي (IHC)
- قم بتضمين الأنسجة في البارافين ، وقم بإعداد الأقسام النسيجية كما هو موضح في الخطوة 5.1.
- قم بإزالة المقاطع مرتين باستخدام الزيلين ، وأعد ترطيبها بسلسلة إيثانول (مثل 100٪ و 95٪ و 80٪ و 70٪ إيثانول في الماء المقطر ، كل منها لمدة 5 دقائق). اغمر الأقسام في المخزن المؤقت Tris-EDTA (قاعدة Tris 10 mM ، محلول EDTA 1 mM ؛ درجة الحموضة 9.0) ، وقم بتسخينها في فرن ميكروويف على حرارة 95 درجة مئوية لمدة 10 دقائق لإجراء استرجاع المستضد.
- قم بتعريض الأقسام لمحلول بيروكسيد الهيدروجين بنسبة 3٪ لمدة 10 دقائق لإزالة البيروكسيديز الداخلي.
- عالج الأقسام بمصل الماعز بنسبة 5٪ لمنع الارتباط غير المحدد.
- أضف الأجسام المضادة الأولية المخففة (تخفيف 1: 1000) ضد CD177 ، واحتضانها طوال الليل عند 4 درجات مئوية. ثم اغسل الأقسام باستخدام برنامج تلفزيوني ثلاث مرات.
- نقع الأقسام مع برنامج تلفزيوني ، واحتضان الأقسام مع الجسم المضاد الثانوي المناسب (نظام مضاد للبوليمر المقترن HRP) لمدة 30 دقيقة في درجة حرارة الغرفة.
- إجراء تصور تلطيخ IHC باستخدام 3،3'-ديامينوبنزيدين (DAB) ككروموجين.
- عرض الأقسام تحت المجهر ، وتحليل الصور المكتسبة.
النتائج
تم تحفيز نموذج فأر KOA باستخدام كولاجيناز من النوع الثاني. بدءا من أسبوع واحد بعد تحريض النموذج ، تم حقن خليط الكولاجين النانوي الفضي المحضر في تجويف المفصل مرة واحدة في الأسبوع لمدة 4 أسابيع (الشكل 1). تمت ملاحظة أوزان الفئران في كل مجموعة وتسجيلها يوميا. أظهرت النتائج أن متوسط وزن جسم الفئران KOA كان أقل بكثير من وزن الفئران في المجموعة الضابطة العادية. ومع ذلك ، كان متوسط وزن الجسم للفئران في مجموعة كولاجيناز + AgNPs من النوع الثاني أعلى مقارنة بفئران KOA ، على الرغم من أن هذا الاختلاف لم يكن ذا دلالة إحصائية (الشكل 2). بعد 30 يوما ، تم جمع الأنسجة الزليلية لمفاصل الركبة من الفئران وخضعت للفحص المرضي. تم تحليل تضخم ، وانتشار الأوعية الدموية ، والتسلل الالتهابي للغشاء الزليلي ، وتلف الغضروف5،10،11. أظهرت النتائج أن السماكة الزليلية للفئران في مجموعة KOA كانت أعلى بكثير مقارنة بمجموعة التحكم العادية. في المجموعة المعالجة بخليط الكولاجين بالجسيمات النانوية الفضية ، تم تقليل سمك الغشاء الزليلي مقارنة بمجموعة KOA (الشكل 3). كان هناك تضخم الأوعية الدموية في الغشاء الزليلي للفئران KOA مقارنة بالمجموعة الضابطة الطبيعية ، وتم تقليل تضخم الأوعية الدموية بشكل كبير في الغشاء الزليلي للفئران المعالجة بخليط الكولاجين من الجسيمات النانوية الفضية (الشكل 4). أظهرت نتائج تلطيخ Safranin-O أن مصفوفة الغضروف لفئران KOA قد تم تدميرها ، بينما أظهرت الفئران المعالجة بخليط الكولاجين من الجسيمات النانوية الفضية مصفوفة غضروفية أفضل بكثير (الشكل 5). تم تقييم درجات السمات المورفولوجية في كل مجموعة كما هو موضح سابقا22. وكانت النتائج على النحو التالي: 0 ± 0 للمجموعة المالحة، 7 ± 0.63 لمجموعة الكولاجين من النوع الثاني، و 4.2 ± 1.17 لمجموعة كولاجيناز من النوع الثاني + AgNPs (الشكل 6). CD177 هو علامة العدلات الرئيسية25. يتم التعبير عن CD177 في 40 ٪ -60 ٪ من العدلات في ظل الظروف العادية. ومع ذلك ، فإن التعبير عن CD177 في العدلات يزيد بشكل كبير أثناء الالتهاب الحاد. أظهرت نتائج تلطيخ IHC أن العدلات المتسربة في المنطقة الزليلية قد انخفضت بشكل كبير في المجموعة المعالجة ب AgNPs مقارنة بمجموعة KOA (الشكل 7) ، مما يشير إلى أن العلاج باستخدام AgNPs يمكن أن يحسن أعراض KOA.
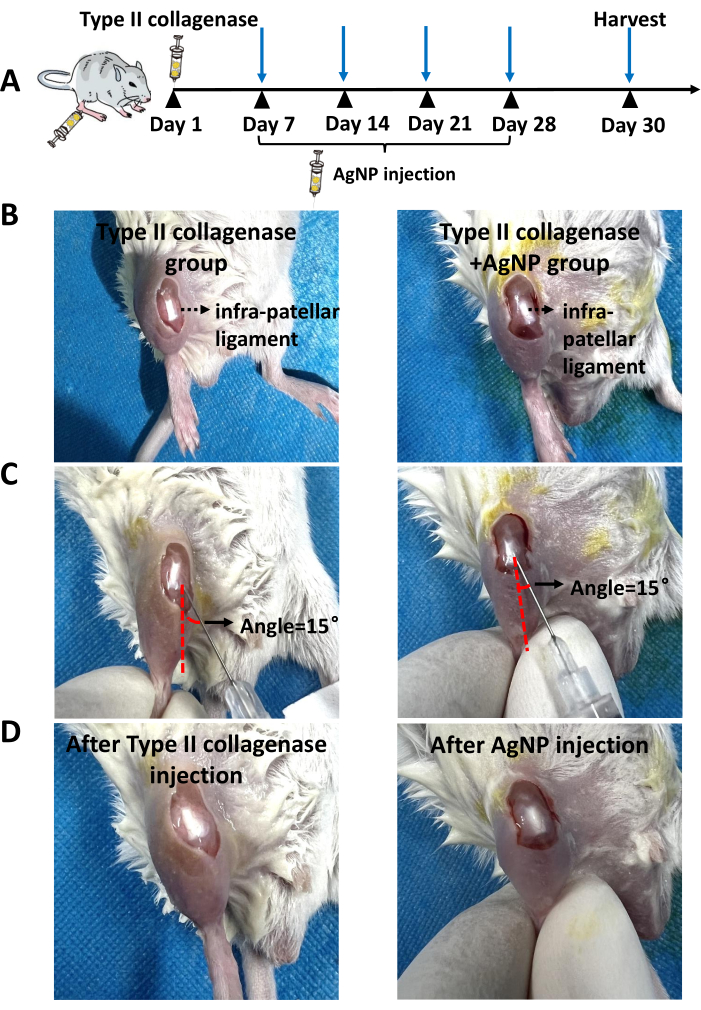
الشكل 1: موقع الحقن. أ: صور تمثيلية لحقن كولاجيناز من النوع الثاني. (ب) صور تمثيلية بعد حقن كولاجيناز من النوع الثاني. (ج) صور تمثيلية لحقن خليط الكولاجين بالجسيمات النانوية الفضية في نموذج فأر KOA. (د) صور تمثيلية بعد حقن خليط الكولاجين بالجسيمات النانوية الفضية في الفئران النموذجية KOA. يمثل الخط الأحمر المنقط الخط الموازي لأربطة ركبة الفأر. يمثل السهم الأسود الزاوية بين إبرة حقنة الأنسولين والجلد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تغيرات وزن جسم الفئران في كل مجموعة. توضح هذه اللوحة متوسط وزن الفئران في كل مجموعة في نقاط زمنية مختلفة. يشير المحور السيني إلى عدد الأيام بعد حقن الكولاجين من النوع الثاني ، ويشير المحور ص إلى تغير الطي في وزن الجسم. مجموعة المياه المالحة (ن = 7) ، مجموعة كولاجيناز النوع الثاني (ن = 5) ، كولاجيناز النوع الثاني + مجموعة AgNPs (ن = 5). * ص < 0.05. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
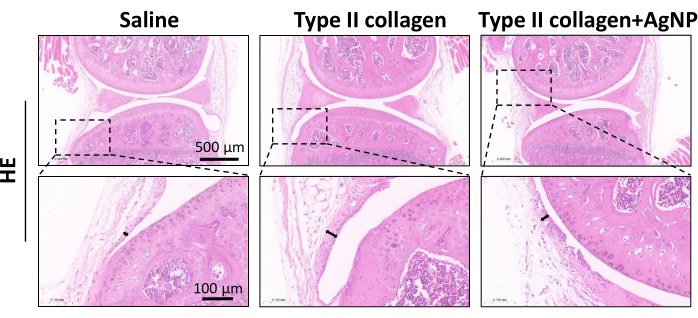
الشكل 3: تلطيخ الهيماتوكسيلين-يوزين (H&E) الذي يمثل فرط التنسج الزليلي. تم جمع الأنسجة الزليلية في كل مجموعة من الفئران وتثبيتها وتقطيعها وتلطيخها ب H&E بعد 30 يوما من الجراحة. تمثل الأسهم المزدوجة السماكة الزليلية المكتشفة. شريط المقياس = 0.1 مم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: صورة تمثيلية لتضخم الأوعية الدموية حول الزليلي. تشير الأسهم إلى الأوعية. شريط المقياس = 0.05 مم. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
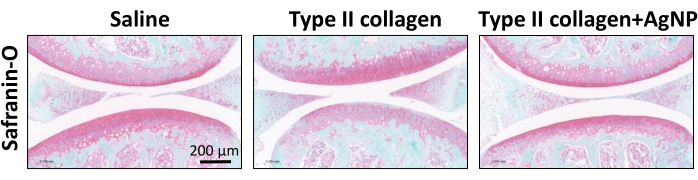
الشكل 5: تلطيخ Safranin-O لمفصل الركبة في كل مجموعة من الفئران. شريط المقياس = 0.2 مم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: درجات المعالم المورفولوجية في كل مجموعة. تم استخدام النسيج الزليلي لقياس درجة الميزة المورفولوجية للفئران في كل مجموعة. تم اختيار خمسة أقسام نسيجية في كل مجموعة لتحليل درجة تضخم / تضخم طبقة خلية البطانة الزليلية ، ودرجة تسلل العدلات في النسيج الزليلي ، ودرجة تنشيط السدى الزليلي (الجدول 1). تم استخدام متوسط القيمة كنتيجة نهائية. ** p < 0.01 و ***p < 0.001 مع اختبار t للطالب لكل مجموعة مقارنة بمجموعة KOA غير المعالجة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
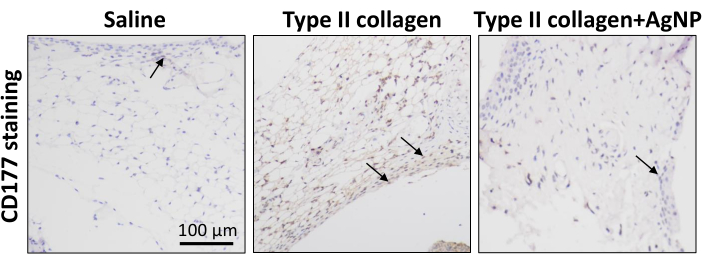
الشكل 7: التلوين الكيميائي النسيجي المناعي لعلامة العدلات في النسيج الزليلي في كل مجموعة من الفئران. تم استخدام تلطيخ كيميائي مناعي للكشف عن التعبير عن علامة العدلات CD177 في النسيج الزليلي للفئران في كل مجموعة. تشير الأسهم إلى العدلات. شريط المقياس = 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
الجدول 1: تسجيل السمات المورفولوجية. الرجاء الضغط هنا لتنزيل هذا الجدول.
Discussion
تظهر جسيمات الفضة النانوية تأثيرات مضادة للالتهابات ومضادة للبكتيريا ومضادة للأكسدة ومناعية ، مما يعني أنها يمكن أن تحمي الخلايا والأنسجة من التلف عن طريق تقليل إنتاج أنواع الأكسجين التفاعلية26. يشعر بعض الباحثين بالقلق إزاء سمية جسيمات الفضةالنانوية 27. ترتبط سمية جسيمات الفضة النانوية ارتباطا مباشرا بوجود أيونات الفضة الحرة. نظرا للحجم النانوي لجسيمات الفضة النانوية ، يمكن أن تتداخل بسهولة مع الجزيئات الحيوية والخلايا والأعضاء البشرية15،28،29. أفادت العديد من الدراسات أن جسيمات الفضة النانوية يمكن أن تحفز الإجهاد التأكسدي وتضعف وظيفة الميتوكوندريا في الخلايا البشرية30. بالإضافة إلى ذلك ، يمكن اكتشاف Ag في الأعضاء البشرية ، وخاصة في الكبد والطحال ، بعد استخدام كميات كبيرة من جزيئات الفضة النانوية. أفاد الباحثون أيضا أن الجسيمات النانوية الفضية لديها القدرة على عبور الحاجز الدموي الدماغي عبر النقل عبر المشبكي وتتراكم في الدماغ31. لم يتم إجراء تقرير منهجي عن السمية الحيوية لجسيمات الفضة النانوية ، على الرغم من أن بعض الباحثين يعترفون بسلامة جسيمات الفضةالنانوية 32.
في هذه الدراسة ، قمنا بإعداد خليط الكولاجين من الجسيمات النانوية الفضية. في الواقع ، فإن فترة مدة جسيمات الفضة النانوية في الأنسجة البشرية قصيرة ، ولكن يمكن إطالة فترة مدة جسيمات الفضة النانوية عند تطبيقها بمزيج الكولاجين. هذا لا يقلل فقط من الصدمة ولكن أيضا من جرعة الأدوية. بالنظر إلى سمية جسيمات الفضة النانوية ، كانت جرعة جسيمات الفضة النانوية المطبقة في هذه الدراسة 30 مجم / كجم ، بما يتماشى مع البحث السابق33.
بعض الاعتبارات الحيوية للعملية التجريبية هي كما يلي. يجب تخزين كولاجيناز النوع الثاني عند -20 درجة مئوية بعد التحضير لمنع التدهور بسبب الانقسام الأنزيمي. يجب أن يتم تحضير خليط الكولاجين بالجسيمات النانوية الفضية على الثلج بشكل مستمر في درجة حرارة الغرفة لأن خليط الكولاجين بالجسيمات النانوية الفضية يصبح هلاما شبه صلب بسرعة ومن ثم لا يمكن استخدامه للحقن. يجب تخزين المحلول عند 4 درجات مئوية بعد التحضير. يجب اختيار حقنة أنسولين سعة 1 مل بإبرة أصغر للإعطاء داخل المفصل ، وهذا يمكن أن يمنع بشكل فعال تسرب الأدوية المحقونة. يجب إدخال الإبرة بزاوية 15 درجة لحقن خليط الكولاجين بالجسيمات النانوية الفضية. عندما تكون الإبرةغير مقاومة ، فهذا يشير إلى أن الإبرة قد وصلت إلى تجويف مفصل الركبة. بعد الحقن ، يجب تغيير زاوية الحقن ، ويجب سحب الإبرة ببطء لتجنب تسرب الدواء المحقون.
في هذه الدراسة ، حسنت جسيمات الفضة النانوية بشكل فعال أعراض KOA الناجم عن الكولاجين من النوع الثاني في الفئران ، مما يدل على التأثير المضاد للالتهابات لجسيمات الفضة النانوية. أفادت العديد من الدراسات بوجود موت الخلايا المبرمج في الخلايا المحتضنة في المختبر بجسيمات الفضةالنانوية 34،35،36. يمكن أن يكون الانخفاض في تضخم الغشاء الزليلي ناتجا عن جسيمات الفضة النانوية بسبب تورطها في ضعف وظيفة الميتوكوندريا ، أو ربما تم التوسط في هذه النتائج بواسطة أنواع الأكسجين التفاعلية. لوحظ تضخم الأوعية الدموية في الغشاء الزليلي للفئران في مجموعة نموذج KOA. كان من الممكن أن تكون الكيموكينات قد دفعت العدلات من الأوعية الدموية إلى الأنسجة الزليلية خلال هذه العملية وأن انفجار الالتهاب تسبب في استهلاك الخلايا لمزيد من الأكسجين ، مما أدى إلى تضخم الأوعية الدموية. وبالتالي ، هناك حاجة إلى مزيد من التجارب لإثبات موثوقية هذه الفرضية. تقدم هذه الدراسة فوائد نظرية للبحث في علاج KOA. في الدراسات المستقبلية ، نهدف إلى الجمع بين طريقة الرباط الصليبي الأمامي (ACL) جنبا إلى جنب مع طريقة نموذج KOA المستحث كيميائيا لمراقبة تأثير جسيمات الفضة النانوية. تظهر النتائج التجريبية أن جسيمات الفضة النانوية يمكن أن تقلل بشكل كبير من تسلل الخلايا الالتهابية في الغشاء الزليلي في فئران KOA ، لكن آليات هذا التأثير لا تزال بحاجة إلى مزيد من الدراسة ، والتي قد تكشف عن التسبب في KOA.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
تم تمويل هذا العمل من قبل مؤسسة العلوم الطبيعية بمقاطعة قوانغدونغ (الرقم: 2019A1515010209) ومشروع العلوم والتكنولوجيا في مدينة قوانغتشو ، الصين (الرقم: 202102010164).
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL insulin syringe | BD | 305932 | None |
| CD177 Polyclonal Antibody | ThermoFisher Scientific | PA5-98759 | None |
| Chloral hydrate | Sigma-Aldrich | 302-17-0 | None |
| DAB | MCE | HY-15912 | None |
| Eosin | Beyotime Biotechnology | C0109 | None |
| Formalin | Sigma-Aldrich | HT501128 | None |
| Hematoxylin | Beyotime Biotechnology | C0107 | None |
| Light Microscopy | Leica | DM500 | None |
| Silver nanoparticle | Wolcacvi | S-10-20 | Store product in the dark at 4°C |
| Safranine O-Fast Green FCF Cartilage Stain Kit | Solarbio | 90-15-3 | None |
| Type II collagen | Sigma-Aldrich | C6885-500mg | None |
References
- Kuyinu, E. L., Narayanan, G., Nair, L. S., Laurencin, C. T. Animal models of osteoarthritis: Classification, update, and measurement of outcomes. Journal of Orthopaedic Surgery and Research. 11, 19(2016).
- Kraus, V. B., Blanco, F. J., Englund, M., Karsdal, M. A., Lohmander, L. S. Call for standardized definitions of osteoarthritis and risk stratification for clinical trials and clinical use. Osteoarthritis and Cartilage. 23 (8), 1233-1241 (2015).
- Smith, M. D. The normal synovium. Open Rheumatology Journal. 5, 100-106 (2011).
- de Sousa, E. B., Casado, P. L., Moura, N. V., Duarte, M. E., Aguiar, D. P. Synovial fluid and synovial membrane mesenchymal stem cells: Latest discoveries and therapeutic perspectives. Stem Cell Research and Therapy. 5 (5), 112(2014).
- Scanzello, C. R., Goldring, S. R. The role of synovitis in osteoarthritis pathogenesis. Bone. 51 (2), 249-257 (2012).
- Glyn-Jones, S., et al. Osteoarthritis. Lancet. 386 (9991), 376-387 (2015).
- Roemer, F. W., et al. Presence of MRI-detected joint effusion and synovitis increases the risk of cartilage loss in knees without osteoarthritis at 30-month follow-up: The MOST study. Annals of Rheumatic Diseases. 70 (10), 1804-1809 (2011).
- Furman, B. D., et al. Articular ankle fracture results in increased synovitis, synovial macrophage infiltration, and synovial fluid concentrations of inflammatory cytokines and chemokines. Arthritis and Rheumatology. 67 (5), 1234-1239 (2015).
- Ayral, X., Pickering, E. H., Woodworth, T. G., Mackillop, N., Dougados, M. Synovitis: A potential predictive factor of structural progression of medial tibiofemoral knee osteoarthritis -- Results of a 1 year longitudinal arthroscopic study in 422 patients. Osteoarthritis and Cartilage. 13 (5), 361-367 (2005).
- Henrotin, Y., Lambert, C., Richette, P. Importance of synovitis in osteoarthritis: Evidence for the use of glycosaminoglycans against synovial inflammation. Seminars in Arthritis and Rheumatism. 43 (5), 579-587 (2014).
- Liu-Bryan, R. Synovium and the innate inflammatory network in osteoarthritis progression. Current Rheumatology Reports. 15 (5), 323(2013).
- Towheed, T., Shea, B., Wells, G., Hochberg, M. Analgesia and non-aspirin, non-steroidal anti-inflammatory drugs for osteoarthritis of the hip. Cochrane Database of Systematic Reviews. (2), (2000).
- Co, C. M., et al. Click chemistry-based pre-targeting cell delivery for cartilage regeneration. Regenerative Biomaterials. 8 (3), (2021).
- Oo, W. M., Liu, X., Hunter, D. J. Pharmacodynamics, efficacy, safety and administration of intra-articular therapies for knee osteoarthritis. Expert Opinion on Drug Metabolism and Toxicology. 15 (12), 1021-1032 (2019).
- Morozova, O. V. Silver nanostructures: Limited sensitivity of detection, toxicity and anti-inflammation effects. International Journal of Molecular Sciences. 22 (18), 9928(2021).
- He, M., et al. A pH-responsive mesoporous silica nanoparticles-based drug delivery system with controlled release of andrographolide for OA treatment. Regenerative Biomaterials. 8 (4), (2021).
- Samuel, M. S., Jose, S., Selvarajan, E., Mathimani, T., Pugazhendhi, A. Biosynthesized silver nanoparticles using Bacillus amyloliquefaciens; Application for cytotoxicity effect on A549 cell line and photocatalytic degradation of p-nitrophenol. Journal of Photochemistry and Photobiology B. 202, 111642(2020).
- Liu, X., et al. Silver nanoparticles mediate differential responses in keratinocytes and fibroblasts during skin wound healing. ChemMedChem. 5 (3), 468-475 (2010).
- Tian, J., et al. Topical delivery of silver nanoparticles promotes wound healing. ChemMedChem. 2 (1), 129-136 (2007).
- Vendidandala, N. R., et al. Gallocatechin-silver nanoparticle impregnated cotton gauze patches enhance wound healing in diabetic rats by suppressing oxidative stress and inflammation via modulating the Nrf2/HO-1 and TLR4/NF-kappaB pathways. Life Sciences. 286, 120019(2021).
- Kikuchi, T., Sakuta, T., Yamaguchi, T. Intra-articular injection of collagenase induces experimental osteoarthritis in mature rabbits. Osteoarthritis and Cartilage. 6 (3), 177-186 (1998).
- Lorenz, J., Grässel, S. Experimental osteoarthritis models in mice. Methods in Molecular Biology. 1194, 401-419 (2014).
- Zhao, Z., et al. Design and synthesis of Ag NPs/chitosan-starch nano-biocomposite as a modern anti-human malignant melanoma drug. International Journal of Biological Macromolecules. 236, 123823(2023).
- Ahmed, E., et al. Decellularized extracellular matrix-rich hydrogel-silver nanoparticle mixture as a potential treatment for acute liver failure model. Journal of Biomedical Materials Research Part A. 108 (12), 2351-2367 (2020).
- Bai, M., et al. CD177 modulates human neutrophil migration through activation-mediated integrin and chemoreceptor regulation. Blood. 130 (19), 2092-2100 (2017).
- Singh, D., Chaudhary, D., Kumar, V., Verma, A. Amelioration of diethylnitrosamine (DEN) induced renal oxidative stress and inflammation by Carissa carandas embedded silver nanoparticles in rodents. Toxicology Reports. 8, 636-645 (2021).
- Singh, N., et al. NanoGenotoxicology: The DNA damaging potential of engineered nanomaterials. Biomaterials. 30 (23-24), 3891-3914 (2009).
- Noronha, V. T., et al. Silver nanoparticles in dentistry. Dental Materials. 33 (10), 1110-1126 (2017).
- Ahamed, M., Alsalhi, M. S., Siddiqui, M. K. Silver nanoparticle applications and human health. Clinica Chimica Acta. 411 (23-24), 1841-1848 (2010).
- Palacios-Hernandez, T., et al. cellular uptake and apoptotic responses in human coronary artery endothelial cells exposed to ultrasmall superparamagnetic iron oxide nanoparticles. Journal of Applied Toxicology. 40 (7), 918-930 (2020).
- Lebda, M. A., et al. Potential role of alpha-lipoic acid and Ginkgo biloba against silver nanoparticles-induced neuronal apoptosis and blood-brain barrier impairments in rats. Life Sciences. 212, 251-260 (2018).
- Yin, I. X., et al. The antibacterial mechanism of silver nanoparticles and its application in dentistry. International Journal of Nanomedicine. 15, 2555-2562 (2020).
- Kim, Y. S., et al. Subchronic oral toxicity of silver nanoparticles. Particle and Fibre Toxicology. 7, 20(2010).
- Pascarelli, N. A., et al. Effects of gold and silver nanoparticles in cultured human osteoarthritic chondrocytes. Journal of Applied Toxicology. 33 (12), 1506-1513 (2013).
- Braydich-Stolle, L. K., et al. Silver nanoparticles disrupt GDNF/Fyn kinase signaling in spermatogonial stem cells. Toxicological Sciences. 116 (2), 577-589 (2010).
- Eom, H. J., Choi, J. p38 MAPK activation, DNA damage, cell cycle arrest and apoptosis as mechanisms of toxicity of silver nanoparticles in Jurkat T cells. Environmental Science and Technology. 44 (21), 8337-8342 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved