Method Article
Dois métodos de descascamento para o isolamento de compartimentos celulares fotorreceptor na retina do rato para análise de proteínas
Neste Artigo
Resumo
Este protocolo apresenta duas técnicas para isolar os compartimentos subcelulares de fotorreceptores de haste murina para análise de proteínas. O primeiro método utiliza papel filtro de retina viva e celulose para separar segmentos externos da haste, enquanto o segundo emprega retina liofilizada e fita adesiva para descascar camadas internas e externas do segmento.
Resumo
Os fotorreceptores de rod são neurônios sensoriais altamente polarizados com compartimentos distintos. As hastes do mouse são longas (~80 μm) e finas (~2 μm) e são embaladas lateralmente na camada mais externa da retina, a camada fotorreceptora, resultando no alinhamento de compartimentos subcelulares análogos. Tradicionalmente, a seção tangencial da retina congelada montada plana tem sido usada para estudar o movimento e a localização de proteínas dentro de diferentes compartimentos de vara. No entanto, a alta curvatura da retina do rato dominante da haste torna a seção tangencial desafiadora. Motivados pelo estudo do transporte de proteínas entre compartimentos, desenvolvemos dois métodos de descascamento que isolam de forma confiável o segmento externo da haste (ROS) e outros compartimentos subcelulares para manchas ocidentais. Nossas técnicas relativamente rápidas e simples fornecem frações enriquecidas e subcelulares específicas para medir quantitativamente a distribuição e redistribuição de importantes proteínas fotorreceptoras em hastes normais. Além disso, essas técnicas de isolamento também podem ser facilmente adaptadas para isolar e investigar quantitativamente a composição proteica de outras camadas celulares dentro da retina saudável e degenerada.
Introdução
As células fotorreceptoras de rod, bem embaladas na camada mais externa da retina neural, são parte integrante da visão de luz fraca. Para funcionar como contadores de fótons fiéis, as hastes utilizam uma via de sinalização baseada em proteína G, denominada fototransdução, para gerar respostas rápidas, amplificadas e reprodutíveis à captura de fótons únicos. Esta resposta à luz finalmente desencadeia uma mudança na correnteza na membrana plasmática e é posteriormente sinalizada para o resto do sistema visual1. Como o nome indica, cada célula de haste tem uma forma distinta semelhante a uma haste e exibe uma morfologia celular altamente polarizada, consistindo de um segmento externo (OS), segmento interno (IS), corpo celular (CB) e terminal sináptico (ST). Cada compartimento subcelular possui máquinas proteicas específicas (ligadas à membrana e solúveis), características biomoleculares e complexos proteicos que desempenham papéis cruciais, como fototransdução visual, limpeza geral e síntese de proteínas, e transmissão sináptica2,3.
Há mais de 30 anos, o movimento recíproco dependente da luz de proteínas subcelulares, especificamente transdutina (longe do SO) e preso (em direção ao SO), foi observado pela primeira vez4,5,6,7. No início, esse fenômeno observado foi recebido com ceticismo, devido, em parte, à vulnerabilidade da imunohistoquímica ao mascaramento de epítope8. No início dos anos 2000, a translocação de proteínas dependentes de estímulos foi confirmada por meio de uma rigorosa e árdua técnica de secção física9. A seção tangencial serial da retina de roedores congelados, seguida de imunoblotting, revelou que transducin9,10, prende em 11,12, e recupera em 13 todos passam por redistribuição subcelular em resposta à luz. Acredita-se que a translocação leve dessas proteínas de sinalização chave não só regula a sensibilidade da cascata de fototransdução9,14,15, mas também pode ser neuroprotetora contra danos leves16,17,18. Como o transporte de proteínas leve em hastes parece ser muito significativo para a biologia celular e fisiologia, técnicas que permitem o isolamento de diferentes compartimentos subcelulares para determinar a distribuição de proteínas são ferramentas valiosas de pesquisa.
Atualmente, existem alguns métodos que visam isolar os compartimentos subcelulares da haste. No entanto, esses métodos podem ser longos e difíceis de reproduzir, ou requerem uma quantidade considerável de isolamento da retina. As preparações do segmento externo de rod (ROS) através da centrifugação gradiente de densidade19, por exemplo, é comumente usada para separar o ROS do homogeneato da retina. Este método é amplamente utilizado para a mancha ocidental, mas o procedimento é muito demorado e requer um mínimo de 8-12 retinas murinas20. Por outro lado, a secção tangencial serial da retina congelada de murina e rato foi implementada com sucesso na isolação do SO, IS, CB e ST9,11,13. No entanto, este método é tecnicamente desafiador devido à necessidade de achatar totalmente a pequena e altamente curvada retina murina para alinhar as camadas de retina antes da seção tangencial. Como há uma infinidade de modelos de camundongos e camundongos transgênicos recapitulando doenças do sistema visual, a criação de uma técnica que separa de forma confiável, rápida e fácil os compartimentos individuais de hastes é promissora na revelação dos processos fisiológicos que ocorrem em cada compartimento especializado e dos mecanismos que fundamentam os processos visuais em saúde e doença.
Para facilitar essas investigações, descrevemos dois métodos de descascamento que isolam compartimentos subcelulares de haste mais facilmente do que os protocolos atuais. O primeiro método de peeling, adaptado de uma técnica para expor células bipolares fluorescentes rotuladas para gravação de grampo de remendo21, emprega papel filtro de celulose para remover sequencialmente o ROS de uma retina murina viva e isolada (Figura 1). O segundo método, adaptado de um procedimento que isola as três camadas primárias das células da retina de uma retina de 22 e sapo, utiliza fita adesiva para remover o segmento interno de ROS e haste (RIS) de uma retina liofilizada (Figura 2). Ambos os procedimentos podem ser concluídos em 1h e são consideravelmente fáceis de usar. Fornecemos validação da eficácia desses dois protocolos de separação para a mancha ocidental utilizando retinas adaptadas à escuridão e expostas à luz de camundongos C57BL/6J para demonstrar translocação induzida pela luz de transduína de haste (GNAT1) e arrestin (ARR1). Além disso, usando o método de descascamento de fita, fornecemos evidências adicionais de que nossa técnica pode ser usada para examinar e abordar inconsistências entre dados de localização de proteínas adquiridos pela imunocitoquímica (ICC) e manchas ocidentais. Especificamente, nossa técnica mostrou que: 1) a isoforma proteína quinase C-alfa (PKCα) está presente não apenas em células bipolares, mas também em murine ROS e RIS, embora em baixas concentrações24,25, e 2) rhodopsin quinase (GRK1) está presente predominantemente na amostra isolada do SO. Esses dados demonstram a eficácia de nossas duas técnicas de descascamento para separar e quantificar proteínas específicas de vara e retina.
Protocolo
Todos os experimentos foram realizados de acordo com as diretrizes institucionais locais do comitê de pesquisa em cuidados com animais da Universidade do Sul da Califórnia (USC).
1. Método de peeling de retina de células vivas
- Preparação dos buffers de Ames, papéis descascando e prato de dissecção
- Utilizando uma tesoura de íris de ponta cega (ou tipo de tesoura equivalente), corte o papel filtro de celulose (Grau 413) em retângulos medindo aproximadamente 5 mm x 2,5 mm. Armazene as estacas para uso futuro.
- Prepare 1 L do buffer HEPES da Ames combinando uma garrafa de Ames'Medium, 2,38 g HEPES e 0,877 g de NaCl. Dissolva os reagentes em uma garrafa de vidro estéril com água ultrauso destilada e ajuste a osmolaridade e pH para 280 mOsm e 7,4, respectivamente. Filtrar para esterilizar (tamanho de poros 0,2 μm), selar a tampa com filme de parafina e armazenar a 4 °C.
- Prepare 1 L do tampão de bicarbonato da Ames combinando uma garrafa de Ames's Medium e 1,9 g de NaHCO3. Dissolva os reagentes em uma garrafa de vidro estéril com água ultrauso destilada e ajuste a osmolaridade e pH para 280 mOsm e 7,4, respectivamente. Filtrar para esterilizar (tamanho de poros 0,2 μm), selar a tampa com filme de parafina e armazenar a 4 °C.
NOTA: Os buffers de bicarbonato de AMES e Ames podem ser preparados com antecedência e armazenados por 1 semana a 4 °C. - Na parte inferior de uma placa de Petri de 35 x 10 mm, crie um padrão de treliça ou dama de bico com um bisturi (lâmina nº 11, 40 mm).
NOTA: O fundo texturizado da placa de Petri mantém o olho isolado e flutuante no lugar durante a dissecção da retina.
- Dissecção da retina
NOTA: Para este procedimento, o tampão deve ser trazido e mantido em temperatura ambiente (RT). Atualize o tampão de bicarbonato dos Ames a cada 15 minutos com o tampão de bicarbonato de Ames carbogenado fresco durante a dissecção. Isso mantém o pH fisiológico necessário.- Cerca de 15-20 minutos antes da dissecação, oxigene o buffer HEPES dos Ames em um laboratório de 100 mL ou garrafa de mídia equipada com um adaptador de tampa de tubulação e bolha do tampão bicarbonato ames com 95% de O2 e 5% de CO2 em uma câmara de incubação de tecidos e em um laboratório de 100 mL ou garrafa de mídia equipada com um adaptador de tampa de tubo.
- Eutanize um número igual de ambos os sexos de camundongos C57BL/6J (2-3 meses de idade) seja por inalação de isoflurane ou dióxido de carbono (CO2) seguido de luxação cervical. Enuclear os olhos com tesouras curvas e colocar os olhos na placa de Petri texturizada de 35 x 10 mm cheia de tampão bicarbonato de Ames borbulhado.
- Crie um copo ocular (Figura 1A) perfurando um buraco na junção córnea-limbus com uma agulha de 18 G. Corte ao longo do perímetro desta junção usando uma tesoura de íris de micro dissecção para remover a córnea de cada olho. Separe a lente e o humor vítreo de cada olho usando pinças e descarte.
- Isole a retina do copo ocular descascando cuidadosamente o epitélio pigmentado da retina (RPE)-esclera-coroide do complexo da retina neural. Descarte o complexo RPE-eclera-coroide. Certifique-se de que a retina não está danificada durante a dissecção, manuseando apenas as bordas.
- Transfira retina isolada usando uma pipeta de transferência de furo largo para a tampa de um prato de 60 x 15 mm cheio de tampão bicarbonato de Ames borbulhado.
- Oriente o côncavo de retina em forma de hemisfério (os fotorreceptores estão voltados para baixo em direção ao fundo do prato) e bissecte cada retina (através do nervo óptico) usando uma tesoura de íris ou um bisturi (lâmina nº 10, 40 mm). Corte as bordas curvas de cada meia retina para fazer dois retângulos (Figura 1A).
NOTA: Minimizar a curvatura de cada retina pela metade permite que a retina se achate melhor em etapas subsequentes de descascamento e produz uma casca precisa da camada do segmento externo da haste (ROS). - Armazene a retina pela metade na câmara de incubação de tecidos que é continuamente borbulhada com 95% de O2 e 5% de CO2.
NOTA: A retina isolada pode ser mantida no tampão de bicarbonato de Ames carbogenado por ~24 h.
- Coleção do segmento externo da haste (ROS) por descascamento de papel filtrante
NOTA: Refresque o tampão HEPES de Ames oxigenado a cada 15-20 minutos durante o processo de descascamento para manter o pH fisiológico necessário.- Transfira um retângulo de retina da câmara de tecido com uma pipeta de transferência de furo largo e um papel filtro de 5 mm x 2,5 mm em uma placa de Petri de 35 x 10 mm cheia de tampão HEPES da Ames com 100% de O2.
- Oriente a retina particionada côncave para cima e certifique-se de que os fotorreceptores estão voltados para baixo em direção ao fundo do prato. Segure levemente os lados da retina pela metade com pinças e mova-a em cima do papel do filtro. Uma vez que a retina esteja centrada no papel do filtro, mova o papel do filtro para cima para que a retina pela metade toque no papel do filtro para criar a adesão do papel ROS-to-filter (Figura 1B).
NOTA: Certifique-se de que a camada do fotorreceptor faça contato direto com o papel do filtro. - Levante cuidadosamente o papel do filtro com a retina anexada do tampão HEPES dos Ames. Coloque o lado inferior do papel filtro (o lado sem a retina) em uma toalha de papel e dab 2-3 vezes para secar (Figura 1B).
- Adicione uma gota de HEPES de Ames na lateral do papel filtro com a retina. Coloque o papel filtro sobre a toalha de papel novamente para secar, como apenas descrito. Repita este processo mais duas vezes.
- Coloque o papel filtro com a retina de volta na placa de Petri. Usando pinças, empurre suavemente todas as bordas da retina pela metade para cima e para longe do papel filtro em todos os lados.
- Descasque delicadamente a retina do papel filtro. Toque apenas o perímetro extremo da retina durante o processo de descascamento para preservar a integridade estrutural da retina.
- Retire o papel filtro da placa de Petri e remova o excesso de líquido em uma toalha de papel. Certifique-se de que o lado que esteve em contato com a retina não entre em contato com a toalha de papel.
- Coloque o papel filtro com a camada ROS parcial em um tubo rotulado no gelo (Figura 1B). Mantenha a retina descascada submersa no tampão HEPES de Ames.
- Repita o processo de descascamento desta retina pela metade aproximadamente 7-8 vezes para remover toda a camada ROS. Após cada casca, coloque o papel filtro no mesmo tubo, que conterá o ROS isolado de uma retina pela metade.
NOTA: Tome cuidado para não rasgar a retina pela metade ao descascá-la do papel filtro, pois a retina fica mais fina durante esse processo. - Coloque o tubo contendo todas as cascas de papel filtro da ROS isolada no gelo para uso imediato ou congele diretamente em gelo seco e armazene a -80 °C.
- Use pinças para transferir as sobras de retina descascada (sem ROS) em um tubo apropriadamente rotulado. Coloque o tubo no gelo para uso imediato ou congele com gelo seco e armazene a -80 °C.
- Repita o processo de descascamento de cada retina pela metade e rotule com precisão cada tubo.
2. Método de peeling de retina lyophilizado
- Tampões, meio descascamento, preparação de pratos de dissecção e configuração de liofilizador
- Em uma garrafa de armazenamento de 1 L, prepare a solução do Ringer adicionando 500 mL de água ultrapura destilada. Dissolva os reagentes para atingir uma concentração final de 130 mM NaCl, 3,6 mM KCl, 2,4 mM MgCl2, 1,2 mM CaCl2, 10 mM HEPES e 0,02 mM EDTA. Ajuste o pH para 7.4 com NaOH, adicione água ultrauso para levar o volume final a 1 L e ajuste a osmolaridade para 313 mOsm.
- Antes do uso, filtre a solução do Ringer com um filtro estéril (tamanho de poros 0,2 μm), sele a tampa com filme de parafina e armazene a 4 °C.
- Usando uma tesoura de íris de ponta cega (ou tipo de tesoura equivalente), corte o papel do filtro de celulose em retângulos medindo aproximadamente 5 mm x 2,5 mm. Use um lápis para escrever em um lado do papel filtro para criar uma etiqueta única.
- Crie um padrão de rede ou placa de xadrez na parte inferior de uma placa de Petri de 35 x 10 mm usando um bisturi (lâmina nº 11, 40 mm).
- Ligue o liofilizado de acordo com as especificações do fabricante.
- Adquira nitrogênio líquido em um frasco de de guerra ou frasco de vácuo isolante similar.
- Dissecção de retina
- Completar a dissecção da retina conforme descrito na seção 1 do protocolo (Figura 1A). Use a solução de Ringer fria em vez do buffer de Ames.
- Pós-dissecção, armazene a retina retangular pela metade em uma placa de Petri de 35 x 10 mm cheia de solução fria de Ringer e coloque no gelo.
- Preparação da amostra de retina para liofilização
- Coloque um pedaço de 5 x 2,5 mm de papel filtro e transfira uma retina pela metade para a placa de Petri texturizada de 35 x 10 mm cheia com tampão de Ringer frio. Use uma pipeta de transferência de furo largo para mover cada retina entre os pratos.
- Use pinças para virar cuidadosamente a retina para que ela seja orientada côncava para cima (os fotorreceptores estão apontando para cima) e movê-la para que ela repouse em cima do papel filtro (Figura 2A).
NOTA: Certifique-se de que os fotorreceptores não entrem em contato com o papel do filtro (a camada de célula de gânglio da retina deve estar em contato direto com o papel do filtro) e o rótulo único é visível. Para identificar de forma fácil e rápida o isolado da retina, recomenda-se que o rótulo único esteja localizado na parte inferior do papel filtro. - Levante o papel do filtro pelas bordas para cima para que o pedaço de retina pela metade toque no papel do filtro e continue a levantar o papel do filtro da solução do Ringer.
- Coloque o lado inferior do papel do filtro (o lado sem a retina sobre ele) sobre uma toalha de papel e cuidadosamente dab 2-3 vezes para remover o excesso de líquido (Figura 2A).
- Pegue o papel filtro com pinças e adicione uma gota de ringer frio na lateral do papel do filtro com a retina. Coloque novamente o papel filtro sobre a toalha de papel para remover o excesso de líquido. Repita o processo mais duas vezes.
NOTA: Estas etapas alternadas de molhar e secar garantem que o tecido esteja firmemente preso ao papel do filtro. - Armazene cada amostra de papel de retina/filtro aderido em uma placa de Petri cheia de Ringer frio até estar pronta para congelar todas as amostras. Repita este processo para toda a retina pela metade.
- Obtenha uma placa de Petri de 35 x 10 mm limpa e seca (apenas para baixo) e um pedaço de papel alumínio cortado em um quadrado de 3,5 x 3,5 polegadas.
- Retire cada amostra do tampão do Ringer frio com pinças. Certifique-se de que as pinças entrem em contato apenas com as bordas do papel do filtro, evitando a retina pela metade.
- Coloque o lado inferior de cada papel filtro (o lado sem a retina sobre ele) sobre uma toalha de papel e remova o excesso de líquido.
- Adicione uma gota de PBS 1x frio (137 mM NaCl, 2,7 mM KCl, 10 mM Na2HPO4, 2 mM KH2PO4, pH 7.4) na lateral do papel filtro onde a retina é aderida. Dab o papel filtro na toalha de papel para remover o excesso de líquido.
NOTA: Certifique-se de que a umidade do papel do filtro esteja suficientemente removida antes de congelar. - Coloque todos os pedaços de papel filtro na placa de Petri de 35 x 10 mm. Use um papel de tecido sem fiapos para afastar qualquer excesso de líquido ao redor do papel filtro.
NOTA: Não desloe a placa de Petri com amostras. Se mais de quatro olhos murinos forem usados, considere usar uma placa de Petri maior ou várias placas menores de Petri para segurar as amostras de papel de retina/filtro. - Enrole firmemente todo o prato com papel alumínio. Certifique-se de que as bordas da folha de alumínio estão presas e suavemente pressionadas na parte inferior da placa de Petri. Puna um punhado de furos de 0,1-0,2 mm na tampa da folha de alumínio (Figura 2A).
- Usando pinças metálicas, abaixe gradualmente a folha de alumínio coberta de placa de Petri no nitrogênio líquido. Mantenha as amostras no nitrogênio líquido (<10 min) até liofilizar.
- Liofilização
- Coloque a folha de alumínio coberta de placa de Petri em um frasco de secagem congelante e conecte-a à máquina de liofilizador seguindo o protocolo do fabricante. Lyophilize a retina por 30 minutos.
- Retire o frasco do liofilizador e desligue a máquina de acordo com o fabricante.
- Remova a folha de alumínio e trabalhe com as amostras congeladas no mesmo dia ou armazene-as em tubos de microcentrifuuge de 1 mL devidamente rotulados. Coloque esses tubos em um recipiente (como um tubo cônico de 50 mL) cheio de um dessecante anidro e armazene as amostras a -80 °C.
- Rod coleção de segmento externo e interno por peeling de fita adesiva.
- Corte tiras de fita adesiva clara (1-2 cm) e armazene tiras na borda do dispensador de fita/banco de laboratório/etc. para uso rápido.
- Mova uma amostra de retina para a tampa de uma placa de Petri de plástico de 60 x 15 mm para descascar. Certifique-se de apenas pegar as bordas mais externas do papel filtro e evitar tocar na retina.
- Usando uma tesoura de íris de ponta cega (ou tipo de tesoura equivalente), corte um pequeno pedaço retangular de fita para o tamanho aproximado do tecido (1,5 x 2,5 mm).
- Coloque cuidadosamente um pequeno pedaço de fita em cima da retina liofilizada (Figura 2B) e aplique uma leve pressão com a pinça para garantir que ela se liga à camada fotorreceptora (a camada superior laranja/rosa).
- Descasque lentamente a fita. Tanto o segmento externo da haste (ROS) quanto o segmento interno da haste (RIS) serão aderidos à fita (Figura 2B).
- Certifique-se de que há um filme branco fino na superfície fraturada. Isto é RIS.To separar o RIS, colocar outro pedaço de fita e empurrar a fita para baixo na superfície fraturada (Figura 2B).
NOTA: Pode ser necessário mais de um pedaço de fita para remover toda a fina camada branca. - Coloque a peça de fita apenas com a camada laranja/rosa em um tubo de microcentrifutura rotulado +ROS.
- Coloque a fita ou pedaços de fita com a fina camada branca em um tubo de microcentrifuuagem rotulado +RIS.
NOTA: Separar a retina liofilizada com fita requer prática. A quantidade de pressão aplicada à fita afetará a forma como a amostra liofilizada fracionará. Se muita pressão for colocada sobre a fita sobre a amostra, toda a retina liofilizada descascará o papel do filtro e grudará na fita. Se muito pouca pressão for adicionada à fita, a camada superior laranja/rosa (+ROS) não grudará na fita. - Colete o tecido de retina restante (despojado de camadas ROS e RIS, -OIS) localizado no papel do filtro, descascando a camada branca e grossa do papel filtro usando fita adesiva. Coloque o isolado em um tubo rotulado -OIS.
- Repita estes passos para cada amostra de retina pela metade.
- Armazene as camadas isoladas da retina linofilizada, seja à temperatura ambiente, se realizar quantificação proteica, eletroforese gel e imunoblots proteicos no mesmo dia, ou armazenar em um recipiente (como tubo cônico de 50 mL) preenchido com dessecante a-80 °C para uso posterior.
3. Preparação da amostra de manchas ocidentais para descascar isolamentos
- Prepare o tampão de lise RIPA
- Em uma garrafa de armazenamento de 100 mL, adicione reagentes para obter uma concentração final de 50 mM Tris-HCl pH 7,4, 150 mM NaCl, 1% Triton X-100, 1% desoxilato de sódio, 0,1% SDS e 1 mM EDTA. Adicione 100 mL de água ultrapura deionizada e misture bem.
NOTA: O tampão de lise RIPA pode ser armazenado a 2-8 °C por 2-3 semanas. Para maior armazenamento, alíquota e armazenamento no congelador -20 °C. - No dia do experimento, adicione um coquetel inibidor de protease (0,1 M PMSF, 1:1000 Aprotinína e 1:1000 Leupeptina) ao tampão de lise RIPA e mantenha no gelo.
- Em uma garrafa de armazenamento de 100 mL, adicione reagentes para obter uma concentração final de 50 mM Tris-HCl pH 7,4, 150 mM NaCl, 1% Triton X-100, 1% desoxilato de sódio, 0,1% SDS e 1 mM EDTA. Adicione 100 mL de água ultrapura deionizada e misture bem.
- Filtro de papel descascando lysate preparação para mancha ocidental
- Certifique-se de que os tubos que contenham as cascas de papel do filtro e as sobras de retina descascada sejam mantidos no gelo (para o experimento no mesmo dia) ou removidos do armazenamento do congelador de -80 °C e colocados no gelo.
- Remova qualquer excesso de líquido da parte inferior dos tubos de microcentrifuuge que contenham as cascas de papel filtro. Gire rapidamente em uma mini centrífuga para 2-4 s e descarte qualquer líquido restante.
- Pipeta 45-55 μL de tampão RIPA frio em tubos contendo o isolado do papel filtro.
- Homogeneize cada amostra com um misturador de pilão limpo e autoclavado por 1 min. Certifique-se de que o papel filtro mantenha contato com o misturador de pilos. Mantenha o papel filtro na lateral de cada tubo e não na parte inferior.
- Com pinças, mova os papéis do filtro para o lado de cada tubo e gire na mini centrífuga para 2-4 s. Isso removerá o buffer RIPA do papel filtro.
- Remova o papel do filtro seco e repita para todos os papéis do filtro dentro de cada tubo, se necessário.
- Transfira o homogeneizar para um novo tubo e rotulá-lo adequadamente.
NOTA: Esta é a etapa mais demorada e, se não for concluída corretamente, grande parte da amostra acabará sendo absorvida pelo papel filtro. - Pipeta 60-80 μL de tampão RIPA frio nos tubos individuais com as sobras de retina descascada.
- Homogeneize cada amostra com um misturador de pilão limpo e autoclavado por 1 min.
- Fita descascando preparação lysate para mancha ocidental
- Coloque as amostras de linofilizado RT ou as amostras de -80 °C no gelo.
- Pipeta 50-70 μL de tampão RIPA frio em cada tubo contendo +ROS e +RIS tiras de fita.
- Pipeta 60-80 μL de tampão de lise fria nos tubos -OIS contendo a retina liofilizada restante, com o ROS e RIS removidos.
- Homogeneize cada amostra com um misturador de pilão limpo por 1 min. Certifique-se de que a fita nos tubos individuais mantenha contato com o misturador de pilos e o tampão de lise.
- Com pinças esterilizadas, mova a fita para o lado dos tubos e gire com uma mini centrífuga para 2-4 s. Isso removerá o líquido da fita. Remova a fita seca dos tubos.
NOTA: Neste ponto, você pode combinar dois isolados de retina meio da mesma retina para o método "peeling de papel filtro" ou "peeling de fita" para garantir que você tenha volume suficiente para realizar um ensaio de ácido bicinchonínico (BCA).
Resultados
As estratégias atuais foram desenvolvidas para fornecer métodos relativamente rápidos e simples para isolar e analisar proteínas entre compartimentos subcelulares específicos da haste para análise de manchas ocidentais. Aplicamos duas técnicas sequenciais de peeling (Figura 1 e Figura 2) seguidas de imunoblotting para demonstrar que esses métodos poderiam ser usados de forma confiável para detectar a distribuição conhecida de transdutina de haste (GNAT1) e arrestin (ARR1) em animais adaptados à escuridão e à luz. Para validar a eficácia de nossos dois protocolos em compartimentos subcelulares de hastes precisamente isoladores sem contaminação de outras camadas celulares, os imunoblots foram sondados com anticorpos para citocromo C (Cyt C), actin e Gß5S/Gß5L26. Uma lista de anticorpos e diluições utilizadas é apresentada na Tabela 1. Cyt C e actin indicaram pureza ROS, pois são proteínas abundantes na retina proximal, mas estão ausentes no ROS. Gß5L, um componente da proteína ativante GTPase (GAP) para GNAT127, está presente no ROS e RIS e serviu como um controle para esses isolamentos. Gß5S, a isóforma de emenda mais curta que não está presente em ROS ou RIS, mas está em todos os outros compartimentos de vara, servido como um controle para compartimentos subcelulares isolados não ROS/RIS.
Em primeiro lugar, a eficácia do nosso método sequencial de peeling de retina de células vivas foi avaliada pela análise da distribuição de GNAT1 e ARR1 em barras de camundongos adaptados à luz e escura (Figura 3). Os papéis do filtro contendo o ROS (+ROS) foram agrupados de um total de uma retina inteira, e o tecido residual correspondente (-ROS) também foi combinado. Os sinais das proteínas indicadas foram posteriormente comparados entre as amostras +ROS e as amostras -ROS, e toda uma retina isolada serviu como controle de entrada. A concentração proteica e o volume de homogeneização dessas amostras são apresentados na Tabela 2. Os resultados apresentados na Figura 3A mostram que, em animais adaptados ao escuro, a distribuição de GNAT1 e ARR128 coincidiu de perto com suas distribuições conhecidas de estado escuro, onde o sinal GNAT1 era visivelmente o mais forte no isolamento +ROS, enquanto o sinal ARR1 era mais robusto no isolamento -ROS. Assim, na retina exposta à luz, o sinal GNAT1 foi visivelmente reduzido no isolamento +ROS e teve um sinal aumentado na amostra -ROS, enquanto a translocação ARR1 induzida pela luz poderia ser visualizada em amostras +ROS e -ROS. Os resultados de seis experimentos diferentes foram quantificados, e foram encontradas diferenças estatisticamente significativas entre as condições escuras/claras para GNAT1 e ARR1 nas amostras +ROS e -ROS (Figura 3B). Esses achados são consistentes com o movimento de luz/escuridão da proteína anteriormente conhecido dentro dos compartimentos subcelulares da haste e indicam fortemente que essa técnica pode isolar frações enriquecidas +ROS.
Para validar ainda mais nosso método de peeling de células vivas, investigamos distribuições conhecidas de marcadores de pureza ROS em amostras +ROS e -ROS. Em amostras escuras e claras, os sinais Gß5S, Cyt C e actin são excluídos das amostras +ROS (Figura 3A), demonstrando ausência de contaminação de outras camadas celulares. Além disso, o sinal Gß5L era claramente visível nas amostras +ROS (Figura 3A). Além disso, os sinais actin e Gß5L não só confirmaram a pureza das frações +ROS e -ROS, mas também atuaram como controles para a normalização, com os sinais das amostras +ROS sendo normalizados contra amostras de Gß5L e -ROS sendo normalizados contra actina. Conforme apresentado na Figura 3A, recomenda-se que os isolados de descascamento de células vivas sejam carregados ao lado de um controle de carga, especificamente um homogeneizado de retina inteira, para normalização e análise de imunoblotação ideal. Juntos, esses dados validam que nosso método de peeling de células vivas pode fornecer uma abordagem rápida e reprodutível para isolar a camada subcelular ROS do resto da haste e da retina para análise de proteínas.
Em seguida, avaliamos nossa técnica de peeling liofilizada para verificar se esse método poderia isolar de forma reprodutivelmente os compartimentos ROS e RIS. Antes da imunoblotting, nós fotografamos as superfícies da retina do rato liofilizado intacto e descascado usando um microscópio eletrônico de varredura (SEM) para analisar qual camada subcelular fotoreceptor a casca de fita rendeu (Figura 4). Antes de descascar com fita adesiva, a superfície da retina liofilizada intacta (camada laranja/rosa) combinava de perto com o perfil da característica ros cilíndrica (Figura 4A). Após a casca da fita inicial, o ROS e o RIS pareciam estar totalmente removidos, como evidenciado pela camada nuclear uniforme presente na superfície da retina linofilizada descascada (Figura 4C). As cascas de fita subsequentes removeram o RIS (fina camada branca, Figura 4B) da superfície livre da camada descascada, um processo provavelmente auxiliado pelo estreito e frágil cilium de conexão que liga os segmentos interno e externo. Esses resultados confirmaram que as camadas subcelulares da haste do tecido retiniano liofilizado podem ser especificamente fracionadas usando fita.
Tendo validado a eficácia deste método visualmente, retinas descascadas escuras e adaptadas à luz foram submetidas à imunoblotação usando a mesma abordagem utilizando marcadores proteicos para diferentes compartimentos como descrito para o nosso método de peeling de células vivas (Figura 3). A concentração proteica e o volume de homogeneização para isolamento ROS (+ROS), isolamento do RIS (+RIS) e as demais camadas de retina (-OIS) são apresentados na Tabela 2. Como esperado, houve uma clara mudança induzida pela luz para gnat1 do ROS para o RIS, bem como ARR1 do RIS para o ROS (Figura 5A). O GNAT1 foi mais abundante na amostra +ROS no escuro e na amostra +RIS na luz, enquanto o sinal ARR1 foi invertido (Figura 5A). Em seguida, normalizamos e quantificamos os sinais proteicos translocados dos isolamentos +ROS, +RIS e -OIS (Figura 5B), utilizando os mesmos controles e abordagem da metodologia de peeling ao vivo. Também combinamos amostras de +RIS e -OIS (Figura 5C) para uma comparação mais direta com nosso método de descascamento de papel filtro de células vivas (Figura 3B). Ambos os gráficos mostram a translocação bem estabelecida e característica induzida pela luz tanto do GNAT1 quanto do ARR1. Com base nessas observações, a preparação de descascamento de fitaparenta parecer produzir frações enriquecidas de ROS e RIS, como evidenciado pela composição proteica de ARR1 e GNAT1 nesses isolamentos.
Em seguida, foi avaliada a pureza dos isolamentos subcelulares individuais. Semelhante aos resultados mostrados na Figura 3A, as amostras +ROS não tinham sinais para actin, citocromo C e Gß5S enquanto exibiam um forte sinal Gß5L (Figura 5). Este achado mostra a falta de contaminação de outros compartimentos subcelulares em nossa preparação de amostras +ROS. O teor proteico da camada subcelular subsequente da haste, o isolamento +RIS, foi então avaliado. Descobrimos que a amostra +RIS foi positiva para Cyt C, Gß5L e actin. Este achado é consistente com a composição conhecida do RIS, que é rico em mitocôndrias e elementos citoesqueléticos. A camada final, o isolado -OIS, tinha distribuições proteicas consistentes com as amostras -ROS mostradas na Figura 3A.
Para avaliar melhor a utilidade do nosso método de descascamento de fita adesiva na investigação das composições proteicas dos compartimentos subcelulares da haste, examinamos especificamente a imunoreatividade da quinase de rhodopsin (GRK1) e da proteína quinase C-alfa (PKCα) em nossas amostras +ROS, +RIS e -OIS. Diferentes métodos experimentais, como a imunocitoquímica (ICC) e a mancha ocidental, muitas vezes produzem resultados conflitantes sobre a localização precisa dessas proteínas em hastes e na retina. Acredita-se que o GRK1, por exemplo, seja relativamente abundante em haste e cone OS para mediar a fosforilação de opsinas ativadas pela luz29. No entanto, o imunolabelamento de fatias de retina revelou a localização de GRK1 especificamente no OS30,31 ou em toda a camada fotorreceptora32. PKCα, por outro lado, é uma proteína que é comumente usada para ICC para rotular células bipolares. Apesar de não haver evidências claras de imunolabeling PKCα específico em fatias de retina25, há considerável bioquímico24,25 e evidências funcionais333,34,35 que suportam o papel de presença e fosforilação do PKCα no ROS. Utilizando nossa técnica, descobrimos que a imunoreatividade GRK1 foi mais intensa nas amostras +ROS em retina exposta à luz e esteve ausente em amostras de -OIS (Figura 6A). Por outro lado, mostramos que as amostras +ROS e +RIS apresentaram um sinal fraco para PKCα. Como pode ser visto na Figura 6B, pkcα é comumente não detectado no ROS ou RIS pela coloração de imunofluorescência de seções de retina. No entanto, pkcα foi imunodeduzida por mancha ocidental (Figura 6A,D). Como os isolamentos +ROS e +RIS exibem um forte sinal Gß5L e uma ausência de Gß5S (Figura 6A), estamos confiantes de que o sinal PKCα dim em amostras ROS e RIS é genuíno e não devido à contaminação de outras camadas. Para visualizar os sinais individuais em +ROS, +RIS e isolamentos -OIS, manchas GRK1 e PKCα foram combinadas e traçadas para comparação (Figura 6C).
Por fim, um exemplo de uma sessão de peeling sub-ideal (Figura 6D) demonstra como a contaminação de diferentes subcamas pode distorcer resultados, ilustrando ainda mais a importância da interpretação dos dados e da inclusão dos anticorpos de controle apropriados para a triagem de erros experimentais de peeling. Neste exemplo de isolamento de descascamento de fita, um sinal Gß5S fraco é evidente na faixa de isolamento ris, indicando uma leve contaminação da amostra -OIS. Dependendo do objetivo do usuário, essa pequena contaminação pode não ser um problema. No entanto, neste caso, estávamos investigando o sinal PKCα em amostras +ROS e +RIS, e o sinal PKCα é ligeiramente maior na pista RIS em comparação com a pista ROS (Figura 6A,D), talvez devido à contaminação. Assim, deve-se tomar cuidado durante o processo de descascamento para garantir um isolamento preciso e minimizar a contaminação. Apesar da contaminação mínima devido a erros individuais, esses dados fornecem evidências convincentes de que a metodologia de descascamento de fitas pode produzir isolamentos sequenciais precisos de camadas fotorreceptoras de vara para análise de proteínas.

Figura 1: O esquema dos degraus de descascamento de células vivas. (A) O diagrama mostra os principais passos para dissecar e hemistar o olho isolado. (B) Os segmentos externos do fotorreceptor são removidos incrementalmente por descascamento sequencial usando papel filtro. Primeiro, as retinas são orientadas para que a camada fotorreceptora esteja em contato com o papel filtro. Em seguida, o papel filtro é seco por manchas em uma toalha de papel, e a retina é descascada do papel filtro. Este isolado descascado é coletado em um tubo mantido no gelo. Esse processo é repetido sete a oito vezes para remover totalmente o segmento externo da haste (+ROS). Este número foi criado com BioRender.com. Clique aqui para ver uma versão maior desta figura.
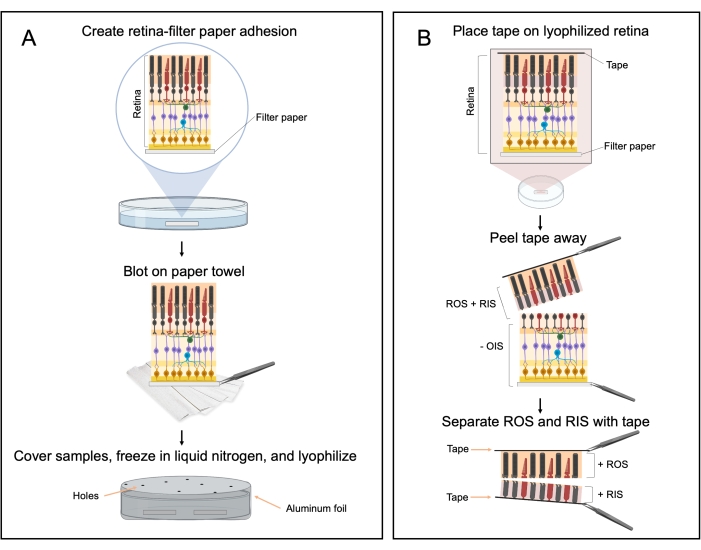
Figura 2: Processo de peeling de retina liofilizada. (A) Diagrama de fluxo da preparação da amostra para a retina liofilizada. As retinas são orientadas para que a camada de células gânglios da retina esteja em contato com o papel filtro e os fotorreceptores estejam voltados para cima. (B) Após a liofilização, a retina congelada é aderida a um pedaço de fita após adicionar uma leve pressão na parte superior da fita. A fita é descascada, removendo as camadas do segmento externo da haste (ROS) e da haste interna (RIS). A camada RIS é removida por mais cascas de fita até que a camada ROS esteja visível (camada laranja/rosa). Este número foi criado com BioRender.com. Clique aqui para ver uma versão maior desta figura.

Figura 3: Expressão de GNAT1 e ARR1 em fotorreceptores isolados da haste após descascamento de papel de filtro sequencial. (A) Immunoblots de +ROS e -ROS (ROS-esgotado) amostras coletadas pelo método de descascamento de papel filtro adquirido a partir de retinas adaptadas à luz e escura. As manchas foram sondadas com anticorpos para proteínas acionadas pela luz (transdutina (GNAT1) e arrestin (ARR1)) e marcadores de controle de qualidade (GTPase ativando proteína (Gß5L/S) citocromo C (Cyt C) e actin). Duas retinas pela metade foram combinadas para essas manchas representativas. (B) Sinais quantificados de GNAT1 e ARR1 a partir de retinas adaptadas à luz e escuras. Há movimento recíproco de GNAT1 e ARR de +ROS e -ROS isolados. As tramas de violino retratam a expressão normalizada de amostras +ROS e -ROS. Este número foi modificado de Rose et al.36. Clique aqui para ver uma versão maior desta figura.
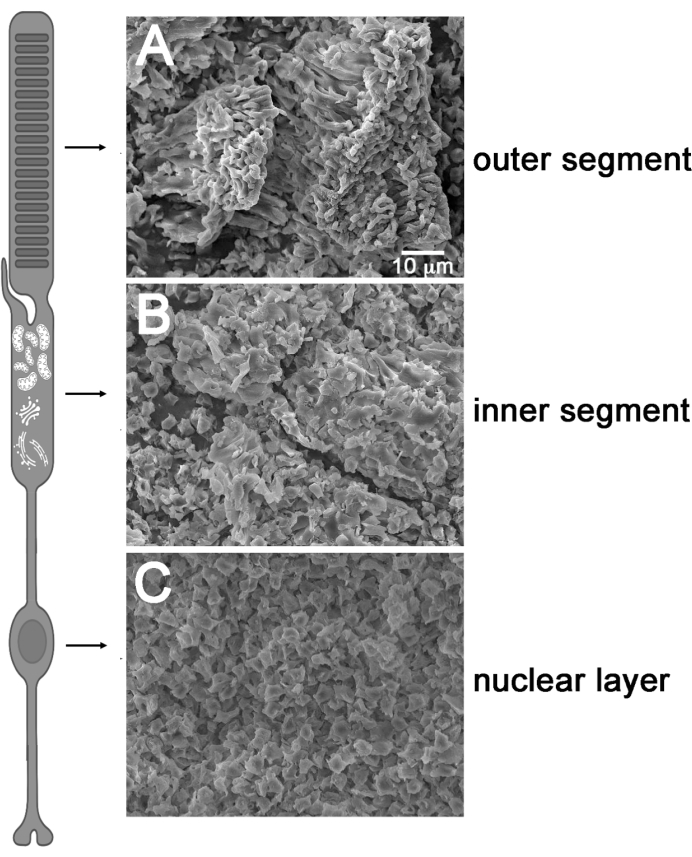
Figura 4: Escaneando imagens de microscópio eletrônico da retina liofilizada. (A) Superfície de retina liofilizada antes de descascar fita (lado fotorreceptor para cima). (B) O descascamento da fita pós-fita de camada do segmento interno. (C) A camada do corpo celular que a fita pós-fita mostra uma aparência nuclear uniforme. Este número foi modificado a partir de Rose et al.36 e foi criado com BioRender.com. Clique aqui para ver uma versão maior desta figura.

Figura 5: Validação do método de descascamento de fita para isolar ros e RIS de retina liofilizada. (A) Manchas ocidentais de +ROS, +RIS e -OIS (ROS/RIS-esgotado) amostras coletadas pelo método de descascamento de fita. Os imunoblots foram sondados com transdutina (GNAT1), detenção (ARR1), proteína ativante GTPase (Gß5L/S), citocromo C (Cyt C) e anticorpos actinas. As amostras foram obtidas a partir de retinas escuras e claras e isolados de retina pela metade (+ROS, +RIS, -OIS) foram combinados para material mais concentrado. (B) Os sinais quantificados de GNAT1 e ARR1 são traçados como parcelas de violino para as diferentes camadas isoladas da retina, que foram obtidas a partir de retinas adaptadas à luz e escuras. (C) Os níveis de expressão normalizados de +RIS e -OIS foram combinados e traçados para comparar métodos de descascamento de fita e papel filtro. Amostras com adaptação escura e clara mostraram movimento conhecido de proteínas de fototransdução chave. Este número foi modificado de Rose et al.36. Clique aqui para ver uma versão maior desta figura.

Figura 6: Descascamento de fitas de retina liofilizada para investigar a localização subcelular de GRK1 e PKCα em fotorreceptores. (A) Uma mancha ocidental representativa de amostras descascadas de camundongos C57BL/6J adaptados à luz demonstrando os níveis relativos de rhodopsin kinase (GRK1), proteína quinase C-alfa (PKCα), proteína ativante GTPase (Gß5L/S) e actin. (B) Seção de retina congelada preparada a partir de camundongos expostos à luz incubados com anticorpo PKCα (verde, 1:100). RPE, epitélio pigmentado da retina; OS, segmento externo; IS, segmento interno; CB, corpo celular; ST, terminal sináptico. Barra de escala = 10 μm. (C) PKCα e GRK1 normalizados níveis de expressão para +ROS, +RIS, -Amostras de OIS são plotadas como parcelas de violino. (D) A descascamento de fitas abaixo do ideal poderia potencialmente produzir amostras ligeiramente contaminadas. O quadrado vermelho destaca a amostra +RIS contaminada com alguma amostra de -OIS, produzindo tanto bandas Gß5L/S quanto um sinal PKCα mais alto. Duas retinas pela metade foram combinadas para todas as manchas. Clique aqui para ver uma versão maior desta figura.
| Alvo | Anticorpo | Diluição | Fabricante |
| Arrestin | Coelho anti-ARR1 | 1:1000 | Chen, et. al., 2006. |
| Transduduzir | Anti-GNAT do mouse (TF-15) | 1:1000 | O Citosignal. |
| ß Actin | Coelho anti-ß Actin | 1:5000 | GeneTex Inc. |
| Citocromo C | Coelho anti-citocromo C | 1:500 | Santa Cruz, SC-7159. |
| GAP (Gß5L/S) | Coelho anti-Gß5L/S (CT2-15) | 1:2000 | Watson, et. al., 1996. |
| Proteína quinase C alfa (PKC) | Coelho anti-PKC (#2050) | 1:1000 | Tecnologia de sinalização celular. |
| Rhodopsin Kinase (GRK1) | Mouse anti-GRK1 (G-8) | 1:200 | Santa Cruz, SC-8004. |
Tabela 1: Lista de anticorpos utilizados para validação de manchas ocidentais de técnicas de separação.
| Isolamento da retina de papel filtrante | ||||||
| +ROS* | -ROS* | Retina inteira | ||||
| Concentração média de proteínas (μg/mL) | 700 | 1,500 | 1,500 | |||
| Volume de buffer RIPA (μL) | 90 | 150 | 200 | |||
| Isolamento de retina descascando fita | ||||||
| +ROS* | +RIS* | -ROS* | Retina inteira | |||
| Concentração média de proteínas (μg/mL) | 520 | 440 | 1,200 | 1,600 | ||
| Volume de buffer RIPA (μL) | 100 | 100 | 125 | 150 | ||
| * Combinados dois isolamentos de retina pela metade. | ||||||
Tabela 2: Concentração de proteínas no isolamento da retina homogeneiza.
Discussão
Muitas doenças da retina afetam as células fotorreceptoras da haste, levando à morte da haste e, em última instância, à perda completa da visão37. Uma parte significativa das origens genéticas e mecanicistas da degeneração da retina humana foram recapituladas com sucesso em inúmeros modelos de camundongos ao longo dos anos. Nesse contexto, a capacidade de separar facilmente e seletivamente compartimentos subcelulares individuais da pequena retina do rato aumentaria muito nossa compreensão dos fundamentos bioquímicos e moleculares localizados das doenças da retina. Além disso, a natureza em camadas da retina neural, combinada com o arranjo único e altamente polarizado de fotorreceptores de vara, permite o isolamento dos compartimentos de vara por descascamento seletivo. Este manuscrito descreve dois protocolos usados para isolar compartimentos subcelulares individuais de células fotorreceptoras de vara para imunoblotação. Não só ambos os métodos são consideravelmente mais rápidos e menos tecnicamente desafiadores quando comparados com o método existente de seção tangencial9, mas também requerem um tamanho amostral substancialmente menor do que o isolamento bioquímico comum da ROS usando gradientes de densidade19. Tais técnicas de purificação de gradiente ROS requerem 8-10 retinas de murina para recuperar de forma confiável ros ampla, enquanto os protocolos aqui apresentados são adequados para retina única.
Apesar da simplicidade geral das técnicas propostas, um dos principais desafios comuns a ambos os protocolos diz respeito ao achatamento da retina curvada no papel filtro necessário para o isolamento adequado dos diferentes compartimentos subcelulares. A retina isolada tende a se enrolar e assumir uma forma de molusco. Se a retina tiver bordas dobradas quando colocada no papel do filtro (lado fotorreceptor para cima ou para baixo), isso pode diminuir o rendimento das camadas de haste isoladas desejadas. Mais importante, se a retina não for adequadamente achatada, então o desalinhamento e a contaminação de outras células subcelulares e células da retina é um resultado provável (Figura 6D). Para limitar a curvatura do retângulo de retina pela metade e corrigir o alinhamento imperfeito da haste e das camadas da retina, o retângulo da retina pode ser cortado ao meio para produzir dois quadrados de retina. Ao cortar a retina neural em pedaços menores, a curvatura natural da retina é reduzida, e o tecido é mais provável que esteja liso no papel do filtro.
Reconhecer quando os diferentes compartimentos de vara foram fisicamente separados pode ser complicado para alguém inexperiente com essas técnicas. Aconselhamos que antes de iniciar um experimento biologicamente significativo, o usuário deve executar o processo com retina amostral por uma ou duas horas. A prática deve resultar em melhoria substancial nas habilidades e proficiência do operador nos métodos. Ao usar papel filtro para retirar o ROS de uma retina viva, nenhum sinal visual óbvio indica quando a camada ROS foi isolada. Enquanto a retina se torna mais fina e frágil, o usuário terá que auto-monitorar e validar o número de cascas para isolar o ROS com precisão. Além disso, o uso de papel filtro com diferentes espessuras de fibras e grosserias alterará o tempo de descascamento ros. O papel filtro com fibras mais grossas (como o VWR Grade 413) isolará camadas de retina mais rapidamente (6-8 cascas), mas pode não ser tão seletivo e pode levar à contaminação de outras camadas. O papel filtro com fibras mais finas (como whatman grau 1) isolará camadas de retina mais lentamente (12-15 cascas) e dará um isolamento limpo das camadas do fotorreceptor. Recomendamos o uso de papel filtro mais grosso e fino para minimizar o tempo de descascamento e garantir a pureza da coleta.
Ao mesmo tempo, a aproximação visual e o manuseio da amostra de fita são a chave para o sucesso de isolar os compartimentos subcelulares da retina liofilizada. Se muita pressão for adicionada à fita, toda a retina liofilizada vai aderir à fita. Uma vez que isso ocorra, separar o ROS torna-se mais longo e mais difícil, mas não impossível: coloque um segundo pedaço de fita na superfície livre (no lado da célula de gânglio) da retina e lentamente retire as camadas com fita até que apenas a camada laranja/rosada seja visível na peça inicial da fita. Isolar o RIS neste momento, no entanto, é impossível. Se muito pouca pressão for adicionada à fita, uma grande parte do ROS não aderirá à fita. Para garantir a adesão adequada da fita ROS, aconselhamos pressionar suavemente com pinças nas regiões que não estão grudando na fita. Normalmente, a menor pressão resulta na remoção das camadas ROS e RIS, no entanto, a quantidade de pressão deve ser determinada com base na experiência. A presença de RIS isolado pode ser apurada verificando se uma camada fina e branca (semelhante a um pó claro de neve) é visível na casca inicial da fita ROS, enquanto a presença de ROS isolado pode ser facilmente determinada verificando a cor da camada fotorreceptora da haste (laranja para adaptado escuro, rosado para adaptação à luz) na fita.
Um desafio final surge ao homogeneizar as cascas de papel filtro (+ROS) da retina viva. O papel filtrante absorve facilmente o líquido, e uma quantidade considerável do buffer homogeneizador será absorvida durante esta etapa do protocolo. Girar o líquido para baixo em uma mini centrífuga depois de colocar o papel descascando na lateral de cada tubo ajuda a evitar a perda da amostra. Infelizmente, girar vários pedaços de papel filtro pode ser um processo demorado, e a perda de amostra é inevitável. Para resolver esse problema, remova algumas peças de papel do filtro e foque na homogeneização de menos peças ao mesmo tempo. Além disso, para evitar a perda da amostra durante esta etapa, considere minimizar a quantidade total de papel filtro utilizado para isolar o ROS.
Embora ambos os nossos métodos não exijam um grande tamanho amostral, ou o alinhamento preciso de uma lâmina para seção da retina, existem algumas limitações às nossas técnicas de peeling de fotorreceptor que merecem ser notadas. Primeiro, a retina murina liofilizada pode não ser passível de descascar camadas fotorreceptoras subsequentes além do ROS e RIS. Em segundo lugar, nossos métodos de peeling são mais adequados para o processamento de retinas individuais e não são favoráveis ao processamento de grandes lotes em uma sessão. Em terceiro lugar, o sucesso do experimento depende do limite de sensibilidade do anticorpo usado na mancha ocidental. Apesar dessas limitações, nossos resultados representativos demonstram que nossas duas técnicas de descascamento de isolamento podem isolar eficientemente compartimentos específicos de fotorreceptor de vara. Além disso, esses dois métodos utilizam materiais de laboratório baratos e comuns (papel filtro e fita adesiva), tornando-os altamente acessíveis. Em nosso estudo, não avaliamos diretamente se outras células da retina poderiam ser isoladas para imunoblotação; no entanto, acreditamos que esses métodos podem ser facilmente modificados para beneficiar as necessidades de uma ampla seção transversal da comunidade de pesquisa da retina.
Divulgações
Os autores declaram que não têm interesses concorrentes.
Agradecimentos
Este trabalho foi apoiado pelo NIH Grant EY12155, EY027193 e EY027387 para JC. Somos gratos ao Dr. Spyridon Michalakis (Caltech, Pasadena, EUA) e Natalie Chen (USC, Los Angeles, EUA) por revisar o manuscrito. Também gostaríamos de agradecer ao Dr. Seth Ruffins (USC, Los Angeles, EUA) e ao Dr. Janos Peti-Peterdi (USC, Los Angeles, EUA) por fornecerem os equipamentos necessários para coletar as imagens fornecidas pelo autor. Material de: Kasey Rose et al, Separação de compartimentos celulares fotorreceptor na retina do rato para análise de proteínas, Neurodegeneração Molecular, publicado [2017], [Springer Nature].
Materiais
| Name | Company | Catalog Number | Comments |
| 100 mL laboratory or media bottle equipped with a tubing cap adapter | N/A | N/A | |
| 100% O2 tank | N/A | N/A | |
| 1000mL Bottle Top Filter, PES Filter Material, 0.22 μm | Genesee Scientific | 25-235 | |
| 4X SDS Sample Buffer | Millipore Sigma | 70607-3 | |
| 50 mL Falcon tube | Fisher Scientific | 14-432-22 | |
| 95% O2 and 5% CO2 tank | N/A | N/A | |
| Ames’ Medium with L-glutamine, without bicarbonate | Sigma-Aldrich | A1420 | |
| CaCl2 (99%, dihydrate) | Sigma | C-3881 | |
| Drierite (Anhydrous calcium sulfate, >98% CaSO4, >2% CoCl2) | WA Hammond Drierite Co LTD | 21005 | |
| Falcon Easy-Grip Petri Dish (polystyrene, 35 x 10 mm) | Falcon-Corning | 08-757-100A | |
| Falcon Easy-Grip Tissue Culture Dish (60 x 15 mm) | Falcon-Corning | 08-772F | |
| Feather Scalpel (No. 10, 40 mm) | VWR | 100499-578 | |
| Feather Scalpel (No. 11, 40 mm) | VWT | 100499-580 | |
| KCl (99%) | Sigma | P-4504 | |
| Kimble Kontes pellet pestle | Sigma | z359971 | |
| Labconco Fast-Freeze Flasks | Labconco | N/A | |
| LN2 (liquid nitrogen) + Dewar flask or similar vacuum flask | N/A | N/A | |
| MgCl2 | Sigma | M-9272 | |
| Milli-Q/de-ionized water | EMD Millipore | N/A | |
| Na2HPO4 (powder) | J.T. Baker | 4062-01 | |
| NaCl (crystal) | EMD Millipore | Sx0420-3 | |
| NaHCO3 | Amresco | 0865 | |
| OmniPur EDTA | EMD | 4005 | |
| OmniPur HEPES, Free Acid | EMD | 5320 | |
| Parafilm M | Sigma-Aldrich | P7793 | |
| Reynolds Wrap Aluminum Foil | Reynolds Brands | N/A | |
| Scotch Magic Tape (12.7 mm x 32.9 m) | Scotch-3M | N/A | |
| Sodium deoxycholate | Sigma-Aldrich | D67501 | |
| Spectrafuge mini centrifuge | Labnet International, Inc | C1301 | |
| Tissue incubation chamber (purchased or custom made) | N/A | N/A | |
| Tris-HCl | J.T.Baker | 4103-02 | |
| Triton X-100 | Signma-Aldrich | T8787 | |
| VirTis Benchtop 2K Lyophilizer or equivalent machine | SP Scientific | N/A | |
| VWR Grade 413 Filer Paper (diameter 5.5 cm, pore size 5 μm) | VWR | 28310-015 | |
| Whatman Grade 1 Qualitative Filter Paper (diameter 9 cm, pore size 11 μm) | Whatman/GE Healthcare | 1001-090 | |
| Wide bore transfer pipet, Global Scientific | VWR | 76285-362 |
Referências
- Arshavsky, V. Y., Lamb, T. D., Pugh, E. N. G proteins and phototransduction. Annual Review of Physiology. 64, 153-187 (2002).
- Molday, R. S., Moritz, O. L. Photoreceptors at a glance. Journal of Cell Science. 128 (22), 4039-4045 (2015).
- Koch, K. W., Dell'Orco, D. Protein and signaling networks in vertebrate photoreceptor cells. Frontiers in Molecular Neuroscience. 8, 67 (2015).
- Semple-Rowland, S. L., Dawson, W. W. Cyclic light intensity threshold for retinal damage in albino rats raised under 6 lx. Experimental Eye Research. 44 (5), 643-661 (1987).
- Brann, M. R., Cohen, L. V. Diurnal expression of transducin mRNA and translocation of transducin in rods of rat retina. Science. 235 (4788), 585-587 (1987).
- Philp, N. J., Chang, W., Long, K. Light-stimulated protein movement in rod photoreceptor cells of the rat retina. FEBS Letters. 225 (1-2), 127-132 (1987).
- Broekhuyse, R. M., Tolhuizen, E. F., Janssen, A. P., Winkens, H. J. Light induced shift and binding of S-antigen in retinal rods. Current Eye Research. 4 (5), 613-618 (1985).
- Roof, D. J., Heth, C. A. Expression of transducin in retinal rod photoreceptor outer segments. Science. 241 (4867), 845-847 (1988).
- Sokolov, M., et al. Massive light-driven translocation of transducin between the two major compartments of rod cells: a novel mechanism of light adaptation. Neuron. 34 (1), 95-106 (2002).
- Lobanova, E. S., et al. Transducin translocation in rods is triggered by saturation of the GTPase-activating complex. The Journal of Neuroscience. 27 (5), 1151-1160 (2007).
- Strissel, K. J., Sokolov, M., Trieu, L. H., Arshavsky, V. Y. Arrestin translocation is induced at a critical threshold of visual signaling and is superstoichiometric to bleached rhodopsin. The Journal of Neuroscience. 26 (4), 1146-1153 (2006).
- Nair, K. S., et al. Light-dependent redistribution of arrestin in vertebrate rods is an energy-independent process governed by protein-protein interactions. Neuron. 46 (4), 555-567 (2005).
- Strissel, K. J., et al. Recoverin undergoes light-dependent intracellular translocation in rod photoreceptors. The Journal of Biological Chemistry. 280 (32), 29250-29255 (2005).
- Calvert, P. D., Strissel, K. J., Schiesser, W. E., Pugh, E. N., Arshavsky, V. Y. Light-driven translocation of signaling proteins in vertebrate photoreceptors. Trends in Cell Biology. 16 (11), 560-568 (2006).
- Majumder, A., et al. Transducin translocation contributes to rod survival and enhances synaptic transmission from rods to rod bipolar cells. Proceedings of the National Academy of Sciences of the United States of America. 110 (30), 12468-12473 (2013).
- Fain, G. L. Why photoreceptors die (and why they don't). BioEssays. 28 (4), 344-354 (2006).
- Chen, J., Simon, M. I., Matthes, M. T., Yasumura, D., LaVail, M. M. Increased susceptibility to light damage in an arrestin knockout mouse model of Oguchi disease (stationary night blindness). Investigative Ophthalmology & Visual Science. 40 (12), 2978-2982 (1999).
- Song, X., et al. Arrestin-1 expression level in rods: balancing functional performance and photoreceptor health. Neuroscience. 174, 37-49 (2011).
- McConnell, D. G. The isolation of retinal outer segment fragments. The Journal of Cell Biology. 27 (3), 459-473 (1965).
- Tsang, S. H., et al. Role for the target enzyme in deactivation of photoreceptor G protein in vivo. Science. 282 (5386), 117-121 (1998).
- Walston, S. T., Chow, R. H., Weiland, J. D. Patch clamp recordings of retinal bipolar cells in response to extracellular electrical stimulation in wholemount mouse retina. Annual International Conference of the IEEE Engineering in Medicine and Biology Society. 2015, 3363-3366 (2015).
- Guido, M. E., et al. A simple method to obtain retinal cell preparations highly enriched in specific cell types. Suitability for lipid metabolism studies. Brain Research. Brain Research Protocols. 4 (2), 147-155 (1999).
- Hayashi, F., et al. Phosphorylation by cyclin-dependent protein kinase 5 of the regulatory subunit of retinal cGMP phosphodiesterase. II. Its role in the turnoff of phosphodiesterase in vivo. The Journal of Biological Chemistry. 275 (42), 32958-32965 (2000).
- Wolbring, G., Cook, N. J. Rapid purification and characterization of protein kinase C from bovine retinal rod outer segments. European Journal of Biochemistry. 201 (3), 601-606 (1991).
- Williams, D. S., et al. Characterization of protein kinase C in photoreceptor outer segments. Journal of Neurochemistry. 69 (4), 1693-1702 (1997).
- Watson, A. J., Aragay, A. M., Slepak, V. Z., Simon, M. I. A novel form of the G protein beta subunit Gbeta5 is specifically expressed in the vertebrate retina. The Journal of Biological Chemistry. 271 (45), 28154-28160 (1996).
- Makino, E. R., Handy, J. W., Li, T., Arshavsky, V. Y. The GTPase activating factor for transducin in rod photoreceptors is the complex between RGS9 and type 5 G protein beta subunit. Proceedings of the National Academy of Sciences of the United States of America. 96 (5), 1947-1952 (1999).
- Chen, J., Shi, G., Concepcion, F. A., Xie, G., Oprian, D. Stable rhodopsin/arrestin complex leads to retinal degeneration in a transgenic mouse model of autosomal dominant retinitis pigmentosa. The Journal of Neuroscience. 26 (46), 11929-11937 (2006).
- Chen, C. K., et al. Abnormal photoresponses and light-induced apoptosis in rods lacking rhodopsin kinase. Proceedings of the National Academy of Sciences of the United States of America. 96 (7), 3718-3722 (1999).
- Zhang, H., et al. Mistrafficking of prenylated proteins causes retinitis pigmentosa 2. FASEB Journal. 29 (3), 932-942 (2015).
- Weiss, E. R., et al. Species-specific differences in expression of G-protein-coupled receptor kinase (GRK) 7 and GRK1 in mammalian cone photoreceptor cells: implications for cone cell phototransduction. The Journal of Neuroscience. 21 (23), 9175-9184 (2001).
- Zhao, X., Huang, J., Khani, S. C., Palczewski, K. Molecular forms of human rhodopsin kinase (GRK1). The Journal of Biological Chemistry. 273 (9), 5124-5131 (1998).
- Newton, A. C., Williams, D. S. Involvement of protein kinase C in the phosphorylation of rhodopsin. The Journal of Biological Chemistry. 266 (27), 17725-17728 (1991).
- Pinzon-Guzman, C., Zhang, S. S., Barnstable, C. J. Specific protein kinase C isoforms are required for rod photoreceptor differentiation. The Journal of Neuroscience. 31 (50), 18606-18617 (2011).
- Sokal, I., et al. Identification of protein kinase C isozymes responsible for the phosphorylation of photoreceptor-specific RGS9-1 at Ser475. The Journal of Biological Chemistry. 278 (10), 8316-8325 (2003).
- Rose, K., Walston, S. T., Chen, J. Separation of photoreceptor cell compartments in mouse retina for protein analysis. Molecular Neurodegeneration. 12 (1), 28 (2017).
- Wright, A. F., Chakarova, C. F., Abd El-Aziz, M. M., Bhattacharya, S. S. Photoreceptor degeneration: genetic and mechanistic dissection of a complex trait. Nature Reviews. Genetics. 11 (4), 273-284 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados