Method Article
שתי שיטות פילינג לבידוד תאי קולטני אור ברשתית העכבר לניתוח חלבונים
In This Article
Summary
פרוטוקול זה מציג שתי טכניקות לבודד את התאים התת-תאיים של קולטני מוט מורין לניתוח חלבונים. השיטה הראשונה משתמשת בשרשתית חיה ונייר סינון תאית כדי להפריד מקטעים חיצוניים מוט, ואילו השני משתמש ברשתית ליופילית וקלטת דבק כדי לקלף שכבות מגזר פנימיות וחיצוניות מוט.
Abstract
קולטני אור מוט הם נוירונים חושיים מקוטבים מאוד עם תאים נפרדים. מוטות העכבר ארוכים (~ 80 מיקרומטר) ודקים (~ 2 מיקרומטר) והם ארוזים לרוחב בשכבה החיצונית ביותר של הרשתית, שכבת קולטן האור, וכתוצאה מכך יישור של תאים תת-תאיים אנלוגיים. באופן מסורתי, חתך משיק של הרשתית השטוחה הקפואה שימש לחקר התנועה והלוקליזציה של חלבונים בתוך תאי מוט שונים. עם זאת, העקמומיות הגבוהה של רשתית העכבר הדומיננטית מוט עושה חתך משיק מאתגר. מונע על ידי המחקר של הובלת חלבון בין תאים, פיתחנו שתי שיטות פילינג לבודד באופן אמין את החלק החיצוני מוט (ROS) ותאים תת תאיים אחרים עבור כתמים מערביים. הטכניקות המהירות והפשוטות יחסית שלנו מספקות שברים מועשרים ותת-תאיים ספציפיים כדי למדוד כמותית את ההפצה וההפצה מחדש של חלבונים קולטני אור חשובים במוטות רגילים. יתר על כן, טכניקות בידוד אלה יכולות גם להיות מותאמות בקלות כדי לבודד ולחקור כמותית את הרכב החלבון של שכבות תאיות אחרות בתוך רשתית בריאה ומנוונת כאחד.
Introduction
תאי קולטני אור מוט, ארוזים היטב בשכבה החיצונית ביותר של הרשתית העצבית, הם חלק בלתי נפרד מראיית אור עמום. כדי לתפקד כמוני פוטון נאמנים, מוטות משתמשים במסלול איתות מבוסס חלבון G, המכונה פוטו-טרנסדוקציה, כדי ליצור תגובות מהירות, מוגברות וניתנות לשחזור ללכידת פוטון יחיד. תגובה זו לאור בסופו של דבר מפעילה שינוי בזרם בקרום הפלזמה ולאחר מכן מאותתת לשאר מערכת הראייה1. כפי ששמם מרמז, לכל תא מוט יש צורה ייחודית דמוית מוט והוא מציג מורפולוגיה תאית מקוטבת מאוד, המורכבת מקטע חיצוני (OS), קטע פנימי (IS), גוף התא (CB) ומסוף סינפטי (ST). לכל תא תת-תאי יש מכונות חלבון ספציפיות (קשורות ממברנה ומסיסות), תכונות ביו-מולקולריות ומתחמי חלבון הממלאים תפקידים מכריעים כגון פוטו-טרנסדוקציה חזותית, משק בית כללי וסינתזת חלבונים, והעברה סינפטית 2,3.
לפני יותר מ -30 שנה, התנועה ההדדית התלויה באור של חלבונים תת-תאיים, במיוחד טרנסדוצין (הרחק ממערכת ההפעלה) ו arrestin (לכיוון מערכת ההפעלה), נצפתה לראשונה4,5,5,6,7. בשלב מוקדם, תופעה נצפתה זו התקבלה בספקנות, בין היתר בשל הפגיעות של אימונוהיסטוכימיה למסכת אפיטופה8. בתחילת שנות ה -2000, טרנסלוקציה חלבון תלוי גירוי אושרה באמצעות טכניקת חתך פיזית קפדנית ומפרכת9. חתך משיק סדרתי של רשתית מכרסמים שטוחה קפואה ואחריו חיסונים גילה כי transducin9,10, arrestin11,12, ו recoverin13 כל לעבור הפצה מחדש תת תאית בתגובה לאור. הוא האמין כי טרנסלוקציה מונחית אור של חלבוני איתות מפתח אלה לא רק מווסת את הרגישות של מפל phototransduction9,14,15, אלא גם עשוי להיות neuroprotective מפני נזק אור16,17,18. מכיוון שהעברת חלבונים מונחית אור במוטות נראית משמעותית מאוד לביולוגיה ופיזיולוגיה של תאי מוט, טכניקות המאפשרות בידוד של תאים תת-תאיים שונים כדי לקבוע את התפלגות החלבון הן כלי מחקר יקרי ערך.
נכון לעכשיו, ישנן מספר שיטות שמטרתן לבודד את התאים התת-תאיים מוט. עם זאת, שיטות אלה יכולות להיות ארוכות וקשה להתרבות, או לדרוש כמות ניכרת של בידוד רשתית. תכשירי קטע חיצוני מוט (ROS) באמצעות צנטריפוגה שיפוע צפיפות19, למשל, משמש בדרך כלל כדי להפריד את ROS מן הומוגנט רשתית. שיטה זו נמצאת בשימוש נרחב עבור כתם מערבי, אבל ההליך הוא זמן רב מאוד דורש מינימום של 8-12 retinae murine20. מצד שני, חתך משיק סדרתי של מורין קפוא ורשתית חולדה יושם בהצלחה בבידוד מערכת ההפעלה, IS, CB, ו ST9,11,13. עם זאת, שיטה זו מאתגרת מבחינה טכנית בשל הצורך של שיטוח מלא של רשתית מורין קטנה ומעוקלת מאוד כדי ליישר את שכבות הרשתית לפני חתך משיק. מכיוון שיש שפע של מודלים של עכברים ועכברים מהונדסים המסכמים מחלות של מערכת הראייה, יצירת טכניקה המפרידה באופן אמין, מהיר וקל מפריד בין תאי מוט בודדים מחזיקה בהבטחה בחשיפת התהליכים הפיזיולוגיים המתרחשים בכל תא מיוחד ואת המנגנונים העומדים בבסיס תהליכים חזותיים בבריאות ובמחלות.
כדי להקל על חקירות אלה, אנו מתארים שתי שיטות פילינג המבודדות תאים תת-תאיים מוט בקלות רבה יותר מהפרוטוקולים הנוכחיים. שיטת הפילינג הראשונה, המותאמת מטכניקה לחשיפת תאים דו-קוטביים בעלי תווית פלואורסצנטית להקלטת מהדק תיקון21, משתמשת בנייר סינון תאית כדי להסיר ברצף את ה- ROS מרשתית מורין חיה ומבודדת (איור 1). השיטה השנייה, המותאמת מהליך המבודד את שלוש שכבות תאי הרשתית העיקריות מרשתית אפרוח 22 וצפרדע23, משתמשת בסרט הדבקה כדי להסיר את החלק הפנימי ROS והמוט (RIS) מרשתית ליופילית (איור 2). ניתן להשלים את שני ההליכים תוך שעה אחת והם ידידותיים במידה ניכרת למשתמש. אנו מספקים אימות של האפקטיביות של שני פרוטוקולי הפרדה אלה עבור כתם מערבי על ידי שימוש ברשתית כהה מותאמת אור חשוף אור מעכברי C57BL / 6J כדי להדגים טרנסלוקציה הנגרמת על ידי אור של transducin מוט (GNAT1) ו arrestin (ARR1). יתר על כן, באמצעות שיטת פילינג הקלטת, אנו מספקים ראיות נוספות לכך שניתן להשתמש בטכניקה שלנו כדי לבחון ולטפל בחוסר עקביות בין נתוני לוקליזציה של חלבונים שנרכשו על ידי אימונוציטוכימיה (ICC) וכתמים מערביים. באופן ספציפי, הטכניקה שלנו הראתה כי: 1) חלבון קינאז C-אלפא (PKCα) איזופורם קיים לא רק בתאים דו קוטביים, אלא גם מורין ROS ו RIS, אם כי בריכוזים נמוכים24,25, ו 2) rhodopsin קינאז (GRK1) נמצא בעיקר במדגם מערכת ההפעלה המבודדת. נתונים אלה מדגימים את האפקטיביות של שתי טכניקות הפילינג שלנו להפרדה וכימות של חלבוני מוט ורשתית ספציפיים.
Protocol
כל הניסויים בוצעו על פי ההנחיות המוסדיות המקומיות של הוועדה לטיפול בבעלי חיים מחקר מאוניברסיטת דרום קליפורניה (USC).
1. שיטת פילינג רשתית תא חי
- הכנת המאגרים של איימס, ניירות קילוף ומנת ביתור
- באמצעות מספריים קשתית קצה קהה (או סוג מספריים שווה ערך), לחתוך את נייר מסנן תאית (כיתה 413) לתוך מלבנים מדידה כ 5 מ"מ x 2.5 מ"מ. אחסן את הגזירים לשימוש עתידי.
- הכן 1 L של חיץ HEPES של איימס על ידי שילוב בקבוק אחד של מדיום איימס, 2.38 גרם HEPES, ו 0.877 גרם של NaCl. ממיסים את הריאגנטים בבקבוק זכוכית סטרילי עם מים אולטרה-פורים מזוקקים ומתאימים את האוסמולריות וה-pH ל-280 mOsm ו-7.4, בהתאמה. מסננים לחיטוי (גודל נקבוביות 0.2 מיקרומטר), אוטמים את המכסה בסרט פרפין ומאחסנים בטמפרטורה של 4 °C (60 °F).
- הכן 1 ליטר של חיץ ביקרבונט של איימס על ידי שילוב בקבוק אחד של מדיום איימס ו 1.9 גרם של NaHCO3. ממיסים את הריאגנטים בבקבוק זכוכית סטרילי עם מים אולטרה-פורים מזוקקים ומתאימים את האוסמולריות וה-pH ל-280 mOsm ו-7.4, בהתאמה. מסננים לחיטוי (גודל נקבוביות 0.2 מיקרומטר), אוטמים את המכסה בסרט פרפין ומאחסנים בטמפרטורה של 4 °C (60 °F).
הערה: ניתן להכין מראש את מאגרי ה-HEPES וה-Bicarbonate של איימס ולאחסן אותם למשך שבוע אחד בטמפרטורה של 4 מעלות צלזיוס. - בתחתית צלחת פטרי 35 x 10 מ"מ, ליצור תבנית סריג או לוח דמקה עם אזמל (להב מס '11, 40 מ"מ).
הערה: החלק התחתון בעל המרקם של צלחת הפטרי מחזיק את העין המבודדת והחופשית צפה במקומה במהלך ניתוח הרשתית.
- ניתוח של הרשתית
הערה: עבור הליך זה, יש להביא את המאגר ולשמור אותו בטמפרטורת החדר (RT). רענן את מאגר הדו-קרבונט של איימס כל 15 דקות עם חיץ ביקרבונט טרי של איימס במהלך הניתוח. זה שומר על ה-pH הפיזיולוגי הדרוש.- בסביבות 15-20 דקות לפני הניתוח, לחמצן את חיץ HEPES של איימס במעבדה של 100 מ"ל או בקבוק מדיה המצויד במתאם כובע צינור ולבעבע את מאגר ביקרבונט של איימס עם 95% O2 ו 5% CO2 בתא דגירה של רקמות ובמעבדה של 100 מ"ל או בקבוק מדיה המצויד במתאם כובע צינור.
- המתת חסד מספר שווה של שני המינים של עכברי C57BL/6J (בני 2-3 חודשים) או על ידי שאיפת איזופלוראן או פחמן דו חמצני (CO2) ואחריו נקע צוואר הרחם. לעטוף את העיניים עם מספריים מעוקלים ולהניח את העיניים לתוך מרקם 35 x 10 מ"מ צלחת פטרי מלא עם חיץ ביקרבונט של איימס מבעבע.
- צרו עיניים (איור 1A) על ידי ניקוב חור בצומת הקרנית-לימבוס עם מחט של 18 גרם. לחתוך לאורך ההיקף של צומת זה באמצעות מספריים קשתית מיקרו-לנתח כדי להסיר את הקרנית של כל עין. מפרידים את העדשה ואת ההומור הזגוגי מכל עין באמצעות פינצטה ומשליכים.
- לבודד את הרשתית מכוס העין על ידי קילוף בזהירות את הרשתית פיגמנט אפיתל (RPE)-sclera-choroid קומפלקס הרחק מהרשתית העצבית. השלך את קומפלקס RPE-sclera-choroid. ודא שהרשתית אינה פגומה במהלך הניתוח על-ידי טיפול רק בקצוות.
- מעבירים רשתית מבודדת באמצעות פיפטה רחבה של העברת שעמום למכסה של צלחת 60 x 15 מ"מ מלאה במאגר ביקרבונט של איימס מבעבע.
- כוון את הרשתית בצורת חצי הכדור קעור כלפי מעלה (קולטני האור פונים כלפי מטה לכיוון תחתית המנה) וחצה כל רשתית (דרך עצב הראייה) באמצעות מספריים איריס או אזמל (להב מס '10, 40 מ"מ). חתכו את הקצוות המעוקלים של כל חצי רשתית כדי ליצור שני מלבנים (איור 1A).
הערה: מזעור העקמומיות של כל רשתית חצויה מאפשר לרשתית להשתטח טוב יותר בשלבי הפילינג הבאים ומייצר קליפה מדויקת של שכבת החלק החיצוני של המוט (ROS). - אחסן את הרשתית החצויה בתא הדגירה של הרקמות כי הוא בועות ברציפות עם 95% O2 ו 5% CO2.
הערה: רשתית מבודדת ניתן לשמור במאגר ביקרבונט של איימס קרבוגנטי במשך ~ 24 שעות.
- אוסף קטע חיצוני מוט (ROS) על-ידי פילינג נייר סינון
הערה: רענן את מאגר HEPES המחומצן של RT איימס כל 15-20 דקות במהלך תהליך הפילינג כדי לשמור על החומציות הפיזיולוגית הדרושה.- מעבירים מלבן רשתית אחד מתא הרקמות עם פיפטת העברה רחבת שעמום וחתיכת נייר סינון 5 מ"מ x 2.5 מ"מ לצלחת פטרי בגודל 35 x 10 מ"מ מלאה במאגר HEPES של איימס עם בועות 100% O2.
- כוונו את הרשתית המחוצצת כלפי מעלה וודאו שצורכי האור פונים כלפי מטה לכיוון החלק התחתון של המנה. אוחזים קלות בצידי הרשתית החצויה עם פינצטה ומזיזים אותה על גבי נייר הסינון. לאחר שהרשתית ממורכזת בנייר הסינון, הזיזו את נייר הסינון כלפי מעלה כך שהרשתית החצויה תיגע בנייר המסנן כדי ליצור את הידבקות הנייר ROS-to-filter (איור 1B).
הערה: ודאו ששכבת קולטן האור יוצרת קשר ישיר עם נייר הסינון. - הרם בזהירות את נייר הסינון עם הרשתית המצורפת מתוך מאגר HEPES של איימס. הניחו את הצד התחתון של נייר הסינון (הצד ללא הרשתית) על מגבת נייר ושטפו 2-3 פעמים לייבוש (איור 1B).
- הוסף טיפה של HEPES של איימס על הצד של נייר המסנן עם הרשתית. מניחים את נייר הסינון על מגבת הנייר שוב לייבוש, כפי שתואר זה עתה. חזור על תהליך זה פעמיים נוספות.
- מחזירים את נייר הסינון עם הרשתית לצלחת הפטרי. בעזרת פינצטה, דוחפים בעדינות את כל הקצוות של הרשתית החצויה למעלה והרחק מנייר הסינון מכל הצדדים.
- מקלפים בעדינות את הרשתית מנייר הסינון. גע רק בהיקף הקיצוני של הרשתית במהלך תהליך הפילינג כדי לשמור על השלמות המבנית של הרשתית.
- מרימים את נייר הסינון מצלחת הפטרי ומסירים נוזל עודף על מגבת נייר. ודא שהצד שהיה במגע עם הרשתית אינו יוצר קשר עם מגבת הנייר.
- הניחו את נייר הסינון עם שכבת ה-ROS החלקית בצינור מסומן בקרח (איור 1B). שמור את הרשתית הקלופה שקועה במאגר HEPES של איימס.
- חזור על תהליך הפילינג עבור רשתית חצויה זו כ 7-8 פעמים כדי להסיר את שכבת ROS כולה. לאחר כל קליפה, מניחים את נייר הסינון לתוך אותו צינור, אשר יכיל את ROS המבודד מרשתית חצויה אחת.
הערה: יש להקפיד לא לקרוע את הרשתית החצויה בעת קילוף אותה מנייר הסינון, שכן הרשתית הופכת דקה יותר במהלך תהליך זה. - מניחים את הצינור המכיל את כל קליפות נייר הסינון של ROS המבודד על קרח לשימוש מיידי או להקפיא ישירות על קרח יבש ולאחסן ב -80 °C (80 °F).
- השתמש פינצטה כדי להעביר את הרשתית קלופה שאריות (חסר ROS) לתוך צינור מסומן כראוי. מניחים את הצינור על קרח לשימוש מיידי או להקפיא עם קרח יבש ולאחסן ב -80 °C (80 °F).
- חזור על תהליך הפילינג עבור כל רשתית חצויה וסמן במדויק כל צינור.
2. שיטת פילינג רשתית Lyophilized
- חוצצים, מדיום קילוף, הכנת צלחת ביתור, והגדרת ליופילר
- בבקבוק אחסון של 1 ליטר, הכינו את הפתרון של הצלצול על ידי הוספת 500 מ"ל של מים מזוקקים במיוחד. להמיס את הריאגנטים כדי להגיע לריכוז סופי של 130 mM NaCl, 3.6 mM KCl, 2.4 mM MgCl2, 1.2 mM CaCl2, 10 mM HEPES, ו 0.02 mM EDTA. כווננו את רמת החומציות ל-7.4 עם NaOH, הוסיפו מים אולטרה-פור כדי להביא את הנפח הסופי ל-1 ליטר והתאמו את ה-osmolarity ל-313 mOsm.
- לפני השימוש, לסנן את הפתרון של רינגר עם מסנן סטרילי (גודל נקבוביות 0.2 מיקרומטר), לאטום את המכסה עם סרט פרפין, ולאחסן ב 4 °C (60 °F).
- באמצעות מספריים קשתית קצה קהה (או סוג מספריים שווה ערך), לחתוך את נייר מסנן תאית לתוך מלבנים מדידה כ 5 מ"מ x 2.5 מ"מ. השתמש בעיפרון כדי לכתוב בצד אחד של נייר הסינון כדי ליצור תווית ייחודית.
- צור תבנית סריג או דמקה בתחתית צלחת פטרי 35 x 10 מ"מ באמצעות אזמל (להב מס '11, 40 מ"מ).
- הפעל את הליופילרייזר בהתאם למפרט היצרן.
- לרכוש חנקן נוזלי בבקבוק Dewar או בקבוק ואקום מבודד דומה.
- כריתת רשתית
- השלם את ניתוח הרשתית כמתואר בסעיף 1 של הפרוטוקול (איור 1A). השתמש בפתרון של קר רינגר במקום חוצץ איימס.
- לאחר הניתוח, לאחסן את הרשתית המלבנית חצויה בצלחת פטרי 35 x 10 מ"מ ממולאת בתמיסה של רינגר קר ומניחים על הקרח.
- הכנת מדגם רשתית לליופיליזציה
- מניחים פיסת נייר סינון בגודל 5 x 2.5 מ"מ ומעבירים רשתית חצויה לצלחת פטרי בגודל 35 x 10 מ"מ ממולאת במאגר של צלצול קר. השתמשו בפיפטה רחבה להעברה כדי להעביר כל רשתית בין הכלים.
- השתמשו בפינצטה כדי להפוך בזהירות את הרשתית כך שהיא תהיה קעורה מכוונת כלפי מעלה (קולטני האור מצביעים כלפי מעלה) והזיזו אותה כך שהיא תישען על נייר הסינון (איור 2A).
הערה: ודאו שצולי האור אינם יוצרים קשר עם נייר הסינון (שכבת תא גנגליון הרשתית צריכה להיות במגע ישיר עם נייר הסינון) והתווית הייחודית גלויה. כדי לזהות בקלות ובמהירות את בידוד הרשתית, מומלץ כי התווית הייחודית צריכה להיות ממוקמת בחלק התחתון של נייר הסינון. - הרם את נייר הסינון בקצוות כלפי מעלה כדי שחתיכת הרשתית החצויה תיגע בנייר הסינון ותמשיך להרים את נייר הסינון מהפתרון של הצלצול.
- מניחים את הצד התחתון של נייר הסינון (הצד ללא הרשתית עליו) על מגבת נייר ומטפטפים בזהירות 2-3 פעמים כדי להסיר נוזל עודף (איור 2A).
- הרימו את נייר הסינון עם פינצטה והוסיפו טיפה של צלצול קר על הצד של נייר הסינון עם הרשתית. מניחים שוב את נייר הסינון על מגבת הנייר כדי להסיר נוזל עודף. חזור על התהליך פעמיים נוספות.
הערה: שלבי הרטבה וייבוש מתחלפים אלה מבטיחים שהרקמה מחוברת היטב לנייר הסינון. - יש לאחסן כל דגימת נייר רשתית/סינון דבוקה בצלחת פטרי מלאה ב-Ringer's קר עד שתהיה מוכנה להקפיא את כל הדגימות. חזור על תהליך זה עבור כל הרשתית החצויה.
- קבל צלחת פטרי נקייה ויבשה בגודל 35 x 10 מ"מ (למטה בלבד) וחתיכת רדיד אלומיניום שנחתכה לריבוע בגודל 3.5 x 3.5 אינץ'.
- הרימו כל דגימה מהמאגר של הצלצול הקר עם פינצטה. ודא כי פינצטה ליצור קשר רק עם קצוות נייר הסינון, הימנעות הרשתית חצויה.
- מניחים את הצד התחתון של כל נייר סינון (הצד ללא הרשתית עליו) על מגבת נייר ומסירים נוזל עודף.
- הוסיפו טיפה של PBS קר 1x (137 מ"מ NaCl, 2.7 mM KCl, 10 mM Na2HPO4, 2 mM KH2PO4, pH 7.4) על הצד של נייר המסנן שבו הרשתית דבקה. יש למרוח את נייר הסינון על מגבת הנייר כדי להסיר עודפי נוזלים.
הערה: ודא שהלחות מנייר הסינון מוסרת במידה מספקת לפני ההקפאה. - מניחים את כל חתיכות נייר הסינון לתוך צלחת פטרי 35 x 10 מ"מ. השתמשו בנייר טישו ללא מוך כדי לקלף כל נוזל עודף המקיף את נייר הסינון.
הערה: אין לדחוס את צלחת הפטרי בדגימות. אם נעשה שימוש ביותר מארבע עיניים מוריניות, שקול להשתמש בצלחת פטרי גדולה יותר או במספר מנות פטרי קטנות יותר כדי להחזיק את דגימות נייר הרשתית / המסנן. - עוטפים בחוזקה את כל המנה בנייר אלומיניום. ודא כי הקצוות של רדיד האלומיניום מאובטחים ולחץ בצורה חלקה לתוך החלק התחתון של צלחת פטרי. ניקבו חופן חורים בגודל 0.1-0.2 מ"מ במכסה רדיד האלומיניום (איור 2A).
- באמצעות מלקחיים מתכת, בהדרגה להוריד את רדיד אלומיניום מכוסה צלחת פטרי לתוך החנקן הנוזלי. שמור את הדגימות בחנקן הנוזלי (<10 דקות) עד מוכן lyophilize.
- ליופיליזציה
- מניחים את רדיד האלומיניום מכוסה צלחת פטרי לתוך בקבוק ייבוש בהקפאה ולחבר אותו למכונת lyophilizer בעקבות הפרוטוקול של היצרן. ליופיל את הרשתית במשך 30 דקות.
- לנתק את הבקבוקון מן lyophilizer ולכבות את המכונה על פי היצרן.
- הסר את רדיד האלומיניום או לעבוד עם דגימות מיובשות בהקפאה באותו יום או לאחסן אותם כראוי מסומן כראוי 1 מ"ל צינורות microcentrifuge. מניחים צינורות אלה במיכל (כגון צינור חרוטי 50 מ"ל) מלא בייבוש נטול מים ומאחסנים את הדגימות בטמפרטורה של -80 מעלות צלזיוס.
- אוסף מוט חיצוני וקטע פנימי על ידי קילוף סרט דבק.
- חותכים רצועות של סרט הדבקה שקוף (1-2 ס"מ) ומאחסנים רצועות בקצה מתקן הטייפ/ספסל המעבדה/וכו' לשימוש מהיר.
- מעבירים דגימת רשתית אחת למכסה של צלחת פטרי מפלסטיק בגודל 60 x 15 מ"מ לפילינג. ודאו לתפוס רק את הקצוות החיצוניים ביותר של נייר הסינון והימנעו מלגעת ברשתית.
- באמצעות מספריים קשתית קצה קהה (או סוג מספריים שווה ערך), לחתוך חתיכת מלבני קטן של קלטת לגודל המשוער של הרקמה (1.5 x 2.5 מ"מ).
- הניחו בזהירות פיסת סרט קטנה על הרשתית הליופילית (איור 2B) והפעילו לחץ קל עם הפינצטה כדי לוודא שהיא מתחברת לשכבת קולטן האור (השכבה העליונה הכתומה/ורודה).
- לקלף לאט את הקלטת משם. הן המקטע החיצוני של המוט (ROS) והן המקטע הפנימי של המוט (RIS) יידבקו לקלטת (איור 2B).
- ודא שיש סרט לבן דק על פני השטח השבורים. זהו RIS.To להפריד את ה-RIS, להניח פיסת סרט נוספת ולדחוף את הסרט כלפי מטה על המשטח השבור (איור 2B).
הערה: ייתכן שיידרשו יותר מחתיכת סרט דבק אחת כדי להסיר את כל השכבה הלבנה הדקה. - מניחים את פיסת הסרט רק עם השכבה הכתומה/ורודה לתוך צינור microcentrifuge שכותרתו +ROS.
- מקם את הקלטת או חתיכות הסרט עם השכבה הלבנה הדקה לתוך צינור microcentrifuge שכותרתו +RIS.
הערה: הפרדת הרשתית הליופילית באמצעות קלטת דורשת תרגול. כמות הלחץ המופעלת על הקלטת תשפיע על האופן שבו המדגם הליופילי יתפרק. אם יותר מדי לחץ מופעל על הקלטת על המדגם, כל הרשתית lyophilized יהיה לקלף את נייר הסינון יהיה מקל על הקלטת. אם מוסיפים מעט מדי לחץ לקלטת, השכבה העליונה הכתומה/ורודה (+ROS) לא תידבק לקלטת. - לאסוף את שאריות רקמת הרשתית (שכול של שכבות ROS ו RIS, -OIS) הממוקם על נייר המסנן על ידי קילוף את השכבה הלבנה העבה מנייר המסנן באמצעות קלטת. מקם את הבידוד לתוך צינור שכותרתו -OIS.
- חזור על שלבים אלה עבור כל דגימת רשתית חצויה.
- יש לאחסן את השכבות המבודדות מהרשתית הליופילית בטמפרטורת החדר אם מבצעים כימות חלבונים, אלקטרופורזה ג'ל ואימונולוט חלבון באותו יום, או לאחסן במיכל (כגון שפופרת חרוטית של 50 מ"ל) ממולא בייבוש נטול מים בטמפרטורה של -80 מעלות צלזיוס לשימוש מאוחר יותר.
3. הכנת מדגם כתם מערבי לבידודי קילוף
- הכנת מאגר תמוגה של RIPA
- בבקבוק אחסון של 100 מ"ל, הוסיפו ריאגנטים כדי לקבל ריכוז סופי של 50 מ"מ טריס-HCl pH 7.4, 150 מ"מ NaCl, 1% טריטון X-100, 1% נתרן דאוקסיכולט, 0.1% SDS ו-1 מ"מ EDTA. מוסיפים 100 מ"ל של מים אולטרה-פורים שעברו דה-יוניזציה ומערבבים היטב.
הערה: מאגר תמוגה RIPA ניתן לאחסן ב 2-8 °C (5 °F) במשך 2-3 שבועות. לאחסון ארוך יותר, aliquot ולאחסן במקפיא -20 °C (60 °F). - ביום הניסוי, הוסיפו קוקטייל מעכב פרוטאז (0.1 M PMSF, 1:1000 אפרוטינין ו-1:1000 לאלופפטין) למאגר תמוגה של RIPA ושמרו על הקרח.
- בבקבוק אחסון של 100 מ"ל, הוסיפו ריאגנטים כדי לקבל ריכוז סופי של 50 מ"מ טריס-HCl pH 7.4, 150 מ"מ NaCl, 1% טריטון X-100, 1% נתרן דאוקסיכולט, 0.1% SDS ו-1 מ"מ EDTA. מוסיפים 100 מ"ל של מים אולטרה-פורים שעברו דה-יוניזציה ומערבבים היטב.
- סינון נייר קילוף lysate הכנה עבור כתם מערבי
- ודא כי צינורות המכילים את קליפות נייר המסנן ושאריות רשתית קלופה נשמרים על קרח (לניסוי באותו יום) או מוסרים מאחסון מקפיא של -80 °C (80 °F) ומונחים על קרח.
- הסר כל נוזל עודף מתחתית צינורות microcentrifuge המכילים את קליפות נייר המסנן. יש לסובב במהירות צנטריפוגה קטנה ל-2-4 שניות ולהשליך כל נוזל שנותר.
- פיפטה 45-55 μL של חיץ RIPA קר לתוך צינורות המכילים את נייר המסנן לבודד.
- הופכים כל דגימה להומוגנית עם מערבל עלים נקי ומשופץ אוטומטי למשך דקה אחת. ודאו שנייר הסינון שומר על קשר עם מערבל העלים. שמור את נייר הסינון בצד של כל צינור ולא בתחתית.
- עם פינצטה, להזיז את ניירות המסנן לצד של כל צינור ולסובב את צנטריפוגה מיני עבור 2-4 שניות. פעולה זו תסיר את מאגר RIPA מנייר הסינון.
- הסר נייר סינון מיובש וחזור על הפעולה עבור כל ניירות הסינון בתוך כל צינור במידת הצורך.
- מעבירים את ההומוגנט לצינור חדש ומתייגים אותו כראוי.
הערה: זהו השלב הגוזל זמן רב ביותר, ואם לא יושלם כראוי, חלק גדול מהדגימה בסופו של דבר ייספג על ידי נייר הסינון. - פיפטה 60-80 μL של חיץ RIPA קר לתוך הצינורות בודדים עם שאריות רשתית קלופה.
- הופכים כל דגימה להומוגנית עם מערבל עלים נקי ומשופץ אוטומטי למשך דקה אחת.
- הקלטת קילוף Lysate הכנה עבור כתם מערבי
- מניחים את הדגימות RT lyophilized או -80 °C דגימות על קרח.
- פיפטה 50-70 μL של חיץ RIPA קר לתוך כל צינור המכיל +ROS ו + קליפות קלטת RIS.
- פיפטה 60-80 μL של חיץ תמוגה קרה לתוך צינורות -OIS המכילים את הרשתית lyophilized הנותרת, עם ROS ו RIS הוסרו.
- עושים הומוגניזציה לכל דגימה עם מערבל עלים נקי למשך דקה אחת. ודא שהקלטת בצינורות הבודדים שומרת על קשר עם מערבל העלים וחיץ התמזה.
- עם פינצטה מעוקרת, להזיז את הסרט לצד הצינורות ולסובב עם צנטריפוגה מיני עבור 2-4 שניות. זה יסיר את הנוזל מהקלטת. הסר את הסרט המיובש מהצינורות.
הערה: בשלב זה, אתה יכול לשלב שני מבודדי רשתית למחצה מאותה רשתית עבור שיטת 'פילינג נייר סינון' או 'קילוף סרט' כדי להבטיח שיש לך מספיק נפח כדי לבצע בדיקת חומצה bicinchoninic (BCA).
תוצאות
האסטרטגיות הנוכחיות פותחו כדי לספק שיטות מהירות ופשוטות יחסית לבודד ולנתח חלבונים בין תאים תת-תאיים מוט ספציפיים לניתוח כתמים מערביים. יישמנו שתי טכניקות פילינג רציפות (איור 1 ואיור 2) ואחריהן חיסונים כדי להדגים שניתן להשתמש בשיטות אלה באופן אמין כדי לזהות את ההתפלגות הידועה של טרנסדוצין מוט (GNAT1) ו- arrestin (ARR1) הן בבעלי חיים כהים והן בבעלי חיים המותאמים לאור. כדי לאמת את האפקטיביות של שני הפרוטוקולים שלנו בדיוק בידוד תאים תת-תאיים מוט ללא זיהום משכבות תאיות אחרות, חיסונים נחקרו עם נוגדנים עבור ציטוכרום C (Cyt C), actin, ו Gß5S / Gß5L26. רשימה של נוגדנים ודילולים המשמשים מוצגת בטבלה 1. ציט C ו actin הצביעו על טוהר ROS, כפי שהם חלבונים בשפע ברשתית הפרוקסימלית אבל נעדרים ROS. Gß5L, רכיב של GTPase הפעלת חלבון (GAP) עבור GNAT127, נמצא ROS ו RIS ושימש בקרה עבור בידודים אלה. Gß5S, איזופורם החיבור הקצר יותר שאינו קיים ב- ROS או RIS אך נמצא בכל תאי המוט האחרים, שימש כפקד עבור תאים תת-תאיים מבודדים שאינם ROS / RIS.
ראשית, האפקטיביות של שיטת פילינג הרשתית החיה הרציפה שלנו הוערכה על ידי ניתוח ההתפלגות של GNAT1 ו- ARR1 במוטות של עכברים כהים ומותאמים לאור (איור 3). ניירות הסינון המכילים את ROS (+ROS) אוגדו מתוך רשתית שלמה אחת בסך הכל, והרקמה השיורית המתאימה (-ROS) שולבה גם היא. האותות מהחלבונים שצוינו הושוו לאחר מכן בין דגימות +ROS לבין דגימות ה- -ROS, ורשתית מבודדת שלמה שימשה כבקרת קלט. ריכוז חלבון ונפח הומוגניזציה עבור דגימות אלה מוצגים בטבלה 2. התוצאות שהוצגו באיור 3A מראות כי בבעלי חיים שהותאמו בחשיכה, ההתפלגות של GNAT1 ו-ARR128 התאימה באופן הדוק להפצות המצב האפל הידועות שלהם, שבהן האות GNAT1 היה החזק ביותר בבידוד +ROS, בעוד שאות ה-ARR1 היה חזק יותר בבידוד -ROS. בהתאם לכך, ברשתית החשופה לאור, האות GNAT1 הופחת באופן ניכר בבידוד +ROS והיה לו אות מוגבר במדגם -ROS, בעוד טרנסלוקציה ARR1 הנגרמת על ידי אור ניתן לדמיין בדגימות +ROS ו- -ROS. תוצאות משישה ניסויים שונים כונתו, ונמצאו הבדלים מובהקים סטטיסטית בין תנאי אור/כהים עבור GNAT1 ו-ARR1 בדגימות +ROS ו-ROS (איור 3B). ממצאים אלה עולים בקנה אחד עם התנועה האור/כהה של החלבון הידועה בעבר בתוך תאי מוט ומצביעים בחום על כך שטכניקה זו יכולה לבודד שברי +ROS מועשרים.
כדי לאמת עוד יותר את שיטת פילינג התא החי שלנו, חקרנו הפצות ידועות של סמן טוהר ROS הן בדגימות +ROS והן ב- -ROS. הן בדגימות כהות והן בדגימות המותאמות לאור, אותות Gß5S, Cyt C ו-actin אינם נכללים בדגימות +ROS (איור 3A), מה שמדגים היעדר זיהום משכבות תאיות אחרות. בנוסף, אות Gß5L נראה בבירור בדגימות +ROS (איור 3A). יתר על כן, אותות actin ו- Gß5L לא רק אישרו את הטוהר של שברי +ROS ו- -ROS, אלא גם פעלו כפקדים לנורמליזציה, עם האותות מדגימות +ROS להיות מנורמל נגד Gß5L ו - ROS דגימות להיות מנורמל נגד actin. כפי שמוצג באיור 3A, מומלץ כי בידודי פילינג התאים החיים ייטענו לצד בקרת טעינה, במיוחד הומוגנט רשתית שלמה, לנורמליזציה וניתוח חיסוניים אופטימליים. יחד, נתונים אלה מאמתים כי שיטת פילינג התאים החיים שלנו יכולה לספק גישה מהירה וניתנת לשחזור כדי לבודד את השכבה התת-תאית ROS משאר המוט והרשתית לניתוח חלבונים.
לאחר מכן הערכנו את טכניקת הפילינג הליופילית שלנו כדי לוודא ששיטה זו יכולה לבודד באופן רב את תאי ROS ו- RIS. לפני החיסון, דמיינו את המשטחים של רשתית עכבר ליופילית שלמה וקלופה באמצעות מיקרוסקופ אלקטרונים סורק (SEM) כדי לנתח איזו שכבה תת-תאית של קולטני אור הניבה פילינג הסרט (איור 4). לפני קילוף עם סרט הדבקה, פני השטח של הרשתית השלמות (שכבה כתומה/ורודה בגוון) תאמו באופן הדוק לפרופיל של ROS הגלילי האופייני (איור 4A). לאחר קליפת הסרט הראשונית, נראה כי ה-ROS וה-RIS הוסרו לחלוטין, כפי שמעיד השכבה הגרעינית האחודה הקיימת על פני השטח של הרשתית הליופילית הקלופה (איור 4C). קליפות הסרט הבאות הסירו את ה-RIS (שכבה לבנה דקה, איור 4B) מהמשטח החופשי של השכבה הקלופה, תהליך שסביר להניח שנעזר בסיליום המחבר הצר והשברירי המקשר בין המקטעים הפנימיים והחיצוניים. תוצאות אלה אישרו כי שכבות תת-תאיות מוט מרקמת רשתית lyophilized ניתן לפצל במיוחד באמצעות קלטת.
לאחר שאימתו את האפקטיביות של שיטה זו מבחינה חזותית, רשתית קלופה כהה ובהירה הותאמה הייתה נתונה לאימונופולציה תוך שימוש באותה גישה תוך שימוש בסמני חלבון לתאים שונים כפי שמתואר בשיטת פילינג התאים החיים שלנו (איור 3). ריכוז חלבונים ונפח הומוגניזציה לבידוד ROS (+ROS), בידוד RIS (+RIS) ושכבות הרשתית הנותרות (-OIS) מוצגות בטבלה 2. כצפוי, חלה תזוזה ברורה לאור עבור GNAT1 מה-ROS ל-RIS, כמו גם ARR1 מה-RIS ל-ROS (איור 5A). GNAT1 היה הנפוץ ביותר בדגימת +ROS בחושך ובדגימת +RIS באור, בעוד אות ARR1 היה הפוך (איור 5A). לאחר מכן נרמלנו וכימתנו את אותות החלבון המתמרים מבידוד +ROS, +RIS ו- OIS (איור 5B), תוך שימוש באותם פקדים וגישה כמו מתודולוגיית הפילינג החיה. שילבנו גם דגימות +RIS ו-OIS (איור 5C) להשוואה ישירה יותר לשיטת פילינג הנייר של סינון תאים חיים (איור 3B). שני הגרפים מראים את הטרנסלוקציה המבוססת והמאפיינת הנגרמת על ידי אור הן של GNAT1 והן של ARR1. בהתבסס על תצפיות אלה, הכנת קילוף הקלטת נראה להניב שברי ROS ו RIS מועשרים, כפי שמעיד הרכב החלבון של ARR1 ו- GNAT1 בבידודים אלה.
לאחר מכן, הטוהר של בידודים תת-תאיים בודדים הוערך. בדומה לתוצאות המוצגות באיור 3A, לדגימות +ROS לא היו אותות עבור אקטין, ציטוכרום C ו- Gß5S תוך הצגת אות Gß5L חזק (איור 5). ממצא זה מראה חוסר זיהום מתאים תת-תאיים אחרים בהכנת מדגם +ROS שלנו. תוכן החלבון של השכבה התת-תאית הבאה של המוט, בידוד +RIS, הוערך אז. מצאנו כי מדגם +RIS היה חיובי עבור Cyt C, Gß5L, ו actin. ממצא זה עולה בקנה אחד עם ההרכב הידוע של RIS, אשר עשיר במיטוכונדריה ואלמנטים ציטוסקנטליים. בשכבה הסופית, איזולט ה-OIS, היו התפלגות חלבונים התואמת לדגימות ה-ROS המוצגות באיור 3A.
כדי להעריך עוד יותר את התועלת של שיטת פילינג סרט הדבקה שלנו בחקירת הרכבי החלבון של תאי מוט תת-תאיים, בדקנו באופן ספציפי את חוסר החיסון של רודופסין קינאז (GRK1) וחלבון קינאז C-אלפא (PKCα) בדגימות +ROS, +RIS ו- -OIS שלנו. שיטות ניסיוניות שונות, כגון אימונוציטוכימיה (ICC) וכתם מערבי, מניבות לעתים קרובות תוצאות סותרות לגבי הלוקליזציה המדויקת של חלבונים אלה במוטות וברשתית. GRK1, למשל, נחשבת נפוצה יחסית במערכת ההפעלה מוט וחרוט כדי לתווך זרחן של opsins29 מופעל אור. עם זאת, חיסון של פרוסות רשתית חשף את הלוקליזציה של GRK1 או במיוחד ב OS30,31 או לאורך כל שכבת קולטני האור32. PKCα, לעומת זאת, הוא חלבון המשמש בדרך כלל עבור ICC לתיוג תאים דו קוטביים. למרות שאין ראיות ברורות של חיסון PKCα ספציפי מוט בפרוסות רשתית25, יש ביוכימיים ניכרים24,25 ופונקציונלי 33,34,35 ראיות התומכות בנוכחות ותפקיד זרחן של PKCα ב ROS. תוך שימוש בטכניקה שלנו, גילינו שהאימונוראקטיביות של GRK1 הייתה האינטנסיבית ביותר בדגימות +ROS ברשתית חשופה לאור ונעדרת בדגימות OIS (איור 6A). לעומת זאת, אנו מראים כי +ROS ו + RIS דגימות הציגו אות קלוש עבור PKCα. כפי שניתן לראות באיור 6B, PKCα בדרך כלל לא מזוהה ב- ROS או RIS על ידי כתמי אימונופלואורסצנטיות של מקטעי רשתית. עם זאת, PKCα היה מחוסן על ידי כתם מערבי (איור 6A, D). מכיוון שהבידודים +ROS ו- +RIS מציגים אות Gß5L חזק והיעדר Gß5S (איור 6A), אנו בטוחים שאות PKCα העמום הן בדגימות ROS והן בדגימות RIS הוא אמיתי ולא עקב זיהום משכבות אחרות. כדי להמחיש את האותות הבודדים בבידודי +ROS, +RIS ו- -OIS, כתמי GRK1 ו- PKCα שולבו ושורטטו להשוואה (איור 6C).
לבסוף, דוגמה של מפגש פילינג תת-אופטימלי (איור 6D) מדגימה כיצד זיהום מתת-שכבות שונות יכול להטות את התוצאות, מה שממחיש עוד יותר את החשיבות של פרשנות נתונים והכללת נוגדני הבקרה המתאימים למסך לשגיאות פילינג ניסיוניות. בדוגמה זו בידוד קילוף קלטת, אות Gß5S קלוש ניכר בנתיב הבידוד RIS, המציין זיהום קל מדגם -OIS. בהתאם למטרה של המשתמש, זיהום קל זה לא יכול להיות בעיה. עם זאת, במקרה זה, חקרנו את אות PKCα בדגימות +ROS ו- +RIS, ואות PKCα מעט גבוה יותר בנתיב RIS בהשוואה לנתיב ROS (איור 6A,D), אולי עקב זיהום. לכן, יש להקפיד במהלך תהליך הפילינג כדי להבטיח בידוד מדויק ולמזער את הזיהום. למרות זיהום מינימלי עקב טעות בודדת, נתונים אלה מספקים ראיות משכנעות לכך שמתודולוגיית קילוף הקלטת יכולה להניב בידודים רציפים מדויקים של שכבות קולטן מוט לניתוח חלבונים.

איור 1: שרטוט של שלבי קילוף התאים החיים. (A) דיאגרמה מציגה את השלבים העיקריים לניתוח ולניתוח העין המבודדת. (B) מקטעים חיצוניים של קולטני אור מוסרים בהדרגה על-ידי קילוף רציף באמצעות נייר סינון. ראשית, הרשתיות מכוונות כך ששכבת קולטן האור נמצאת במגע עם נייר הסינון. לאחר מכן, נייר הסינון מיובש על ידי סופג על מגבת נייר, והרשתית מקולפת מנייר הסינון. מבודד קלוף זה נאסף בצינור כל הזמן על קרח. תהליך זה חוזר על עצמו שבע עד שמונה פעמים כדי להסיר באופן מלא את המקטע החיצוני של המוט (+ROS). דמות זו נוצרה עם BioRender.com. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
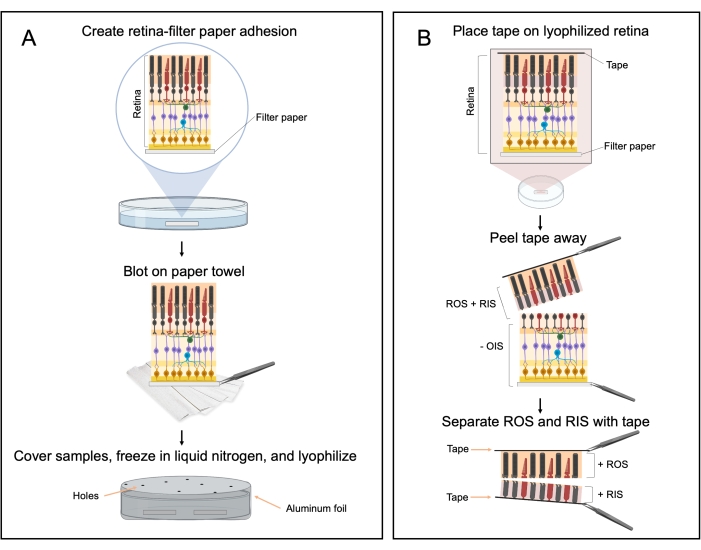
איור 2: תהליך פילינג רשתית ליופילית. (א) דיאגרמת זרימה של הכנת הדגימה לרשתית הליופילית. הרשתיות מכוונות כך ששכבת תא גנגליון הרשתית נמצאת במגע עם נייר המסנן ו קולטני האור פונים כלפי מעלה. (B) לאחר הליופיליזציה, הרשתית המיובשת בהקפאה דבקה בחתיכת סרט הדבקה לאחר הוספת לחץ קל לחלק העליון של הקלטת. הקלטת מקולפת, מסירה את שכבות המקטע החיצוני של המוט (ROS) והמקטע הפנימי של המוט (RIS). שכבת ה-RIS מוסרת על-ידי קליפות סרט נוספות עד ששכבת ROS גלויה (שכבה כתומה/ורודה). דמות זו נוצרה עם BioRender.com. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: ביטוי של GNAT1 ו- ARR1 בפוטרצפטורים מבודדים של מוט לאחר פילינג נייר סינון רציף. (A) אימונולוטים של +ROS ו- -ROS (מרוקן ROS) דגימות שנאספו בשיטת פילינג נייר המסנן שנרכשה מרשתית כהה ומותאמת לאור. כתמים נבדקו עם נוגדנים לחלבונים המופעלים באור (transducin (GNAT1) ו arrestin (ARR1)) וסמני בקרת איכות (GTPase הפעלת חלבון (Gß5L/ S) ציטוכרום C (Cyt C), ו actin). שתי רשתיות חצויות שולבו עבור כתמים מייצגים אלה. (ב) אותות מכמתים של GNAT1 ו- ARR1 מרשתית כהה ואור מותאמת אור. יש תנועה הדדית המופעלת באור של GNAT1 ו- ARR מ + ROS ו - ROS מבודד. עלילות כינור מתארות את הביטוי המנורמל של +ROS ו- -ROS דגימות. נתון זה שונה מרוז ואח' 36. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
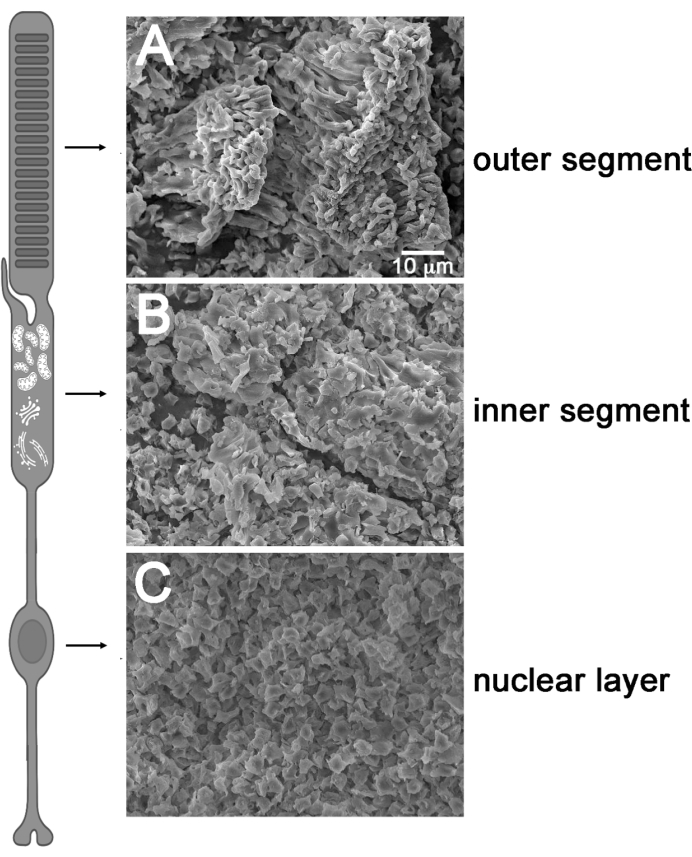
איור 4: סריקת תמונות מיקרוסקופ אלקטרונים של רשתית ליופילית. (A) משטח של רשתית ליופילית לפני קילוף סרט (צד קולטן פוטו למעלה). (ב) שכבת המקטע הפנימית לאחר פילינג קלטת. (ג) פילינג שכבת גוף התא לאחר קילוף סרט מראה גרעיני אחיד. נתון זה שונה מרוז ואח ' 36 ונוצר עם BioRender.com. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 5: אימות שיטת פילינג הקלטת כדי לבודד ROS ו-RIS מרשתית ליאופילית. (A) כתמים מערביים של +ROS, +RIS ו- -OIS (ROS/RIS-מדולדל) שנאספו בשיטת קילוף הקלטת. אימונובוטים נחקרו עם טרנסדוצין (GNAT1), arrestin (ARR1), GTPase הפעלת חלבון (Gß5L/S), ציטוכרום C (Cyt C) ונוגדני אקטין. דגימות התקבלו מרשתית כהה ואור מותאמת אור ומבודדי רשתית חצויים (+ROS, +RIS, -OIS) שולבו לחומר מרוכז יותר. (ב) אותות מכמתים של GNAT1 ו- ARR1 משורטטים כעלילות כינור לשכבות הרשתית המבודדות השונות, שהתקבלו מרשתית כהה ואור. (ג) רמות ביטוי מנורמלות מ- +RIS ו- -OIS שולבו והתווותו כדי להשוות שיטות פילינג סרט וסינון נייר. דגימות כהות ומותאמות לאור הציגו תנועה ידועה של חלבוני פוטו-טרנסדוקציה מרכזיים. נתון זה שונה מרוז ואח' 36. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 6: קילוף קלטות של רשתית ליופילית כדי לחקור את הלוקליזציה התת-תאית של GRK1 ו- PKCα בפוטרצפטורים. (A) כתם מערבי מייצג של דגימות קלופות מעכברי C57BL/6J המותאמים לאור המדגימים את הרמות היחסיות של רודופסין קינאז (GRK1), חלבון קינאז C-אלפא (PKCα), GTPase המפעיל חלבון (Gß5L/S) ואקטין. (ב) קטע רשתית קפואה שהוכן מעכברים חשופים לאור עם נוגדן PKCα (ירוק, 1:100). RPE, אפיתל פיגמנט רשתית; מערכת הפעלה, קטע חיצוני; IS, קטע פנימי; CB, גוף התא; ST, מסוף סינפטי. סרגל קנה מידה = 10 מיקרומטר. (C) רמות ביטוי מנורמלות של PKCα ו- GRK1 עבור +ROS, +RIS, -OIS דגימות משורטטות כעלילות כינור. (D) פילינג סרט תת-אופטימלי עלול להניב דגימות מזוהמות מעט. הריבוע האדום מדגיש את מדגם +RIS מזוהם עם כמה -OIS מדגם, לייצר הן רצועות Gß5L / S ואות PKCα גבוה יותר. שתי רשתיות חצויות שולבו עבור כל הכתמים. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| יעד | נוגדן | דילול | יצרן |
| מעצרין | ארנב נגד ARR1 | 1:1000 | חן, ואח', 2006. |
| טרנסדוצין | עכבר נגד יתושים (TF-15) | 1:1000 | ציטו-סיניאל. |
| ß Actin | ארנב אנטי-ß אקטין | 1:5000 | GeneTex Inc. |
| ציטוכרום C | ארנב אנטי-ציטוכרום C | 1:500 | סנטה קרוז, sc-7159. |
| GAP (Gß5L/S) | ארנב נגד Gß5L/S (CT2-15) | 1:2000 | ווטסון, ואח', 1996. |
| חלבון קינאז C אלפא (PKC) | ארנב נגד PKC (#2050) | 1:1000 | טכנולוגיית איתות סלולרי. |
| רודופסין קינאז (GRK1) | עכבר נגד GRK1 (G-8) | 1:200 | סנטה קרוז, sc-8004. |
טבלה 1: רשימת הנוגדנים המשמשים לאימות כתמים מערביים של טכניקות הפרדה.
| סינון בידוד רשתית נייר | ||||||
| +ROS* | -ROS* | רשתית שלמה | ||||
| ריכוז חלבון ממוצע (מיקרוגרם/מ"ל) | 700 | 1,500 | 1,500 | |||
| אמצעי אחסון של מאגר RIPA (μL) | 90 | 150 | 200 | |||
| בידוד רשתית קילוף קלטת | ||||||
| +ROS* | +RIS* | -ROS* | רשתית שלמה | |||
| ריכוז חלבון ממוצע (מיקרוגרם/מ"ל) | 520 | 440 | 1,200 | 1,600 | ||
| אמצעי אחסון של מאגר RIPA (μL) | 100 | 100 | 125 | 150 | ||
| * בשילוב שני בידודי רשתית חצויים. | ||||||
טבלה 2: ריכוז חלבון בהומוגנטים של בידוד רשתית.
Discussion
מחלות רשתית רבות משפיעות על תאי קולטני המוט, מה שמוביל למוות מוט, ובסופו של דבר, אובדן ראייה מלא37. חלק ניכר מהמקורות הגנטיים והמכניסטיים של ניוון הרשתית האנושית שוחזרו בהצלחה במודלים רבים של עכברים לאורך השנים. בהקשר זה, היכולת להפריד בקלות ובאופן סלקטיבי תאים תת-תאיים של מוט בודדים מרשתית העכבר הקטנה תשפר מאוד את הבנתנו את היסודות הביוכימיים והמולקולריים המקומיים של מחלות רשתית. יתר על כן, האופי השכבות של הרשתית העצבית, בשילוב עם הסידור הייחודי והמקוטב מאוד של קולטני מוט, מאפשר בידוד של תאי מוט על ידי פילינג סלקטיבי. כתב יד זה מתאר שני פרוטוקולים המשמשים לבידוד תאים תת-תאיים בודדים של תאי קולטני מוטות לחיסון. לא רק ששתי השיטות מהירות יותר מבחינה ניכרת ופחות מאתגרות מבחינה טכנית בהשוואה לשיטה הקיימת של חלוקה משיקה9, אלא שהן גם דורשות גודל מדגם קטן משמעותית מהבידוד הביוכימי הנפוץ של ROS באמצעות שיפועי צפיפות19. טכניקות טיהור הדרגתיות ROS כאלה דורשות 8-10 רשתית מורין כדי לשחזר באופן אמין ROS בשפע, ואילו הפרוטוקולים המוצגים כאן מתאימים לרשתית אחת.
למרות הפשטות הכללית של הטכניקות המוצעות, אחד האתגרים העיקריים המשותפים לשני הפרוטוקולים נוגע לשיטוח הרשתית המעוקלת על נייר הסינון הנדרש לבידוד נאות של התאים התת-תאיים השונים. הרשתית המבודדת נוטה להתכרבל ולקבל צורה דמוית צדפה. אם לרשתית יש קצוות מקופלים כאשר היא ממוקמת על נייר הסינון (צד קולטן האור למעלה או למטה), הדבר עשוי להקטין את התשואה של שכבות המוט המבודדות הרצויות. חשוב מכך, אם הרשתית אינה שטוחה כראוי, אי-התאמה וזיהום של השכבה מתאי תת-תאיים ותאי רשתית אחרים היא תוצאה סבירה (איור 6D). כדי להגביל את העקמומיות של מלבן הרשתית חצוי וכדי לתקן את היישור הלא מושלם של המוט ואת שכבות הרשתית, מלבן הרשתית ניתן לחתוך לשניים כדי לייצר שני ריבועי רשתית. על ידי חיתוך הרשתית העצבית לחתיכות קטנות יותר, העקמומיות הטבעית של הרשתית מצטמצמת, והרקמה נוטה יותר לשכב שטוחה על נייר הסינון.
הכרה מתי תאי המוט השונים הופרדו פיזית יכולה להיות מסובכת עבור מישהו חסר ניסיון בטכניקות אלה. אנו ממליצים כי לפני תחילת ניסוי משמעותי ביולוגית, המשתמש צריך לרוץ דרך התהליך עם רשתית מדגם במשך שעה או שעתיים. התרגול צריך להביא לשיפור משמעותי בכישורי המפעיל ובמיומנותו בשיטות. בעת שימוש בנייר סינון כדי לקלף את ROS מרשת חיה, אין רמזים חזותיים ברורים המציינים מתי שכבת ROS מבודדת. בעוד הרשתית הופכת רזה יותר שביר יותר, המשתמש יצטרך לפקח על עצמו ולאמת את מספר קליפות כדי לבודד את ROS במדויק. יתר על כן, שימוש בנייר סינון עם עובי סיבים שונים גסות ישנה את זמן הפילינג של ROS. נייר סינון עם סיבים עבים יותר (כגון VWR כיתה 413) יבודד שכבות רשתית מהר יותר (6-8 קליפות), אבל לא יכול להיות סלקטיבי כמו יכול להוביל לזיהום משכבות אחרות. נייר סינון עם סיבים דקים יותר (כגון Whatman כיתה 1) יבודד את שכבות הרשתית לאט יותר (12-15 קליפות) ויעניק בידוד נקי של שכבות קולטן האור. מומלץ להשתמש בנייר סינון עבה ודק יותר כדי למזער את זמן הפילינג ולהבטיח טוהר איסוף.
יחד עם זאת, קירוב חזותי וטיפול בדגימת קלטת הם שניהם המפתח להצלחת בידוד התאים התת-תאיים מהרשתית הליופילית. אם יתווסף יותר מדי לחץ לקלטת, כל הרשתית הליופילית תדבק בקלטת. ברגע שזה קורה, הפרדת ROS הופך ארוך יותר וקשה יותר, אבל לא בלתי אפשרי: מניחים פיסת סרט שנייה על המשטח החופשי (בצד תא גנגליון) של הרשתית ולאט לאט למשוך את השכבות עם קלטת עד רק את השכבה הכתומה / ורדרד גלוי על פיסת הסרט הראשונית. בידוד RIS בשלב זה, עם זאת, הוא בלתי אפשרי. אם יתווסף מעט מדי לחץ לקלטת, חלק גדול מה- ROS לא יידבק לקלטת. כדי להבטיח הידבקות נכונה של סרט ROS, אנו ממליצים ללחוץ בעדינות עם פינצטה באזורים שאינם נדבקים לקלטת. בדרך כלל, הלחץ הקל ביותר גורם להסרת שכבות ROS ו- RIS, עם זאת, יש לקבוע את כמות הלחץ על סמך ניסיון. נוכחות של RIS מבודד ניתן לברר על ידי בדיקה אם שכבה דקה, לבנה (בדומה לאבק אור של שלג) גלוי על קליפת קלטת ROS הראשונית, בעוד נוכחות של ROS מבודד ניתן לקבוע בקלות על ידי בדיקת הצבע של שכבת photoreceptor מוט (כתום עבור כהה מותאם, ורדרד עבור אור מותאם) על הקלטת.
אתגר אחד אחרון מתעורר כאשר הומוגניזציה של קליפות נייר המסנן (+ROS) מהרשתית החיה. נייר סינון סופג בקלות נוזלים, וכמות ניכרת של חיץ הומוגניזציה תיספג במהלך שלב זה של הפרוטוקול. סיבוב הנוזל בצנטריפוגה קטנה לאחר הנחת נייר הפילינג בצד של כל צינור מסייע במניעת אובדן מדגם. למרבה הצער, ספינינג חתיכות מרובות של נייר סינון יכול להיות תהליך גוזל זמן, ואובדן מדגם הוא בלתי נמנע. כדי לטפל בבעיה זו, הסר חלק מחלקי נייר הסינון והתמקד בהומוגניזציה של פחות חלקים בכל פעם. בנוסף, כדי למנוע אובדן מדגם במהלך שלב זה, שקול למזער את הכמות הכוללת של נייר סינון המשמש לבידוד ROS.
בעוד ששתי השיטות שלנו אינן דורשות גודל מדגם גדול, או יישור מדויק של להב כדי לחלק את הרשתית, יש כמה מגבלות לטכניקות הפילינג קולטן האור שלנו שראוי לציין. ראשית, רשתית מורין lyophilized לא יכול להיות מקובל על קילוף שכבות קולטני אור הבאים מעבר ROS ו RIS. שנית, שיטות הפילינג שלנו מתאימות יותר לעיבוד רשתית בודדת ואינן מקובלות לעיבוד אצווה גדול בישיבה אחת. שלישית, הצלחת הניסוי תלויה במגבלת הרגישות של הנוגדן המשמש בכתם המערבי. למרות מגבלות אלה, התוצאות הייצוגיות שלנו ממחישות כי שתי טכניקות פילינג הבידוד שלנו יכולות לבודד ביעילות תאים ספציפיים של קולטני מוט. בנוסף, שתי שיטות אלה משתמשות בחומרי מעבדה זולים ונפוצים (נייר סינון וסרט דבק), מה שהופך אותם לנגישים מאוד. במחקר שלנו, לא הערכנו ישירות אם תאי רשתית אחרים יכולים להיות מבודדים עבור חיסונים; עם זאת, אנו מאמינים כי שיטות אלה עשויות להשתנות בקלות לטובת הצרכים של חתך רחב של קהילת המחקר ברשתית.
Disclosures
המחברים מצהירים כי אין להם אינטרסים מתחרים.
Acknowledgements
עבודה זו נתמכה על ידי NIH גרנט EY12155, EY027193, ו EY027387 ל- JC. אנו מודים לד"ר ספירידון מיכלקיס (קלטק, פסדינה, ארה"ב) ולנטלי צ'ן (USC, לוס אנג'לס, ארה"ב) על הגהת כתב היד. ברצוננו גם להודות לד"ר סת' ראפינס (USC, לוס אנג'לס, ארה"ב) וד"ר יאנוס פטי-פיטרדי (USC, לוס אנג'לס, ארה"ב) על שסיפקו את הציוד הדרוש לאיסוף צילומי המחבר שסופקו. חומר מ: Kasey Rose ואח ', הפרדה של תאי קולטן פוטורצפטור ברשתית העכבר לניתוח חלבון, ניוון עצבי מולקולרי, פורסם [2017], [טבע ספרינגר].
Materials
| Name | Company | Catalog Number | Comments |
| 100 mL laboratory or media bottle equipped with a tubing cap adapter | N/A | N/A | |
| 100% O2 tank | N/A | N/A | |
| 1000mL Bottle Top Filter, PES Filter Material, 0.22 μm | Genesee Scientific | 25-235 | |
| 4X SDS Sample Buffer | Millipore Sigma | 70607-3 | |
| 50 mL Falcon tube | Fisher Scientific | 14-432-22 | |
| 95% O2 and 5% CO2 tank | N/A | N/A | |
| Ames’ Medium with L-glutamine, without bicarbonate | Sigma-Aldrich | A1420 | |
| CaCl2 (99%, dihydrate) | Sigma | C-3881 | |
| Drierite (Anhydrous calcium sulfate, >98% CaSO4, >2% CoCl2) | WA Hammond Drierite Co LTD | 21005 | |
| Falcon Easy-Grip Petri Dish (polystyrene, 35 x 10 mm) | Falcon-Corning | 08-757-100A | |
| Falcon Easy-Grip Tissue Culture Dish (60 x 15 mm) | Falcon-Corning | 08-772F | |
| Feather Scalpel (No. 10, 40 mm) | VWR | 100499-578 | |
| Feather Scalpel (No. 11, 40 mm) | VWT | 100499-580 | |
| KCl (99%) | Sigma | P-4504 | |
| Kimble Kontes pellet pestle | Sigma | z359971 | |
| Labconco Fast-Freeze Flasks | Labconco | N/A | |
| LN2 (liquid nitrogen) + Dewar flask or similar vacuum flask | N/A | N/A | |
| MgCl2 | Sigma | M-9272 | |
| Milli-Q/de-ionized water | EMD Millipore | N/A | |
| Na2HPO4 (powder) | J.T. Baker | 4062-01 | |
| NaCl (crystal) | EMD Millipore | Sx0420-3 | |
| NaHCO3 | Amresco | 0865 | |
| OmniPur EDTA | EMD | 4005 | |
| OmniPur HEPES, Free Acid | EMD | 5320 | |
| Parafilm M | Sigma-Aldrich | P7793 | |
| Reynolds Wrap Aluminum Foil | Reynolds Brands | N/A | |
| Scotch Magic Tape (12.7 mm x 32.9 m) | Scotch-3M | N/A | |
| Sodium deoxycholate | Sigma-Aldrich | D67501 | |
| Spectrafuge mini centrifuge | Labnet International, Inc | C1301 | |
| Tissue incubation chamber (purchased or custom made) | N/A | N/A | |
| Tris-HCl | J.T.Baker | 4103-02 | |
| Triton X-100 | Signma-Aldrich | T8787 | |
| VirTis Benchtop 2K Lyophilizer or equivalent machine | SP Scientific | N/A | |
| VWR Grade 413 Filer Paper (diameter 5.5 cm, pore size 5 μm) | VWR | 28310-015 | |
| Whatman Grade 1 Qualitative Filter Paper (diameter 9 cm, pore size 11 μm) | Whatman/GE Healthcare | 1001-090 | |
| Wide bore transfer pipet, Global Scientific | VWR | 76285-362 |
References
- Arshavsky, V. Y., Lamb, T. D., Pugh, E. N. G proteins and phototransduction. Annual Review of Physiology. 64, 153-187 (2002).
- Molday, R. S., Moritz, O. L. Photoreceptors at a glance. Journal of Cell Science. 128 (22), 4039-4045 (2015).
- Koch, K. W., Dell'Orco, D. Protein and signaling networks in vertebrate photoreceptor cells. Frontiers in Molecular Neuroscience. 8, 67(2015).
- Semple-Rowland, S. L., Dawson, W. W. Cyclic light intensity threshold for retinal damage in albino rats raised under 6 lx. Experimental Eye Research. 44 (5), 643-661 (1987).
- Brann, M. R., Cohen, L. V. Diurnal expression of transducin mRNA and translocation of transducin in rods of rat retina. Science. 235 (4788), 585-587 (1987).
- Philp, N. J., Chang, W., Long, K. Light-stimulated protein movement in rod photoreceptor cells of the rat retina. FEBS Letters. 225 (1-2), 127-132 (1987).
- Broekhuyse, R. M., Tolhuizen, E. F., Janssen, A. P., Winkens, H. J. Light induced shift and binding of S-antigen in retinal rods. Current Eye Research. 4 (5), 613-618 (1985).
- Roof, D. J., Heth, C. A. Expression of transducin in retinal rod photoreceptor outer segments. Science. 241 (4867), 845-847 (1988).
- Sokolov, M., et al. Massive light-driven translocation of transducin between the two major compartments of rod cells: a novel mechanism of light adaptation. Neuron. 34 (1), 95-106 (2002).
- Lobanova, E. S., et al. Transducin translocation in rods is triggered by saturation of the GTPase-activating complex. The Journal of Neuroscience. 27 (5), 1151-1160 (2007).
- Strissel, K. J., Sokolov, M., Trieu, L. H., Arshavsky, V. Y. Arrestin translocation is induced at a critical threshold of visual signaling and is superstoichiometric to bleached rhodopsin. The Journal of Neuroscience. 26 (4), 1146-1153 (2006).
- Nair, K. S., et al. Light-dependent redistribution of arrestin in vertebrate rods is an energy-independent process governed by protein-protein interactions. Neuron. 46 (4), 555-567 (2005).
- Strissel, K. J., et al. Recoverin undergoes light-dependent intracellular translocation in rod photoreceptors. The Journal of Biological Chemistry. 280 (32), 29250-29255 (2005).
- Calvert, P. D., Strissel, K. J., Schiesser, W. E., Pugh, E. N., Arshavsky, V. Y. Light-driven translocation of signaling proteins in vertebrate photoreceptors. Trends in Cell Biology. 16 (11), 560-568 (2006).
- Majumder, A., et al. Transducin translocation contributes to rod survival and enhances synaptic transmission from rods to rod bipolar cells. Proceedings of the National Academy of Sciences of the United States of America. 110 (30), 12468-12473 (2013).
- Fain, G. L. Why photoreceptors die (and why they don't). BioEssays. 28 (4), 344-354 (2006).
- Chen, J., Simon, M. I., Matthes, M. T., Yasumura, D., LaVail, M. M. Increased susceptibility to light damage in an arrestin knockout mouse model of Oguchi disease (stationary night blindness). Investigative Ophthalmology & Visual Science. 40 (12), 2978-2982 (1999).
- Song, X., et al. Arrestin-1 expression level in rods: balancing functional performance and photoreceptor health. Neuroscience. 174, 37-49 (2011).
- McConnell, D. G. The isolation of retinal outer segment fragments. The Journal of Cell Biology. 27 (3), 459-473 (1965).
- Tsang, S. H., et al. Role for the target enzyme in deactivation of photoreceptor G protein in vivo. Science. 282 (5386), 117-121 (1998).
- Walston, S. T., Chow, R. H., Weiland, J. D. Patch clamp recordings of retinal bipolar cells in response to extracellular electrical stimulation in wholemount mouse retina. Annual International Conference of the IEEE Engineering in Medicine and Biology Society. 2015, 3363-3366 (2015).
- Guido, M. E., et al. A simple method to obtain retinal cell preparations highly enriched in specific cell types. Suitability for lipid metabolism studies. Brain Research. Brain Research Protocols. 4 (2), 147-155 (1999).
- Hayashi, F., et al. Phosphorylation by cyclin-dependent protein kinase 5 of the regulatory subunit of retinal cGMP phosphodiesterase. II. Its role in the turnoff of phosphodiesterase in vivo. The Journal of Biological Chemistry. 275 (42), 32958-32965 (2000).
- Wolbring, G., Cook, N. J. Rapid purification and characterization of protein kinase C from bovine retinal rod outer segments. European Journal of Biochemistry. 201 (3), 601-606 (1991).
- Williams, D. S., et al. Characterization of protein kinase C in photoreceptor outer segments. Journal of Neurochemistry. 69 (4), 1693-1702 (1997).
- Watson, A. J., Aragay, A. M., Slepak, V. Z., Simon, M. I. A novel form of the G protein beta subunit Gbeta5 is specifically expressed in the vertebrate retina. The Journal of Biological Chemistry. 271 (45), 28154-28160 (1996).
- Makino, E. R., Handy, J. W., Li, T., Arshavsky, V. Y. The GTPase activating factor for transducin in rod photoreceptors is the complex between RGS9 and type 5 G protein beta subunit. Proceedings of the National Academy of Sciences of the United States of America. 96 (5), 1947-1952 (1999).
- Chen, J., Shi, G., Concepcion, F. A., Xie, G., Oprian, D. Stable rhodopsin/arrestin complex leads to retinal degeneration in a transgenic mouse model of autosomal dominant retinitis pigmentosa. The Journal of Neuroscience. 26 (46), 11929-11937 (2006).
- Chen, C. K., et al. Abnormal photoresponses and light-induced apoptosis in rods lacking rhodopsin kinase. Proceedings of the National Academy of Sciences of the United States of America. 96 (7), 3718-3722 (1999).
- Zhang, H., et al. Mistrafficking of prenylated proteins causes retinitis pigmentosa 2. FASEB Journal. 29 (3), 932-942 (2015).
- Weiss, E. R., et al. Species-specific differences in expression of G-protein-coupled receptor kinase (GRK) 7 and GRK1 in mammalian cone photoreceptor cells: implications for cone cell phototransduction. The Journal of Neuroscience. 21 (23), 9175-9184 (2001).
- Zhao, X., Huang, J., Khani, S. C., Palczewski, K. Molecular forms of human rhodopsin kinase (GRK1). The Journal of Biological Chemistry. 273 (9), 5124-5131 (1998).
- Newton, A. C., Williams, D. S. Involvement of protein kinase C in the phosphorylation of rhodopsin. The Journal of Biological Chemistry. 266 (27), 17725-17728 (1991).
- Pinzon-Guzman, C., Zhang, S. S., Barnstable, C. J. Specific protein kinase C isoforms are required for rod photoreceptor differentiation. The Journal of Neuroscience. 31 (50), 18606-18617 (2011).
- Sokal, I., et al. Identification of protein kinase C isozymes responsible for the phosphorylation of photoreceptor-specific RGS9-1 at Ser475. The Journal of Biological Chemistry. 278 (10), 8316-8325 (2003).
- Rose, K., Walston, S. T., Chen, J. Separation of photoreceptor cell compartments in mouse retina for protein analysis. Molecular Neurodegeneration. 12 (1), 28(2017).
- Wright, A. F., Chakarova, C. F., Abd El-Aziz, M. M., Bhattacharya, S. S. Photoreceptor degeneration: genetic and mechanistic dissection of a complex trait. Nature Reviews. Genetics. 11 (4), 273-284 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved