Method Article
In situ Exploração de Murine Megacaryopoiesis usando Microscopia eletrônica de transmissão
Neste Artigo
Resumo
Aqui, apresentamos um protocolo para analisar a ultraestrutura dos megacaiócitos in situ usando microscopia eletrônica de transmissão (TEM). As medulas ósseas murinas são coletadas, fixas, embutidas em resina epóxi e cortadas em seções ultrafinas. Após a coloração de contraste, a medula óssea é observada sob um microscópio TEM a 120 kV.
Resumo
A diferenciação e a maturação dos megacaiócitos ocorrem em estreita associação com os componentes celulares e extracelulares da medula óssea. Esses processos são caracterizados pelo aparecimento gradual de estruturas essenciais no citoplasma de megacaitosto, como um núcleo poliploide e polilobulado, uma rede interna de membrana chamada sistema de membrana demarcação (DMS) e os grânulos densos e alfa que serão encontrados em plaquetas circulantes. Neste artigo, descrevemos um protocolo padronizado para o estudo ultraestrutural in situ de megacariócitos murinas utilizando microscopia eletrônica de transmissão (TEM), permitindo a identificação de características-chave que definem seu estágio de maturação e densidade celular na medula óssea. As medulas ósseas são lavadas, fixas, desidratadas no etanol, embutidas em resina plástica e montadas para geração de seções transversais. Seções semifinas e finas são preparadas para observações histológicas e TEM, respectivamente. Este método pode ser usado para qualquer célula de medula óssea, em qualquer instalação EM e tem a vantagem de usar pequenos tamanhos de amostra permitindo a combinação de várias abordagens de imagem no mesmo mouse.
Introdução
Os megacariócitos são grandes células poliploides especializadas, localizadas na medula óssea, responsáveis pela produção deplaquetas 1. Elas se originam de células-tronco hematopoiéticas através de um intrincado processo de maturação, durante o qual os precursores de megacaitos aumentam progressivamente de tamanho, enquanto passam por extensas alterações morfológicas concomitantes no citoplasma e núcleo2. Durante o amadurecimento, os megacaitos desenvolvem uma série de elementos estruturais distintos, incluindo: um núcleo polilobulado, invaginações da membrana superficial que formam o sistema de membrana de demarcação (DMS), uma zona periférica desprovida de organelas cercadas pela rede citoesqueletal baseada em actina, e inúmeras organelas, incluindo α-granulos, granulos densoss, lysosomes, e múltiplos complexos de Gol. No nível ultraestrutural, uma grande modificação observada é a compartimentação citoplasmática em regiões discretas delimitadas pelo DMS3. Esse extenso fornecimento de membranas alimentará a extensão de longos processos citoplasmados na fase inicial de produção de plaquetas, que depois se remodelará em plaquetas dentro da circulação. Qualquer defeito durante a diferenciação e maturação do megacaito pode afetar a produção de plaquetas em termos de contagem de plaquetas e/ou função plaqueta.
A microscopia eletrônica de transmissão de camada fina (TEM) tem sido a abordagem de imagem escolhida há décadas fornecendo ultraestrutura de alta qualidade de megacaiócitos que moldaram nossa compreensão da fisiologia da trombopoiese4,5. Este artigo se concentra em um método TEM padronizado que permite capturar o processo de biogênese plaquetária que ocorre in situ dentro do microambiente nativo da medula óssea, que também poderia servir de base para analisar qualquer tipo de célula de medula óssea. Fornecemos exemplos ultraestruturais do desenvolvimento de megacaiócitos de imaturos a totalmente maduros, que estendem processos citoplasmicos à microcirculação dos sinusoides6. Descrevemos também um procedimento fácil para quantificar os diferentes estágios de maturação de megacariote, instruindo sobre a capacidade de regeneração e produção de plaquetas da medula óssea.
Protocolo
Todos os experimentos em animais foram realizados de acordo com as normas europeias 2010/63/UE e o Comitê de Ética dos Experimentos Animais da Universidade de Estrasburgo (Comité Régional d'Ethique en Matière d'Expérimentation Animale Strasbourg). O protocolo é mostrado esquematicamente na Figura 1.
1. Coleta e fixação da medula óssea (Figura 1A)
ATENÇÃO: Este procedimento inclui substâncias cancerígenas, mutagênicas e/ou tóxicas e é realizado sob uma capa de extração química. Use equipamentos de proteção adequados, como luvas e óculos de proteção.
- Prepare a solução fixativa composta por 2,5% de glutaraldeído no tampão de cacodilato (ver Arquivo Suplementar).
- Coleta de medula óssea
- Use camundongos adultos C57BL/6 de ambos os sexos de 12 a 18 semanas de idade. Eutanize os camundongos por asfixia de CO2 e luxação cervical.
- Com um par de tesouras finas, corte a pele ao redor da coxa e use pinças para descascar a pele. Retire a extremidade da pata e corte entre o quadril e a coxa. Desprender a tíbia do fêmur cortando a articulação do joelho e removendo tecido aderente nas tíbias e fêmures usando um bisturi.
- Remova as epífitas com uma lâmina afiada. Enquanto segura o fêmur com pinças, use uma seringa de 5 mL cheia de tampão de cacodilato com uma agulha de 21 G para lavar a medula óssea em um tubo de 15 mL preenchido com tampão de cacodilato de 2 mL. Para isso, insira o bisel da agulha na abertura da medula óssea e pressione lentamente o êmbolo até que a medula seja expelida.
- Fixação da medula óssea por rápida imersão em fixação.
- Imediatamente após a descarga, use uma pipeta de plástico para transferir o cilindro de medula óssea para 1 mL de solução fixativa de glutaraldeído fresco (previamente preparado em 1,1) por 60 minutos à temperatura ambiente.
NOTA: Para preservar o tecido, certifique-se de que todo o processo, desde a dissecção óssea até a etapa de fixação, seja concluído em menos de 10 minutos. Para a fixação, certifique-se de que a solução fixada esteja à temperatura ambiente para evitar choque térmico.
- Imediatamente após a descarga, use uma pipeta de plástico para transferir o cilindro de medula óssea para 1 mL de solução fixativa de glutaraldeído fresco (previamente preparado em 1,1) por 60 minutos à temperatura ambiente.
2. Incorporando medula óssea em agarose
NOTA: O tecido de medula não é suficientemente coeso para manter sua integridade durante as diferentes etapas de lavagem e o material pode ser facilmente perdido. Para superar esse problema, a medula é coberta por um gel de ágar antes da desidratação.
- Prepare a solução agarose conforme descrito no Arquivo Suplementar.
- Lave a medula fixa da seção 1.3 no tampão de cacodilato e transfira-a cuidadosamente para um slide de vidro usando uma pipeta de plástico. Usando uma pipeta quente, aplique rapidamente uma gota de ágar líquido de 2% no cilindro de medula óssea.
NOTA: O ágar se solidifica rapidamente durante o resfriamento. Para garantir uma cobertura homogênea da medula óssea, a solução de ágar deve ser mantida aquecida até que seja depositada no slide. - Coloque rapidamente o deslizamento no gelo até que o ágar se solidifique (1-2 min).
- Sob um microscópio, use uma lâmina afiada para cortar e descartar as extremidades do cilindro de medula óssea devido a uma possível compressão tecidual nessas áreas. Transfira os blocos de medula em tubos de microcentrifuus de 1,5 mL contendo 1 mL de tampão de cacodilato.
3. Incorporando medula óssea em resina
ATENÇÃO: Os componentes da resina são tóxicos; alguns são cancerígenos e devem ser tratados com cuidado sob uma capa de extração química. Use equipamentos de proteção adequados, como luvas e óculos de proteção. O tetroxida de ósmio é altamente volátil à temperatura ambiente e seus vapores são muito prejudiciais aos olhos, nariz e garganta. Antes de ser descartado, 2% de tetroxida de ósmio deve ser neutralizado adicionando o dobro do volume de óleo vegetal.
- Prepare a resina epóxi conforme descrito no Arquivo Suplementar.
- Incorporação de resina
NOTA: Mantenha as amostras nos mesmos tubos de microcentrifuuuge durante incubações em banhos sucessivos de ósmio, acetato de urânyl e etanol. Aspire os supernantes com uma pipeta Pasteur. O volume de solução utilizado para cada banho deve ser igual a pelo menos 10x o volume da amostra.- Corrija os blocos com 1% de osmium no tampão de cacodilato por 1h a 4 °C, lave uma vez no tampão de cacodilato e, em seguida, uma vez em água destilada.
- Colora com acetato de 4% de urano em água destilada por 1h, lave duas vezes em água destilada.
- Desidratar através de uma série classificada de etanol em água destilada: 4 vezes em 75% de etanol por 5 min, seguido por 3 vezes em 95% etanol por 20 min e depois 3 vezes em 100% etanol por 20 min. Nesta etapa, retire uma seringa de resina epóxi do congelador.
NOTA: O protocolo pode ser pausado em 100% de etanol por 1h. - Para obter infiltração uniforme e polimerização de resina epóxi dentro da medula, incubar primeiro os blocos em 2 banhos sucessivos de óxido de propileno por 15 minutos.
- Adicione uma mistura de 1:1 de óxido de propileno 100% e resina epóxi e incubar por 1h. Coloque as amostras em um agitador rotativo lento à temperatura ambiente.
- Adicionar resina 100% epóxi deixe a amostra para incubação durante a noite sob agitação.
- Adicione resina 100% epóxi para incubação de 2 h, ainda sob agitação.
- Sob um microscópio, coloque os blocos de medula em moldes planos de silicone. Orientar amostras para permitir a secção transversal subsequente de toda a medula óssea. Encha os moldes com resina epóxi e coloque-os a 60 °C por 48 h.
NOTA: Todas as soluções (exceto etanol e óxido de propileno) são filtradas através de filtro de 0,22 μm para evitar a contaminação das amostras. Para garantir a polimerização adequada da resina, evite bolhas enquanto encha os moldes.
4. Secção ultrathin(Figura 1B)
NOTA: A transmissão EM requer seções de tecido fino através das quais os elétrons podem passar gerando uma imagem de projeção do interior das células, estrutura e organização de organelas internas (grânulos, órticulum endoplasmático, Golgi) e o arranjo de membranas celulares intracelulares.
- Monte o bloco de amostra em um suporte ultra-microtóm mestom. Coloque no suporte da amostra. Corte as amostras em 45° para remover o excesso de resina ao redor do tecido com um cortador de fresagem de diamante rotativo ou tungstênio.
- Monte as amostras no ultramicroome com uma lâmina de faca de diamante equipada com um tanque de água. Corte seções transversais de 500 nm e 100 nm de espessura para análises histológicas e TEM, respectivamente. Colete seções flutuantes na superfície da água com um laço.
- Deposite a seção de 500 nm de espessura em um escorregador de vidro e seções de 100 nm de espessura em 200 grades de cobre de malha fina com um filtro de papel por baixo. Prepare cinco grades para uma condição: manche duas grades primeiro e mantenha as três grades restantes como backup, se necessário.
5. Mancha azul toluidina para histologia
NOTA: As seções de coloração para histologia são importantes por três razões: 1) para garantir que o tecido seja realmente cortado e não a resina, 2) para verificar a qualidade da inclusão, e 3) para avaliar rapidamente a amostra de medula. Se isso não estiver correto, corte mais fundo no bloco.
- Seque as seções semifinas deslizem sobre uma placa de calor (60 °C).
- Adicione 1% de toluidina azul/1 % de borato de sódio em água destilada nas lâminas e aqueça em uma placa quente (60 °C) por 1-2 min. Lave os slides com água destilada e deixe secar na placa de calor.
- Monte seções em tampas com uma gota de poli (methacrilato-co-metil metacrilato de butil) meio de montagem e examine sob um microscópio leve.
6. Manchas de metais pesados para observação TEM(Figura 1C)
NOTA: Para o contraste, o lado superior das grades são invertidos em gotas de 100 μL de cada banho sucessivo com um laço. Antes de ser utilizado, cada solução é filtrada por 0,22 μm. Remova o excesso de líquido entre cada banho, entre em contato suavemente com o lado da grade em um papel filtro.
- Mancha com acetato de 4% de uranyl em água destilada por 5 min.
- Lave 3 vezes em água destilada por 5 minutos.
- Mancha com citrato de chumbo por 3 minutos.
- Lave 3 vezes em água destilada por 5 minutos.
- Deposite as grades pelo lado inferior em contato com o papel do filtro para deixá-las secar.
NOTA: Metais pesados reagem na presença de dióxido de carbono. Para minimizar os precipitados, evite o deslocamento do ar durante o contraste, não fale, mantenha o ambiente calmo e desligue o ar-condicionado.
7. TEM (Figura 1E)
NOTA: As seções são introduzidas em um microscópio TEM e examinadas a 120 kV.
- Primeiro examine as seções em baixa ampliação (< 500x) para apreciar o aspecto geral da preparação (ausência de orifício na resina, dobras/compressão nas seções, precipita devido à coloração).
- Em seguida, examine as seções em maior ampliação (~ 2000x permitindo distinguir o estágio de maturação). Conte manualmente os megacaiócitos de cada etapa de maturação sobre seções transversais inteiras (consulte Resultados Representativos sobre como identificar visualmente cada estágio).
NOTA: Cada quadrado das grades é definido como uma área para exame (o que equivale a 16000 μm2 para 200 grades de cobre de malha). - Para avaliar o número de megacaiócitos, quantifique apenas os quadrados que estão totalmente cobertos com uma seção. Para isso, use um modelo baseado na triagem de faixas. Observe uma primeira gama de quadrados de uma extremidade da seção para outra, depois outra faixa da mesma forma, etc. Usando este procedimento, tela total e sistematicamente toda a seção transversal da medula quadrada por quadrado.
- Para cada quadrado, marque o número de megacaiócitos estágio I, II ou III.
NOTA: Ampliações mais elevadas são necessárias para analisar os grânulos, a organização DMS, o tamanho dos territórios citoplasmáticos e o núcleo polilobulado.
Resultados
Histologia da medula óssea
A observação da histologia azul toluidina da medula óssea sob um microscópio leve é fundamental para analisar rapidamente a arquitetura geral do tecido em termos de, por exemplo, compactação tecidual, continuidade de microvasos e o tamanho e forma de megacaiócitos (Figura 1D). É realizado antes de seções ultrathin para determinar a necessidade de corte mais profundo no bloco de medula óssea. Devido ao seu tamanho gigante e lobulação nuclear, os megacaiócitos mais maduros podem ser facilmente visualizados com um objetivo de 40x. Isso dá uma visão geral excelente e rápida da densidade de megacaiócitos maduros no tecido e sua localização relativa aos microvessels. Anomalias na proliferação e maturação de megacaitos já podiam ser detectadas em seções semifinas.
Ultraestrutura de medula óssea
Com base em características ultraestruturais distintas, os megacaiócitos murinos são divididos em 4 etapas representando estágios sequenciais em sua maturação (Figura 2A). Os megacariócitos estágio I têm 10-15 μm de diâmetro com um grande núcleo ocupando a maior parte da célula e contendo ribossomos abundantes e espastúlume endoplasmático áspero. A presença do estágio detectável mais antigo do DMS, chamado pré-DMS, também é um critério fundamental para distinguir os MKs do estágio I na análise TEM3. Na fase II de maturação, começa a formação do grânulo e inicia-se o desenvolvimento do DMS. Os megacariócitos aumentam de tamanho, medindo de 15 a 25 μm de diâmetro e desenvolvem lobulação nuclear. Os megacaitos maduros estágio III são células gigantes de 25-50 μm de diâmetro. Seu citoplasma contém um DMS bem desenvolvido com territórios citoplasmados claramente definidos e uma zona periférica desprovida de organelas. Nesta fase, o núcleo é geralmente localizado excentricamente e parece muito irregular com cromatina condensada localizada na membrana nuclear. O último passo é caracterizado por um núcleo nu, também chamado pirenocito, consistindo de um grande núcleo cercado por uma membrana plasmática após a eliminação da maior parte do citoplasma. Em camundongos do tipo selvagem C57BL/6, a medula óssea compreende cerca de 8% do estágio I, 20% estágio II, 71% de megacariócitos estágio III e < 1% pirócitos. O número médio de megacaiócitos é entre 1,7 e 2,2 células por quadrado. Esta classificação arbitrária permite monitorar convenientemente um processo contínuo de diferenciação celular e detectar suas possíveis anomalias.
Ao lado desses estágios clássicos de maturação, a observação de megacaiócitos fixos na medula óssea permite analisar a série de eventos ocorridos à medida que os megacaiócitos interagem com a parede sinusoidal (Figura 2B). Megacariócitos em contato com as células endoteliais são frequentemente observados em seções finas. Na ocasião, observa-se megacaiócitos formando breves saliências invasivas penetrando no endotélio ou estendendo grande projeção de seu citoplasma no lúmen sinusoidal7,8. Notavelmente, esses processos citoplasmesmic intravasculares exibem tamanhos, comprimentos e diâmetros variáveis, ilustrando a remodelação progressiva da plaqueta na circulação. As plaquetas já presentes na circulação geral, tendo uma forma descolorida mantida por bobinas de microtúbulos circunferenciais, também são visíveis no lúmen dos sinusoides. Esta morfologia típica das plaquetas é indicativa da fixação correta da amostra.
A microscopia eletrônica de transmissão tem o nível de resolução necessário para visualizar detalhes ultraestruturais, como lobulação nuclear, organização espacial do DMS e grânulos em termos de tamanho, forma e distribuição. A Figura 2C é um exemplo da região perinuclear em um megacariócito estágio III mostrando a presença de α grânulos, cisternae golgi, mitocôndrias e regúrio endoplasmático. Destaca-se também na Figura 2C um corpo multivesicular, que representa um estágio intermediário na formação de grânulos alfa e denso, contendo exosóis múltiplos medindo menos de 200 Å de diâmetro9,10. Finalmente, a microscopia eletrônica de transmissão permite visualizar neutrófilos e outras células hematopoiéticas presentes dentro dos megacariócitos, seguindo um processo incomum chamado emperipolese pelo qual uma célula penetra outra célula viva11. Esse processo, que diz respeito a 4% dos megacaiócitos em condições fisiológicas normais, pode ser significativamente aumentado em determinadas condições patológicas12.
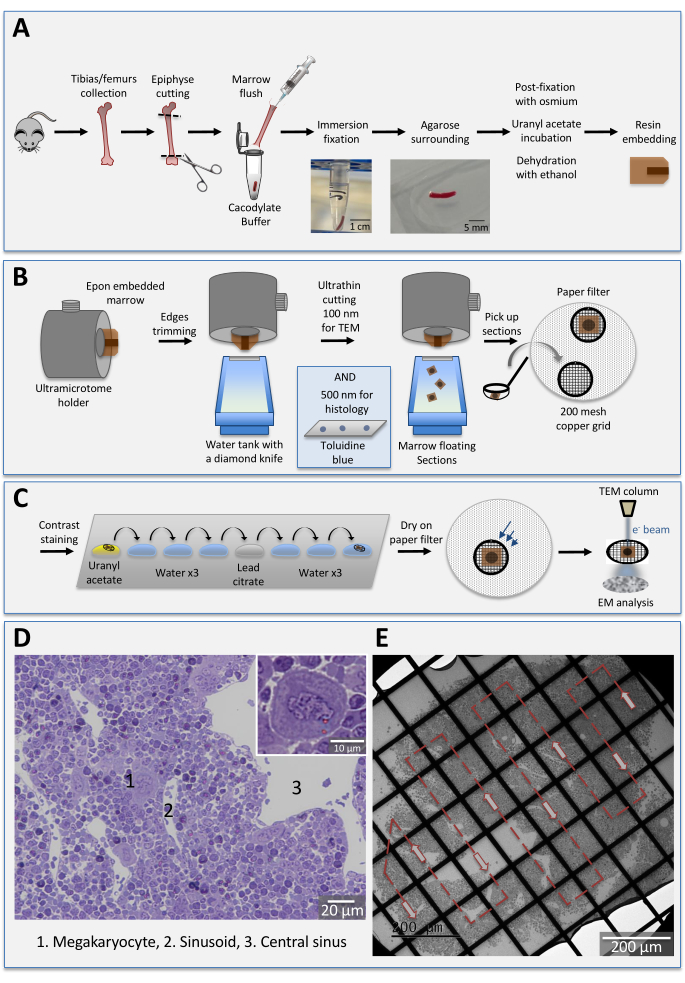
Figura 1: Ilustração esquemática da configuração experimental. (A) Procedimento de incorporação da medula óssea. A medula óssea é lavada e fixada por rápida imersão na solução de glutaraldeído. A fotografia ilustra a aparência típica do cilindro de medula óssea após a descarga. Após fixação de 1h à temperatura ambiente, a medula é cercada em agarose, pós-fixada em tetroxida de ósmio e incubada em acetato de urânyl. Os tecidos são então enxaguados em tampão, desidratados em uma série de etanol classificado, incubados em óxido de propileno e infiltrados com resina epóxi. (B) Medulas ósseas bloqueiam a secção. A medula óssea incorporada é montada em um suporte ultramicroméro, aparada a 45° e cortada em seções semifinas (500 nm) ou finas (100 nm). Para estudos ultraestruturais, as seções flutuantes são captadas com um loop e depositadas em grades com um filtro de papel por baixo. (C) Coloração de contraste para observações TEM. As grades são invertidas em gotas de acetato deuranyl, lavadas em gotas de água destiladas e incubadas em citrato de chumbo antes de outra série de lavagem. Após a secagem (parte superior com as seções), as amostras estão prontas para serem examinadas sob o TEM. (D) Histologia de uma seção de medula femoral do rato manchada com azul toluidina. As células gigantes correspondem a megacaiócitos maduros (1), alguns em contato com sinusoides (2). Os sinusoides convergem em uma grande veia sinusída central (3). Barra: 20 μm. Inset: Aparência normal de um megacariócito maduro a 40x de ampliação. (E) Imagem tem representativa de uma seção de medula óssea em baixa ampliação. As células estão bem embaladas com pouco espaço extracelular. Cada quadrado de grade da seção é observado de uma extremidade para outra seguindo o caminho esquemático de seta (setas vermelhas). Barra: 200 μm. Por favor, clique aqui para ver uma versão maior desta figura.
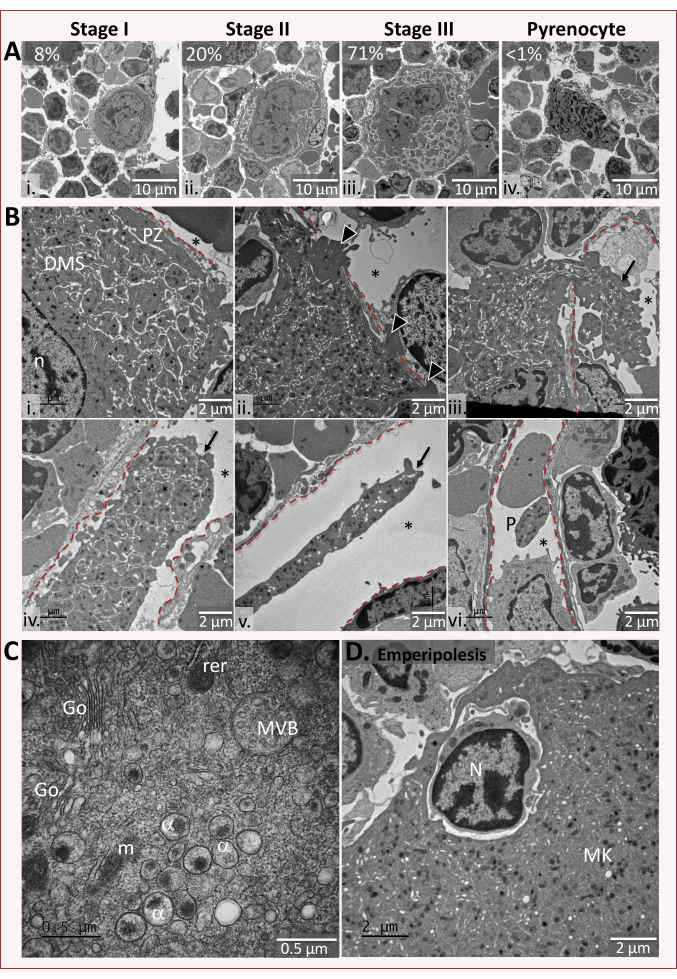
Figura 2: Representante em imagens in situ de megacariocitas ultraestrutura. (A) Estágios de maturação característicos de megacariócitos do tipo selvagem. Os megacariócitos são classificados em quatro estágios de maturação: Estágio I, uma célula de 10 a 15 μm de diâmetro com um núcleo grande; estágio II, uma célula de 15-30 μm de diâmetro contendo o DMS em desenvolvimento; estágio III, uma célula de 30-50 μm contendo um sistema de membrana de demarcação bem desenvolvido (DMS) definindo territórios citoplasmados e tendo uma zona periférica livre de organela. Um pirócito corresponde ao núcleo polilobulado nu que permanece na medula óssea após extensão citoplasmática completa. Barras: 10 μm(B) Interações celulares megacariocíte-endoteliais e processos citoplasmados intravasculares. i A zona periférica (PZ) de um megacaiócito está intimamente apposta à superfície abluminal do endotélio sinusoidal. (ii) Um megacaiócito formando breves saliências invasivas que penetram profundamente na camada endotelial (pontas de flecha). (iii-v) As setas indicam processos citoplasmados de megacaiócitos com diâmetros variados, alguns dos quais são muito grandes e têm uma zona periférica que pode representar fragmentos que acabaram de entrar na corrente sanguínea. (vi) Uma plaqueta descolorida típica (P) observada no lúmen sinuso. Em cada micrografo, a linha vermelha indica o lado luminal da barreira endotelial e a estrela indica o lúmen sinusoide. Barras: 2 μm. (C) Ampliações mais altas da região perinuclear de um megacaiócito maduro. α, granulo alfa; rer, reticulum endoplasmático áspero; G, golgi; MVB, corpo multivesicular; m, mitocôndrias. Barra: 0,5 μm. (D) Exemplo de um megacariócito mostrando emperipolese. O neutrófilo engolido aparece morfologicamente sem alterações pela interação com megacariócitos. Barra: 2 μm. Clique aqui para ver uma versão maior desta figura.
Arquivo Suplementar: Preparação dos reagentes. Clique aqui para baixar este Arquivo.
Discussão
O exame direto dos megacaitos em seu ambiente nativo é essencial para entender a megacariopoiese e a formação de plaquetas. Neste manuscrito, fornecemos um método de microscopia eletrônica de transmissão combinando descarga e fixação da medula óssea por imersão, permitindo dissecar in situ as características de morfologia de todo o processo de morfogênese de megacaiócito ocorrendo na medula óssea.
A lavagem da medula óssea é um passo crítico desse método, pois o sucesso de uma descarga de alta qualidade depende da prática e treinamento do operador. Embora delicado, lavar a medula óssea é a melhor maneira de evitar a remoção do osso mineralizado, que geralmente requer um tratamento EDTA de 2 semanas para descalcificação completa associado a artefatos significativos na morfologia de megacaiócitos. Além disso, uma grande vantagem de coletar medulas ósseas inteiras não fixas da tíbia e dos fêmures é a capacidade de combinar várias abordagens de imagem ao mesmo rato. Na prática, apenas uma única medula óssea é necessária para o estudo ultraestrutural, sendo que as outras três amostras estão disponíveis para análises complementares. A segunda medula óssea pode então ser usada para a preparação de explants de medula óssea frescas, para estudar em tempo real a dinâmica da formação proplatelet de megacaiócitos nativos6. A terceira amostra é geralmente projetada para estudos de imunossuagem em seções grossas, fornecendo imagens 3D e distribuição de megacaiócitos dentro de seu ambiente natural. A última amostra pode ser congelada e armazenada para estudos posteriores por microscopia eletrônica de imuno-ouro, onde a localização subcelular de proteínas é investigada em alta resolução4. Estes métodos combinados de imagem, juntamente com a disponibilidade da exclusão/mutação direcionada de genes em um camundongo, fornecem um meio importante de delinear in situ o papel biológico de uma determinada proteína em trombopoiese. No entanto, deve-se salientar aqui que uma limitação desse método é a retirada das epífitas necessárias para lavar a medula. As epífitas são conhecidas por serem áreas importantes para a hematopeia, e sua remoção dificulta, portanto, qualquer possibilidade de análise de células-tronco hematopoiéticas e as fases iniciais de engajamento13. Outra limitação é que os progenitores de megacaiócitos antes do estágio imaturo não posso ser identificado porque essas células não têm características ultraestruturais específicas. Para superar essa limitação, uma abordagem de imunogold EM poderia ser usada.
O segundo passo importante do método é a fixação da medula óssea por imersão. Quando realizado sob as condições descritas aqui, ou seja, fixação imediatamente após a descarga do cilindro de medula óssea compacto, ele tem as seguintes vantagens: (i) é rápido e fácil de executar, (ii) preserva uma ultraestrutura próxima à observada após a fixação por perfusão6, e (iii) mantém processos de megacariócitos livres e plaquetas na corrente sanguínea sinusoide que são lavadas/perdidas após perfusões. Com esta técnica é possível investigar a entrada de megacaiócitos na circulação sinusoidal e caracterizar todas as formas intermediárias de processos citoplasmados dos quais as plaquetas surgem8. Em consonância com isso, foi recentemente relatado que as grandes protrusões intravasas de megacaiócitos in vivo são estruturalmente distintas das finas extensões formadas por megacaiócitos in vitro,com notavelmente um arranjo diferente dos microtúbulos7. Da mesma forma, mostramos recentemente que o mecanismo que rege a formação de plaquetas in vivo difere do identificado in vitro14.
Importantes diferenças ultraestruturais são cada vez mais reconhecidas entre megacaiócitos nativos in vitro e in vivo gerados, ressaltando a necessidade do microambiente de medula óssea para uma diferenciação/maturação de megacaiócitos completos. Após a combinação de lavagem e fixação da medula óssea por imersão descrita neste artigo, a microscopia eletrônica de transmissão convencional ainda continua sendo uma ferramenta inestimável para estudar a biologia do megacaito e a formação de plaquetas, sob condições fisiológicas e patológicas.
Divulgações
Os autores não têm conflitos de interesses para declarar.
Agradecimentos
Os autores agradecem a Fabienne Proamer, Jean-Yves Rinckel, David Hoffmann, Monique Freund pela assistência técnica. Este trabalho foi apoiado pela ARMESA (Association de Recherche et Développement en Médecine et Santé Publique), pela União Europeia através do Fundo Europeu de Desenvolvimento Regional (ERDF) e pelo Grant ANR-17-CE14-0001-01 ao H.d.S.
Materiais
| Name | Company | Catalog Number | Comments |
| 2,4,6-Tri(dimethylaminomethyl)phenol (DMP-30) | Ladd Research Industries, USA | 21310 | |
| Agarose type LM-3 Low Melting Point Agar | Electron Microscopy Sciences, USA | 1670-B | |
| CaCl2 Calcium chloride hexahydrate | Merck, Germany | 2083 | |
| Copper grids 200 mesh thin-bar | Oxford Instrument, Agar Scientifics, England | T200-CU | |
| Dimethylarsinic acid sodium salt trihydrate | Merck, Germany | 8.20670.0250 | |
| Dodecenyl Succinic Anhydride (DDSA) | Ladd Research Industries, USA | 21340 | |
| Double Edge Stainless Razor blade | Electron Microscopy Sciences-EMS, USA | EM-72000 | |
| Ethanol absolut | VWR International, France | 20821296 | |
| Filter paper, 90 mm diameter | Whatman, England | 512-0326 | |
| Flat embedding silicone mould | Oxford Instrument, Agar Scientific, England | G3533 | |
| Glutaraldehyde 25% | Electron Microscopy Sciences-EMS, USA | 16210 | |
| Heat plate Leica EMMP | Leica Microsystems GmbH, Austria | 705402 | |
| Histo Diamond Knife 45° | Diatome, Switzerland | 1044797 | |
| JEOL 2100 Plus TEM microscope | JEOL, Japan | EM-21001BU | |
| Lead citrate - Ultrostain 2 | Leica Microsystems GmbH, Austria | 70 55 30 22 | |
| LX-112 resin | Ladd Research Industries, USA | 21310 | |
| MgCl2 Magnesium chloride hexahydrate | Sigma, France | M2393-100g | |
| Mounting medium - Poly(butyl methacrylate-co-methyl methacrylate) | Electron Microscopy Sciences-EMS, USA | 15320 | |
| Nadic Methyl Anhydride (NMA) | Ladd Research Industries, USA | 21350 | |
| Osmium tetroxide 2% | Merck, Germany | 19172 | |
| Propylene oxide (1.2-epoxypropane) | Sigma, France | 82320-250ML | |
| Saline injectable solution 0.9% NaCl | C.D.M Lavoisier, France | MA 575 420 6 | |
| Scalpel Surgical steel blade | Swann-Morton, England | .0508 | |
| Sodium tetraborate - Borax | Sigma, France | B-9876 | |
| Sucrose | Merck, Germany | 84100-1KG | |
| Syringe filter 0.2µm | Pall Corporation, USA | 514-4126 | |
| Toluidine blue | Ladd Research Industries, USA | N10-70975 | |
| Trimmer EM TRIM2 | Leica Microsystems GmbH, Austria | 702801 | |
| Ultramicrotome Ultracut UCT | Leica Microsystems GmbH, Austria | 656201 | |
| Uranyl acetate | Ladd Research Industries, USA | 23620 |
Referências
- Machlus, K. R., Italiano, J. E. The incredible journey: From megakaryocyte development to platelet formation. The Journal of Cell Biology. 201 (6), 785-796 (2013).
- Zucker-Franklin, D., Termin, C. S., Cooper, M. C. Structural changes in the megakaryocytes of patients infected with the human immune deficiency virus (HIV-1). American Journal of Pathology. 134 (6), 9 (1989).
- Eckly, A., et al. Biogenesis of the demarcation membrane system (DMS) in megakaryocytes. Blood. 123 (6), 921-930 (2014).
- Scandola, C., et al. Use of electron microscopy to study megakaryocytes. Platelets. , 1-10 (2020).
- Behnke, O., Forer, A. From megakaryocytes to platelets: platelet morphogenesis takes place in the bloodstream. European Journal of Haematology. 60, 3-23 (2009).
- Eckly, A., et al. Characterization of megakaryocyte development in the native bone marrow environment. Platelets and Megakaryocytes. 788, 175-192 (2012).
- Brown, E., Carlin, L. M., Nerlov, C., Lo Celso, C., Poole, A. W. Multiple membrane extrusion sites drive megakaryocyte migration into bone marrow blood vessels. Life Science Alliance. 1 (2), 201800061 (2018).
- Eckly, A., et al. Megakaryocytes use in vivo podosome-like structures working collectively to penetrate the endothelial barrier of bone marrow sinusoids. Journal of Thrombosis and Haemostasis. , 15024 (2020).
- Cramer, E. M., et al. Ultrastructure of platelet formation by human megakaryocytes cultured with the Mpl ligand. Blood. 89 (7), 2336-2346 (1997).
- Heijnen, H. F. G., Debili, N., Vainchencker, W., Breton-Gorius, J., Geuze, H. J. Multivesicular Bodies Are an Intermediate Stage in the Formation of Platelet α-Granules. Blood. 7 (7), 2313-2325 (1998).
- Gupta, N., Jadhav, K., Shah, V. Emperipolesis, entosis and cell cannibalism: Demystifying the cloud. Journal of Oral and Maxillofacial Pathology. 21 (1), 92 (2017).
- Centurione, L., et al. Increased and pathologic emperipolesis of neutrophils within megakaryocytes associated with marrow fibrosis in GATA-1low mice. Blood. 104 (12), 3573-3580 (2004).
- Ellis, S. L., et al. The relationship between bone, hemopoietic stem cells, and vasculature. Blood. 118 (6), 1516-1524 (2011).
- Bornert, A., et al. Cytoskeletal-based mechanisms differently regulate in vivo and in vitro proplatelet formation. Haematologica. , (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados