Method Article
Um pipeline usando eletroporação bilateral no útero para interrogar influências genéticas no comportamento dos roedores
Neste Artigo
Resumo
O papel dos genes recentemente descobertos associados à doença na patogênese das doenças neuropsiquiátricas permanece obscuro. Um bilateral modificado na técnica de eletroporação uterómis permite a transferência genética em grandes populações de neurônios e o exame dos efeitos causadores das mudanças na expressão genética no comportamento social.
Resumo
Como estudos de associação genoma lançam luz sobre os fundamentos genéticos heterogêneos de muitas doenças neurológicas, a necessidade de estudar a contribuição de genes específicos para o desenvolvimento cerebral e a função aumenta. Contar com modelos de camundongos para estudar o papel de manipulações genéticas específicas nem sempre é viável, uma vez que as linhas de camundongos transgênicos são bastante caras e muitos novos genes associados a doenças ainda não têm linhas genéticas disponíveis comercialmente. Além disso, pode levar anos de desenvolvimento e validação para criar uma linha de mouse. No útero a eletroporação oferece um método relativamente rápido e fácil para manipular a expressão genética de uma maneira específica do tipo celular in vivo que só requer o desenvolvimento de um plasmídeo de DNA para alcançar uma manipulação genética particular. Bilateral na eletroporação do útero pode ser usado para atingir grandes populações de neurônios piramixais do córtex frontal. A combinação desse método de transferência genética com abordagens comportamentais permite estudar os efeitos das manipulações genéticas na função das redes de córtex pré-frontal e no comportamento social de camundongos juvenis e adultos.
Introdução
Estudos de associação genoma (GWAS) têm impulsionado a descoberta de novos genes candidatos que estão associados às patologias cerebrais1,2,3,4. Esses estudos têm sido particularmente benéficos na compreensão de distúrbios neuropsiquiátricos devastadores, como a esquizofrenia (SCZ), onde a investigação de novos genes tem servido como ponto de lançamento para novas linhas de pesquisa e intervenção terapêutica5,6. Genes que abrigam risco para SCZ apresentam expressão tendenciosa no córtex pré-frontal (CPF) durante o desenvolvimento pós-natal e pós-natal precoce, região implicada na patologia de vários distúrbios neuropsiquiátricos7. Além disso, modelos de camundongos de transtornos psiquiátricos apresentam atividade anormal nas redes PFC6,8,9. Esses resultados sugerem que os genes associados ao SZC podem desempenhar um papel na fiação de desenvolvimento desta região. Uma investigação mais aprofundada utilizando modelos animais é necessária para compreender a contribuição desses genes candidatos para o estabelecimento de conexões no PFC e determinar se esses genes têm um papel causador na patogênese das doenças neuropsiquiátricas. Técnicas de manipulação genética em camundongos que permitem o estudo de mudanças na expressão genética em circuitos neuronais específicos durante o desenvolvimento pré-natal e pós-natal precoce são um método promissor para entender os mecanismos moleculares que ligam as mudanças de expressão genética à disfunção do FPF.
Linhas genéticas de camundongos oferecem um método para estudar o impacto de determinados genes no desenvolvimento e função cerebral. No entanto, depender de camundongos transgênicos pode ser limitador, uma vez que nem sempre existem linhas disponíveis comercialmente para examinar os efeitos de genes específicos no desenvolvimento de circuitos neurais. Além disso, pode ser extremamente caro e demorado para desenvolver linhas personalizadas de mouse. O uso de estratégias interseccionais de manipulação genética que combinam camundongos transgênicos com abordagens virais revolucionou a compreensão do cérebro10,11,12. Apesar de muito progresso, as estratégias virais vêm com certas limitações dependendo do tipo vetorial viral, incluindo limites na capacidade de embalagem que podem restringir a expressão viral13 e a toxicidade celular associada à expressão viral14. Além disso, na maioria das condições experimentais, a expressão genética robusta usando o vírus associado ao Adeno (AAVs) requer aproximadamente 2 a 4 semanas15, tornando inviáveis estratégias virais rotineiras para manipular genes durante o desenvolvimento pós-natal precoce.
No útero a eletroporação (IUE) é uma abordagem alternativa que permite uma transferência genética rápida e barata16,17 que, quando acoplado à rotulagem fluorescente e abordagens farmacogenéticas ou optogenéticas, fornece uma plataforma poderosa para dissecar a função dos circuitos neuronais. Além disso, com o desenvolvimento de genes de edição de genomas CRISPR-Cas9 pode ser superexpresso ou precisamente alterado através de knock-down ou knock-out específicos do tipo celular ou através da modulação dos promotores18,19. As abordagens de manipulação genética usando iUE são especialmente vantajosas quando o efeito dos genes em circuitos neuronais precisa ser testado durante janelas de desenvolvimentoestreitas 20. IUE é uma técnica versátil e a superexpressão pode ser facilmente realizada inserindo um gene em um vetor de expressão sob um promotor específico. O controle adicional da expressão genética pode ser alcançado através da expressão de condução usando promotores de diferentes pontos fortes ou usando promotores induíveis capazes de controlar temporalmente a expressão genética21,22. Além disso, a IUE permite o direcionamento de células dentro de camadas corticais específicas, tipos de células e regiões cerebrais, o que nem sempre é viável usando outras abordagens5,17. Os recentes avanços na configuração da IUE com base no uso de três eletrodos, que geram uma distribuição de campo elétrico mais eficiente, expandiram o repertório funcional deste método e permitiram aos cientistas direcionar novos tipos de células e aumentar a eficiência, precisão e número de células que podem ser alvode 23,24. Esta técnica foi recentemente utilizada para determinar o papel causador do componente complementar 4A (C4A),gene ligado ao SCZ, na função PFC e na cognição precoce5.
Apresentado aqui é um pipeline experimental que combina abordagens de transferência genética para atingir grandes populações de neurônios excitatórios no córtex frontal, incluindo o PFC, com paradigmas comportamentais que não só permitem o estudo de mudanças de nível celular e circuito, mas também permite que o comportamento seja monitorado durante o desenvolvimento pós-natal e a idade adulta. Descrita pela primeira vez é um método para transfetar bilateralmente grandes populações de neurônios pirambulais de camada (L) 2/3 em regiões corticais frontais. Em seguida, são delineadas tarefas para avaliar o comportamento social em camundongos juvenis e adultos. A contagem celular pode ser obtida após a conclusão de tarefas comportamentais para quantificar a extensão e a localização da transfecção celular. Além disso, o número de células transfeinadas pode ser correlacionado com dados comportamentais para determinar se um maior número de células transfeinadas leva a maiores perturbações no comportamento.
Protocolo
Todos os protocolos experimentais foram conduzidos de acordo com as diretrizes do National Institutes of Health (NIH) para pesquisa animal e foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade de Boston (IACUC).
1. Preparação da solução de DNA
- Compre um plasmídeo comercial ou subclone um gene de interesse em plasmid com promotor desejado. Aqui, foi utilizado um plasmid contendo EGFP sob o promotor CAG (pCAG-EGFP).
NOTA: Determine o promotor desejado com base no nível de expressão necessário. Em geral, plasmídeos sob o promotor CAG podem ser usados para alcançar altos níveis do transgene, enquanto promotores específicos do tipo celular (por exemplo, sinapsina para neurônios) tendem a ser menos ativos. O experimentador deve determinar empiricamente os níveis de expressão apropriados para cada plasmídeo. - Transforme bactérias e cresça estoques em mídia bacteriana com o antibiótico apropriado.
- Remova células competentes (células DH5α) a partir de -80 °C e descongele no gelo por 20 minutos.
- Misture 100 pg -100 ng do DNA plasmídeo com 30 μL de células competentes. Incubar a mistura no gelo por 20 minutos.
- Realize o choque térmico incubando em um banho de água de 42 °C por 45 s e, em seguida, devolvendo o tubo de volta ao gelo por 2 minutos.
- Adicione 200 - 1.000 μL de mídia LB às células competentes transformadas e cresça por 45 min a 37 °C em uma incubadora de agitação.
- Placa 200 μL das células transformadas em uma placa de ágar LB contendo o antibiótico apropriado e incubar a placa durante a noite a 37 °C.
- No dia seguinte, incubar uma colônia bacteriana em 200 mL de caldo LB com o antibiótico apropriado a 37 °C em uma incubadora de agitação durante a noite.
- Purifique o DNA plasmídeo usando um kit maxiprep.
- Siga as instruções fornecidas no kit maxiprep obtido. Para a etapa de eluição, não eute o DNA no tampão de eluição. Em vez disso, dna elute usando 200 μL de 1x PBS estéril ou água de grau molecular.
- Certifique-se de que a concentração final do DNA é maior que 1 μg/μL. Se o plasmídeo contendo o gene de interesse não contiver um gene repórter, então também prepare um plasmídeo para co-transfeito com uma molécula repórter, como a proteína fluorescente verde (GFP), para permitir a visualização de células transfeinadas.
- Prepare a solução de DNA para a cirurgia diluindo o DNA plasmídeo em 1x PBS a 1 μg/μL concentração final de cada plasmídeo. Adicione corante verde rápido à solução de DNA a uma concentração final de 0,1%. Para injeções bilaterais, prepare 60 μL de solução por barragem (para aproximadamente 10 filhotes).
NOTA: Se plasmídeo não contiver um gene repórter, co-eletroporato com GFP. As taxas de co-eletroporação são tipicamente 95% ou mais. Em nossas mãos, a eficiência da transfecção não foi afetada pela co-transfecção. Todos os plasmídeos eletroporados devem ser diluídos a 1 μg/μL.
2. Encomendar ou criar camundongos com tempo cronometrado
- Se encomendar camundongos com gravidez cronometrada, peça aos camundongos que cheguem no dia embrionário (E) 13 ou mais cedo para permitir que as barragens se acostumem com a moradia animal. Neste protocolo, os ratos de raça-DE-CD-1 são usados para todos os experimentos.
NOTA: Encomendar com alguns dias de antecedência reduzirá o estresse animal e levará a uma maior taxa de sobrevivência dos filhotes. - Se criar camundongos grávidas cronometrado, parear camundongos fêmeas com um macho durante a noite, uma vez por semana. Verifique a presença de um plug vaginal na manhã seguinte (E0.5). Determine a gravidez monitorando o peso dos camundongos fêmeas.
NOTA: Diferentes cepas de camundongos têm diferentes aumentos de peso durante a gravidez, por isso determine o ganho de peso típico para a cepa do camundongo utilizada. - Seja ordenando ou criando os camundongos, para reduzir o estresse das barragens, coloque uma almofada de ninho e casa de rato na gaiola. Reduzir o estresse pode ajudar a aumentar a taxa de sobrevivência dos filhotes.
3. Projeto e montagem de três pinos eletrodos
- Use folhas de titânio grau 2 com espessura de 0,063 em material de estoque para contatos de eletrodos.
- Utilizando técnicas de usinagem padrão ou ferramentas manuais de precisão, faça eletrodos com as seguintes dimensões: 20 mm x 5 mm com ponta arredondada e ranhura para trás. Remova quaisquer bordas ásperas ou rebarbas usando lixa de grão fino.
- Para fixar os contatos do eletrodo, enrole 22 G de fio de cobre encalhado ao redor das ranhuras do eletrodo e fixe por solda. Proteja esta articulação usando tubos de encolhimento térmico.
- Em seguida, conecte o eletrodo conectado a fórceps autoclaváveis e não condutores usando um tubo adicional de encolhimento de calor para fazer os dois eletrodos negativos. Conecte o eletrodo positivo único a um material autoclavável e não condutor (como uma alça de escova de dentes com uma cabeça serrada). Encaixe a extremidade aberta do fio com um plugue de banana padrão.
4. Preparação para cirurgia
- Leve as barragens grávidas para a área cirúrgica pelo menos 30 minutos antes da cirurgia para permitir a redução dos níveis de estresse após o transporte da unidade animal.
- Esterilize todo o local da cirurgia usando lenços umedecidos germicida esterilizadores e, em seguida, 70% de etanol. Troque as luvas antes da cirurgia.
- Esterilizar ferramentas autoclavadas em um esterilizador de contas de vidro.
- Transfira 1x PBS estéril (cerca de 50 mL por barragem) para tubos cônicos de 50 mL e coloque em um rack de tubo no banho de água aquecido a 38-40 °C. Verifique a temperatura salina estéril com um termômetro.
- Ligue a bomba de circulação de aquecimento da água para que seja aquecida a 37 °C antes do início da cirurgia. Isso manterá a temperatura corporal do rato durante a cirurgia.
- Ligue o injetor de pressão e o eletroporador e garanta a função adequada antes da cirurgia.
- Gire brevemente a solução de DNA plasmídeo (obtida na etapa 1.4) em uma centrífuga de mesa e coloque-a no gelo.
- Puxe pipetas de vidro em um puxador de pipeta para que a ponta da pipeta de vidro puxado tem cerca de 50 μm de diâmetro.
- Encha a pipeta com 20-40 μL de solução de DNA (obtida na etapa 1.4).
- Configure todos os itens necessários para a cirurgia, incluindo loção de remoção de cabelo, iodo, 70% de etanol, trocas de algodão, pomada ocular, suturas, gaze, etc.
- Prepare uma folha de cirurgia e preencha as informações necessárias, como RG e peso do rato, data da cirurgia, nome do cirurgião, etc.
5. Na cirurgia de eletroporação utera
- Pesar o rato antes da cirurgia e anotar isso na folha de cirurgia.
- Anestesiar um rato grávida (E16) por inalação em uma câmara de indução com 4% (v/v) mistura de oxigênio-isoflurane. Uma vez que o rato tenha sido induzido, mova-se para uma inalação de máscara e mantenha a isoflurano em 1-1,5% (v/v) e monitore a respiração durante toda a cirurgia. Verifique se o mouse está totalmente anestesiado, a taxa de respiração deve ser de ~55-65 respirações por minuto.
- Administrar analgésicos pré-operatórios: buprenorfina (3,25 mg/kg; SC) e meloxicam (1-5 mg/kg; SC) a um volume máximo de 10-30 ml/kg.
- Use creme de depilação ou use cuidadosamente uma navalha para remover a pele do abdômen. Esterilize o abdômen esfregando com povidone-iodo e 70% de etanol e repita isso pelo menos 3 vezes. Crie um campo estéril ao redor do abdômen usando uma gaze estéril, cortinas estéreis também podem ser usadas.
- Faça uma incisão midline (3-4 cm) na pele abdominal, sendo certo levantar a pele com fórceps para evitar cortar através do músculo. Em seguida, corte o músculo, novamente tomando cuidado para levantar o músculo para evitar cortar órgãos vitais.
- Puxe cuidadosamente os chifres uterinos para fora da represa usando fórceps de anel e coloque-os suavemente no campo estéril, certificando-se de que o chifre uterino é suportado com preenchimento e não está puxando muito longe da represa. A partir deste ponto, mantenha o chifre uterino umedecido durante todo o resto da cirurgia com o pré-aquecido 1x PBS estéril.
- Posicione um embrião usando fórceps ou dedos. Insira cuidadosamente a pipeta de vidro puxada em um ângulo de 45 graus em relação ao plano horizontal da cabeça e inserida no ventrículo lateral, que pode ser identificado visualmente entre a linha média do cérebro e o olho. Injete cerca de 2-3 μL em cada ventrículo lateral, inserindo a pipeta em um e depois no outro ventrículo (recomendado) ou injetando a solução de DNA em um ventrículo até que passe em ambos os ventrículos laterais. O ventrículo foi direcionado com sucesso se uma forma crescente estiver presente após a injeção.
NOTA: A ponta da pipeta de vidro pode quebrar durante a cirurgia. Se isso acontecer, substitua a pipeta de vidro, garantindo que os chifres uterinos sejam mantidos umedecidos enquanto uma nova pipeta é preparada e preenchida com a solução de DNA. - Para transfetar as células bilateralmente no córtex frontal, posicione os dois eletrodos negativos nas laterais dos embriões cabeça apenas lateral e ligeiramente caudal para os ventrículos laterais e posicione o eletrodo positivo entre os olhos, bem na frente do focinho em desenvolvimento.
- Certifique-se de que o embrião está generosamente umedecido. Aplique quatro pulsos quadrados (duração do pulso = duração do pulso= 50 ms de duração, amplitude de pulso = 36 V, intervalo interpulse = 500 ms).
- Injete e eletroporá todos os embriões, indo um por um para que cada embrião seja eletroporado imediatamente após a injeção da solução de DNA. Uma vez que todos os embriões tenham sido eletroporados, insira cuidadosamente os chifres uterinos de volta na cavidade abdominal. Durante esta etapa, cubra a cavidade abdominal em PBS estéril (1x) para auxiliar a colocação do chifre uterino.
- Encha a cavidade abdominal com 1x pbs estéril para que não permaneçam bolsões de ar após a sutura estar completa. Sutura o músculo com suturas absorvíveis e a pele com suturas não absorvíveis de seda.
- Deixe a barragem se recuperar totalmente em uma câmara aquecida por pelo menos 1 h. Nas próximas 48 horas, verifique as barragens regularmente. À medida que a represa se recupera da anestesia e recupera a consciência, ela começará a se mover e bater.
- Administre analgésicos pós-operatórios se as barragens estiverem mostrando sinais de dor, como a bola para cima de seus corpos e respiração rapidamente. Só administre se houver sinais de dor, uma vez que as injeções de SC poderiam estressar as barragens, mas se administradas ao grupo experimental também administram ao grupo controle, ou vice-versa.
6. Ensaio do comportamento social precoce em uma tarefa de interação materna
NOTA: Este protocolo é adaptado das publicações anteriores5,25. Realize esta tarefa após os ratos terem nascido do dia pós-natal (P) 18-21.
- Comportamento de amor materna na tarefa de interação materna I (MI1).
- Certifique-se de que a cama da gaiola não seja alterada na semana anterior à realização da tarefa.
- Obtenha ou construa uma arena de campo aberto (OF) que possa ser facilmente limpa (o acrílico é recomendado) com as seguintes dimensões: 50 x 50 x 30 cm (altura de largura de comprimento). As condições de iluminação durante o desempenho dos comportamentos podem variar dependendo da questão experimental e podem influenciar níveis de excitação e comportamento semelhante à ansiedade. Registos comportamentais gravados sob uma luz fraca (aproximadamente 20 lux) posicionados sobre o centro da arena.
- Durante dois dias antes do teste de comportamento, aclimate a barragem na arena colocando-a sob um copo de arame de malha (como um copo de lápis) em um canto da arena por cinco minutos por dia.
- No dia do teste, que pode ser de P18-21, antes que os ratos sejam desmamados, limpe a arena completamente com lenços umedecidos e 70% de etanol.
- Montou a arena com dois cantos opostos contendo roupas de cama limpas e um canto contendo cama de ninho sujo da gaiola do filhote.
- Permita que cada filhote explore a arena por 3 minutos, colocando cada filhote no canto neutro e vazio no início.
NOTA: Regise o comportamento com uma câmera de vídeo a 30 fps. Limpe completamente a arena entre cada filhote e substitua a roupa de cama fresca. Alternar qual canto é a cama fresca versus ninho como um controle para evitar a preferência do canto devido a outras razões (ou seja, ruído ambiente ou luz). Se executar várias ninhadas através da janela de desenvolvimento P18-21, execute experimentos comportamentais ao mesmo tempo entre os dias. Certifique-se também de que durante um determinado dia, os grupos de controle e experimentais sejam executados em paralelo.
- Interação social materna na tarefa de interação materna II (MI2)
- Execute esta tarefa imediatamente após a tarefa MI1.
- Configure a arena para que um canto contenha um copo de malha de arame vazio e o canto oposto contenha a represa sob um copo de arame de malha. Se os ratos forem capazes de mover o copo, pese a xícara com um peso que pode ser colado na parte superior do copo para evitar o movimento. Coloque o ninho sujo de cama da gaiola em outro canto.
- Execute a tarefa MI2. Coloque o filhote no canto vazio e regise o comportamento por cinco minutos a 30 fps, permitindo que o filhote explore. Execute cada filhote separadamente e limpe completamente toda a arena e copos de malha de arame entre cada filhote.
7. Ensaio de trabalho de comportamento social adulto
- Execute o comportamento social adulto nos mesmos camundongos que foram executados na tarefa MI1 e MI2 uma vez que eles são adultos (P60-P70 ou mais). Os dados coletados aqui foram feitos em uma coorte separada.
- Manuseie os camundongos adultos por 3 dias consecutivos para permitir a habituação ao experimentador. Certifique-se de que apenas experimentadores que foram familiarizados com os ratos executam experimentos de comportamento, idealmente ter a mesma pessoa executar todas as tarefas.
- Habituar ratos à arena da arena por 3 dias por 5 minutos por dia.
- Comor o comportamento em uma nova tarefa de reconhecimento de objetos para medir a locomoção geral e o interesse em um novo objeto. Isso permitirá uma interpretação mais significativa do comportamento social se os ratos tiverem um déficit específico nas interações sociais.
- Coloque ratos na arena por 5 minutos com um novo objeto (pequeno brinquedo plástico com superfícies lisas e limpas) em um canto da arena. Limpe completamente a arena entre ratos com 70% de etanol.
- Para reconhecimento de objetos novos, coloque o 'objeto novo' anteriormente exposto, que agora é familiar, em um canto e coloque um novo objeto novo no canto oposto. Para todas as tarefas, troque os cantos entre os ensaios como um controle.
- Para uma nova interação social, certifique-se de que os ratos novos são idade, tensão e sexo e estão aclimatados ao copo de arame de malha por 2 dias consecutivos por 5 minutos por dia. Para cada ensaio, coloque um novo mouse sob um copo de arame de malha e no canto oposto coloque um copo de arame de malha vazio. Deixe os ratos explorarem a arena por 5 minutos enquanto gravam o comportamento. Limpe bem a arena e os copos de arame de malha entre cada ensaio.
8. Analisar dados comportamentais
- Use o DeepLabCut (https://github.com/AlexEMG/DeepLabCut) para realizar o rastreamento básico da parte do corpo). Notas detalhadas sobre como instalar e usar o DeepLabCut podem ser encontradas em sua página do GitHub. Também está disponível uma biblioteca personalizada baseada em píton 'dlc_utils' (https://github.com/balajisriram/dlc_utils) para análise mais aprofundada dos dados após o rastreamento de partes básicas do corpo ser concluído. Mais detalhes sobre como usar esta biblioteca podem ser encontrados na página do GitHub.
- Instale o DeepLabCut usando o processo de instalação de anaconda. Instale uma versão somente para CPU do DeepLabCut, bem como a versão habilitada para GPU para treinar a rede.
- Siga as instruções disponíveis no link abaixo para criar um projeto para rastrear partes do corpo. Breifly, escolha uma amostra de quadros do seu conjunto de dados e marque manualmente as partes relevantes do corpo nesses quadros amostrados. Treine a rede DeepLabCut para prever as partes do corpo e verifique se a rede treinada funciona adequadamente.
https://github.com/AlexEMG/DeepLabCut/blob/master/examples/Demo_yourowndata.ipynb - Para fins de rastreamento da posição corporal e identificação de interações simples em campo aberto, identificar o centroide do animal, a cabeça (operacionalmente definida como o ponto médio entre as orelhas), as orelhas esquerda e direita, bem como o focinho e a base da cauda. Ter várias partes do corpo rastreadas permite a substituição apropriada quando algumas partes do corpo estão faltando no quadro devido à oclusão.
- Além das partes do corpo animal, rastreie uma variedade de pontos relacionados ao ambiente: como as bordas das caixas de comportamento. Estes permitem a estimativa repetível de tais pontos em várias sessões - mesmo que a posição da configuração comportamental mude ligeiramente em relação à câmera entre as sessões.
- Depois de rastrear as partes do corpo a partir dos dados de comportamento, tome cuidado para filtrar os locais de partes do corpo previstos com base na confiança associada à previsão em cada quadro do vídeo. Previsões de baixa confiança são geralmente associadas com partes do corpo ocluídas. Para tais previsões, substitua uma determinada parte do corpo por outra (se tal substituição for apropriada) ou use os locais de outras partes do corpo para prever onde a parte do corpo relevante provavelmente será. Para a maioria das aplicações de campo aberto, o centroid do corpo dos roedores raramente é ocluído e pode ser previsto com alta precisão e precisão.
- Use a localização prevista do centroide, bem como a localização dos pontos rastreados no ambiente para estimar uma série de características do comportamento do animal. Por exemplo, nos dados de campo aberto, a derivada temporal da posição pode ser usada para calcular a velocidade do animal.
- Para evitar viés, realize todos os experimentos "cegos" em relação ao grupo experimental quando possível, especialmente quando houver qualquer elemento subjetivo na avaliação dos resultados. Teste para o efeito das diferenças sexuais nos principais desfechos experimentais pelo agrupamento de dados em grupos masculinos e femininos. Todos os testes estatísticos são projetados para testar um número igual de animais entre grupos.
9. Contagem de células pós-hoc para caracterizar extensão da transfecção celular
- Determine o número de células transfeccionadas por camundongo, uma vez que nem todos os camundongos terão transfecção bem sucedida e haverá variação no número de células transfeccionadas. Um método para conseguir isso envolve a contagem do número de neurônios transfectados em seções coronais alternadas seguidas de uma interpolação para estimar o número total de células transfeminadas. Para isso, imagem e contagem de todas as outras seções coronais (50 μm).
- Use perfusões transcárvias com 4% de PFA para fixar tecido e, em seguida, dissecar o cérebro. Após a crioproteção, se sectionia o cérebro em seções coronais a 50 μm.
- Para o córtex frontal, conte células dentro de +2,75 e + 1,35 mm de Bregma. Estas coordenadas contêm áreas corticais frontais e incluem parte do córtex somatosensorial (S1). Utilizando este método, não foram observadas células transfectadas em regiões corticais mais caudais ou áreas subcorticais.
- Certifique-se de indicar a esquerda do hemisfério direito, como marcar um hemisfério com um orifício de agulha durante a secção, e contar células bilateralmente. Use um software automatizado de contagem de células ou células de contagem manualmente, confirmando a presença de um corpo celular usando DAPI.
- Uma vez que a contagem de células seja obtida, estabeleça um limite para inclusão. Por exemplo, incluem apenas camundongos que são bilateralmente eletroporados na análise. Para análise mais aprofundada, correlacionar o número de células transfeinadas com respostas comportamentais para ver se há associação. Esta técnica atingirá múltiplas áreas cerebrais, por isso é necessário fornecer informações sobre quais regiões cerebrais foram geneticamente manipuladas.
NOTA: É possível que a manipulação de certos genes possa alterar a migração neuronal, especificação e/ou morte. Certifique-se durante a contagem celular que a anatomia cerebral é examinada e cada neurônio transfectado está dentro da camada que supostamente foi transfeccionada (ou seja, L2/3). Medidas anatômicas brutas, como a espessura cortical, também podem ser quantificadas medindo a distância da pia para o cortical L6.
Resultados
Desenvolvimento e implementação bem sucedidos de um eletroporador personalizado e três pinos eletrodos.
Para iues, um eletroporador personalizado barato foi construído com base em um design descrito anteriormente27 (Figura 1A e Figura 2). Um eletrodo de três pinos foi feito23,24 usando fórceps plásticos com 2 eletrodos negativos ligados às pontas dos pinos e o eletrodo positivo foi anexado à extremidade de uma alça de escova de dentes(Figura 1B). O eletroporador e o eletrodo de três pinos foram testados para garantir a função adequada. A IUE foi realizada expondo os chifres uterinos, injetando DNA plasmídeo e eletroporando cada embrião(Figura 1C). O eletrodo de três pinos pode ser mantido facilmente em duas mãos, como mostrado(Figura 1B, à direita), usando as pinças para estabilizar a cabeça do embrião. Somas piramicidas L2/3 PFC e seus processos foram rotulados com GFP via IUE, confirmando assim o sucesso do experimento de transferência genética.
Visando uma grande população de neurônios bilateralmente no córtex frontal dos camundongos.
O número total de células transfeinadas e a distribuição de neurônios transfectados podem ser quantificados tanto para camundongos juvenis quanto adultos5. Utilizando este método bilateral de IUE, cerca de 4000-6000 L2/3 neurônios piramifetos foram transfectados com o plasmídeo pCAG-GFP(Figura 3A). Além disso, a maioria dessas células foi localizada em regiões corticais frontais, incluindo o córtex de associação frontal, áreas de associação motora, córtex pré-córbico e infralímbico e o córtex cingulado orbital e anterior(Figura 3B). Um exemplo representativo mostra a distribuição rostral-caudal de neurônios transfectados em um rato de controle adulto (P60, Figura 3C) e a distribuição entre hemisférios(Figura 3D). Isso confirma a capacidade das UIEs bilaterais de atingir e rotular geneticamente grandes populações de neurônios pirambulais L2/3 no córtex frontal.
Comportamento social em camundongos juvenis e adultos.
A primeira parte da tarefa de interação materna testou a capacidade de controle de camundongos transfectados P18 (IUE com plasmídeo pCAG-GFP) para encontrar cama ninho (interação materna 1 [MI1]). Isso testa as habilidades sensoriais dos camundongos juvenis. Os ratos de controle passaram mais tempo explorando suas roupas de cama do ninho do que explorando roupas de cama frescas. Assim, sugerindo que, como esperado, esses camundongos possuem habilidades sensoriais intactas e comportamento exploratório(Figura 4A e Figura 3B). A segunda parte da tarefa (MI2) aproveita a tendência dos ratos de serem motivados a interagir e estar perto de sua mãe. Nesta tarefa, os filhotes passavam a maior parte do tempo perto da mãe enquanto passavam significativamente menos tempo explorando o copo vazio ou a cama do ninho(Figura 4C,D). Esses resultados sugerem que os camundongos de controle de IUE apresentam um comportamento normal de homing.
Ratos de controle adulto (P60) passaram aproximadamente 35% do tempo explorando um novo objeto (tempo total gasto na arena = 5 min, Figura 5A,B). Quando apresentados com um objeto novo e familiar, ratos adultos passaram mais tempo explorando o novo objeto, sugerindo interesse intacto na novidade(Figura 5C,D). Na tarefa de sociabilidade, o controle de ratos adultos passou quantidades semelhantes de tempo explorando um novo rato e um copo vazio(Figura 5E,F). Esse comportamento foi rastreado automaticamente usando o software DeepLabCut disponível gratuitamente26. Vídeos de exemplo mostram rotulagem bem sucedida de vários pontos em um mouse, incluindo os membros, centroid, cabeça e orelhas (Vídeo 1). O DeepLabCut foi usado para determinar quando os ratos estavam criando examinando o comprimento do corpo do mouse, uma vez que essa distância fica mais curta quando o mouse se levanta(Vídeo 2).

Figura 1: Na eletroporação utericana usando um eletroporador personalizado e um eletrodo de três pinos. (A) Imagem do eletroporador personalizado (esquerda) e seu painel frontal (à direita). 1: Indicador de potência. 2: Interruptor de alimentação. 3: Indicador de pulso. 4: Interruptor de modo de teste. 5: Seletor de tensão. 6: Controle de largura de pulso. 7: Eletrodo (+). 8: Gatilho Externo (TTL). 9: Eletrodo (-). (B) Imagem do eletrodo de três pinos personalizado (esquerda) e do método recomendado para segurar o eletrodo de três pinos durante a IUE (direita). (C) Esquerda: Diagrama representando cirurgia IUE realizada em barragens E16. Direito: imagem confocal representativa 20X da IUE com GFP direcionado a L2/3 mPFC. Asterisco amarelo: neurônios L2/3 GFP+. Barra de escala do painel esquerdo = 250 μm. Barra de escala do painel direito = 75 μm. Números e dados adaptados de Comer et al., 20205. Clique aqui para ver uma versão maior desta figura.

Figura 2: Diagrama do circuito do eletroporador feito sob medida. Um diagrama representando o circuito eletroporador feito sob medida baseado nos exemplos descritos anteriormente27. Clique aqui para ver uma versão maior desta figura.

Figura 3: Direcionando grandes populações de neurônios do córtex frontal L2/3 usando IUE. (A) Número total de células GFP+ em camundongos de controle juvenil. N = 15 ratos. (B) Percentual de células GFP+ por área em camundongos de controle adulto. N = 22 ratos de controle. (C) Seções representativas mostrando extensão rostro-caudal de células transfeinadas no córtex frontal. As imagens nos painéis esquerdos são áreas ampliadas dos painéis direito (quadrado vermelho). Córtex de associação frontal: FrA. Córtex motor suplementar: M2. Córtex pré-ancórbico: PL. Córtex infralímbico: IL. Córtex cingulado anterior: ACC. Córtex orbitofrontal medial: MO. Córtex orbitofrontal ventral: VO. Córtex orbitofrontal lateral: LO. Córtex insular anterior: IA. Córtex frontal área 3: Fr3. Córtex motor primário: M1. Córtex somatosensorial primário: S1. Córtex piriforme: Pir. Núcleo olfativo anterior: AO. Caudate-putamen: Cpu. Números negros: coordenadas de Bregma. Barra de escala do painel esquerdo = 0,5 mm. Barra de escala do painel direito = 1 mm. Média ± SEM. (D) Dados mostrando o número de células eletroporadas no hemisfério direito versus esquerdo dentro de cada rato. Mostrando contagem de células não-entrevistadas de 14 camundongos adultos eletroporados com plasmídeo pCAG-GFP. Teste t emparelhado. p = 0,4757. Dados adaptados de Comer et al., 20205. Clique aqui para ver uma versão maior desta figura.
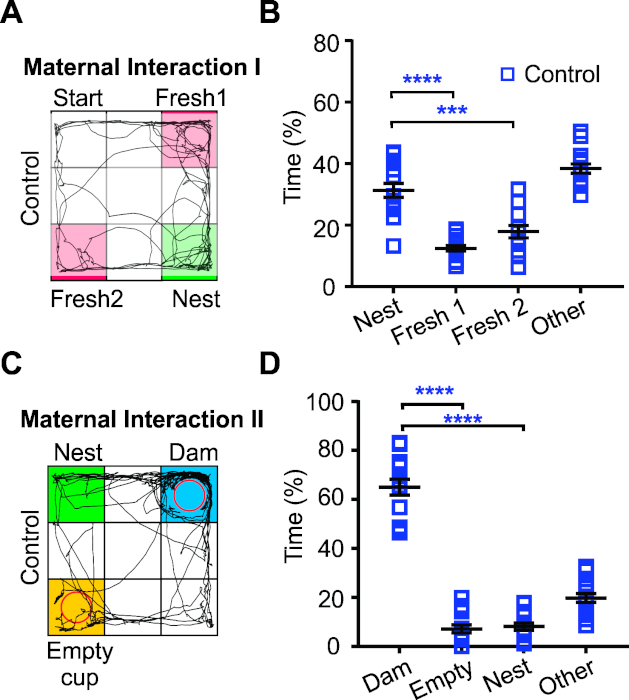
Figura 4: Avaliação de habilidades sensoriais, comportamento exploratório e interações sociais precoces em camundongos transfectados juvenis. (A) Exemplo representativo do caminho percorrido (traço preto) por um filhote de controle P18 na tarefa MI1. Cantos de cama frescos (fresco 1 e 2, rosa) e canto de cama ninho (verde). (B) Os filhotes de controle passaram mais tempo explorando a cama do ninho do que a roupa de cama fresca na tarefa MI1. p < 0,001, ****p < 0,0001. Anova bidirecional e o pós-teste de Sidak. (C) Exemplo representativo do caminho percorrido (traço preto) por um filhote de controle P18 na tarefa MI2. Copo da represa (represa: azul), Copo vazio (copo vazio: amarelo), canto de cama ninho (ninho: verde). (D) Os filhotes de controle passaram mais tempo interagindo com sua represa do que com o copo vazio ou a cama do ninho. Anova bidirecional e o pós-teste de Sidak. p < 0,0001. N = 15 ratos de controle. Números e dados adaptados de Comer et al., 20205. Clique aqui para ver uma versão maior desta figura.

Figura 5: Avaliação das interações sociais em camundongos transfectados adultos. (A) Exemplo representativo do caminho percorrido (traço preto) pelo P60 controlar mouse adulto em nova tarefa de interação de objetos. canto rosa = localização de objeto novo. (B) Os ratos de controle passaram aproximadamente 35% do tempo explorando o objeto novo (5 min de tempo total). Por cento do tempo gasto no canto com objeto novo mostrado. (C) Exemplos representativos de caminho percorrido (traço preto) por um mouse adulto de controle P60 em nova tarefa de reconhecimento de objetos. canto rosa: localização de objeto novo. canto verde: localização de objeto familiar. (D) Os ratos de controle passaram mais tempo explorando o objeto novo do que o objeto familiar. Índice de discriminação (DI) mostrado; DI = ((tempo com objeto novo – tempo com objeto familiar) / (tempo com objeto novo + tempo com objeto familiar)). (E) Exemplos representativos de caminho percorrido (traço preto) pelo P60 controlam o mouse adulto na tarefa de sociabilidade. canto rosa: localização de rato novo sob copo de arame de malha. canto verde: localização de copo de arame de malha vazio. (F) Os ratos de controle gastaram em média tempo igual explorando um copo vazio e um copo contendo um novo rato. Gráfico mostra DI ((tempo com rato novo – tempo com copo vazio) / (tempo com novo mouse + tempo com copo vazio)). Uma vez que os ratos não estavam socialmente isolados antes da tarefa, o impulso de interagir com um novo rato poderia ter sido diminuído. No entanto, ainda havia exploração do novo rato. N = 22 ratos de controle. Números e dados adaptados de Comer et al., 20205. Clique aqui para ver uma versão maior desta figura.
Vídeo 1: Usando DeepLabCut para rastrear automaticamente a posição animal em tarefas comportamentais. Um vídeo representativo de um mouse adulto na tarefa de interação social que foi rotulado usando DeepLabCut. Várias partes do mouse podem ser rotuladas, como os membros e a cabeça. O uso do centroide é apropriado para rastrear a posição do animal, mas outros pontos podem ser usados para identificar comportamentos mais complexos, como o preparo ou a criação. Clique aqui para ver este vídeo. (Clique com o botão direito do download.)
Vídeo 2: Usando o DeepLabCut para acompanhar automaticamente a criação em tarefas comportamentais. Um vídeo representativo de um mouse adulto na tarefa de interação social que foi rotulado usando DeepLabCut. A seta vermelha mostra o comprimento do mouse com a seta apontando para a cabeça do mouse. O comprimento da seta pode ser usado para determinar com o mouse é a criação, uma vez que o comprimento do mouse, e a seta, torna-se menor quando o mouse se levanta. Clique aqui para ver este vídeo. (Clique com o botão direito do download.)
Discussão
Aqui, um oleoduto é descrito que combina a manipulação de novos genes de interesse em grandes populações de neurônios corticais frontais com ensaios comportamentais em camundongos. Além disso, este pipeline permite o estudo longitudinal do comportamento nos mesmos camundongos, tanto durante o desenvolvimento pós-natal precoce quanto na idade adulta. Essa técnica contorna a necessidade de contar com modelos genéticos de animais que podem ser caros em termos de tempo e despesas. A força deste protocolo é que ele pode ser usado para estudar distúrbios neurodesenvolvimentos e neuropsiquiátricos para os quais os GWAS recentes descobriram novas associações genéticas28,29. Embora este método forneça transfecção específica do tipo celular de neurônios excitatórios, uma limitação é que é menos viável atingir outros tipos de células cerebrais, como interneurônios ou células gliais. No entanto, vários estudos sugerem uma abordagem modificada para atingir outros tipos de células cerebrais30,31. Além disso, modificando a posição dos eletrodos em relação à cabeça do embrião e alterando o tempo da IUE, outras regiões cerebrais podem ser transfeinadas bilateralmente, incluindo o hipocampo, amígdala, cerebelo e os cortices visuais, somatosensoriais e motor24,32. Além disso, diferentes camadas corticais podem ser direcionadas realizando IUE em diferentes estágios de desenvolvimento.
Embora a IUE possa ter uma alta taxa de sucesso, existem etapas críticas e solução de problemas do método que é necessário às vezes. É necessário que os plasmídeos sejam cuidadosamente projetados e validados em linhas celulares. Como em toda a clonagem, deve-se tomar cuidado para garantir a expressão genética adequada, como confirmar que a sequência está no quadro. Além disso, o efeito da manipulação genética (por exemplo, superexpressão ou silenciamento) deve ser confirmado levando em consideração que os níveis de expressão podem variar ao longo do curso de tempo de desenvolvimento do mouse e data de desenvolvimento da IUE. A mancha ocidental e o qPCR podem ser usados para determinar a extensão da superexpressão genética5. Recomenda-se co-eletroporar um gene repórter, como o GFP, em um plasmídeo separado, uma vez que as proteínas marcadas com GFP podem ser dobradas incorretamente ou perder sua função. Alternativamente, se um repórter não for usado, o experimentador pode usar em situ hibridização, qPCR ou mancha ocidental para determinar os níveis de expressão do gene de interesse5.
Se os plasmídeos foram verificados, mas não há animais que pareçam positivos para a transfecção, verifique minuciosamente todos os equipamentos, especialmente o eletroporador, para garantir a função adequada. Ao fornecer pulsos de tensão aos embriões, os chifres uterinos devem ser bem umedecidos com soro fisiológico aquecido e os eletrodos devem produzir bolhas após a geração do pulso de tensão. Se não houver bolhas quando a tensão é entregue, provavelmente há um problema com o eletroporador. Alternativamente, o cDNA pode não ter sido injetado corretamente no ventrículo. Quando o CDNA é injetado corretamente no ventrículo lateral, o corante verde rápido será visível na forma de uma crescente. Por fim, a posição dos eletrodos é importante. Se os eletrodos estiverem posicionados ligeiramente incorretamente, as células podem não ser transfeinadas na região de interesse. Portanto, ao verificar se há uma transfecção bem sucedida, salve algumas seções cerebrais mais caudais para ver, se talvez, a região cerebral errada foi transfeccionada. Uma vez praticado esse método, um cirurgião experiente pode esperar alcançar uma taxa de sucesso de quase 90%. Este protocolo pode ser modificado para atingir outras regiões cerebrais de interesse. Por exemplo, é possível atingir a maioria das regiões corticais bilateralmente e até mesmo certas regiões subcorticais, incluindo o hipocampo23 . Também é possível reduzir ainda mais os custos com a construção de um eletroporador personalizado, que foi utilizado nos dados aqui apresentados5,27.
Estudos futuros poderiam fazer uso desse método para entender o papel de candidatos genes recém-descobertos em várias doenças neurológicas. O pipeline apresentado oferece um ensaio relativamente rápido para testar os efeitos de manipulações genéticas específicas no desenvolvimento e comportamento pós-natal precoces na idade adulta. Os esforços futuros que utilizam esse método têm o potencial de descobrir quais genes desempenham um papel causador em certos distúrbios cerebrais, incluindo SCZ e transtorno do espectro autista.
Divulgações
Os autores não declaram interesses concorrentes.
Agradecimentos
Agradecemos a Lisa Kretsge pelo feedback crítico e edição do manuscrito. Agradecemos a todos os assistentes de pesquisa do laboratório Cruz-Martín que foram inestimáveis em ajudar com perfusões e contagem celular de cérebros comportamentais. Agradecemos a Andrzej Cwetsch pela contribuição sobre o design do eletrodo tripolar, e Todd Blute e o Núcleo de Imagem de Biologia da Universidade de Boston pelo uso do microscópio confocal. Este trabalho foi apoiado por um Narsad Young Investigator Grant (AC-M, #27202), o Brenton R. Lutz Award (ALC), o I. Alden Macchi Award (ALC), o NSF NRT UtB: Neurophotonics National Research Fellowship (ALC, #DGE1633516) e o Boston University Research Opportunities Program (WWY). Os financiadores não tiveram papel na concepção do estudo, coleta e análise de dados, decisão de publicar ou elaboração do manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| 13mm Silk Black Braided Suture | Havel's | SB77D | Suture skin |
| Adson Forceps | F.S.T. | 11006-12 | IUE |
| C270 Webcam | Logitech | N/A | Record behavior |
| Electroporator | Custom-built | N/A | See Figure 1 and 2 and Bullmann et al, 2015 |
| EZ-500 Spin Column Plasmid DNA Maxi-preps Kit, 20preps | Bio Basic Inc. | BS466 | Pladmid preparation |
| Fast Green FCF | Sigma | F7252-5G | Dye for DNA solution |
| Fine scissors- sharp | F.S.T. | 14060-09 | IUE |
| Fisherbrand Gauze Sponges | Fisher Scientific | 1376152 | IUE |
| Gaymar Heating/Cooling | Braintree | TP-700 | Heating Pad |
| Glass pipette puller | Sutter Instrument, | P-97 | IUE |
| Glass pipettes | Sutter Instrument, | BF150-117-10 | IUE |
| Hair Removal Lotion | Nair | N/A | Hair removal |
| Hartman Hemostats | F.S.T. | 13002-10 | IUE |
| Open field maze- homemade acrylic arena | Custom-built | N/A | 50 × 50 × 30 cm length-width-height |
| pCAG-GFP | Addgene | 11150 | Mammalian expression vector for expression of GFP |
| Picospritzer III | Parker Hannifin | N/A | pressure injector |
| Retractor - 2 Pronged Blunt | F.S.T. | 17023-13 | IUE |
| Ring forceps | F.S.T. | 11103-09 | IUE |
| Sterilizer, dry bead | Sigma | Z378569 | sterelize surgical tools |
| SUTURE, 3/0 PGA, FS-2, VIOLET FOR VET USE ONLY | Havel's | HJ398 | Suture muscle |
| Water bath | Cole-Parmer | EW-12105-84 | warming sterile saline |
Referências
- Yang, Y., et al. Genetic association and meta-analysis of a schizophrenia GWAS variant rs10489202 in East Asian populations. Translational Psychiatry. 8 (1), 144 (2018).
- Schizophrenia Working Group of the Psychiatric Genomics Consortium. Biological insights from 108 schizophrenia-associated genetic loci. Nature. 511 (7510), 421-427 (2014).
- Howard, D. M., et al. Genome-wide meta-analysis of depression identifies 102 independent variants and highlights the importance of the prefrontal brain regions. Nature Neuroscience. 22 (3), 343-352 (2019).
- Grove, J., et al. Identification of common genetic risk variants for autism spectrum disorder. Nature Genetics. 51 (3), 431-444 (2019).
- Comer, A. L., et al. Increased expression of schizophrenia-associated gene C4 leads to hypoconnectivity of prefrontal cortex and reduced social interaction. PLoS Biology. 18 (1), 3000604 (2020).
- Chini, M., et al. Resolving and Rescuing Developmental Miswiring in a Mouse Model of Cognitive Impairment. Neuron. 105 (1), 60-74 (2020).
- Clifton, N. E., et al. Dynamic expression of genes associated with schizophrenia and bipolar disorder across development. Translational Psychiatry. 9 (1), 74 (2019).
- Oberlander, V. C., Xu, X., Chini, M., Hanganu-Opatz, I. L. Developmental dysfunction of prefrontal-hippocampal networks in mouse models of mental illness. European Journal of Neurosciences. 50 (6), 3072-3084 (2019).
- Batista-Brito, R., et al. Developmental Dysfunction of VIP Interneurons Impairs Cortical Circuits. Neuron. 95 (4), 884-895 (2017).
- Luo, L., Callaway, E. M., Svoboda, K. Genetic Dissection of Neural Circuits: A Decade of Progress. Neuron. 98 (2), 256-281 (2018).
- DeNardo, L., Luo, L. Genetic strategies to access activated neurons. Current Opinion in Neurobiology. 45, 121-129 (2017).
- Huang, Z. J., Zeng, H. Genetic approaches to neural circuits in the mouse. Annual Reviews in Neurosciences. 36, 183-215 (2013).
- Wu, Z., Yang, H., Colosi, P. Effect of genome size on AAV vector packaging. Molecular Therapy. 18 (1), 80-86 (2010).
- Callaway, E. M., Luo, L. Monosynaptic Circuit Tracing with Glycoprotein-Deleted Rabies Viruses. Journal of Neurosciences. 35 (24), 8979-8985 (2015).
- Cruz-Martín, A., et al. A dedicated circuit links direction-selective retinal ganglion cells to the primary visual cortex. Nature. 507 (7492), 358-361 (2014).
- Saito, T. In vivo electroporation in the embryonic mouse central nervous system. Nature Protocols. 1 (3), 1552-1558 (2006).
- Cruz-Martín, A., Crespo, M., Portera-Cailliau, C. Delayed stabilization of dendritic spines in fragile X mice. Journal of Neurosciences. 30 (23), 7793-7803 (2010).
- Zhang, J. H., Adikaram, P., Pandey, M., Genis, A., Simonds, W. F. Optimization of genome editing through CRISPR-Cas9 engineering. Bioengineered. 7 (3), 166-174 (2016).
- Strecker, J., et al. RNA-guided DNA insertion with CRISPR-associated transposases. Science. 365 (6448), 48-53 (2019).
- Cruz-Martín, A., Crespo, M., Portera-Cailliau, C. Glutamate induces the elongation of early dendritic protrusions via mGluRs in wild type mice, but not in fragile X mice. PLoS One. 7 (2), 32446 (2012).
- LoTurco, J., Manent, J. B., Sidiqi, F. New and improved tools for in utero electroporation studies of developing cerebral cortex. Cerebral Cortex. 19, 120-125 (2009).
- Kolk, S. M., de Mooij-Malsen, A. J., Martens, G. J. Spatiotemporal Molecular Approach of in utero Electroporation to Functionally Decipher Endophenotypes in Neurodevelopmental Disorders. Frontiers in Molecular Neurosciences. 4, 37 (2011).
- Szczurkowska, J., et al. Targeted in vivo genetic manipulation of the mouse or rat brain by in utero electroporation with a triple-electrode probe. Nature Protocols. 11 (3), 399-412 (2016).
- dal Maschio, M., et al. High-performance and site-directed in utero electroporation by a triple-electrode probe. Nature Communications. 3, 960 (2012).
- Zhan, Y., et al. Deficient neuron-microglia signaling results in impaired functional brain connectivity and social behavior. Nature Neurosciences. 17 (3), 400-406 (2014).
- Mathis, A., et al. DeepLabCut: markerless pose estimation of user-defined body parts with deep learning. Nature Neurosciences. 21 (9), 1281-1289 (2018).
- Bullmann, T., Arendt, T., Frey, U., Hanashima, C. A transportable, inexpensive electroporator for in utero electroporation. Development Growth and Differentiation. 57 (5), 369-377 (2015).
- Li, Z., et al. Genome-wide association analysis identifies 30 new susceptibility loci for schizophrenia. Nature Genetics. 49 (11), 1576-1583 (2017).
- Ripke, S., et al. Genome-wide association analysis identifies 13 new risk loci for schizophrenia. Nature Genetics. 45 (10), 1150-1159 (2013).
- De Marco Garcia, N. V., Fishell, G. Subtype-selective electroporation of cortical interneurons. Journal of Visualized Experiment. (90), e51518 (2014).
- Borrell, V., Yoshimura, Y., Callaway, E. M. Targeted gene delivery to telencephalic inhibitory neurons by directional in utero electroporation. Journal of Neuroscience Methods. 143 (2), 151-158 (2005).
- Soma, M., et al. Development of the mouse amygdala as revealed by enhanced green fluorescent protein gene transfer by means of in utero electroporation. Journal of Comparative Neurology. 513 (1), 113-128 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados