Method Article
子宮内電散法における両側性を用いたパイプラインによるげっ歯類の行動に対する遺伝的影響の調査
要約
神経精神疾患の病因における最近発見された疾患関連遺伝子の役割は依然として不明瞭である。子宮エレクトロポレーション技術における修飾された両側性は、ニューロンの大規模集団における遺伝子導入と、社会的行動に対する遺伝子発現変化の原因の影響の検討を可能にする。
要約
ゲノムワイド関連研究は、多くの神経疾患の異種遺伝的基盤に光を当てるにつれて、脳の発達と機能に対する特定の遺伝子の寄与を研究する必要性が高まる。トランスジェニックマウスラインは非常に高価であり、多くの新しい疾患関連遺伝子はまだ市販の遺伝的線を持っていないため、特定の遺伝子操作の役割を研究するためにマウスモデルに頼ることは必ずしも実現可能ではありません。また、マウス ラインを作成するには、開発と検証に何年もかかる場合があります。子宮内エレクトロポレーションでは、特定の遺伝子操作を達成するためにDNAプラスミドを開発するだけで必要な生体内での細胞型特異的な方法で遺伝子発現を操作する比較的迅速かつ容易な方法を提供する。子宮内の両側性のエレクトロポレーションは、前頭皮錐体錐神経細胞の大規模な集団を標的にするために使用することができる。この遺伝子導入法と行動アプローチを組み合わせることで、前頭前野ネットワークの機能や若年マウスおよび成体マウスの社会的行動に対する遺伝子操作の効果を研究することができます。
概要
ゲノムワイド関連研究(GWAS)は、脳病理1、2、3、4に関連する新しい候補遺伝子の発見を推進してきた。これらの研究は、統合失調症(SCZ)などの壊滅的な神経精神疾患を理解する上で特に有益であり、新しい遺伝子の調査は、新しい研究ラインと治療介入の開始点として役立っています5,6.SCZに対するリスクを抱える遺伝子は、出生前および出生後早期の発達の間に前頭前野(PFC)において偏った発現を示し、いくつかの神経精神疾患の病理に関与する領域7。さらに、精神障害のマウスモデルはPFCネットワーク6、8、9において異常な活動を示す。これらの結果は、SZC関連遺伝子がこの領域の発達配線に役割を果たす可能性があることを示唆している。動物モデルを用いたさらなる調査は、PFCにおける接続の確立に対するこれらの候補遺伝子の寄与を理解し、これらの遺伝子が神経精神疾患の病因に原因となる役割を有するかどうかを判断するために必要である。出生前および出生後の発達の間に特定の神経回路の遺伝子発現変化を研究することを可能にするマウスの遺伝子操作技術は、遺伝子発現変化をPFC機能不全に結びつける分子メカニズムを理解するための有望な方法である。
遺伝的マウスラインは、脳の発達と機能に対する特定の遺伝子の影響を研究する方法を提供します。しかし、トランスジェニックマウスに頼ることは、特定の遺伝子が神経回路の発達に及ぼす影響を調べるために必ずしも市販のラインが存在するとは限らないので、制限することができます。さらに、カスタムマウスラインを開発するには非常にコストがかかり、時間がかかる場合があります。トランスジェニックマウスとウイルスアプローチを組み合わせた交差遺伝子操作戦略の使用は、脳10、11、12の理解に革命を起こしている。多くの進歩にもかかわらず、ウイルス戦略は、ウイルス発現13およびウイルス発現14に関連する細胞毒性を制限することができる包装能力の限界を含むウイルスベクタータイプに依存する一定の制限を伴う。さらに、ほとんどの実験条件では、アデノ関連ウイルス(AAV)を用いた堅牢な遺伝子発現には約2~4週間の15週間が必要であり、出生後の早期開発中に遺伝子を操作することは不可能な日常的なウイルス戦略を作る。
子宮エレクトロポレーション(IUE)では、蛍光標識および薬理遺伝学的または光遺伝学的アプローチと相まって、神経回路の機能を解剖するための強力なプラットフォームを提供する、迅速かつ安価な遺伝子導入16、17を可能にする代替アプローチである。さらに、CRISPR-Cas9ゲノム編集遺伝子の開発により、細胞型特異的なノックダウンまたは特定遺伝子のノックアウトまたはプロモーター18、19の調節を介して過剰発現または正確に改変することができる。IUEを用いた遺伝子操作アプローチは、狭い発達窓20の間に遺伝子が神経回路に及ぼす影響をテストする必要がある場合に特に有利である。IUEは多目的な技術であり、特定のプロモーターの下で発現ベクターに遺伝子を挿入することによって容易に過剰発現を達成することができる。遺伝子発現のさらなる制御は、異なる強みのプロモーターを用いて発現を駆動するか、または遺伝子発現21,22を時間的に制御できる誘導性プロモーターを用いて達成できる。さらに、IUEは、特定の皮質層、細胞タイプおよび脳領域内の細胞の標的化を可能にするが、これは他のアプローチ5,17を使用して必ずしも実現可能ではない。より効率的な電界分布を発生させる3つの電極の使用に基づくIUE構成の最近の進歩は、この方法の機能的レパートリーを拡大し、科学者が新しい細胞タイプを標的にし、23、24を標的とすることができる細胞の効率、精度、および数を増加させることができた。この技術は、補体成分4A(C4A)、SCZに連結された遺伝子、PFC機能および早期認知5における原因の役割を決定するために最近使用された。
ここでは、PFCを含む前頭皮質の興奮性ニューロンの大規模な集団を標的とする遺伝子導入アプローチと、細胞および回路レベルの変化の研究を可能にするだけでなく、早期産後の発達および成人期を通じて行動を監視することを可能にする行動パラダイムを組み合わせた実験的パイプラインです。第1に説明する、前頭皮質領域における層(L)2/3錐体ニューロンの大きな集団を両側にトランスフェクトする方法である。次に、若年マウスおよび成体マウスにおける社会的行動をアッセイする課題について概説する。細胞数は、細胞トランスフェクションの範囲と位置を定量化する行動タスクの完了時に得ることができます。さらに、トランスフェクトされた細胞の数は、より多くのトランスフェクトされた細胞が行動のより大きな摂動につながるかどうかを判断するために行動データと相関させることができる。
プロトコル
すべての実験プロトコルは、国立衛生研究所(NIH)の動物研究ガイドラインに従って実施され、ボストン大学の施設動物ケアおよび使用委員会(IACUC)によって承認されました。
1. DNA溶液調製
- 目的のプロモーターを使用して、目的の遺伝子を市販のプラスミドまたはサブクローンでプラスミドに購入します。ここで、CAGプロモーター(pCAG-EGFP)下のEGFPを含むプラスミドを用いた。
注: 必要な発現レベルに基づいて、目的のプロモーターを決定します。一般に、CAGプロモーターの下のプラスミドは、高レベルのトランスジーンを達成するために使用され、細胞型特異的プロモーター(例えば、ニューロンのシナプシン)は活性が低くなる傾向がある。実験者は、各プラスミドに対して適切な発現レベルを経験的に決定すべきである。 - 適切な抗生物質で細菌を変換し、細菌培地の在庫を成長させます。
- -80°Cから有能力細胞(DH5α細胞)を取り除き、氷の上で20分間解凍します。
- プラスミドDNAの100 pg-100 ngを30μLの有能な細胞と混合します。氷の上で20分間インキュベートします。
- 42°Cの水浴で45sのインキュベートを行い、チューブを2分間氷に戻します。
- 200 ~ 1,000 μL の LB 培地を形質転換されたコンピテント セルに加え、振るインキュベーターで 37 °C で 45 分間成長させます。
- 200μLの形質転換した細胞を適切な抗生物質を含むLB寒天プレートにプレート200μL、37°Cで一晩インキュベートする。
- 翌日、一晩揺れインキュベーターで37°Cで適切な抗生物質を用いてLBスープの200 mLに1つの細菌コロニーをインキュベートする。
- マキシプレップキットを使用してプラスミドDNAを精製します。
- 入手した maxiprep キットの指示に従ってください。溶出工程では、DNAを溶出バッファーに溶出しないでください。代わりに、200 μLの無菌1x PBSまたは分子グレードの水を使用してDNAを溶出します。
- DNAの最終濃度が1μg/μLより大きいことを確認してください。目的の遺伝子を含むプラスミドにレポーター遺伝子が含まれていない場合は、プラスミドを調製して緑色蛍光タンパク質(GFP)などのレポーター分子と共にトランスフェクトし、トランスフェクトされた細胞の可視化を可能にする。
- プラスミドDNAを各プラスミドの最終濃度1μg/μLに1μg/μLに希釈して手術用のDNA溶液を調製します。最終濃度0.1%にDNA溶液に速緑色染料を加えます。二国間注射の場合は、ダムあたり60μLの溶液を調製します(約10個の子犬)。
注:プラスミドにレポーター遺伝子が含まれていない場合は、GFPと共電気的に電気を入れコエレクトロポレーション率は、通常95%以上である。私たちの手の中では、トランスフェクション効率は共同トランスフェクションの影響を受けませんでした。すべての電気ポレートプラスミドは1 μg/μLに希釈する必要があります。
2. 時を受けたマウスの注文または繁殖
- 時間指定された妊娠マウスを注文する場合は、ダムが動物のハウジングに順応するのに十分な時間を確保するために、マウスに胚の日(E)13以前に到着するように命じる。 このプロトコルでは、CD-1の外血マウスが全ての実験に使用される。
注:数日前に注文すると、動物のストレスが軽減され、子犬の生存率が高くなります。 - 時を取った妊娠マウスを飼育する場合は、雌マウスと雄を一晩、週に1回ペアリングする。翌朝に膣プラグが存在するかどうか確認してください(E0.5)。雌マウスの体重を監視して妊娠を決定する。
注:異なるマウス株は、妊娠を通じて異なる体重増加を持っているので、使用されるマウス株の典型的な体重増加を決定します。 - マウスを飼育するか、飼育するか、ダムのストレスを軽減するために、ケージ内にネスティングパッドとマウスハウスを配置する。ストレスを軽減することは、子犬の生存率を高めることができます。
3. 3つの突起電極の設計と組み立て
- 電極接点のストック材料として、厚さ0.063のグレード2チタンシートを使用してください。
- 標準的な機械加工技術または精密ハンドツールを使用して、次の寸法で電極を作ります:丸い先端と溝を持つ20ミリメートルx 5ミリメートル。細かいグリットサンドペーパーを使用して、粗いエッジやバリを取り除きます。
- 電極接点を配線するには、電極の溝の周りに22Gの撚り線を包み、はんだ付けして固定する。熱収縮チューブを使用して、このジョイントを保護します。
- 次いで、接続された電極をオートクレーブ可能な非導電鉗子に取り付け、追加の熱収縮チューブを使用して2つの負極を作る。単一の正極をオートクレーブ可能な非導電性材料(頭部を切り抜けた歯ブラシハンドルなど)に取り付けます。標準的なバナナプラグでワイヤーの開いた端を合わせます。
4. 手術の準備
- 手術の少なくとも30分前に妊娠中のダムを手術区域に持ち込み、動物施設から輸送後のストレスレベルの低下を可能にする。
- 殺菌殺菌のワイプを使用して手術部位全体を殺菌し、その後70%エタノールを殺菌する。手術を始める前に手袋を交換してください。
- ガラスビーズ滅菌器でオートクレーブ工具を殺菌します。
- 滅菌1x PBS(ダムあたり約50 mL)を50 mL円錐管に移し、38〜40°Cに加熱された水浴中のチューブラックに入れます。 温度計で滅菌生理の温度を確認してください。
- 水冷循環ポンプをオンにして、手術開始前に37°Cに温めます。これは、手術の間、マウスの体温を維持します.
- 圧力インジェクターとエレクトロポレーターをオンにし、手術前に適切な機能を確保してください。
- プラスミドDNA溶液(ステップ1.4で得られた)を卓上遠心分離機の上に簡単に回転させ、氷の上に置きます。
- ピペットのピペットにガラスピペットを引っ張り、引っ張ったガラスピペットの先端の直径が約50μmになるようにします。
- 20~40 μLのDNA溶液(ステップ1.4で得られる)でピペットを充填します。
- 脱毛ローション、ヨウ素、70%エタノール、綿スワップ、目の軟膏、縫合糸、ガーゼなど、手術に必要なすべてのアイテムを設定します。
- 手術シートを用意し、マウスIDや体重、手術日、外科医名などの必要な情報を記入します。
5. 子宮内電気ポレーション手術
- 手術前にマウスの重量を量り、手術シートにこれを注意してください。
- 妊娠マウス(E16)を吸入して、酸素-イロフラン混合物を4%(v/v)で誘導チャンバーに吸入して麻酔をします。マウスが誘発されたら、マスク吸入に移り、イオブルランを1〜1.5%(v/v)で維持し、手術中の呼吸を監視します。マウスが完全に麻酔されていることを確認し、呼吸速度は1分あたり〜55〜65呼吸でなければなりません。
- 術前鎮痛薬の投与: ブプレノルフィン (3.25 mg/kg;SC) とメロキシカム (1 –5 mg/kg;SC)10-30のml/kgの最高容積で。
- 脱毛クリームを使用するか、慎重に腹部から毛皮を除去するためにカミソリを使用してください。ポビドネヨウ素と70%エタノールでスワッピングして腹部を殺菌し、これを少なくとも3回繰り返します。滅菌ガーゼを使用して腹部の周りに無菌フィールドを作成し、滅菌ドレープも使用することができます。
- 腹の皮膚に中線切開(3〜4cm)を行い、筋肉を切り裂かないように鉗子で皮膚を持ち上げることを確認してください。その後、筋肉を切断, 再び重要な臓器を切断しないように筋肉を持ち上げるために世話を.
- リング鉗子を使用してダムから慎重に子宮の角を引き出し、無菌フィールドにそっと置き、子宮ホーンがパディングで支えられており、ダムからあまりにも遠く離れていないことを確認します。この時点から、子宮ホーンは、事前に温めた無菌1x PBSで手術の残りの部分全体を通して湿らせたままにしてください。
- 鉗子または指を使用して胚を配置します。慎重に頭の水平面に対して45度の角度で引っ張られたガラスピペットを挿入し、脳と目の正中線の間で視覚的に識別することができる側心室に挿入します。ピペットを1つに挿入し、もう一方の心室(推奨)または両方の側心室に入るまでDNA溶液を1つの心室に注入して、各側心室に約2〜3μLを注入します。心室は、注入後に三日月形が存在する場合に正常に標的化されている。
注:ガラスピペットの先端は手術中に壊れる可能性があります。この場合は、ガラスピペットを交換し、新しいピペットが準備され、DNA溶液で満たされている間、子宮ホーンを湿らせておきます。 - 前頭皮に細胞を両側にトランスフェクトするには、胚の両側に2つの負極を横方向に配置し、わずかに内側心室に向かい、発達中のスナウトの前に正極を目の間に配置する。
- 胚が寛大に湿っていることを確認します。4つの正方形のパルス(パルス持続時間=50msの持続時間、パルス振幅=36V、インターパルス間隔=500ms)を適用します。
- DNA溶液注射直後に各胚が電気ポポレートされるように、すべての胚を注入し、1つずつ進みます。すべての胚が電気ポポレートされたら、慎重に子宮の角を腹腔に挿入します。このステップの間に、子宮ホーンの配置を助けるために無菌PBS(1x)で腹腔をコーティングする。
- 縫合が完了した後にエアポケットが残らないように、腹腔に無菌1x PBSを充填します。吸収性縫合糸で筋肉を縫合し、シルクの非吸収性縫合糸で皮膚を縫合する。
- ダムは、少なくとも1時間加熱された部屋で完全に回復することを許可します。次の48時間で、定期的にダムをチェックしてください。ダムが麻酔から回復し、意識を取り戻すと、ダムは動き、泡立ち始めます。
- ダムが急速に体を上げて呼吸するなど、痛みの兆候を示している場合は、術後の鎮痛薬を投与する。SC注射がダムを強調する可能性があるため痛みの兆候がある場合にのみ投与するが、実験群に投与された場合は対照群にも投与するか、またはその逆を行う。
6. 母親との相互作用の仕事における初期の社会的行動を言い立て
注 : このプロトコルは、以前の出版物5,25から適用されています。マウスが出生後の日(P)18-21から生まれた後、このタスクを実行します。
- 母体相互作用I(MI1)タスクにおける母体ホーミング行動。
- タスクが実行される前の週にケージの寝具が変更されていないことを確認します。
- 次の寸法で簡単にクリーニングできるオープンフィールド(OF)アリーナを入手または構築します(アクリルを推奨します):50 x 50 x 30 cm(長さ幅-高さ)。行動のパフォーマンス中の照明条件は、実験的な質問によって異なり、覚醒および不安のような行動のレベルに影響を与える可能性があります。アリーナの中央に位置する薄暗い光(約20ルクス)の下で行動実験を記録します。
- 行動テストの前に2日間、1日5分間、アリーナの隅にメッシュワイヤーカップ(鉛筆カップなど)の下に置くことによって、ダムをアリーナに順応させます。
- P18-21から可能な試験日に、マウスが離散する前に、消毒ワイプと70%エタノールで十分にアリーナをきれいにします。
- 清潔な寝具と子犬のホームケージからの汚れた巣の寝具を含む1つのコーナーを含む2つの反対側のコーナーでアリーナを設定します。
- 各子犬が3分間アリーナを探索できるようにし、各子犬をニュートラルで空のコーナーに置きます。
注:30 fpsのビデオカメラで動作を記録します。すべての子犬の間のアリーナを徹底的に清掃し、新鮮な寝具を交換してください。他の理由(すなわち、周囲の騒音または光)によるコーナーの好みを避けるためにコントロールとして、新鮮な対巣の寝具であるコーナーを交互に。P18-21 の開発ウィンドウで複数のごみを実行している場合は、日の間に同時に行動実験を実行します。また、特定の日の間に、制御グループと実験グループが並列に実行されるようにします。
- 母体相互作用II(MI2)タスクにおける母親の社会的相互作用
- MI1 タスクの直後にこのタスクを実行します。
- 1 つのコーナーに空の金網カップが含まれ、反対側のコーナーにメッシュ ワイヤー カップの下にダムが含まれるようにアリーナを設定します。マウスがカップを動かすことができる場合は、カップの上部にテーピングできる重量でカップを下ろして動きを防ぎます。別のコーナーに自宅のケージから汚れた巣の寝具を置きます。
- MI2 タスクを実行します。子犬を空のコーナーに置き、30 fpsで5分間の動作を記録し、子犬が探索できるようにします。各子犬を別々に実行し、完全にすべての子犬の間に全体のアリーナと金網カップをきれいにします。
7. 成人社会行動課題の言い分
- 大人になると、MI1とMI2タスクで実行されたのと同じマウスで成人の社会的行動を実行します(P60-P70以上)。ここで収集されたデータは、別のコホートで行われました。
- 実験者に慣れることができるように、3日間連続して成体マウスを処理する。マウスに慣れている実験者だけが行動実験を実行し、理想的には同じ人にすべてのタスクを実行してもらうことを確認します。
- 毎日5分間、3日間OFアリーナにマウスを習慣化します。
- 新規物体への一般的な移動と関心を測定する新規物体認識タスクにおけるアッセイ挙動。これにより、マウスが社会的相互作用に特定の赤字を抱える場合、社会的行動をより有意義に解釈できるようになる。
- アリーナの片隅に新しいオブジェクト(滑らかで清潔な表面を持つ小さなプラスチック製のおもちゃ)を持つ5分間アリーナにマウスを置きます。70%エタノールでマウスの間のアリーナを徹底的に清掃してください。
- 新しいオブジェクト認識のために、以前に露出した「新しいオブジェクト」を一角に置き、反対のコーナーに新しい新しいオブジェクトを配置します。すべてのタスクについて、コントロールとして試行時間の間でコーナーを切り替えます。
- 新しい社会的相互作用のために、新しいマウスが年齢、緊張および性に一致し、毎日5分間2連続してメッシュワイヤーカップに順応していることを確認してください。各試行のために、メッシュワイヤーカップの下に新しいマウスを置き、反対側のコーナーに空のメッシュワイヤーカップを置きます。行動を記録しながら、マウスは5分間アリーナを探索してみましょう。各トライアルの間に十分にアリーナとメッシュワイヤーカップをきれいにします。
8. 行動データの分析
- 基本的なボディ パーツ のトラッキングを実行するには、DeepLabCut(https://github.com/AlexEMG/DeepLabCut)を使用します。DeepLabCutのインストール方法と使用方法に関する詳細な注意事項は、GitHubページにあります。また、基本的な身体部分の追跡が完了した後のデータのさらなる分析のためのカスタムpythonベースのライブラリ'dlc_utils'(https://github.com/balajisriram/dlc_utils)も利用できます。このライブラリの使用方法の詳細については、GitHub ページを参照してください。
- アナコンダのインストールプロセスを使用してDeepLabCutをインストールします。ネットワークをトレーニングするための GPU 対応バージョンと同様に、GUI 対応の CPU 対応バージョンの DeepLabCut をインストールします。
- 次のリンクに記載されている手順に従って、ボディパーツを追跡するためのプロジェクトを作成します。その場合は、データ セットからフレームのサンプルを選択し、これらのサンプリングされたフレーム内の関連するボディ パーツを手動でマークします。DeepLabCutネットワークをトレーニングして身体部分を予測し、訓練されたネットワークが適切に動作することを確認します。
https://github.com/AlexEMG/DeepLabCut/blob/master/examples/Demo_yourowndata.ipynb - 体の位置を追跡し、オープンフィールドでの単純な相互作用を識別する目的で、動物、頭部(操作上は耳の中間点として定義)、左右の耳、そしてスナ出と尾のベースを識別します。複数のボディ パーツを追跡することで、一部のボディ パーツがオクルージョンのためにフレームに欠落している場合に、適切な置換が可能になります。
- 動物の身体部分とは別に、行動ボックスのエッジなど、環境に関連するさまざまなポイントを追跡します。これらは、複数のセッションにわたってそのようなポイントの繰り返し推定を可能にする - 動作設定の位置がセッション間のカメラに対してわずかに変化した場合でも。
- 行動データから身体部分を追跡した後、ビデオの各フレームの予測に関連する信頼度に基づいて、予測されたボディ部品の位置をフィルタリングするように注意してください。低信頼予測は、通常、閉塞体部位に関連付けられます。このような予測では、特定の身体部分を別の部分に置き換える(そのような置換が適切な場合)か、他の身体部分の位置を使用して、関連する身体部分がどこにあるかを予測する。ほとんどのオープンフィールドアプリケーションでは、げっ歯類の体の図心はほとんど閉塞されず、高精度かつ高精度で予測できます。
- 環境内のトラッキングポイントの位置と同様に、摂心の予測位置を使用して、動物の挙動の特徴を推定します。例えば、オープンフィールドデータにおいて、位置の時間微分を使用して、動物の速度を計算することができる。
- バイアスを避けるために、実験群に対して、特に結果を評価する際に主観的な要素がある場合には、実験群に対して「ブラインド」のすべての実験を行う。男性と女性のグループにデータをプールすることにより、主な実験結果に性差の効果を検定.すべての統計的検定は、グループ間で同じ数の動物をテストするように設計されています。
9. 細胞トランスフェクションの程度を特徴付けるポストホックセルカウント
- すべてのマウスがトランスフェクションに成功するとはかからず、トランスフェクション細胞の数にばらつきがあるため、マウス1匹当たりのトランスフェクト数を決定します。これを達成する1つの方法は、交互のコロナセクション内のトランスフェクトニューロンの数を数え、続いて補間してトランスフェクトされた細胞の総数を推定することを含む。このため、画像と他のすべてのコロナセクション(50 μm)を数えます。
- 4%PFAの経心面灌流を使用して組織を固定し、脳を解剖する。凍結保護の後、50μmのコロナセクションに脳を切り離す。
- 前頭皮質の場合、ブレグマから+2.75および+1.35mm以内の細胞を数える。これらの座標は、前頭皮質領域を含み、体性感覚皮質(S1)の一部を含む。 この方法を用いて、より多くの尾皮質領域または皮質下領域でのトランスフェクト細胞の観察はなかった。
- 断面化中に針穴で 1 つの半球をマークするなど、右半球から左を示し、セルを両側で数えるようにしてください。DAPI を使用してセル本体の存在を確認する、自動セルカウント ソフトウェアを使用するか、セルを手動でカウントします。
- セル数が取得されたら、包含のしきい値を設定します。例えば、分析において二国間電気電解されたマウスのみが含まれる。さらなる分析のために、行動応答にトランスフェクトされた細胞の数を関連付けて、関連があるかどうかを確認します。この技術は複数の脳領域を標的とするため、どの脳領域が遺伝的に操作されたかの情報を提供する必要があります。
注:特定の遺伝子を操作すると、神経の移動、仕様、および/または死が変える可能性があります。細胞数の間に脳の解剖学が検査され、各トランスフェクトニューロンがおそらくトランスフェクトされた層内にあることを確認してください(すなわちL2/3)。皮質厚などの総解剖学的測定は、ピアから皮質L6までの距離を測定することによっても定量することができる。
結果
カスタムエレクトロポレーターと3つのプロング電極の開発と実装に成功しました。
IUE の場合、前述の設計27に基づいて安価なカスタムエレクトロポレーターが構築されました (図 1Aおよび図 2)。突起の先端に2つの負極を取り付けたプラスチック鉗子を用いて23,24の突起電極を作り、正極を歯ブラシハンドルの端に取り付けた(図1B)。エレクトロポレーターと3つの突起電極を試験し、適切な機能を確保した。IUEは、子宮の角を露出させ、プラスミドDNAを注入し、各胚を電気ポッピングすることによって行われた(図1C)。3つの突起電極は、胚の頭部を安定化させるために突起を使用して、図示のように(図1B、右)、両手でかなり容易に保持することができる。L2/3 PFCピラミッド型ソマとそのプロセスは、IUEを介してGFPで標識され、遺伝子導入実験の成功を確認した。
マウスの前頭皮質におけるニューロンの大きな集団を両側に標的とする。
トランスフェクトされた細胞の総数およびトランスフェクトされたニューロンの分布は、若年マウスと成体マウス5の両方について定量することができる。この二国間IUE法を用いて、約4000-6000 L2/3錐体ニューロンをpCAG-GFPプラスミドにトランスフェクションした(図3A)。さらに、これらの細胞の大部分は、前頭会合皮質、運動会合領域、前肢および眼内皮質および眼窩および前帯状皮質を含む前頭皮質領域に局在していた(図3B)。代表的な例は、成人コントロールマウスにおけるトランスフェクトされたニューロンのrostral-caudal分布(P60, 図3C)と半球間の分布(図3D)を示す。これは、両側IUEが前頭皮質のL2/3錐体ニューロンの大きな集団を標的にし、遺伝的に標識する能力を確認する。
若年マウスおよび成人マウスにおける社会的行動
母親の相互作用タスクの最初の部分は、巣寝具(母体相互作用1[MI1])を見つけるためにP18トランスフェクションマウス(pCAG-GFPプラスミドを有するIUE)を制御する能力をテストした。これは、若年マウスの感覚運動能力をテストします。コントロールマウスは、新鮮な寝具を探索するよりも、巣の寝具を探索するのに多くの時間を費やしました。したがって、予想通り、これらのマウスは、無傷の感覚運動能力および探索的行動を有することを示唆している(図4Aおよび図3B)。タスクの第2部(MI2)は、マウスが母親と対話し、近くにいる動機付けになる傾向を利用しています。この作業では、子犬は母親の近くでほとんどの時間を過ごした一方で、空のカップや巣の寝具を探索する時間を大幅に減らしました(図4C、D)。これらの結果は、IUEコントロールマウスが正常なホーミング行動を示していることを示唆している。
成人対照マウス(P60)は、新しい物体を探索するのに約35%の時間を費やしました(アリーナで費やされた合計時間 = 5分、図5A、B)。新しく、身近な物体を提示すると、成体マウスは新しい物体を探索するのに多くの時間を費やし、目新しさへの関心をそのまま示唆した(図5C,D)。社交性タスクでは、制御成体マウスは新しいマウスと空のカップを探索するのに同様の時間を費やしました(図5E,F)。この動作は、自由に利用できる DeepLabCut ソフトウェア26を使用して自動的に追跡されました。例ビデオでは、手足、心、頭、耳など、マウスのさまざまなポイントのラベル付けが成功したことを示しています (ビデオ 1)。DeepLabCutは、マウスの後部のときにこの距離が短くなるため、マウスの体の長さを調べることによって、マウスが飼育されている時期を決定するために使用されました(ビデオ2)。

図1:カスタムメイドのエレクトロポレーターと3つのプロング電極を使用した子宮エレクトロポレーション。(A)カスタムメイドのエレクトロポレーター(左)とそのフロントパネル(右)の画像。1:電源インジケータ。2: 電源スイッチ。3:パルスインジケータ。4: テストモードスイッチ。 5:電圧セレクタ。6:パルス幅制御。7:電極(+)。8: 外部トリガ(TTL)。 9:電極(-)(B)カスタム構築された3つのプロング電極(左)の画像と、IUE(右)の間に3つのプロング電極を保持する推奨方法。(C)左:E16ダムで行われたIUE手術を描いた図。右:L2/3 mPFCを対象としたGFPを有するIUEの代表的な20X共焦点像。黄色のアスタリスク: L2/3 GFP+ ニューロン。左パネルスケールバー= 250 μm右パネルスケールバー= 75 μmComerらから適応した図とデータ, 20205.この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:カスタムメイドエレクトロポレータの回路図 先に説明した例27に基づいてカスタムメイドのエレクトロポレーター回路を描いた図。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:IUEを用いたL2/3前頭皮質ニューロンの集団を対象とする。 (A) 若年性対照マウスにおけるGFP+細胞の総数。N= 15匹のマウス。(B)成人対照マウスにおける領域あたりのGFP+細胞の割合。N= 22コントロールマウス。(C)前頭皮質におけるトランスフェクト細胞のロストロ・カウダル範囲を示す代表的なセクション。左側のパネルの画像は、右のパネル(赤い四角)から拡大された領域です。前頭会合皮質:FrA.補助運動皮質: M2.前脳皮質: PL. インフラリンベクチンコ: IL. 前帯状皮質: ACC. 内側眼窩前頭皮質: MO. 腹側眼窩前頭皮質: VO. 横眼窩前頭皮質: LO.前皮質の前部: AI.前頭皮質領域 3: Fr3. 原発性運動皮質:M1. 原発性体性感覚皮質: S1.ピリフォーム皮質:ピル。前嗅核:AO.カウダテンプタメン:Cpu。黒の数字: ブレグマ座標。左パネルのスケールバー= 0.5 mm右パネルスケールバー = 1 mm. SEM±平均値 (D) 各マウス内の右半球と左半球にエレクトロポレートされたセル数を示すデータ。pCAG-GFPプラスミドで電気ポポレートされた14匹の成体マウスからの非インターポレートされた細胞数を示す。ペアの t 検定。 p = 0.4757. Comerらから適応したデータ, 20205. この図の大きなバージョンを表示するには、ここをクリックしてください。
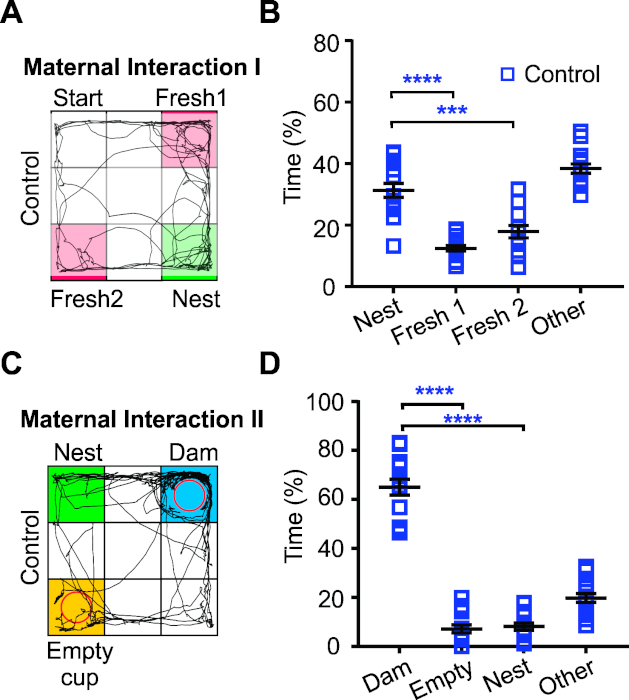
図4:若年性トランスフェクションマウスにおける感覚運動能力、探索的行動および初期社会的相互作用の評価 (A) MI1 タスクの P18 制御子犬による移動経路 (黒いトレース) の代表的な例。新鮮な寝具コーナー(新鮮な1と2、ピンク)と巣の寝具コーナー(緑)。(B) コントロールの子犬はMI1タスクの新鮮な寝具よりも巣の寝具を探索するのに多くの時間を費やしました。p < 0.001, ****p < 0.0001.双方向のANOVAとシダックのポストテスト。(C) MI2 タスクの P18 制御子犬による経路移動(黒いトレース)の代表的な例。 ダムのカップ(ダム:青)、空のカップ(空のカップ:黄色)、巣寝具コーナー(巣:緑)。(D) コントロールの子犬は、空のカップや巣の寝具よりもダムとの相互作用に多くの時間を費やしました。双方向のANOVAとシダックのポストテスト。p < 0.0001.N= 15コントロールマウス。Comerらから適応した図とデータ, 20205. この図の大きなバージョンを表示するには、ここをクリックしてください。

図5:成人トランスフェクションマウスにおける社会的相互作用の評価 (A) P60によって移動した経路(黒いトレース)の代表的な例は、新規のオブジェクト相互作用タスクで大人のマウスを制御する。ピンクの角=新しいオブジェクトの位置。(B)コントロールマウスは、新しい対象物を探索するのに約35%の時間を費やしました(合計5分)。新しいオブジェクトが表示されたコーナーで費やされた時間の割合。(C) 新規物体認識タスクにおけるP60コントロール成体マウスによる移動経路(黒トレース)の代表的な例。ピンクの角:新しいオブジェクトの位置。緑の角: 使い慣れたオブジェクトの位置。(D) Control マウスは、使い慣れたオブジェクトよりも新しいオブジェクトの探索に多くの時間を費やしました。識別指数 (DI) を示します。DI = (新しいオブジェクトを持つ時間 - おなじみのオブジェクトとの時間) / (新しいオブジェクトとの時間 + 使い慣れたオブジェクトとの時間)(E) P60制御大人マウスによる移動経路(黒トレース)の代表的な例ピンクのコーナー:メッシュワイヤーカップの下に新しいマウスの位置。緑の角:空のメッシュワイヤーカップの場所。(F)コントロールマウスは、空のカップと新しいマウスを含むカップを探索するために平均同じ時間を費やしました。グラフはDI(新しいマウスで時間 - 空のカップで時間)/(新しいマウス+空のカップで時間)を示しています。マウスはタスクの前に社会的に隔離されていなかったので、新しいマウスと対話するドライブは減少していた可能性があります。しかし、まだその新しいネズミの探索があった。N= 22コントロールマウス。Comerらから適応した図とデータ, 20205. この図の大きなバージョンを表示するには、ここをクリックしてください。
ビデオ 1: DeepLabCut を使用して、行動タスクの動物の位置を自動的に追跡します。 DeepLabCutを使用してラベル付けされたソーシャルインタラクションタスクにおける大人のマウスの代表的なビデオ。手足や頭部など、マウスの様々な部分にラベルを付けることができます。重心を使用すると、動物の位置を追跡するのに適していますが、他のポイントを使用して、グルーミングや飼育など、より複雑な動作を識別することができます。 このビデオを見るには、ここをクリックしてください。(右クリックしてダウンロードします。
ビデオ 2: DeepLabCut を使用して、行動タスクの後方を自動的に追跡します。 DeepLabCutを使用してラベル付けされたソーシャルインタラクションタスクにおける大人のマウスの代表的なビデオ。赤い矢印は、マウスの頭に向かって矢印を持つマウスの長さを示します。矢印の長さはマウスの長さ、および矢印がマウス後部のときに小さくなるため、マウスが飼育されていることを決定するために使用することができます。 このビデオを見るには、ここをクリックしてください。(右クリックしてダウンロードします。
ディスカッション
本明細書において、前頭皮質ニューロンの大きな集団における関心のある新規遺伝子の操作をマウスにおける行動アッセイと組み合わせたパイプラインが記載されている。さらに、このパイプラインは、出生後の早期発達と成人期の両方で同じマウスの行動の縦断的研究を可能にする。この技術は、時間と費用の面でコストがかかる可能性のある遺伝的動物モデルに依存する必要性をバイパスします。このプロトコルの強みは、最近のGWASが新しい遺伝関連を発見した神経発達および神経精神疾患を研究するために使用することができるということです28,29.この方法は、興奮性ニューロンの細胞型特異的なトランスフェクションを提供するが、1つの制限は、インターニューロンまたはグリア細胞のような他の脳細胞タイプを標的にすることは不可能である。しかし、複数の研究は、他の脳細胞タイプ30、31を標的とする修正されたアプローチを示唆している。さらに、胚の頭部に対する電極の位置を改変し、IUEのタイミングを変更することにより、他の脳領域は海馬、扁桃体、小脳、および視覚、体性感覚および運動皮質24、32を含む二国間トランスフェクトすることができる。さらに、異なる発生段階でIUEを行うことによって、異なる皮質層を標的とすることができる。
IUE は高い成功率を持つことができますが、時には必要な方法の重要な手順とトラブルシューティングがあります。プラスミドは、細胞株で慎重に設計され、検証される必要があります。.すべてのクローニングと同様に、配列がフレーム内にあることを確認するなど、適切な遺伝子発現を確保するために注意する必要があります。さらに、遺伝子操作の効果(例えば、過剰発現またはサイレンシング)は、発現レベルがマウスの発達時間経過およびIUEの発達期全体で変化する可能性があることを考慮して確認されるべきである。ウェスタンブロットおよびqPCRを用いて、遺伝的過剰発現5の程度を決定することができる。GFPでタグ付けされたタンパク質が誤って折りたたまれたり、機能を失ったりする可能性があるため、GFPなどのレポーター遺伝子を別のプラスミドにコエレクトロポレートすることをお勧めします。あるいは、レポーターが使用されない場合、実験者は、その場でハイブリダイゼーション、qPCRまたはウェスタンブロットを使用して、目的の遺伝子5の発現レベルを決定することができる。
プラスミドが検証されているが、トランスフェクションに陽性と思われる動物がいない場合は、適切な機能を確保するために、すべての機器、特にエレクトロポレーターを徹底的にチェックしてください。胚に電圧パルスを送達する場合、子宮ホーンは温められた生理食動物でよく湿らせ、電極は電圧パルスの発生時に気泡を生成するべきである。電圧が送出されたときに気泡が存在しない場合、エレクトロポレーターに問題がある可能性があります。 あるいは、cDNAが心室に適切に注入されていない可能性があります。cDNAが横心室に適切に注入されると、速緑色の染料は三日月の形で見える。最後に、電極の位置が重要である。電極がわずかに誤って配置されている場合、細胞は対象領域でトランスフェクトされない可能性があります。したがって、正常なトランスフェクションをチェックする場合は、おそらく、間違った脳領域がトランスフェクションされた場合を確認するために、いくつかのより多くの尾大の脳のセクションを保存します。この方法が実施されると、経験豊富な外科医はほぼ90%の成功率を達成することが期待できます。このプロトコルは、関心のある他の脳領域をターゲットに変更することができます。例えば、海馬23を含むほとんどの皮質領域を両側および特定の皮質下領域まで標的とすることができる。ここでは、5、27を示すデータで使用したカスタムエレクトロポレーターを構築することによって、さらにコストを削減することも可能です。
今後の研究では、この方法を利用して、様々な神経疾患における新たに発見された遺伝子候補の役割を理解することができます。提示されたパイプラインは、成人期への早期出生後の発達と行動に対する特定の遺伝子操作の影響をテストするための比較的迅速なアッセイを提供する。この方法を用いた今後の取り組みは、SCZおよび自閉症スペクトラム障害を含む特定の脳障害においてどの遺伝子が原因となるかを発見する可能性を秘めている。
開示事項
著者らは競合する利益を宣言しない。
謝辞
リサ・クレツジの批判的なフィードバックと原稿の編集に感謝します。私たちは、行動脳の灌流と細胞カウントを支援する上で非常に貴重だったクルス・マルティン研究所のすべての研究アシスタントに感謝します。三極電極の設計に関するアンジェイ・チェッチ、コンフォーカル顕微鏡の使用に対するトッド・ブルーテとボストン大学生物学イメージングコアに感謝します。この研究は、NARSADヤング・サーポジスト・グラント(AC-M、#27202)、ブレントン・R・ルッツ賞(ALC)、I.アルデン・マッキ賞(ALC)、NSF NRT UtB:神経フォトニクス国立研究フェローシップ(ALC、#DGE1633516)、ボストン大学学部研究機会プログラム(WWY)によって支援されました。資金提供者は、研究デザイン、データ収集と分析、出版の決定、原稿の作成に何の役割も持っていませんでした。
資料
| Name | Company | Catalog Number | Comments |
| 13mm Silk Black Braided Suture | Havel's | SB77D | Suture skin |
| Adson Forceps | F.S.T. | 11006-12 | IUE |
| C270 Webcam | Logitech | N/A | Record behavior |
| Electroporator | Custom-built | N/A | See Figure 1 and 2 and Bullmann et al, 2015 |
| EZ-500 Spin Column Plasmid DNA Maxi-preps Kit, 20preps | Bio Basic Inc. | BS466 | Pladmid preparation |
| Fast Green FCF | Sigma | F7252-5G | Dye for DNA solution |
| Fine scissors- sharp | F.S.T. | 14060-09 | IUE |
| Fisherbrand Gauze Sponges | Fisher Scientific | 1376152 | IUE |
| Gaymar Heating/Cooling | Braintree | TP-700 | Heating Pad |
| Glass pipette puller | Sutter Instrument, | P-97 | IUE |
| Glass pipettes | Sutter Instrument, | BF150-117-10 | IUE |
| Hair Removal Lotion | Nair | N/A | Hair removal |
| Hartman Hemostats | F.S.T. | 13002-10 | IUE |
| Open field maze- homemade acrylic arena | Custom-built | N/A | 50 × 50 × 30 cm length-width-height |
| pCAG-GFP | Addgene | 11150 | Mammalian expression vector for expression of GFP |
| Picospritzer III | Parker Hannifin | N/A | pressure injector |
| Retractor - 2 Pronged Blunt | F.S.T. | 17023-13 | IUE |
| Ring forceps | F.S.T. | 11103-09 | IUE |
| Sterilizer, dry bead | Sigma | Z378569 | sterelize surgical tools |
| SUTURE, 3/0 PGA, FS-2, VIOLET FOR VET USE ONLY | Havel's | HJ398 | Suture muscle |
| Water bath | Cole-Parmer | EW-12105-84 | warming sterile saline |
参考文献
- Yang, Y., et al. Genetic association and meta-analysis of a schizophrenia GWAS variant rs10489202 in East Asian populations. Translational Psychiatry. 8 (1), 144(2018).
- Schizophrenia Working Group of the Psychiatric Genomics Consortium. Biological insights from 108 schizophrenia-associated genetic loci. Nature. 511 (7510), 421-427 (2014).
- Howard, D. M., et al. Genome-wide meta-analysis of depression identifies 102 independent variants and highlights the importance of the prefrontal brain regions. Nature Neuroscience. 22 (3), 343-352 (2019).
- Grove, J., et al. Identification of common genetic risk variants for autism spectrum disorder. Nature Genetics. 51 (3), 431-444 (2019).
- Comer, A. L., et al. Increased expression of schizophrenia-associated gene C4 leads to hypoconnectivity of prefrontal cortex and reduced social interaction. PLoS Biology. 18 (1), 3000604(2020).
- Chini, M., et al. Resolving and Rescuing Developmental Miswiring in a Mouse Model of Cognitive Impairment. Neuron. 105 (1), 60-74 (2020).
- Clifton, N. E., et al. Dynamic expression of genes associated with schizophrenia and bipolar disorder across development. Translational Psychiatry. 9 (1), 74(2019).
- Oberlander, V. C., Xu, X., Chini, M., Hanganu-Opatz, I. L. Developmental dysfunction of prefrontal-hippocampal networks in mouse models of mental illness. European Journal of Neurosciences. 50 (6), 3072-3084 (2019).
- Batista-Brito, R., et al. Developmental Dysfunction of VIP Interneurons Impairs Cortical Circuits. Neuron. 95 (4), 884-895 (2017).
- Luo, L., Callaway, E. M., Svoboda, K. Genetic Dissection of Neural Circuits: A Decade of Progress. Neuron. 98 (2), 256-281 (2018).
- DeNardo, L., Luo, L. Genetic strategies to access activated neurons. Current Opinion in Neurobiology. 45, 121-129 (2017).
- Huang, Z. J., Zeng, H. Genetic approaches to neural circuits in the mouse. Annual Reviews in Neurosciences. 36, 183-215 (2013).
- Wu, Z., Yang, H., Colosi, P. Effect of genome size on AAV vector packaging. Molecular Therapy. 18 (1), 80-86 (2010).
- Callaway, E. M., Luo, L. Monosynaptic Circuit Tracing with Glycoprotein-Deleted Rabies Viruses. Journal of Neurosciences. 35 (24), 8979-8985 (2015).
- Cruz-Martín, A., et al. A dedicated circuit links direction-selective retinal ganglion cells to the primary visual cortex. Nature. 507 (7492), 358-361 (2014).
- Saito, T. In vivo electroporation in the embryonic mouse central nervous system. Nature Protocols. 1 (3), 1552-1558 (2006).
- Cruz-Martín, A., Crespo, M., Portera-Cailliau, C. Delayed stabilization of dendritic spines in fragile X mice. Journal of Neurosciences. 30 (23), 7793-7803 (2010).
- Zhang, J. H., Adikaram, P., Pandey, M., Genis, A., Simonds, W. F. Optimization of genome editing through CRISPR-Cas9 engineering. Bioengineered. 7 (3), 166-174 (2016).
- Strecker, J., et al. RNA-guided DNA insertion with CRISPR-associated transposases. Science. 365 (6448), 48-53 (2019).
- Cruz-Martín, A., Crespo, M., Portera-Cailliau, C. Glutamate induces the elongation of early dendritic protrusions via mGluRs in wild type mice, but not in fragile X mice. PLoS One. 7 (2), 32446(2012).
- LoTurco, J., Manent, J. B., Sidiqi, F. New and improved tools for in utero electroporation studies of developing cerebral cortex. Cerebral Cortex. 19, Suppl 1 120-125 (2009).
- Kolk, S. M., de Mooij-Malsen, A. J., Martens, G. J. Spatiotemporal Molecular Approach of in utero Electroporation to Functionally Decipher Endophenotypes in Neurodevelopmental Disorders. Frontiers in Molecular Neurosciences. 4, 37(2011).
- Szczurkowska, J., et al. Targeted in vivo genetic manipulation of the mouse or rat brain by in utero electroporation with a triple-electrode probe. Nature Protocols. 11 (3), 399-412 (2016).
- dal Maschio, M., et al. High-performance and site-directed in utero electroporation by a triple-electrode probe. Nature Communications. 3, 960(2012).
- Zhan, Y., et al. Deficient neuron-microglia signaling results in impaired functional brain connectivity and social behavior. Nature Neurosciences. 17 (3), 400-406 (2014).
- Mathis, A., et al. DeepLabCut: markerless pose estimation of user-defined body parts with deep learning. Nature Neurosciences. 21 (9), 1281-1289 (2018).
- Bullmann, T., Arendt, T., Frey, U., Hanashima, C. A transportable, inexpensive electroporator for in utero electroporation. Development Growth and Differentiation. 57 (5), 369-377 (2015).
- Li, Z., et al. Genome-wide association analysis identifies 30 new susceptibility loci for schizophrenia. Nature Genetics. 49 (11), 1576-1583 (2017).
- Ripke, S., et al. Genome-wide association analysis identifies 13 new risk loci for schizophrenia. Nature Genetics. 45 (10), 1150-1159 (2013).
- De Marco Garcia, N. V., Fishell, G. Subtype-selective electroporation of cortical interneurons. Journal of Visualized Experiment. (90), e51518(2014).
- Borrell, V., Yoshimura, Y., Callaway, E. M. Targeted gene delivery to telencephalic inhibitory neurons by directional in utero electroporation. Journal of Neuroscience Methods. 143 (2), 151-158 (2005).
- Soma, M., et al. Development of the mouse amygdala as revealed by enhanced green fluorescent protein gene transfer by means of in utero electroporation. Journal of Comparative Neurology. 513 (1), 113-128 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved