Method Article
Medição de phagocitose de Aspergillus fumigatus Conidia por Leukocytes Humanos usando citometria flow
Neste Artigo
Resumo
Este protocolo fornece um método rápido e confiável para medir quantitativamente a fagocitose de Aspergillus fumigatus conidia por phagocitos primários humanos usando citometria de fluxo e para discriminar a fagocitose da conidia de mera adesão a leukócitos.
Resumo
A infecção pulmonar invasora pelo molde Aspergillus fumigatus representa uma grande ameaça para os pacientes imunocomprometidos. Conidia fúngica inalada (esporos) são desmatadas dos avestélios pulmonares humanos por serem fagócitos por monócitos inatos e/ou neutrófilos. Este protocolo oferece uma medida rápida e confiável de fagocitose por citometria de fluxo usando conidia siciana tolice de fluoresceina (FITC) para co-incubação com leukócitos humanos e subsequente contramanchas com anticorpo antiFITC para permitir a discriminação de conidia internada e aderente celular. As principais vantagens deste protocolo são a sua rapidez, a possibilidade de combinar o ensaio com a análise citométrica de outros marcadores celulares de interesse, a análise simultânea de monócitos e neutrófilos de uma única amostra e sua aplicabilidade a outros fungos ou bactérias portadores de parede celular. A determinação de porcentagens de leukócitos de fagocitos fornece um meio aos microbiologistas para avaliar a virulência de um patógeno ou para comparar os wildtypes e os mutantes do micróbio patogénico assim como aos imunologistas para investigar capacidades humanas do leukocyte combater micróbios patogénicos.
Introdução
A aspergillose pulmonar invasiva é uma grande ameaça aos pacientes imunocomprometidos, pois as opções de tratamento são limitadas e só são bem-sucedidas após o diagnóstico precoce, o que leva a altas taxas de mortalidade1. Agentes infecciosos são conidia (esporos) do molde Aspergillus fumigatus que são onipresentes para a maioria dos habitats2. Conidia são inaladas, passam pelas vias aéreas e podem finalmente entrar no pulmão amasso. Em seres humanos imunocompetentes, estes conidia são limpos por células imunes inatas, como monócitos ou macrófagos e grânulos neutrófilos, que ocupam (fagocitose) e digerem os patógenos3. A fagocitose é importante para microbiologistas e imunologistas da mesma forma quando interessado em interações hospedóias-patógenos. Ensaios de confronto, como a co-incubação de leukócitos e conidia, muitas vezes incluem rotulagem dos esporos por fluoresceina ou sua fluoresceina derivada isotiaciana (FITC). Usando um microscópio, é simples identificar conidia fluorescente internalizada e determinar conidia anexada/aderente, embora essa abordagem seja complicada e realisticamente restrita a algumas centenas de células4. No entanto, na citometria de fluxo que facilmente permite a análise de centenas de milhares de células em poucos minutos, a coloração diferencial de conidia fagocitosada e aderente é vital. Portanto, muitos protocolos dependem trypan azul para saciar FITC-fluorescência de conidia adepto5,6,7,8. Outra abordagem é explorar a transferência de energia de ressonância fluorescência de brometo de etídio e FITC para emitir vermelho em vez de fluorescência verde da conidia aderente9,10,11. Se os anticorpos específicos estão disponíveis, como é o caso de algumas bactérias, partículas ligadas à célula podem ser diretamente manchadas12,13.
Aqui, apresentamos um protocolo para avaliar rápida e quantitativamente a fagocitose de FitC-rotulado A. fumigatus conidia por leukócitos humanos, juntamente com o apego de esporos às células e falta de interação, empregando uma alocecianina (APC) acoplado anticorpo anti-FITC. O método também permite a análise citométrica de fluxo simultâneo de marcadores celulares adicionais que podem ser empregados para análise separada da fagocitose por monócitos e neutrófilos da mesma amostra.
O protocolo pode ser aplicado para caracterização de cepas fúngicas (por exemplo, várias espécies de Aspergillus e outros moldes do gênero Mucorales apresentados aqui) e seus mutantes14 e pesquisa imunológica sobre fagócitos, como leukócitos de indivíduos imunocomprometidos.
Protocolo
Este protocolo inclui o uso de casacos de buffy humanos obtidos do Instituto de Medicina Transfusional, Hospital Universitário de Jena e sangue venoso fresco retirado dos pacientes, ambos após o consentimento informado por escrito dos doadores de acordo com a aprovação do comitê de ética 4357-03/15.
1. Preparação de Aspergillus fumigatus Conidia
- Crescer A. fumigatus em 1,5% de malte agar placas de Petri por 5 dias a 37 ° C sem CO2.
CUIDADO: A. fumigatus é um microorganismo de nível 2 de biossegurança e deve ser manuseado em uma instalação apropriada usando um armário de biossegurança e vestindo jaleco, luvas e uma máscara de filtro.
NOTA:A placa deve ser coberta completamente com uma camada verde-acinzentada de conidia. As culturas brancas não sporulate. Composição de malte agar: extrato de malte de 4% (w/v), extrato de levedura 0,4% (w/v), ágar 1,5% (w/v), Aqua destituir. - Colheita de conidia
- Coloque uma toalha de papel molhada com desinfetante no armário de biossegurança e coloque a placa em cima para evitar a sobredistribuição de conidia volátil.
- Adicione 10 mL de salina tampão de fosfato (PBS) + 0,01% detergente em cima do fungo, use uma espátula Drigalski para espalhar o líquido sobre a placa e esfregue a conidia de cor escura. Tenha cuidado para não remover o micélio branco.
- Coloque a suspensão conidia em um tubo de 50 mL usando um filtro de célula de 30 μm para remover qualquer micélio residual.
- Repita os passos 1.2.2 e 1.2.3 e colete no mesmo tubo de 50 mL.
- Gire para 5 min a 2.600 x g à temperatura ambiente.
- Retire o supernatant e resuspender em 20 mL de aqua estéril destituir.
- Determine a concentração de conidia com uma câmara de contagem de Thoma.
NOTA:O protocolo pode ser pausado aqui e a suspensão conidia armazenada por até 1 mês a 4 °C com a tampa parafusada firmemente.
- Rotulagem FITC
- Prepare uma solução de 0,1 mM de pó FITC em 0,1 M Na2CO3 (dissolvido em PBS).
CUIDADO:Fitc pó é perigoso e deve ser manuseado com luvas, óculos e uma máscara de filtro. Coletar resíduos de acordo com as regulamentações locais.
NOTA:Omita luz artificial durante este e os seguintes passos envolvendo conidia. - Resuspenda 1 x 108 (ou menos) conidia em 5 mL da solução FITC em um tubo de 15 mL. Incubar por 20 min a 37 °C em um rotador.
- Para o controle negativo, resuspenda conidia em 0,1 M Na2CO3 (sem FITC) em um tubo de 15 mL. Incubar por 20 min a 37 °C em um rotador.
NOTA:Ao calcular a quantidade de conidia a ser manchada, tome em consideração uma perda de até 70% durante a coloração, o inchamento e todas as etapas de lavagem necessárias. Se nenhum rotador estiver disponível, a suspensão deve ser abalada três vezes durante a incubação. - Para lavar, adicione 10 mL de PBS + 0,01% detergente à suspensão e gire por 5 min a 2.600 x g à temperatura ambiente.
- Retire o detergente supernatant e repita a lavagem duas vezes com 10 mL de PBS + detergente de 0,01%.
- Prepare uma solução de 0,1 mM de pó FITC em 0,1 M Na2CO3 (dissolvido em PBS).
- Inchaço da conidia (pode ser omitido se não desejar)
- Resuspenda a fitc rotulada conidia em 5 mL do Roswell Park Memorial Institute (RPMI) médio + 10% Fetal Calf Serum (FCS) e incubar em um rotador em 37 °C para o tempo desejado (por exemplo, 2 h, 4 h).
NOTA:Se nenhum rotador estiver disponível, a suspensão deve ser abalada pelo menos a cada 20 min durante a incubação. - Adicione 10 mL de PBS + 0,01% detergente à suspensão e gire por 5 min a 2.600 x g à temperatura ambiente.
- Retire o supernatant e lave duas vezes com 10 mL de PBS + 0,01% detergente.
- Filtrar através de um filtro de célula sitira de 30 μm para remover grandes grupos de conidia.
- Resuspenda a fitc rotulada conidia em 5 mL do Roswell Park Memorial Institute (RPMI) médio + 10% Fetal Calf Serum (FCS) e incubar em um rotador em 37 °C para o tempo desejado (por exemplo, 2 h, 4 h).
- Fixação de conidia (pode ser omitido se não desejar)
- Resuspender fitc rotulado e inchado conidia em 1 mL de formaldeído e incubar por 1 h à temperatura ambiente.
- Adicione 10 mL de PBS + 0,01% detergente à suspensão e gire por 5 min a 2.600 x g à temperatura ambiente.
- Retire o supernatant e lave duas vezes com 10 mL de PBS + 0,01% detergente.
NOTA:O protocolo pode ser pausado aqui e as conidia sacadas na PBS no escuro (tubo embrulhado em folha de alumínio) por até 1 semana a 4 °C.
2. Preparação de Leukócitos Primários Humanos
- Coloque 5 mL de casaco de buffy em um tubo de 50 mL. Alternativamente, use sangue venoso periférico humano fresco extraído em monovettes de ácido etiledianomilacetic (EDTA).
CUIDADO:O sangue humano pode transmitir vírus como o vírus da imunodeficiência humana e o vírus da hepatite B. Lidar apenas depois de ser vacinado contra a hepatite B. Lidar com um armário de biossegurança vestindo jaleco e luvas. - Encha o tubo com Erythrocyte Lysis (EL) Buffer, inverta três vezes e incubar por 5-8 min horizontalmente até que a aparência leitosa da mistura fica clara.
NOTA:Ocasionalmente, o sangue pode levar mais tempo para lyse. Vá pela aparência. Não é incomum que dois tubos do mesmo sangue levem tempos diferentes para lise. Composição do tampão el: 0,15 M NH4Cl, 10 mM KHCO3,0,1 mM EDTA - Gire por 10 min a 300 x g à temperatura ambiente. Descarte o supernatant.
- Resuspenda a pelota em 1 mL de EL Buffer por pipetting. Em seguida, adicione mais 24 mL de tampão EL, e inverter várias vezes.
- Gire para 5 min a 300 x g à temperatura ambiente.
- Descarte as células supernatant e resuspendem em 1 mL de RPMI + 10% FCS.
- Determine a concentração celular com uma câmara de contagem de Neubauer.
3. Ensaio de Phagocytosis
- Incubate 2 x 106 leukócitos e 4 x 106 fitc-rotulado conidia (multiplicidade de infecção = 2) em 1,5 mL de RPMI + 10% FCS em uma placa de cultura de 12 poços de células. Como controles, incluem apenas células (sem conidia) e células + conidia sem rótulo.
- Coloque em uma incubadora de CO2 umidificada a 37 °C e incubada pelo período de tempo desejado (por exemplo, 0,5 h, 2 h ou 4 h).
- Após a incubação, as células de colheita com um raspador de células e colocar em um tubo de 15 mL.
- Gire para 5 min a 300 x g à temperatura ambiente.
- Coletar supernatant para análise de citocina ou descartar se não quiser. Resuspenda cada amostra em 100 μL de PBS + 2 mM EDTA.
4. Mancha de anticorpos
- Para cada amostra, prepare 100 μL de mistura de anticorpos, incluindo anticorpo antiFITC aPc, de acordo com a Tabela 1.
- Coloque uma amostra de 100 μL em um poço de uma placa de fundo V de 96 poços. Adicione 150 μL de PBS + 2 mM EDTA para lavar.
- Para compensação de cores, coloque 1 x 106 células para cada cor em poços adicionais da placa inferior V de 96 poços. Inclua um poço de células que é deixada desmanchada. Adicione 150 μL de PBS + 2 mM EDTA para lavar.
- Placa de cobertura com uma folha adesiva.
- Gire para 5 min a 300 x g à temperatura ambiente. Retire a folha.
- Descarte o supernatant rapidamente e vigorosamente invertendo a placa apenas uma vez sobre a pia ou uma toalha de papel descartável.
NOTA:Não repita ou bata a placa em um papel até secar, pois isso resultará em uma enorme perda de células da placa. - Resuspenda as células na mistura de anticorpos de 100 μL e misture bem por pipetting.
- Para compensação de cores, resuspenda as respectivas células em 100 μL de PBS + 2 mM EDTA e adicione um único anticorpo a cada poço na mesma quantidade usada na mistura de anticorpos.
- Cubra com uma folha adesiva e incubada por 20 min à temperatura ambiente no escuro.
- Retire a folha. Adicione 150 μL de PBS + 2 mM EDTA a cada poço para lavar. Cubra com uma folha adesiva.
- Gire para 5 min a 300 x g à temperatura ambiente. Retire a folha. Descarte o supernatant rapidamente e vigorosamente invertendo o prato sobre a pia ou uma toalha de papel descartável.
- Resuspender em 200 μL de PBS + 2 mM EDTA e células de transferência de cada poço para um tubo de fundo redondo separado. Certifique-se de que não há aglomerados celulares na suspensão. Remova clusters de outra forma.
NOTA:Cada cluster que é grande o suficiente para o olho ver é grande o suficiente para potencialmente entupir o citometro.
5. Citometria flow
- Comece o citometro de fluxo e deixe aquecer. Iniciar o software de aquisição.
- Criar um novo experimento e configurar e rotular as amostras.
- Configure parâmetros (FSC 250, SSC 250) e detectores para fluorophores FITC, APC, BUV395, V500, PerCP-Cy5.5.
- Configuração de compensação
- Abra a configuração de compensação.
- Indique cores individuais.
- Usando as células de controle deixadas desmanchadas ou com manchas individuais, definir as tensões detector PMT para incluir todos os eventos dentro da escala.
- Registre pelo menos 10.000 eventos de cada controle.
- Use a configuração de compensação para calcular a repercussão dos fléorforos e aplicar-se às configurações citométricas do experimento.
- Gravação de dados da amostra
- Exibir FSC e SSC no software de aquisição e definir portão em torno de leukócitos.
- Com base no portão de leukócito, exibir o enredo de pontos SSC/CD45 e o portão para as células CD45+ se separarem da conidia.
- Exibir células CD45+ em um lote de pontos CD14/CD66b e monócitos de portão (CD14+) e neutrófilos (CD66b+) separadamente.
- Exibir neutrófilos em um gráfico de pontos anti-FITC/FITC.
- Usando a amostra com conidia não rotulada, ajuste quadrantes para sinais antiFITC e FITC, permitindo um máximo de 1% das células nos respectivos quadrantes.
- Repita os passos 5.5.4 e 5.5.5 para o portão de monócito.
- Registre todas as amostras com pelo menos 20.000 eventos no portão de leukócito.
Resultados
Ao medir a fagocitose de A. fumigatus conidia por células fagocíticas humanas, a discriminação entre internalização genuína e mera fixação de conidia às células é um obstáculo, especialmente quando se trata de métodos de alta audácia, como citometria de fluxo. A fim de superar esse obstáculo, apresentamos um protocolo rápido e confiável com base na coloração de conidia com a corante fluorescente FITC antes da co-incubação de células e conidia, seguido por uma contra-mancha com um anticorpo antiFITC rotulado por APC após a incubação (Figura 1A). Como mostrado na Figura 1B, conidia fitc-rotulados são phagocytosed por monócitos humanos e neutrófilos que fornecem um sinal verde para as células. Estes conidia são inacessíveis para o anticorpo anti-FITC e, portanto, não podem ligar o anticorpo e as células parecem apc negativo (FITC +, APC-). As células não interagindo não adquirem um sinal verde da conidia rotulada pelo FITC e permanecem FITC-, APC-. Algumas células aparecem FITC-, APC +. Uma vez que o anticorpo anti-FITC APC não deve ser capaz de ligar as células sem conidia fitc-rotulados, esses eventos são considerados artefatos de coloração. Fitc-rotulado conidia, que estão ligados às células, mas não internalizados, tornar as células também positivas para FITC, mas também fornecer um alvo para o anticorpo anti-FITC que faz com que essas células duplamente positivo para FITC e APC (FITC +, APC +). Quando analisada microscópico, essa população continha até 20% das células com conidia sidia anexada apenas em nossos experimentos.
Usando os anticorpos descritos neste protocolo e seguindo a estratégia gating na figura 1D,um gating geral de leukocytes humanos por características de FSC e de SSC é seguido por uma separação dos leukocytes e do conidia livre pelo marcador pan-leukocyte CD45. Especialmente ao usar conidia inchada e /ou longos tempos de incubação, conidia pode atingir o tamanho quase celular no momento da citometria de fluxo e, portanto, análise de viés. Uma vez que os monócitos primários humanos e neutrófilos ocupam conidia de forma diferente, este protocolo permite analisar separadamente a população celular com base na coloração com os marcadores de linhagem celular bem estabelecidos CD14 para monócitos e CD66b para neutrófilos. Gating para populações de células de fagocitosing e adepto é feito com base em amostras de controle com conidia sem rótulo que não carregam nem um FITC nem um sinal de APC anti-FITC. Quando a APC e a FITC são traçadas umas contra as outras, quadrantes são definidos de tal forma que um máximo de 1% de células são permitidas nos portões de interesse.
A porcentagem de phagocitos primários humanos internalizando conidia pode ser altamente variável entre os doadores de sangue, mas também depende de fatores experimentais, como tempo de incubação e inchaço do estado de conidia. A internalização do esporos já pode ser detectada após 0,5 h de co-incubação e aumenta com o tempo(Figura 2A). Conidia pré-inchada são absortos mais fácil do que descansar (não inchado) esporos, mesmo em tempos de incubação curta(Figura 2B). Se conidia são fixados com formaldeído, a fagocitose é diminuída em comparação com conidia nativa(Figura 2C).
| Reagente | μl por amostra |
| CD45 BUV395 | 1 |
| CD14 V500 | 0.5 |
| CD66b PerCP-Cy5.5 | 1.5 |
| anti-FITC APC anti-FITC APC | 0.5 |
| PBS + 2 mM EDTA | 97 |
| Total | 100 |
Tabela 1: Mistura de anticorpos para citometria de fluxo. As quantidades de cada reagente são administradas como microlitros por amostra (1 x 106 células) a serem analisadas.

Figura 1: Configuração e análise do ensaio de fagocitose citométrica de fluxo. (A)Esquema do protocolo, incluindo conidia e preparação celular e contra-manchas. (B) A fagocitose é analisada por meio de uma plotagem de dados citommétricos de fluxo de conidia sinuosa com etiqueta FITC contra a contramancha antiFITC APC. Populações resultantes indicam porcentagens de leukócitos não interagindo (FITC-, APC-), leukócitos com conidia aderente (FITC+, APC+) e leukócitos de fagocitos (FITC+, APC-) bem como artefatos de coloração (FITC-, APC+). C) Populações de células duplamente positivas de 3 experimentos diferentes com 3 doadores diferentes (dois deles realizados em duplicatas, um único realizado) foram microscópicamente contados para conidia internalizada e anexada apenas. (D)Estratégia representativa de fluxo citométrica para detectar leukócitos (CD45), identificar monócitos (CD14) e neutrófilos (CD66b) e determinar populações interagindo (FITC, antiFITC). Este número foi modificado a partir de Hartung et al., Citometria A, 95: 3, p. 332-338 (2019)14. Clique aqui para ver uma versão maior deste número.

Figura 2: A fagocitose da conidia pelos fagócitos primários humanos depende de várias condições. (A)A porcentagem de células internalizando conidias de repouso aumentou com o tempo de co-incubação. (B) A fagocitose aumentou com o tempo de inchaço conidial quando co-incubada por 0,5 h. (C)Conidia nativa foram melhor phagocitosed do que conidia fixa. Os dados foram obtidos de 10 doadores diferentes(A,B)ou 5 doadores diferentes (C) em 10(A, B)ou 5(C)experimentos independentes. Barras de erro indicam SD. Este número foi modificado a partir de Hartung et al., Citometria A, 95: 3, p. 332-338 (2019)14. Clique aqui para ver uma versão maior deste número.
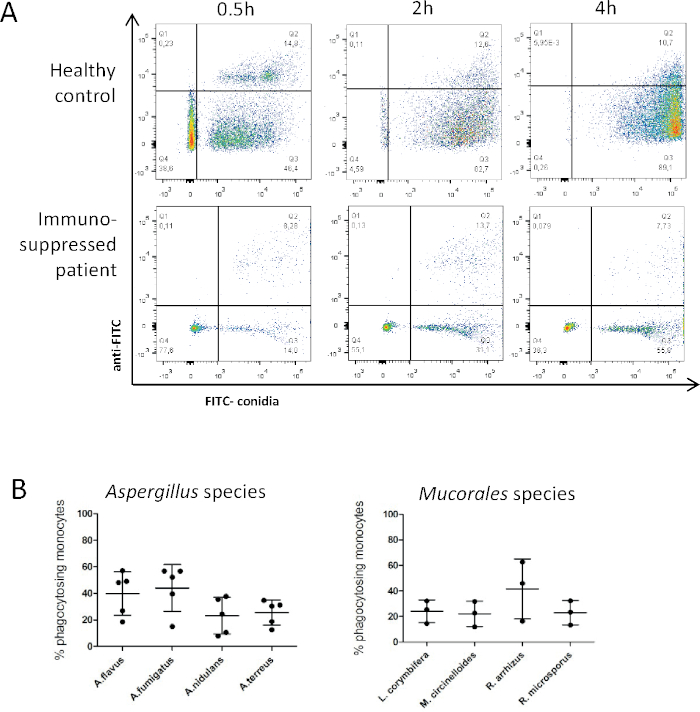
Figura 3: A análise da fagocitose é um meio de avaliar a funcionalidade dos fagócitos primários humanos e caracterizar moldes clinicamente relevantes. (A) Comparação exemplar de monócitos de um doador saudável e um paciente imunossuprimido (após o transplante de células-tronco hematopoiéticas) phagocitosing conidia descansando por 0,5 h, 2 h e 4 h . (B) Phagocitosis de conidia fúngica descansando foi determinada para espécies clinicamente relevantes aspergillus e mucorales após 2 h co-incubação. Os dados foram obtidos de 5(Aspergillus)ou 3(Mucorales)doadores diferentes em 5 ou 3 experimentos independentes cada. Barras de erro indicam SD. Abreviaturas: A. Aspergillus, L. Lichtheimia, M. Mucor, R. Rhizopus Clique aqui para ver uma versão maior desta figura.
Discussão
Este protocolo apresenta um método citométrico de fluxo rápido para medir a interação de A. fumigatus conidia com um grande número de leukócitos humanos primários que não são possíveis em protocolos microscópicos comuns. As células de imagem com um microscópio e conidia internalizada de contagem manual é complicada e podem ser feitas de forma realista apenas para algumas centenas de células. A citometria do fluxo supera este problema medindo milhares de pilhas dentro dos minutos. Um obstáculo comum a ambas as abordagens é a distinção de conidias fagocitosas e aderentes em ou nas células, respectivamente. Na microscopia, o branco calcofluor corante é frequentemente usado para colorir conidias adeptos, mas seu uso é limitado a microorganismos com uma parede celular contendo chitina.
Esse protocolo, em contraste, utilizou fluorofóforos distintos para caracterização de eventos de interação que permitem a adição de marcadores celulares adicionais, como os marcadores de linhagem CD45, CD14 e CD66b. Assim, também é possível discriminar a fagocitose de patógenos por monócitos e neutrófilos em uma única amostra. Embora a escolha de marcadores e fluorofóforos para identificação celular possa ser adaptada às necessidades do experimento e às capacidades do citometro disponível, o uso do anticorpo específico APC mencionado neste protocolo é recomendado anticorpo mais confiável em nossas mãos.
Como os conidias fixas de formaldeído não são internalizados igualmente bem, os esporos nativos são recomendados para ensaios de fagagocitose. No entanto, conidia nativa vai começar ou continuar inchaço durante a co-incubação com leukócitos humanos e, eventualmente, germinar. Normalmente, A. fumigatus conidia germina após cerca de 8-9 h em mídia contendo glicose em 37 °C. A combinação de tempo de inchaço e tempo de co-incubação com fagócitos não deve exceder esse período de tempo, pois a germinação causa a perda de FITC na superfície da conidia. Mais importante, germes não podem mais ser fagocitosed por monócitos ou neutrófilos. Em vez disso, esses fagócitos se acumulam ao redor e se ater a germes que produzem aglomerados de células que obstruem o citometro, se não removido. Da mesma forma, 4 conidias inchadas tendem a gerar aglomerados entre si e com células. Muitas vezes, esses aglomerados não podem ser mais separados mecanicamente e as células dentro são perdidas para análise citométrica de fluxo.
Embora gating é simples e fácil no início, quanto mais conidia são internalizados por células, o gating blurrier pode se tornar. Usando MOIs > 2 aumenta a fagocitose nos pontos iniciais do tempo, mas problemas de gating podem surgir mais cedo também. Portanto, os MOIs devem ser cuidadosamente determinados com as células específicas e patógenos de interesse.
Uma limitação desse protocolo está na dualidade da população celular com conidia aderente (FITC+ APC+) que também pode estar abrigando células com conidia internada e aderente. A possibilidade de mais discriminação é a aplicação do fluxo de imagem citometria15 que permite a imagem visual de todas as células medidas no citometro de fluxo.
Devido à rotulagem fitc inespecífica da parede celular conidial, este método é facilmente transferível para outros fungos de interesse, tais como moldes clinicamente relevantes do gênero Mucorales ou o fermento Candida albicans. Além disso, também as bactérias portadores de parede celular podem ser rotuladas em FITC. A contra-mancha universal com o anticorpo anti-FITC permite a medição rápida e fácil da fagocitose de todos esses patógenos por um grande número de leukócitos humanos.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Agradecemos à Sra. Pia Stier por excelente assistência técnica. M. von Lilienfeld-Toal é apoiado pelo Center for Sepsis Control and Care (Ministério Federal Alemão de Educação e Saúde, BMBF, FKZ 01E01002) e InfectoGnóstics Research Campus (BMBF, FKZ 13GW0096D). Thi Ngoc Mai Hoang é apoiado pela Jena School of Microbial Communication (Deutsche Forschungsgemeinschaft, FKZ 214/2)
Materiais
| Name | Company | Catalog Number | Comments |
| Adhesive foil | Brand | 701367 | |
| anti-CD14 V500 | BD Biosciences | 561391 | clone M5E2 |
| anti-CD45 BUV395 | BD Biosciences | 563792 | clone HI30 |
| anti-CD66b PerCP-Cy5.5 | BD Biosciences | 562254 | clone G10F5 |
| anti-FITC APC | ThermoFisher Scientific | 17-7691-82 | clone NAWESLEE |
| Cell culture plate, 12-well | Greiner Bio-one | 665180 | |
| Cell scraper | Bioswisstech | 800020 | |
| Cell strainer, 30 µm | Miltenyi Biotech | 130-098-458 | SmartStrainer |
| Cytometer | BD Biosciences | LSR Fortessa II, lasers: 488 nm (blue), 405 nm (violet), 355 nm (UV) and 640 nm (red) | |
| Detergent | Sigma Aldrich | P1379 | Tween 20, 0.01% in PBS |
| Drigalski spatula | Carl Roth | PC59.1 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma Aldrich | ED3SS-500g | 2 mM in PBS |
| Erythrocyte lysis buffer | 0.15 M NH4Cl, 10 mM KHCO3, 0.1 mM EDTA | ||
| Fetal Calf Serum (FCS) | Biochrom AG | S 0115 | 10% in RPMI 1640 |
| Fluorescein isothiocyanate (FITC) | Sigma Aldrich | F3651-100MG | 0.1 mM in Na2CO3 /PBS solution |
| Formaldehyd | Carl Roth | PO87.3 | Histofix |
| Malt agar (1.5%) | malt extract (40 g), yeast extract (4 g), agar (15 g), Aqua dest. (1 L), adjust pH to 5.7-6.0, sterilise at 121 °C for 35 minutes | ||
| Na2CO3 | Carl Roth | 8563.1 | 0.1 M in PBS |
| Petri dish | Greiner Bio-one | 633180 | |
| Phosphat Buffered Saline (PBS) | ThermoFisher Scientific | 189012-014 | without Calcium, without Magnesium |
| RPMI 1640 | ThermoFisher Scientific | 61870010 | RPMI 1640 Medium, GlutaMAX Supplement |
| Rotator | Miltenyi Biotech | 130-090-753 | MACSmix Tube Rotator |
| Round-bottom tube, 7.5 mL | Corning | REF 352008 | |
| Software for data acquisition and analysis | BD Biosciences | FACSDiva 8.0 | |
| V-bottom plate, 96 well | Brand | 781601 | untreated surface |
Referências
- Brown, G. D., et al. Hidden killers: human fungal infections. Science Translational Medicine. 4 (165), 113 (2012).
- Brakhage, A. A., Bruns, S., Thywissen, A., Zipfel, P. F., Behnsen, J. Interaction of phagocytes with filamentous fungi. Current Opinion in Microbiology. 13 (4), 409-415 (2010).
- Heinekamp, T., et al. Interference of Aspergillus fumigatus with the immune response. Seminars in Immunopathology. 37 (2), 141-152 (2015).
- Slesiona, S., et al. Persistence versus escape: Aspergillus terreus and Aspergillus fumigatus employ different strategies during interactions with macrophages. PLoS One. 7 (2), 31223 (2012).
- Busetto, S., Trevisan, E., Patriarca, P., Menegazzi, R. A single-step, sensitive flow cytofluorometric assay for the simultaneous assessment of membrane-bound and ingested Candida albicans in phagocytosing neutrophils. Cytometry A. 58 (2), 201-206 (2004).
- Lowe, D. M., et al. A novel assay of antimycobacterial activity and phagocytosis by human neutrophils. Tuberculosis (Edinb). 93 (2), 167-178 (2013).
- Nuutila, J., Lilius, E. M. Flow cytometric quantitative determination of ingestion by phagocytes needs the distinguishing of overlapping populations of binding and ingesting cells. Cytometry A. 65 (2), 93-102 (2005).
- Saresella, M., et al. A rapid evaluation of phagocytosis and killing of Candida albicans by CD13+ leukocytes. Journal of Immunological Methods. 210 (2), 227-234 (1997).
- Fattorossi, A., Nisini, R., Pizzolo, J. G., D'Amelio, R. New, simple flow cytometry technique to discriminate between internalized and membrane-bound particles in phagocytosis. Cytometry. 10 (3), 320-325 (1989).
- Heinzelmann, M., Gardner, S. A., Mercer-Jones, M., Roll, A. J., Polk, H. C. Quantification of phagocytosis in human neutrophils by flow cytometry. Microbiology and Immunology. 43 (6), 505-512 (1999).
- Perticarari, S., Presani, G., Mangiarotti, M. A., Banfi, E. Simultaneous flow cytometric method to measure phagocytosis and oxidative products by neutrophils. Cytometry. 12 (7), 687-693 (1991).
- Sveum, R. J., Chused, T. M., Frank, M. M., Brown, E. J. A quantitative fluorescent method for measurement of bacterial adherence and phagocytosis. Journal of Immunolological Methods. 90 (2), 257-264 (1986).
- de Boer, E. C., Bevers, R. F., Kurth, K. H., Schamhart, D. H. Double fluorescent flow cytometric assessment of bacterial internalization and binding by epithelial cells. Cytometry. 25 (4), 381-387 (1996).
- Hartung, S., et al. Fast and Quantitative Evaluation of Human Leukocyte Interaction with Aspergillus fumigatus Conidia by Flow Cytometry. Cytometry A. 95 (3), 332-338 (2019).
- Fei, C., Lillico, D. M. E., Hall, B., Rieger, A. M., Stafford, J. L. Connected component masking accurately identifies the ratio of phagocytosed and cell-bound particles in individual cells by imaging flow cytometry. Cytometry A. 91 (4), 372-381 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados