Method Article
Medición de la fagocitosis de Aspergillus fumigatus Conidia por leucocitos humanos utilizando citometría de flujo
En este artículo
Resumen
Este protocolo proporciona un método rápido y fiable para medir cuantitativamente la fagocitosis de Aspergillus fumigatus conidia por los fagocitos primarios humanos utilizando citometría de flujo y para discriminar la fagocitosis de la conidia de la mera adhesión a los leucocitos.
Resumen
La infección pulmonar invasiva por el moho Aspergillus fumigatus representa una gran amenaza para los pacientes inmunocomprometidos. La conidia fúngica inhalada (esporas) se elimina de los alvéolos pulmonares humanos al ser fagocitos innatados por monocitos innatos y/o neutrófilos. Este protocolo ofrece una medición rápida y fiable de la fagocitosis mediante citometría de flujo utilizando conidia etiquetada con isotiocianato de fluoresceína (FITC) para la coincubación con leucocitos humanos y posterior contramancha con un anticuerpo anti-FITC para permitir la discriminación de la conidia internaizada y celular. Las principales ventajas de este protocolo son su rapidez, la posibilidad de combinar el ensayo con el análisis citométrico de otros marcadores celulares de interés, el análisis simultáneo de monocitos y neutrófilos a partir de una sola muestra y su aplicabilidad a otros hongos o bacterias portadoras de paredes celulares. La determinación de porcentajes de leucocitos fagocitos proporciona un medio a los microbiólogos para evaluar la virulencia de un patógeno o para comparar los tipos silvestres patógenos y mutantes, así como a los inmunólogos para investigar las capacidades de leucocitos humanos para combatir patógenos.
Introducción
La aspergilosis pulmonar invasiva es una gran amenaza para los pacientes inmunocomprometidos, ya que las opciones de tratamiento son limitadas y solo tienen éxito tras el diagnóstico precoz, lo que conduce a altas tasas de mortalidad1. Los agentes infecciosos son conidia (esporas) del moho Aspergillus fumigatus que son omnipresentes en la mayoría de los hábitats2. Conidia se inhala, pasa a través de las vías respiratorias y finalmente puede entrar en los alvéolos pulmonares. En los seres humanos inmunocompetentes, estas conidias son borradas por células inmunitarias innatas como monocitos o macrófagos y granulocitos neutrófilos, que toman (fagocitosa) y digieren los patógenos3. La fagocitosis es importante para los microbiólogos e inmunólogos también cuando están interesados en interacciones huésped-patógeno. Los ensayos de confrontación, como la coincubación de leucocitos y conidia, a menudo incluyen el etiquetado de las esporas por fluoresceína o su derivado fluoresceína isotiocianato (FITC). Usando un microscopio, es sencillo identificar la conidia fluorescente internalizada y determinar la conidia adjunta/adherente, aunque este enfoque es engorroso y realistamente restringido a unos cientos de células4. Sin embargo, en la citometría de flujo que permite fácilmente el análisis de cientos de miles de células en cuestión de minutos, la tinción diferencial de la conidia fagocitosed y adherente es vital. Por lo tanto, muchos protocolos dependen de Trypan Blue para saciar la fluorescencia FITC de la conidia5adherente,6,7,8. Otro enfoque es explotar la transferencia de energía de resonancia de fluorescencia de bromuro de etidio y FITC para emitir rojo en lugar de fluorescencia verde de conidiaadherente 9,10,11. Si se dispone de anticuerpos específicos, como es el caso de algunas bacterias, las partículas enlazadas a las células se pueden teñir directamente12,13.
Aquí, presentamos un protocolo para evaluar rápida y cuantitativamente la fagocitosis de A. fumigatus conidia con la etiqueta FITC por leucocitos humanos junto con la unión de esporas a las células y la falta de interacción mediante el empleo de un anticuerpo anti-FITC acoplado con aloficocianina (APC). El método también permite el análisis citométrico de flujo simultáneo de otros marcadores celulares que se pueden emplear para el análisis separado de la fagocitosis por monocitos y neutrófilos de la misma muestra.
El protocolo se puede aplicar para la caracterización de cepas fúngicas (por ejemplo, varias especies de Aspergillus y otros mohos del género Mucorales presentados aquí) y sus mutantes14 e investigación inmunológica sobre fagocitos, como leucocitos de individuos inmunocomprometidos.
Protocolo
Este protocolo incluye el uso de abrigos de buffy humanos obtenidos del Instituto de Medicina Transfusional, Hospital Universitario de Jena y sangre venosa fresca extraída de los pacientes, tanto después del consentimiento informado por escrito de los donantes de acuerdo con la aprobación 4357-03/15 del comité de ética.
1. Preparación de Aspergillus fumigatus Conidia
- Cultivar A. fumigatus en platos de agar de malta Petri al 1,5% durante 5 días a 37 oC sin CO2.
ADVERTENCIA: A. fumigatus es un microorganismo de nivel 2 de bioseguridad y debe manipularse en una instalación adecuada utilizando un gabinete de bioseguridad y usando bata de laboratorio, guantes y una máscara de filtro.
NOTA: La placa debe cubrirse completamente con una capa de conidia grisáceo verdoso. Las culturas blancas no esporulan. Composición del agar malta: 4% (p/v) extracto de malta, extracto de levadura 0,4% (p/v), agar 1,5% (p/v), Aqua dest. - Cosecha de conidia
- Coloque una toalla de papel húmeda con desinfectante en el gabinete de bioseguridad y coloque la placa en la parte superior para evitar la sobredistribución de la conidia volátil.
- Añadir 10 ml de solución salina tamponada de fosfato (PBS) + 0,01% detergente en la parte superior del hongo, utilizar una espátula Drigalski para esparcir el líquido sobre la placa y frotar la conidia de color oscuro. Tenga cuidado de no quitar el micelio blanco.
- Coloque la suspensión de conidia en un tubo de 50 ml utilizando un colador de células de 30 m para eliminar cualquier micelio residual.
- Repita los pasos 1.2.2 y 1.2.3 y recoja en el mismo tubo de 50 ml.
- Girar durante 5 min a 2.600 x g a temperatura ambiente.
- Retire el sobrenadante y resuspenda en 20 ml de Aqua dest estéril.
- Determinar la concentración de conidia con una cámara de recuento de Thoma.
NOTA: El protocolo se puede pausar aquí y la suspensión de conidia se almacena hasta 1 mes a 4 oC con la tapa atornillada firmemente.
- Etiquetado FITC
- Preparar una solución de 0,1 mM de polvo FITC en 0,1 M Na2CO3 estéril (disuelto enPBS).
ADVERTENCIA: El polvo FITC es peligroso y debe manipularse con guantes, gafas y una máscara de filtro. Recoger los residuos de acuerdo con la normativa local.
NOTA: Omita la luz artificial durante este y los siguientes pasos relacionados con conidia. - Resuspenda 1 x 108 (o menos) conidia en 5 ml de solución FITC en un tubo de 15 ml. Incubar durante 20 min a 37oC en un rotador.
- Para el control negativo, resuspenda la conidia en 0,1 M Na2CO3 (sin FITC) en un tubo de 15 ml. Incubar durante 20 min a 37oC en un rotador.
NOTA: Al calcular la cantidad de conidia a manchar, tenga en cuenta una pérdida de hasta el 70% durante la tinción, la hinchazón y todas las etapas de lavado necesarias. Si no hay rotador disponible, la suspensión debe agitarse tres veces durante la incubación. - Para el lavado, añadir 10 ml de detergente PBS + 0.01% a la suspensión y girar durante 5 min a 2.600 x g a temperatura ambiente.
- Retire el sobrenadante y repita el lavado dos veces con 10 ml de DETERGENTE PBS + 0.01%.
- Preparar una solución de 0,1 mM de polvo FITC en 0,1 M Na2CO3 estéril (disuelto enPBS).
- Hinchazón de conidia (puede omitirse si no se desea)
- Resuspender la conidia etiquetada FITC en 5 mL del medio del Roswell Park Memorial Institute (RPMI) + 10% Fetal Calf Serum (FCS) e incubar en un rotador a 37oC durante el tiempo deseado (por ejemplo, 2 h, 4 h).
NOTA: Si no hay rotador disponible, la suspensión debe agitarse al menos cada 20 minutos durante la incubación. - Añadir 10 ml de detergente PBS + 0.01% a la suspensión y girar durante 5 min a 2.600 x g a temperatura ambiente.
- Retire el sobrenadante y lave dos veces con 10 ml de PBS + 0,01% detergente.
- Filtrar a través de un colador de células de 30 m para eliminar grandes grupos de conidia.
- Resuspender la conidia etiquetada FITC en 5 mL del medio del Roswell Park Memorial Institute (RPMI) + 10% Fetal Calf Serum (FCS) e incubar en un rotador a 37oC durante el tiempo deseado (por ejemplo, 2 h, 4 h).
- Fijación de conidia (puede omitirse si no se desea)
- Resuspender la conidia etiquetada e hinchada del FITC en 1 ml de formaldehído e incubar durante 1 h a temperatura ambiente.
- Añadir 10 ml de detergente PBS + 0.01% a la suspensión y girar durante 5 min a 2.600 x g a temperatura ambiente.
- Retire el sobrenadante y lave dos veces con 10 ml de PBS + 0,01% detergente.
NOTA: El protocolo se puede pausar aquí y la conidia almacenada en PBS en la oscuridad (tubo envuelto en papel de aluminio) durante un máximo de 1 semana a 4 oC.
2. Preparación de leucocitos primarios humanos
- Poner 5 ml de capa buffy en un tubo de 50 ml. Alternativamente, utilice sangre venosa periférica humana fresca extraída en monovettes de ácido etilendiaminetetraacético (EDTA) (10 ml por tubo de 50 ml).
ADVERTENCIA: La sangre humana puede transmitir virus como el Virus de Inmunodeficiencia Humana y el Virus de la Hepatitis B. Mango sólo después de ser vacunado contra la Hepatitis B. Manipular en un gabinete de bioseguridad usando abrigo de laboratorio y guantes. - Llene el tubo con Tampón de Eritrocitos Lysis (EL), invierta tres veces e incubar durante 5-8 min horizontalmente hasta que la apariencia lechosa de la mezcla se vuelva clara.
NOTA: Ocasionalmente, la sangre puede tardar más en tener les. Ve por la apariencia. No es inusual que dos tubos de la misma sangre tomen diferentes tiempos para la lequita. Composición del buffer EL: 0.15 M NH4Cl, 10 mM KHCO3, 0.1 mM EDTA - Gire durante 10 min a 300 x g a temperatura ambiente. Descarta el sobrenadante.
- Resuspenda el pellet en 1 ml de el búfer EL pipeteando. A continuación, agregue otros 24 ml del búfer EL e invierta varias veces.
- Gire durante 5 min a 300 x g a temperatura ambiente.
- Deseche el sobrenadante y resuspenda las células en 1 ml de RPMI + 10% FCS.
- Determine la concentración celular con una cámara de recuento Neubauer.
3. Ensayo de fagocitosis
- Incubar 2 x 106 leucocitos y 4 x 106 conidia etiquetada sIC (multiplicidad de infección 2) en 1,5 ml de RPMI + 10% FCS en una placa de cultivo celular de 12 pocillos. Como controles, incluya solo celdas (sin conidia) y celdas + conidia sin etiquetar.
- Colocar en una incubadora de CO2 humidificada a 37oC e incubar durante el período de tiempo deseado (p. ej., 0,5 h, 2 h o 4 h).
- Después de la incubación, cosechar células con un rascador celular y poner en un tubo de 15 ml.
- Gire durante 5 min a 300 x g a temperatura ambiente.
- Recoger sobrenadante para el análisis de citoquinas o descartar si no se desea. Resuspenda cada muestra en 100 s de PBS + 2 mM EDTA.
4. Staining de anticuerpos
- Para cada muestra, prepare 100 l de mezcla de anticuerpos, incluido el anticuerpo anti-FITC APC, de acuerdo con la Tabla 1.
- Ponga una muestra de 100 l en un pozo de una placa inferior en V de 96 pocillos. Añadir 150 l de PBS + 2 mM EDTA para el lavado.
- Para la compensación de color, coloque 1 x 106 celdas para cada color en otros pozos de la placa inferior de 96 pocillos En V. Incluya un pozo de celdas que se deja sin mancha. Añadir 150 l de PBS + 2 mM EDTA para el lavado.
- Cubra la placa con una lámina adhesiva.
- Gire durante 5 min a 300 x g a temperatura ambiente. Retire la lámina.
- Deseche el sobrenadante invirtiendo rápida y forzosamente la placa sólo una vez sobre el fregadero o una toalla de papel desechable.
NOTA: No repita ni golpee la placa sobre un papel hasta que se seque, ya que esto resultará en una pérdida masiva de células de la placa. - Resuspenda las células en la mezcla de anticuerpos de 100 l y mezcle bien pipeteando.
- Para la compensación de color, resuspenda las celdas respectivas en 100 éL de PBS + 2 mM EDTA y agregue un solo anticuerpo a cada pocal en la misma cantidad utilizada en la mezcla de anticuerpos.
- Cubrir con una lámina adhesiva e incubar durante 20 minutos a temperatura ambiente en la oscuridad.
- Retire la lámina. Añadir 150 sl de PBS + 2 mM EDTA a cada pocto para el lavado. Cubra con una lámina adhesiva.
- Gire durante 5 min a 300 x g a temperatura ambiente. Retire la lámina. Deseche el sobrenadante invirtiendo rápida y forzosamente la placa sobre el fregadero o una toalla de papel desechable.
- Resuspenda en 200 s de PBS + 2 mM EDTA y transfiera las células de cada pocal a un tubo inferior redondo separado. Asegúrese de que no haya clústeres de celdas en la suspensión. De lo contrario, quite los clústeres.
NOTA: Cada racimo que es lo suficientemente grande como para que el ojo lo vea es lo suficientemente grande como para obstruir potencialmente el citometro.
5. Citometría de flujo
- Encienda el citómetro de flujo y deje que se caliente. Inicie el software de adquisición.
- Cree un nuevo experimento y configure y etiquete los ejemplos.
- Configurar parámetros (FSC 250, SSC 250) y detectores para fluoróforos FITC, APC, BUV395, V500, PerCP-Cy5.5.
- Configuración de compensación
- Abra la configuración de compensación.
- Indique colores individuales.
- Usando las celdas de control que no se han manchado o con manchas individuales, establezca los voltajes del detector PMT para incluir todos los eventos dentro de la escala.
- Registre al menos 10.000 eventos de cada control.
- Utilice la configuración de compensación para calcular el derrame de fluoróforos y aplicar a la configuración del citómetro del experimento.
- Grabación de datos de muestra
- Muestre FSC y SSC en el software de adquisición y establezca la puerta alrededor de los leucocitos.
- Basado en la puerta de leucocitos, mostrar la gráfica de puntos SSC/CD45 y la puerta para que las células CD45+ se separen de la conidia.
- Visualice las células CD45+ en una gráfica de puntos CD14/CD66b y monocitos de puerta (CD14+) y neutrófilos (CD66b+) por separado.
- Mostrar neutrófilos en una gráfica de puntos anti-FITC/FITC.
- Usando la muestra con conidia sin etiquetar, establezca cuadrantes para señales anti-FITC y FITC, permitiendo un máximo del 1% de las células en los cuadrantes respectivos.
- Repita los pasos 5.5.4 y 5.5.5 para la compuerta de monocitos.
- Registre todas las muestras con al menos 20.000 eventos en la puerta de leucocitos.
Resultados
Al medir la fagocitosis de A. fumigatus conidia por las células fagocíticas humanas, la discriminación entre la internalización genuina y la mera vinculación de la conidia a las células es un obstáculo, especialmente cuando se trata de métodos de alto rendimiento como la citometría de flujo. Para superar este obstáculo, presentamos un protocolo rápido y fiable basado en la tinción de conidia con el tinte fluorescente FITC antes de la coincubación de células y conidia, seguido de un contramanchado con un anticuerpo anti-FITC etiquetado por APC después de la incubación(Figura 1A). Como se muestra en la Figura 1B,la conidia etiquetada por FITC es fagocitosed por monocitos humanos y neutrófilos que proporcionan una señal verde a las células. Estas conidios son inaccesibles para el anticuerpo anti-FITC y, por lo tanto, no pueden unir el anticuerpo y las células aparecen APC negativas (FITC+, APC-). Las células no interactantes no adquieren una señal verde de la conidia etiquetada por el FITC y siguen siendo FITC-, APC-. Algunas celdas aparecen FITC-, APC+. Dado que el anticuerpo anti-FITC APC no debe ser capaz de unir células sin conidia etiquetada por FITC, estos eventos se consideran artefactos de tinción. La conidia etiquetada por el FITC, que está unida a las células pero no se internaliza, representa las células también positivas para el FITC, pero también proporciona un objetivo para el anticuerpo anti-FITC que hace que estas células sean doblemente positivas para FITC y APC (FITC+, APC+). Cuando se analiza microscópicamente, esta población contenía hasta el 20% de las células con conidia unida sólo en nuestros experimentos.
Utilizando los anticuerpos descritos en este protocolo y siguiendo la estrategia de gating en la Figura 1D, una gating general de leucocitos humanos por características FSC y SSC es seguido por una separación de leucocitos y conidia libre por el marcador pan-leucocito CD45. Especialmente cuando se utiliza conidia hinchada y /o largos tiempos de incubación, la conidia puede alcanzar casi el tamaño celular en el momento de la citometría de flujo y, por lo tanto, el análisis de sesgo. Dado que los monocitos primarios humanos y los neutrófilos ocupan la conidia de manera diferente, este protocolo permite analizar por separado estas poblaciones celulares en función de la tinción con los marcadores de linaje celular bien establecidos CD14 para monocitos y CD66b para los neutrófilos. La ampliación para las poblaciones celulares de fagocitos y adherentes se realiza sobre la base de muestras de control con conidia sin etiquetar que no llevan ni una señal FITC ni una señal APC anti-FITC. Cuando APC y FITC se trazan entre sí, los cuadrantes se establecen de tal manera que se permite un máximo de 1% de celdas en las puertas de interés.
El porcentaje de fagocitos primarios humanos que internalizan la conidia puede ser muy variable entre los donantes de sangre, pero también depende de factores experimentales como el tiempo de incubación y el estado de hinchazón de la conidia. La internalización de las esporas se puede detectar después de 0,5 h de coincubación ya y aumenta con el tiempo(Figura 2A). Las conidias pre-inflamadas se toman más fácilmente que las esporas de reposo (no hinchadas) incluso en tiempos de incubación cortos(Figura 2B). Si la conidia se fija con formaldehído, la fagocitosis disminuye en comparación con la conidia nativa(Figura 2C).
| Reactivo | L por muestra |
| CD45 BUV395 | 1 |
| CD14 V500 | 0.5 |
| CD66b PerCP-Cy5.5 | 1.5 |
| APC anti-FITC | 0.5 |
| PBS + 2 mM EDTA | 97 |
| Total | 100 |
Tabla 1: Mezcla de anticuerpos para la citometría de flujo. Las cantidades de cada reactivo se dan como microlitros por muestra (1 x 106 células) a analizar.

Figura 1: Configuración y análisis del ensayo de fagocitosis citométrica de flujo. (A) Esquema del protocolo que incluye conidia y preparación y contramanchación celular. (B) La fagocitosis se analiza trazando los datos citométricos de flujo de la conidia etiquetada por el FITC frente a la contramancha de APC anti-FITC. Las poblaciones resultantes indican porcentajes de leucocitos no interactuantes (FITC-, APC-), leucocitos con conidia adherente (FITC+, APC+) y leucocitos fagocitos (FITC+, APC-), así como artefactos de tinción (FITC-, APC+). (C) Las poblaciones de células dobles positivas de 3 experimentos diferentes con 3 donantes diferentes (dos de ellos realizados en duplicados, uno realizado individualmente) se contaron microscópicamente para internalizary adjuntar sólo conidia. (D) Estrategia representativa de la medición de datos citométricos de flujo para detectar leucocitos (CD45), identificar monocitos (CD14) y neutrófilos (CD66b) y determinar poblaciones que interactúan (FITC, anti-FITC). Esta cifra ha sido modificada de Hartung et al., Cytometry A, 95: 3, p. 332-338 (2019)14. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: La fagocitosis de la conidia por los fagocitos primarios humanos depende de varias condiciones. (A) Porcentaje de células internalizantes de conidia en reposo aumentó con el tiempo de coincubación. (B) La fagocitosis aumentó con el tiempo de hinchazón conidial cuando se coincubaron durante 0,5 h.(C) La conidia nativa fue mejor fagocitosa que la conidios fija. Se obtuvieron datos de 10 donantes diferentes (A,B) o 5 donantes diferentes (C) en 10(A,B)o 5 (C) experimentos independientes. Las barras de error indican SD. Esta cifra ha sido modificada de Hartung et al., Cytometry A, 95: 3, p. 332-338 (2019)14. Haga clic aquí para ver una versión más grande de esta figura.
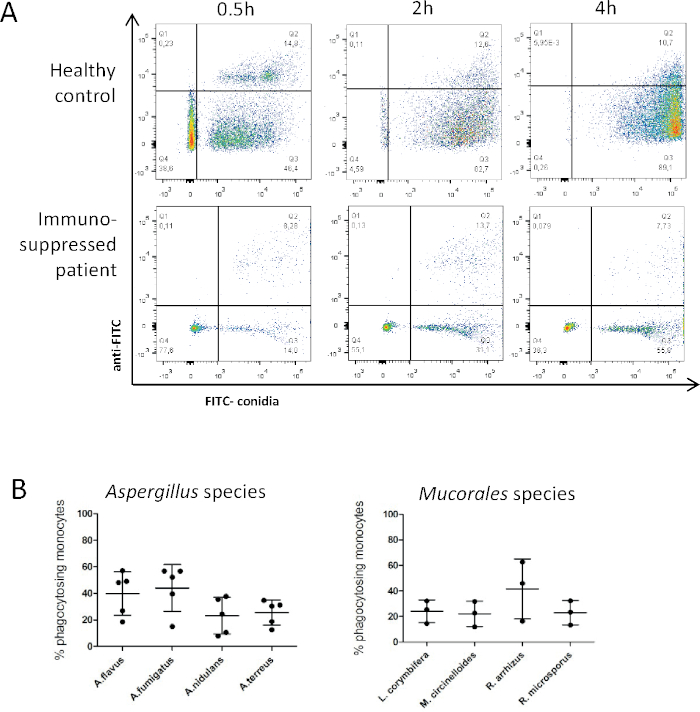
Figura 3: El análisis de la fagocitosis es un medio para evaluar la funcionalidad de los fagocitos primarios humanos y caracterizar los mohos clínicamente relevantes. (A) Comparación ejemplar de monocitos de un donante sano y un paciente inmunosuprimido (después del trasplante de células madre hematopoyéticas) conidia en reposo para 0,5 h, 2 h y 4 h.(B) Se determinó la fagocitosis de conidia fúngica en reposo para especies clínicamente relevantes de Aspergillus y Mucorales después de 2 h de coincubación. Los datos se obtuvieron de 5 (Aspergillus) o 3 (Mucorales) diferentes donantes en 5 o 3 experimentos independientes cada uno. Las barras de error indican SD. Abreviaturas: A. Aspergillus, L. Lichtheimia, M. Mucor, R. Rhizopus Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este protocolo presenta un método citométrico de flujo rápido para medir la interacción de A. fumigatus conidia con un gran número de leucocitos humanos primarios que no es posible en los protocolos microscópicos comunes. Las células de imagen con un microscopio y el recuento manual de conidias internalizadas son engorrosas y se pueden hacer de forma realista solo para unos pocos cientos de células. La citometría de flujo supera este problema midiendo miles de células en cuestión de minutos. Un obstáculo común a ambos enfoques es la distinción de conidia fagocitosed y adherente en o sobre las células, respectivamente. En microscopía, el colorante blanco calcofluor se utiliza a menudo para manchar la conidia adherente, pero su uso se limita a microorganismos con una pared celular que contiene quitina.
Este protocolo, en cambio, utiliza fluoróforos distintos para la caracterización de eventos de interacción que permite la adición de marcadores de celda adicionales, como los marcadores de linaje CD45, CD14 y CD66b. Por lo tanto, también es posible discriminar la fagocitosis de patógenos por monocitos y neutrófilos en una sola muestra. Si bien la elección de marcadores y fluoróforos para la identificación celular se puede adaptar a las necesidades del experimento y a las capacidades del citómetro disponible, se recomienda el uso del anticuerpo específico aPC anti-FITC mencionado en este protocolo, ya que anticuerpos más fiables en nuestras manos.
Dado que los conidios fijados por formaldehído no se internalizan igual mente bien, se recomiendan esporas nativas para los ensayos de fagocitosis. Sin embargo, la conidia nativa comenzará o continuará la hinchazón durante la coincubación con leucocitos humanos y eventualmente germinará. Típicamente, A. fumigatus conidia germina después de aproximadamente 8-9 h en medios que contienen glucosa a 37 oC. La combinación de tiempo de hinchazón y tiempo de co-incubación con fagocitos no debe exceder este período de tiempo, ya que la germinación causa la pérdida de FITC en la superficie de la conidia. Más importante aún, los germlings ya no pueden ser fagocitos por monocitos o neutrófilos. En su lugar, estos fagocitos se acumulan alrededor y se adhieren a los germlings que producen racimos celulares que obstruyen el citómetro, si no se eliminan. Del mismo modo, 4 h conidia hinchada tienden a generar racimos entre sí y con células. A menudo estos clústeres ya no se pueden separar mecánicamente y las celdas dentro se pierden para el análisis citométrico de flujo.
Aunque el gating es sencillo y fácil al principio, cuanto más conidia se internalizan por las células, más borroso puede llegar a ser. El uso de MOI > 2 aumenta la fagocitosis en los puntos de tiempo iniciales, pero también pueden surgir problemas de gating antes. Por lo tanto, los MOI deben determinarse cuidadosamente con las células específicas y los patógenos de interés.
Una limitación de este protocolo está en la dualidad de la población celular con conidiaadherenta (FITC+ APC+) que también podría estar albergando células con conidia adherente e internalizada. Una posibilidad de discriminación adicional es la aplicación de citometría de flujo de imágenes15 que permite imágenes visuales de todas las células medidas en el citometro de flujo.
Debido al etiquetado INespecífico FITC de la pared celular conidial, este método es fácilmente transferible a otros hongos de interés como moldes clínicamente relevantes del género Mucorales o la levadura Candida albicans. Además, también las bacterias portadoras de paredes celulares pueden estar etiquetadas con FITC. El contramanchado universal con el anticuerpo anti-FITC permite la medición rápida y fácil de la fagocitosis de todos estos patógenos por igual por un gran número de leucocitos humanos.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a la Sra. Pia Stier por su excelente asistencia técnica. M. von Lilienfeld-Toal cuenta con el apoyo del Centro de Control y Cuidado de la Sepsis (Ministerio Federal Alemán de Educación y Salud, BMBF, FKZ 01E01002) y el Campus de Investigación Desinfecciosa (BMBF, FKZ 13GW0096D). Thi Ngoc Mai Hoang cuenta con el apoyo de la Escuela de Comunicación Microbiana de Jena (Deutsche Forschungsgemeinschaft, FKZ 214/2)
Materiales
| Name | Company | Catalog Number | Comments |
| Adhesive foil | Brand | 701367 | |
| anti-CD14 V500 | BD Biosciences | 561391 | clone M5E2 |
| anti-CD45 BUV395 | BD Biosciences | 563792 | clone HI30 |
| anti-CD66b PerCP-Cy5.5 | BD Biosciences | 562254 | clone G10F5 |
| anti-FITC APC | ThermoFisher Scientific | 17-7691-82 | clone NAWESLEE |
| Cell culture plate, 12-well | Greiner Bio-one | 665180 | |
| Cell scraper | Bioswisstech | 800020 | |
| Cell strainer, 30 µm | Miltenyi Biotech | 130-098-458 | SmartStrainer |
| Cytometer | BD Biosciences | LSR Fortessa II, lasers: 488 nm (blue), 405 nm (violet), 355 nm (UV) and 640 nm (red) | |
| Detergent | Sigma Aldrich | P1379 | Tween 20, 0.01% in PBS |
| Drigalski spatula | Carl Roth | PC59.1 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma Aldrich | ED3SS-500g | 2 mM in PBS |
| Erythrocyte lysis buffer | 0.15 M NH4Cl, 10 mM KHCO3, 0.1 mM EDTA | ||
| Fetal Calf Serum (FCS) | Biochrom AG | S 0115 | 10% in RPMI 1640 |
| Fluorescein isothiocyanate (FITC) | Sigma Aldrich | F3651-100MG | 0.1 mM in Na2CO3 /PBS solution |
| Formaldehyd | Carl Roth | PO87.3 | Histofix |
| Malt agar (1.5%) | malt extract (40 g), yeast extract (4 g), agar (15 g), Aqua dest. (1 L), adjust pH to 5.7-6.0, sterilise at 121 °C for 35 minutes | ||
| Na2CO3 | Carl Roth | 8563.1 | 0.1 M in PBS |
| Petri dish | Greiner Bio-one | 633180 | |
| Phosphat Buffered Saline (PBS) | ThermoFisher Scientific | 189012-014 | without Calcium, without Magnesium |
| RPMI 1640 | ThermoFisher Scientific | 61870010 | RPMI 1640 Medium, GlutaMAX Supplement |
| Rotator | Miltenyi Biotech | 130-090-753 | MACSmix Tube Rotator |
| Round-bottom tube, 7.5 mL | Corning | REF 352008 | |
| Software for data acquisition and analysis | BD Biosciences | FACSDiva 8.0 | |
| V-bottom plate, 96 well | Brand | 781601 | untreated surface |
Referencias
- Brown, G. D., et al. Hidden killers: human fungal infections. Science Translational Medicine. 4 (165), 113 (2012).
- Brakhage, A. A., Bruns, S., Thywissen, A., Zipfel, P. F., Behnsen, J. Interaction of phagocytes with filamentous fungi. Current Opinion in Microbiology. 13 (4), 409-415 (2010).
- Heinekamp, T., et al. Interference of Aspergillus fumigatus with the immune response. Seminars in Immunopathology. 37 (2), 141-152 (2015).
- Slesiona, S., et al. Persistence versus escape: Aspergillus terreus and Aspergillus fumigatus employ different strategies during interactions with macrophages. PLoS One. 7 (2), 31223 (2012).
- Busetto, S., Trevisan, E., Patriarca, P., Menegazzi, R. A single-step, sensitive flow cytofluorometric assay for the simultaneous assessment of membrane-bound and ingested Candida albicans in phagocytosing neutrophils. Cytometry A. 58 (2), 201-206 (2004).
- Lowe, D. M., et al. A novel assay of antimycobacterial activity and phagocytosis by human neutrophils. Tuberculosis (Edinb). 93 (2), 167-178 (2013).
- Nuutila, J., Lilius, E. M. Flow cytometric quantitative determination of ingestion by phagocytes needs the distinguishing of overlapping populations of binding and ingesting cells. Cytometry A. 65 (2), 93-102 (2005).
- Saresella, M., et al. A rapid evaluation of phagocytosis and killing of Candida albicans by CD13+ leukocytes. Journal of Immunological Methods. 210 (2), 227-234 (1997).
- Fattorossi, A., Nisini, R., Pizzolo, J. G., D'Amelio, R. New, simple flow cytometry technique to discriminate between internalized and membrane-bound particles in phagocytosis. Cytometry. 10 (3), 320-325 (1989).
- Heinzelmann, M., Gardner, S. A., Mercer-Jones, M., Roll, A. J., Polk, H. C. Quantification of phagocytosis in human neutrophils by flow cytometry. Microbiology and Immunology. 43 (6), 505-512 (1999).
- Perticarari, S., Presani, G., Mangiarotti, M. A., Banfi, E. Simultaneous flow cytometric method to measure phagocytosis and oxidative products by neutrophils. Cytometry. 12 (7), 687-693 (1991).
- Sveum, R. J., Chused, T. M., Frank, M. M., Brown, E. J. A quantitative fluorescent method for measurement of bacterial adherence and phagocytosis. Journal of Immunolological Methods. 90 (2), 257-264 (1986).
- de Boer, E. C., Bevers, R. F., Kurth, K. H., Schamhart, D. H. Double fluorescent flow cytometric assessment of bacterial internalization and binding by epithelial cells. Cytometry. 25 (4), 381-387 (1996).
- Hartung, S., et al. Fast and Quantitative Evaluation of Human Leukocyte Interaction with Aspergillus fumigatus Conidia by Flow Cytometry. Cytometry A. 95 (3), 332-338 (2019).
- Fei, C., Lillico, D. M. E., Hall, B., Rieger, A. M., Stafford, J. L. Connected component masking accurately identifies the ratio of phagocytosed and cell-bound particles in individual cells by imaging flow cytometry. Cytometry A. 91 (4), 372-381 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados