Method Article
Na aplicação do sistema de controle remoto para a manipulação da expressão do Gene endógeno de vivo
Neste Artigo
Resumo
Este protocolo descreve as etapas necessárias para gerar um modelo de sistema em que a transcrição de um gene endógeno de interesse pode ser condicionalmente controlada em animais vivos ou células usando reforçada ALC repressor e/ou sistemas de ativador de tet .
Resumo
Aqui descrevemos um protocolo para a implementação do sistema de controle remoto (Reversible Manipulation of Transcription em Endogenous loci), que permite o controle de expressão reversíveis e ajustáveis de uma endógena do gene de interesse na vida modelar sistemas. O sistema de controle remoto emprega sistemas de ativação repressão e tet reforçada ALC para alcançar para baixo - ou upregulation de um gene alvo dentro de um sistema biológico. Repressão apertado pode ser alcançado de repressor vinculação sites flexìvel localizados mais a jusante de um site de início de transcrição por inibição da elongação da transcrição. Upregulation robusto pode ser alcançado por reforçar a transcrição de um gene endógeno pela segmentação ativadores transcricionais de tet à promotora cognata. Este controle de expressão reversível e ajustável pode ser aplicada e retirada repetidamente em organismos. A potência e a versatilidade do sistema, como demonstrado por endógena Dnmt1 aqui, permitirá mais precisas análises funcionais in vivo, permitindo a investigação da função dos genes em vários níveis de expressão e de testes a reversibilidade de uma fenótipo.
Introdução
Nocaute genético ou abordagens transgênicas foram meios eficazes para estudar a função do gene em modelos animais. No entanto, regulação da expressão por essas abordagens é dicotômica (ligar/desligar), não-temporal e, portanto, não é capaz de revelar o espectro completo e funcional de um gene. Tecnologias deimg Cre/L condicionais permitiram inactivação espácio-temporais ou ativação da função do gene, mas sua natureza dicotômica continua a representar limitações, tais como célula letalidade e irreversibilidade1,2 , 3. a fim de preencher esse vazio, abordagens knockdown condicionais têm sido desenvolvidos usando tet-regulada shRNA ou miRNA4. No entanto, o alvo efeitos permanecem uma preocupação para RNAi5 e tem sido um desafio para controlar in vivo. Mais recentemente, CRISPR/Cas-mediada por tecnologias de controle transcricional introduziram uma abordagem mais versátil para alcançar tanto a montante e downregulation da expressão do gene endógeno e demonstrou seus utilitários6,7 . No entanto, a eficácia do controle transcricional mediada CRISPR/Cas desconhece-se ainda na vivo e a reversibilidade da repressão com base em CASCUDO continua a ser visto, tão forte repressão por CASCUDO e sua proteína de interação KAP1 foi mostrada para induzir silenciamento de8,9do gene permanente.
Para lidar com essas limitações, nós desenvolvemos um sistema regulador transcricional romance capaz de Controlar condicionalmente a expressão do gene endógeno em um reversível e forma sintonizável em ratos usando engenharia transcricional procariótico binário sistemas de regulação10. Sistemas reguladores transcricionais binários procarióticos com ligantes reguladoras, tais como lac e tet, permitiram tal reversível e expressão sintonizável controlar11,12,13, 14. no entanto, a potência de repressão inadequada dos sistemas binário atuais tem impedido sua ampla adoção para controlar a expressão do gene endógeno nos mamíferos. Desenvolvemos um sistema de repressão ALC reforçada suficientemente potente para a repressão de genes endógenos e empregou uma estratégia romance de direcionamento tet ativadores transcricionais diretamente para o cognato promotor de um gene endógeno para alcançar upregulation robusto (Figura 1)10. Com esta tecnologia, conseguimos fazer quase duas ordens de magnitude controle de expressão do gene endógeno Dnmt1 numa forma sintonizável, inducible e reversível10. Aqui nós fornecemos instruções passo a passo para a sua aplicação in vivo de outros genes e organismos usando ratos como uma espécie de modelo.
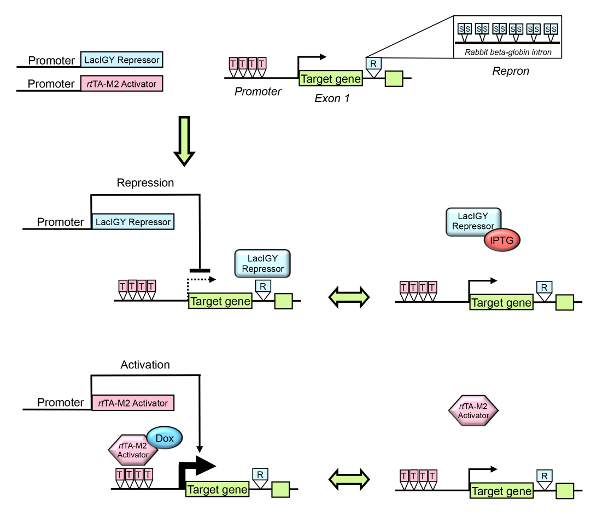
Figura 1 : Visão geral do sistema de controle remoto. A transcrição de um gene endógeno do alvo pode ser regulada usando repressor lac de engenharia e sistemas de ativador de tet . O promotor do gene alvo ou intrão é projetado para conter operadores para o repressor de LacIGY apertado-vinculação e/ou o rtativador TA-M2. R indica Repron (RepCV intrno), que contém 12 operadores simétrica ALC (S) e mais um intrão de beta-globina coelho parcial. T indica o operador tet . O repressor activator é e/ou exprimem-se de um promotor de tecido-específica. A expressão do gene do alvo pode então ser reversível sintonizada para o nível de expressão desejada pela administração de IPTG (isopropil β-D-1-thiogalactopyranoside, um antagonista do repressor LacIGY) ou doxiciclina (Dox). Esta figura foi modificada de Lee et al.10, por favor clique aqui para ver uma versão maior desta figura.
Antes de iniciar este protocolo, rever tabela 1 para identificar as etapas relevantes para o controle desejado da expressão do gene. Por exemplo, provocar um mouse que permite reversível downregulation de "Gene X", completar as seções 1, 3 e 4 da abaixo de protocolo. Tabela 1 também resume os componentes necessários do sistema de controle remoto.
| Mudança de expressão desejada | Repressão apenas | Ativação somente | Tanto a repressão e a ativação |
| Seções relevantes do protocolo | 1, 3-4 | 2-4 | 1-4 |
| Sequência de controle remoto necessária no Gene alvo | Repron ("Intrão repressão"; 12 operadores de ALC simétrica mais um intrão de beta-globina coelho parcial) | Operadores de Tet | Operadores Repron e Tet |
| Localização de sequência de controle remoto | Intrão | Promotor | Intrão & promotor |
| Ativador/Repressor necessário para o controle desejado | LacIGY Repressor | Ativador de rtTA-M2 | LacIGY Repressor e ativador rtTA-M2 |
| Ligantes regulamentares | IPTG | Doxiciclina | IPTG e/ou doxiciclina |
Tabela 1: Visão geral dos componentes de controle remoto.
Protocolo
Todos os procedimentos de animais foram realizados com a aprovação do cuidado institucional do Animal e Comissão de utilização (IACUC) da Universidade do Sul da Califórnia e o Instituto de pesquisa Van Andel e em conformidade com o guia para o cuidado e o uso de animais de laboratório de institutos nacionais de saúde15.
1. modificar o gene de interesse para a repressão por controle remoto
- Usando as diretrizes abaixo, identificar um intrão transcricionalmente inerte no final 5' do gene de interesse para a inserção da sequência de Repron ("RepCV intrna"; 12 operadores de ALC simétrica, mais um intrão de beta-globina coelho parcial). Lembre-se de promotores alternativos para o gene de interesse e escolher um intrão de acordo com o transcript(s) para ser controlado (ou seja, um intrão compartilhado por todas as transcrições ou um específico para uma transcrição desejada).
Nota: Para os genes sem um intrão ou com aqueles no final 3', inserir a sequência de Repron o promotor (Lee, et al.10 para um procedimento detalhado de ver).- Obter a sequência genômica para o gene de interesse.
- Navegue até a UCSC Genome Browser16,17e selecione o mais recente projecto do genoma do rato (Mouse GRCm38/mm10 no momento da publicação), que está atualmente sob a guia de genomas .
- Digite o nome ou símbolo do gene de interesse para a barra de pesquisa para ver as transcrições para o gene. Clique em ir.
- Selecione a variante de transcrição desejada para o gene de interesse.
- Clique no símbolo ao lado da variante de transcrição de interesse (será o símbolo da transcrição previamente selecionado em uma caixa escura) gene.
- Sob a bandeira de sequência e Links para ferramentas e bancos de dados , clique no link de Sequência genômica .
- Para Sequência de recuperação região opções, selecione apenas exões (5' UTR, CDS e 3' UTR), os intrões e o padrão de registro de uma FASTA por gene. Para Sequência de opções de formatação, selecione exões em letras maiusculas, tudo em letras minúsculas e Máscara insiste em N (para esconder sequências repetitivas). Clique em submeter.
- Salvar esta sequência, preservando o superior - e minúsculas, formatação, em um documento ou um programa que pode ser anotado.
- Evite a interrupção de consoles de CpG, que pode indicar regiões com função reguladora do gene.
Nota: Embora um intrão 5' é preferível para a inserção da sequência de Repron, o primeiro intron pode conter elementos reguladores transcriptional tais como consoles de CpG (examinados nesta etapa) ou potenciador elementos (examinados na etapa 1.1.4), que devem ser evitados por Repron inserção.- Sob a bandeira de expressão e Regulamento do UCSC Genome Browser, selecione Mostrar para a faixa de Consoles de CpG e clique em Atualizar.
- -Zoom nos 5' intrões, clique em cada ilha de CpG (mostrada em verde, no momento da publicação, se estiver presente) e selecione View DNA para este recurso.
- Depois de selecionar a máscara se repete para N, selecione obter o DNA para obter a sequência de ilha de CpG.
- Essas sequências de sobreposição com o arquivo original da sequência e anotar estas como regiões intrônicas para evitar devido a funções reguladoras do gene possível.
- Evite a interrupção das não-codificantes RNAs, no caso, eles têm uma função reguladora.
- Sob a bandeira de Genes e previsões de Gene do UCSC Genome Browser, selecione Mostrar para a faixa GENCODE (Ensembl) e clique em Atualizar.
- -Zoom nos 5' intrões, clique sobre cada RNA não-codificante (mostrado em verde, no momento da publicação, se estiver presente) e obter a sequência de DNA de cada um, clicando em suas coordenadas cromossômicas.
- No menu suspenso de exibição , selecione o DNAe clique em máscara repete a N. Clique em obter o DNA.
- Essas sequências de sobreposição com o arquivo original da sequência e anotar estas como regiões intrônicas para evitar devido a funções reguladoras do gene possível.
- Evitar regiões intrônicas com assinaturas potenciador no tissue(s) de interesse, tais como H3K4me1, H3K27ac e DNase eu hipersensibilidade18,19,20,21, bem como a ligação do CTCF sites, que regulam o realçador do loop22,23.
- Navegue até o banco de dados ENCODE24,25e selecione o ícone de experimentos .
- Para o tipo de ensaio, selecione o ChIP-seq ou DNase-seqe preencher as outras categorias (organismo, tipo Biosample, etc.) de acordo com as células para ser projetada.
- Após a seleção de recursos, focalize os pictogramas em azul e selecione aquele para o qual Exibir resultados como lista aparece (pictograma mais à esquerda no momento da publicação).
- Selecione os conjuntos de dados para os alvos de DNase H3K4me1, H3K27ac, eu e CTCF que correspondem mais de perto as células para ser projetada.
- Dentro de cada conjunto de dados relevante, role até a seção de arquivos , verifique se esse mm10 (ou versão mais recente do genoma) e UCSC está selecionado e clique no botão Visualizar .
- Agora na UCSC Genome Browser e zoom nos intrões de 5' para o gene de interesse, clique em cada H3K4me1, H3K27ac, DNase eu e CTCF peak em suas trilhas do pico anotado respectivos.
- Obter a sequência de DNA para cada região de pico clicando em suas coordenadas cromossômicas.
- No menu suspenso de exibição , selecione o DNAe clique em máscara repete a N. Clique em obter o DNA.
- Essas sequências de sobreposição com o arquivo original da sequência e anotar estas como regiões intrônicas para evitar devido a funções reguladoras do gene possível.
- Evite a ruptura do consenso emendando sequências, para não interferir com splicing apropriado os exões.
Nota: Embora sequências necessárias para a emenda são largamente confinadas para cerca de seis bases na extremidade 5' de um intrão26 e cerca de 60 bases em 3' fim27, é aconselhável selecionar um intrão grande, permitindo margens consideravelmente mais ampla a partir desses regiões de consenso para minimizar a probabilidade de impactar o splicing. Recomenda-se o uso de ferramentas de análise intrão, como SVM-BPfinder28, para uma análise mais aprofundada do potencial da tala de sequências.
- Obter a sequência genômica para o gene de interesse.
- Depois de identificar uma região intrônicas que satisfaz os critérios acima (como exemplificado por Dnmt1 nos dados complementares), tela a sequência usando um sgRNA on-line design ferramenta para identificar um sgRNA na região com alta especificidade e previu escores de eficiência.
- Navegar para uma ferramenta de design on-line sgRNA de escolha, como CRISPOR29.
- Digite a sequência da região intrônicas de interesse, especifique o genoma de referência relevantes e selecione o desejado Protospacer adjacentes Motif (PAM). Clique em submeter.
- Classificar o sgRNAs previsto pelo placar de especificidade e selecione um ou mais sgRNAs que também possuem uma alta eficiência prevista marcar29.
- Opcional: Para maximizar a probabilidade de usar um sgRNA eficaz, primeiro testar a eficiência de clivagem de vários sgRNAs top-marcando em um ensaio in vitro de30e proceder com o sgRNA mais eficiente em vivo.
- Criar um modelo de DNA contendo um PITT (baseado em injeção pró-nuclear alvo transgênese) sequência de almofada, como exemplificado em complementar a figura 1A, B, ladeada de ambos os lados por braços de homologia de 60-base que correspondem a sgRNA corte local31 de pouso .
Nota: A área de pouso contém dois sites heterotypic loxP (JT15 e Lox2272) e permite a inserção de alvo de grandes sequências através de uma abordagem em duas fases; Certifique-se de que as junções desta inserção não criam sites enigmática da tala. Alternativamente, uma células-tronco embrionárias (ESC) - TOC com base - na estratégia pode ser usada para inserir a sequência de Repron diretamente. - Preparar o sgRNA, Cas9 proteína e o single-stranded DNA (ssDNA) modelo para a área de pouso e microinjeção em ovos fertilizados (de ratos B6C3F1/J ou outra estirpe desejada) de acordo com protocolos estabelecidos32,33.
- Tela para ratos com desembarque almofada TOC-a.
- Projeto complementar de iniciadores de PCR para o locus genômico, mas fora das regiões alvejadas pelos braços homologia, como demonstrado por Dnmt1 em complementar a Figura 1. Evite repetitivas sequências genomic ao projetar as primeiras demão.
- Extrai o DNA dos clipes de cauda dos ratos de acordo com protocolos estabelecidos34.
- Use o PCR e eletroforese para identificar os ratos com uma inserção de almofada de aterragem do gel.
- Confirme que a batida foi bem sucedida por sequenciamento dos produtos PCR.
Nota: Rearranjos e exclusões grandes indesejadas podem ser introduzidos por CRISPR/Cas935, tão cuidadosa triagem para fora do alvo edição é aconselhável antes de prosseguir,35,36,37.
- Usando ovos fertilizados dos ratos de almofada de aterragem, microinjeção de mRNA iCre38 e um plasmídeo geneticamente modificado que contém a sequência de Repron, ladeada por JTZ17 e Lox2272 recombinação sites31,39,40, 41 de acordo com estabelecido métodos38,42,43.
- Tela para ratos com a inserção de Repron.
- Iniciadores de PCR de projeto complementar para o locus genômico, fora a inserção do Repron. Evite repetitivas sequências genomic ao projetar as primeiras demão.
- Extrai o DNA dos clipes de cauda dos ratos de acordo com protocolos estabelecidos34.
- Uso do PCR e gel de electroforese para identificar os ratos com uma inserção de Repron.
- Confirme que a batida foi bem sucedida por sequenciamento dos produtos PCR.
2. modificar o gene de interesse para upregulation por controle remoto
- Usando as diretrizes abaixo, identifica uma região no promotor do gene de interesse que é improvável que perturbam a função de promotor após inserção de sequências de operador tet . Lembre-se de promotores alternativos para o gene de interesse e escolher um promotor de acordo com o transcript(s) para ser controlado (ou seja, um promotor, compartilhado por todas as transcrições ou um específico para uma transcrição desejada).
- Obter a sequência genômica para o promotor do interesse.
- Navegue até a UCSC Genome Browser16,17e selecione o mais recente projecto do genoma do rato (Mouse GRCm38/mm10 no momento da publicação), que está atualmente sob a guia de genomas .
- Digite o nome ou símbolo do gene de interesse para a barra de pesquisa para ver as transcrições para o gene. Clique em ir.
- Selecione a variante de transcrição desejada para o gene de interesse.
- Clique no símbolo ao lado da variante de transcrição de interesse (gene será o símbolo da transcrição previamente selecionado em uma caixa escura) gene.
- Sob a bandeira de sequência e Links para ferramentas e bancos de dados , clique no link de Sequência genômica .
- Para Sequência de recuperação região opções, selecione apenas o promotor/Upstream por 1000 bases. Para Sequência de opções de formatação, selecione Máscara repete a N (para esconder sequências repetitivas). Clique em submeter.
- Salve esta sequência de promotor em um documento ou um programa que pode ser anotado.
- Selecionadas regiões livres de locais de ligação do fator de transcrição putativo, como interromper essas sequências podem alterar a expressão de gene endógeno.
- Navegue até a UCSC Genome Browser e abra a versão mais recente do genoma do rato.
- Acima o banner de mapeamento e sequenciamento , selecione rastrear cubos.
- Clique mm10 ao lado do nome de cubo de JASPAR 2018 TFBS (ou versão mais recente de JASPAR).
- Digite o nome ou símbolo do gene de interesse para a barra de pesquisa para ver as transcrições para o gene. Clique em ir.
- Selecione a variante de transcrição desejada para o gene de interesse.
- Desloque-se para o banner de JASPAR 2018 TFBS e clique na seta suspensa para selecionar a opção de visualização desejada para a pista, como esmagar. Clique em Atualizar.
- Zoom na região promotora do gene de interesse e identificar as regiões que estão livres (ou relativamente livre) de locais de ligação do fator de transcrição de acordo com a faixa JASPAR. Grave as coordenadas cromossômicas destas regiões.
- Obter a sequência genômica destas coordenadas cromossômicas digitá-los na barra da busca e clicando em ir. No menu suspenso de exibição , selecione o DNAe clique em máscara repete a N. Clique em obter o DNA.
- Essas sequências de sobreposição com o arquivo original da sequência e anotar estas como regiões de promotor ideal para alvo devido à falta de ligação do fator de transcrição.
- Dentro destas sequências, selecione uma região promotora perturbable que é contra a corrente, mas perto do local de início de transcrição do gene de interesse.
Nota: Uma inserção que está muito perto do que site de início de transcrição pode aumentar a chance de prejudicar a atividade do promotor, mas uma inserção que é longe demais pode diminuir o nível de regulação alta. Inserção de sequências de operador tet cerca de 200 basepairs a montante do local de início da transcrição resultou em robusto upregulation dos dois promotores testado (ver discussão)10.
- Obter a sequência genômica para o promotor do interesse.
- Região promotora selecionado usando uma ferramenta de design de sgRNA on-line para identificar um sgRNA na região com alta especificidade e eficiência previsto scores de tela.
- Navegar para uma ferramenta de design on-line sgRNA de escolha, como CRISPOR29.
- Digite a sequência da região de interesse, especifique o genoma de referência relevantes e selecione o desejado Protospacer adjacentes Motif (PAM). Clique em submeter.
- Classificar o sgRNAs previsto pelo placar de especificidade e selecione um ou mais sgRNAs que também possuem uma alta eficiência prevista marcar29.
- Opcional: Para maximizar a probabilidade de usar um sgRNA eficaz, primeiro testar a eficiência de clivagem de vários sgRNAs em um ensaio in vitro de30e proceder com o sgRNA mais eficiente em vivo.
- Cria um modelo de DNA que contém operadores tet flanqueados de ambos os lados por braços de homologia de 60-base que correspondem a sgRNA corte local31,33.
Nota: O número de operadores de tet é personalizável; inserção de duas a quatro sequências de operador de tet em tandem anteriormente foi mostrada para ser eficaz, mas em princípio mais operadores são desejáveis para a condução de maior expressão. Alternativamente, uma estratégia baseada em ESC bater-no pode ser usada para inserir os operadores de tet .- Opcional: Para que as alterações propostas não provavelmente interromperá a atividade transcricional endógena do gene de interesse de evidências experimentais, clonar a sequência de promotor projetado em um vetor de luciferase de vaga-lume (tais como pGL3-Basic), e Compare sua eficácia para o promotor original usando um ensaio de luciferase.
- Preparar o sgRNA, proteína Cas9 e o modelo do ssDNA que contém as sequências de operador tet e microinjeção em ovos fertilizados (de ratos B6C3F1/J ou outra estirpe desejada) de acordo com protocolos estabelecidos32,33.
Nota: Devido à complexidade de sintetizar uma sequência repetitiva, uma abordagem baseada na transcrição de transcrição in vitro/reverso é recomendada para sintetizar um modelo ssDNA de uma dupla-hélice (dsDNA) de DNA plasmídeo44. Alternativamente, um modelo de dsDNA pode ser utilizado para microinjeção, mas a batida-em eficiência pode ser reduzida de45. - Tela para ratos com TOC-in dos operadores tet .
- Iniciadores de PCR de projeto complementar para o locus genômico, fora das regiões alvejado pelos braços homologia. Evite repetitivas sequências genomic ao projetar as primeiras demão.
- Extrai o DNA dos clipes de cauda dos ratos de acordo com protocolos estabelecidos34.
- Uso do PCR e gel de electroforese para identificar os ratos com a inserção dos operadores tet .
- Confirme que a batida foi bem sucedida por sequenciamento dos produtos PCR.
Nota: Rearranjos e exclusões grandes indesejadas podem ser introduzidos por CRISPR/Cas935, tão cuidadosa triagem para fora do alvo edição é aconselhável antes de prosseguir,35,36,37.
3. desenvolver o ativador e / ou ratos repressor-expressando
- Identifica um promotor robustamente expressando para o tissue(s) ou célula tipo (s) de interesse.
Nota: Uma pesquisa bibliográfica e o promotor de tecido-específica de banco de dados46 podem ser útil para identificar tal um promotor. - Coloque a melhorada fornecida ALC repressor ou sequência de ativador tet a jusante do promotor desejado para gerar uma construção transgênica.
- Produzir a linha (s) rato transgénico usando os procedimentos padrão de transgénicos42,,43,47. Alternativamente, uma abordagem de transgênese site-specific pode ser usada para evitar efeitos de posição e permitir a cópia única do transgene inserção31,48.
- Propagar os fundadores e determinar o padrão de expressão e o nível do transgene na prole de cada fundador. Selecione linhas com expressão robusta no tipo de tecido pretendido (s) para mais de reprodução.
- Os fundadores a sua ratos se reproduzem.
- Iniciadores de PCR de projeto que irão detectar a inserção do ativador e/ou repressor.
- Extrai o DNA dos clipes de cauda da descendência de acordo com protocolos estabelecidos34.
- Use o PCR e eletroforese para identificar os ratos com a inserção do gel.
- Confirme a inserção do transgene por sequenciamento dos produtos do PCR.
- Propagar as linhas transgénicas.
- Sacrificar alguns filhotes de cada linha e coletar os tecidos de interesse por qRT-PCR, imunohistoquímica e/ou mancha ocidental para analisar a expressão do gene/proteína de interesse nos tipos de tecido alvo.
- Selecione as linhas com a expressão mais forte nos tecidos de interesse para uso na seção 4.
4. manipular a expressão de gene in vivo
- Os ratos com o gene modificado de interesse (seção 1 e/ou 2) com os ratos transgénicos da seção 3, de acordo com práticas de reprodução estabelecida49se reproduzem. Para controle de expressão máxima, reproduzem os ratos a homozigotia para o alelo modificado.
- Para reversão ou ajuste da repressão do gene alvo, administre IPTG na água potável.
- Para determinar experimentalmente a dose de IPTG usar, tratar os ratos do genótipo apropriado e controles com dentre uma gama de doses (recomendado iniciar intervalo: 0 – 400 mM IPTG) pelo menos uma semana50,51. Incluir pelo menos três ratos por grupo de tratamento e selecione a idade e o sexo de ratos que são mais relevantes para as experiências futuras planejadas. Nota: Casais reprodutores de ratos podem ser tratados com água IPTG para fornecer uma exposição do desenvolvimento de IPTG para a prole se desejado13, ou ratos podem começar o tratamento a qualquer momento após o nascimento.
- Dissolver a massa desejada de IPTG em água destilada esterilizada no dia da administração e mexa com uma barra de agitar por 5 minutos ou até dissolver totalmente.
- Embrulhe a garrafa com papel alumínio e administrar a água IPTG em um frasco protegido contra luz. Substitua duas vezes por semana. Fornece a mesma fonte de água para os ratos recebendo 0 mM IPTG.
- Depois de pelo menos uma semana, sacrificar os ratos e analisar a expressão do gene de interesse no tissue(s) de destino usando qRT-PCR, imunohistoquímica e/ou mancha ocidental.
- Identificar a dose que restaura a expressão do gene de interesse para que de sua controles e usar esta dose para alcançar expressão normal do gene em experiências futuras.
- Para determinar experimentalmente a dose de IPTG usar, tratar os ratos do genótipo apropriado e controles com dentre uma gama de doses (recomendado iniciar intervalo: 0 – 400 mM IPTG) pelo menos uma semana50,51. Incluir pelo menos três ratos por grupo de tratamento e selecione a idade e o sexo de ratos que são mais relevantes para as experiências futuras planejadas. Nota: Casais reprodutores de ratos podem ser tratados com água IPTG para fornecer uma exposição do desenvolvimento de IPTG para a prole se desejado13, ou ratos podem começar o tratamento a qualquer momento após o nascimento.
- Para indução do gene upregulation, administre doxiciclina (Dox) na dieta.
- Para determinar experimentalmente a concentração de Dox para administrar, tratar ratos do genótipo apropriado e controles com uma concentração de gama de Dox (recomendado iniciar intervalo: 0 – 5000mg/kg Doxycycline Hyclate) pelo menos uma semana52 ,53, incluindo pelo menos três ratos por grupo de tratamento. Compra de Dox, contendo alimentos de rato de um fornecedor comercial.
Nota: Casais de ratos podem ser tratada com Dox alimentos para fornecer uma exposição do desenvolvimento da Dox para a prole se desejado54,55, ou ratos podem começar o tratamento a qualquer momento após o nascimento. - Substitua a dieta uma vez por semana. Fornece a mesma dieta de base aos ratos recebendo alimento livre de Dox.
- Depois de pelo menos uma semana, sacrificar os ratos e analisar a expressão do gene de interesse no tissue(s) de destino usando qRT-PCR, imunohistoquímica e/ou mancha ocidental.
- Identificar a dose que eleva a expressão do gene de interesse para o nível desejado e usar esta dose para atingir a superexpressão do gene em experiências futuras.
- Para determinar experimentalmente a concentração de Dox para administrar, tratar ratos do genótipo apropriado e controles com uma concentração de gama de Dox (recomendado iniciar intervalo: 0 – 5000mg/kg Doxycycline Hyclate) pelo menos uma semana52 ,53, incluindo pelo menos três ratos por grupo de tratamento. Compra de Dox, contendo alimentos de rato de um fornecedor comercial.
Resultados
A capacidade de repressão do sistema de controle remoto tem sido demonstrada em duas abordagens diferentes, até agora. Na primeira abordagem, sítios de ligação de repressor lac foram inseridos no promotor do gene da Dnmt1 endógeno. A segunda abordagem, que é recomendada pelo presente protocolo, os sítios de ligação do repressor foram inseridos em um intrão a jusante para evitar o risco potencial de afetar a função de promotor pela inserção e, desse modo, para simplificar a aplicação do controle-remoto sistema. Ambas as abordagens resultaram na bem sucedida repressão (Figura 2A, B e Figura 3A-C)10. DNMT1 expressão foi reprimida a 15% dos níveis não regulamentados usando a abordagem baseada em promotor(Figura 2). Essa repressão apertado foi revertida de forma dose-dependente por tratamento de ratos com quantidades variadas de IPTG(Figura 2). A repressão Dnmt1 observada foi validada a nível de proteína por imunocoloração (Figura 2B). Não observamos qualquer diferença perceptível na expressão de Dnmt1 entre Dnmt1+ + e Dnmt1LO/LO ratos, confirmando que nossa inserção de operador do lac não tinha interrompido promotor normal função10. A abordagem baseada em intrão alcançado mais de repressão de 90% dos operadores localizado diversos kilobases a jusante do local de início da transcrição se atenuar a transcrição do alongamento (Figura 3A, B)10. Essa abordagem baseada em intrão mais foi validada em sete promotores de robustos adicionais (Figura 3C). Repressão invariavelmente apertado foi alcançado de todos os promotores testados. Nenhuma correlação entre os níveis de expressão residual e os pontos fortes dos promotores foi observada, sugerindo que a capacidade de repressão de nosso sistema de repressão baseado em intrão excede a potência transcriptional de todos os promotores robustos testamos ( Figura 3 C).
A capacidade de regulação alta in vivo do sistema de controle remoto também foi demonstrada no gene Dnmt1 . Duas cópias do operador tet introduzido o promotor Dnmt1 , juntamente com sequências de operador do lac , para permitir a regulação alta ou downregulation dependendo qual effector proteína está presente. Upregulation robusto e downregulation de expressão de Dnmt1 , perto de duas ordens de magnitude (10% a 650%), foram alcançados na CES contendo o alelo modificado de Dnmt1 endógeno (Dnmt1LGT)(Figura 4)10 . Ambos os regulamentos foram totalmente reversíveis e inducible por tratamentos de IPTG e Dox, respectivamente(Figura 4). Em seguida apresentamos a modificação de Dnmt1LGT para testar a capacidade de regulação alta in vivo do sistema de controle remoto da linha germinal rato. Observou-se uma forte regulação alta de Dnmt1 desde o fígado, baço e rins, Considerando que nenhum upregulation detectável no coração foi observada (Figura 4B)7. O padrão de expressão de ciclo celular dependente de Dnmt1 e a escassez de células proliferativas no coração podem subjacentes a esta observação10,56. Remanesce ser visto se essa limitação pode ser superada pelo aumento do nível de expressão do ativador ou o número de seus sítios de ligação.

Figura 2 : Na vivo repressão de Dnmt1 pelo repressor LacIGY. (A) ratos com operadores de ALC (LO) inseridos o promotor Dnmt1 , com ou sem expressão de LacIGY, foram tratados com diferentes doses de IPTG. análise de qRT-PCR de Dnmt1 expressão mostra a inversão de dose-dependente da repressão Dnmt1 in vivo por tratamento de IPTG. Cada barra representa dados de um mouse diferente. Dados representam média ± SEM (n = 3). (B) imunocoloração de Dnmt1 proteína nas criptas do cólon de ratos fornecida água potável, com ou sem 160 mM IPTG por 3 semanas. Esta figura foi modificada de Lee et al.10, por favor clique aqui para ver uma versão maior desta figura.

Figura 3 : Na vivo e repressão in-vitro de vários promotores pelo sistema de controle remoto. (A), uma versão inicial da sequência de Repron (R *) foi inserido um intrão a jusante do promotor Villin em um rato transgénico Villin-mKate2 (VilmKate2). análise de qRT-PCR de expressão mKate2 no intestino delgado de ratos com ou sem o repressor de LacIGY é mostrado. Cada barra representa dados de um mouse diferente. (B) mKate2 Confocal imagens do intestino delgado com e sem expressão de LacIGY . (C) os seis operadores simétrica ALC (S) foram inseridos entre vários promotores e um repórter do luciferase. Repórteres (50 ng/bem em placa de 96 poços) e repressor plasmídeos transitoriamente foram introduzidos em células NIH/3T3 na proporção molar de 1:1. Luciferase valores foram avaliado 24 h depois do transfection. Estas dados in vitro representam a porcentagem de expressão do luciferase em LacIGY-expressando células em relação aqueles expressando não funcionais Laureano (NFlacI). T-testes foram usados para determinar a significância estatística. Dados representam média ± SEM (n = 3). P ≤ 0,05, * *P ≤ 0.01. Esta figura foi modificada de Lee et al.10, por favor clique aqui para ver uma versão maior desta figura.

Figura 4 : Para baixo e / ou upregulation de expressão Dnmt1 in vitro e in vivo. (A) o sistema completo de controle remoto foi projetado em CES cultivadas por abordagens de segmentação e eletroporação de gene. Máxima repressão da expressão de Dnmt1 foi alcançado sem tratamento enquanto máxima ativação foi alcançada pelo tratamento tanto IPTG e Dox. Dados representam média ± SEM (n = 3). P ≤ 0,05, * *P ≤ 0.01 (Welch t-testes). (B) ativação In vivo de Dnmt1 pelo sistema de controle remoto, como demonstrado por imunocoloração de Dnmt1 proteína em vários tecidos de ratos controle remoto. O alelo LGT representa modificação promotor de Dnmt1 para conter os locais de ligação ativador de operador e tet ALC . Os ratos foram tratados com uma dieta normal ou contendo Dox (Doxycycline Hyclate 5000 mg/kg) por um mês. Esta figura foi modificada de Lee et al.10, por favor clique aqui para ver uma versão maior desta figura.
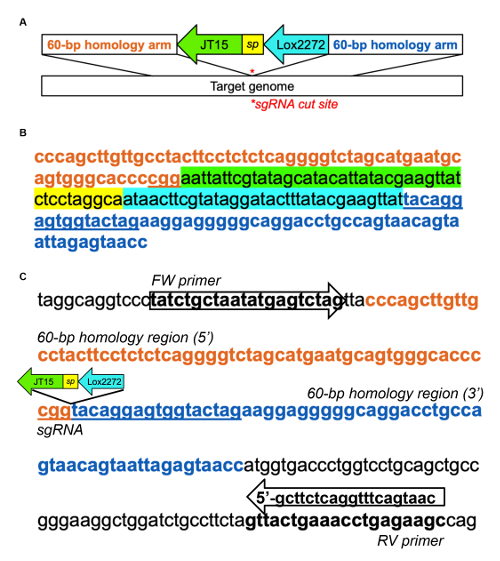
Complementar Figura 1 : Exemplo de inserção de almofada de aterragem em murino intrão Dnmt1 1. (A) esquema do modelo de DNA para aterrar a inserção de almofada, adaptada de Quadros et al (2015)31. Sites heterotypic loxP , JT15 e Lox2272, são separados por uma sequência curta do espaçador (sp) e flanqueados de cada lado por 60-bp de DNA que é homóloga à região genômica de alvo. (B) amostra de DNA modelo para desembarque inserção de almofada para o intrão Dnmt1 usando o seguinte sgRNA: CTAGTACCACTCCTGTACCG (que tem como alvo a vertente inversa). A região selecionada intrônicas foi bioinformatically informado pela etapa 1.1, e o sgRNA foi identificado usando o CRISPOR29. (C) exemplo de projeto da primeira demão PCR para avaliar a inserção da área de pouso. Iniciadores de PCR foram concebidos fora os braços de homologia do modelo para confirmar a integração no endógeno Dnmt1. A sua PCR amplicons é 213 bp; após a inserção, torna-se 291 dom clique aqui para ver uma versão maior desta figura.
Discussão
Um passo crítico e limitação potencial do sistema de controle remoto é o desafio que está associado com a inserção do repressor e/ou locais obrigatórios de ativador sem afetar a expressão do gene alvo. Nossa abordagem original de repressão, como aplicado ao gene Dnmt1 , envolveu inserção dos sítios de ligação do repressor lac dentro regiões transcricionalmente críticas de um promotor. Para reduzir o risco de afetar a função de promotor e, portanto, para melhorar a aplicabilidade geral do sistema de controle remoto, desenvolvemos uma abordagem baseada em intrão repressão. A potência do nosso sistema de reforço ALC permitiu-nos firmemente a reprimir a transcrição de todos os promotores fortes que testamos em operadores localizados centenas de diversos kilobases a jusante da transcrição iniciar sites (Figura 3A – C) 10. importante, os níveis de repressão eram independentes das forças transcriptional dos promotores (Figura 3A – C)10. Isto sugere que a capacidade de repressão de nosso sistema de repressão baseado em intrão excede a força transcriptional dos promotores testados. Essa abordagem baseada em intrão, é provável que a repressão é mediada através de interferência física entre dois componentes, a máquina de alongamento de transcrição e a ALC repressores57. Este mecanismo simples repressão e a robustez demonstrada do método baseado em intrão podem tornar essa abordagem geralmente aplicáveis aos organismos, tecidos e genes diferentes.
O upregulation pelo sistema de controle remoto requer as sequências de ligação liberada para estar em proximidade com o promotor do gene alvo, que implica um risco de afetar a função de promotor. No entanto, encontramos que a posição de ligação a sequências pode ser fora da região transcricionalmente crítica. Promotores de tanto Dnmt1 e EF1α foram robustamente upregulated de tet operadores localizado um par de cem bases rio acima da transcrição iniciar sites10. Essa restrição relaxada reduz bastante a chance de afetar a função de promotor de um gene alvo na ausência da liberada. Aumentando o número de ligação a sequências e/ou uso de transactivators mais fortes pode ajudar a reduzir ainda mais o risco, permitindo a regulação alta de sites mais distante longe do local de início de transcrição.
Nosso sistema de controle remoto fornece controle elegante do nível, sincronismo e localização da expressão do gene endógeno, permitindo testar a reversibilidade de um fenótipo e as consequências dos níveis de expressão diferente, que não são facilmente alcançáveis por atual em tecnologias de controle de expressão de gene vivo. É importante notar que, na maioria das análises de expressão de gene, incluindo a nossa, expressão valores representam a média de uma população de células entre as quais uma variação considerável pode ser encontrada. Esta heterogeneidade pode influenciar processos de tomada de decisão celulares, tais como diferenciação ou apoptose58. Embora a precisão do controle de expressão de gene provavelmente poderia ser melhorada pelo circuito genéticos adicionais engenharia59, a potência observada do nosso atual sistema permitirá investigação útil da função dos genes em muitos contextos biológicos. Além disso, espera-se um elevado grau de especificidade do alvo por causa da complexidade de sequências de operador, bem como a grande distância evolutiva entre mamíferos e a espécie originário dos componentes regulatórios60. Além disso, linhas de rato transgénico dos repressores e ativadores podem ser desenvolvidas e empregadas para qualquer gene endógeno. Por exemplo, modelos de rato liberada tet existentes podem ser adaptados para realizar a regulação alta de um gene alvo nos tecidos do mouse desejado. Recentemente desenvolvemos uma linha de transgênica que poderá conduzir a robusta expressão tecido-específica de nosso repressor lac reforçada em vários tipos de tecido quando combinado com linhas existentes do Cre introduzindo o gene lacIGY para o locus Hipp11 48 sob o controle de um elemento de Lox-STOP-Lox (não publicado). Esta linha substancialmente facilitaria a aplicação de tecido-específica do sistema de controle remoto.
Gene upregulation pelo sistema de controle remoto oferece várias vantagens em comparação com as abordagens atuais de transgénicas inducible. Não requer geração de múltiplas linhas transgénicas para testar os efeitos da posição da inserção, como ele utiliza o locus endógeno. Além disso, essa abordagem é well-suited para upregulation de genes com expressão de base forte porque aumenta a expressão de um promotor já robusto, Considerando que modelos transgénicos convencionais dependem mínimos promotores virais. Por último, o tecido especificidade, controle do ciclo celular e variantes de um gene alvo de emenda podem ser mantidos com upregulation pela nossa abordagem, que conserva elementos de regulação natural como inata cis-elementos reguladores. O advento da tecnologia de gene-alvo CRISPR/Cas-mediada facilitará grandemente a aplicação desta tecnologia em sistemas de diversos modelo.
Divulgações
PWL serve nas placas consultivo científico de AnchorDx e Progenity, Inc.
Agradecimentos
Agradecemos a tarde Dr Heidi Scrable pelo seu generoso presente da construção de gene de mamífero Laureano (Mayo Clinic, Rochester, MN), Dr Daniel Louvard (Institut Curie, Paris, França) para fornecer o promotor Villin e Dr Laurie Jackson-Grusby (Hospital infantil, Boston, MA) por suas contribuições para as fases iniciais de desenvolvimento desta tecnologia. Estamos gratos por Dr Nancy Wu e Dr Robert Maxson por sua assistência na geração de ratos transgênicos e nocaute. Agradecemos os membros do laboratório Laird para discussões úteis e apoio. Este trabalho foi financiado pelos institutos nacionais de saúde [CA75090 R01 R01 DA030325, R01 CA157918 e R01 CA212374 para P.W.L. e 1F31CA213897-01A1 para N.A.V.S].
Materiais
| Name | Company | Catalog Number | Comments |
| B6C3F1/J | The Jackson Laboratory | 100010 | https://www.jax.org/strain/100010 |
| Cas9 Protein | PNA Bio | CP04 | http://www.pnabio.com/products/CRISPR_Cas9.htm?gclid=EAIaIQobChMIsoG8pLL33QIVBr7ACh0naQ4dEAAYAiAAEgKyHvD_BwE |
| CRISPOR | Haeussler et al. 2016 | http://crispor.tefor.net/ | |
| Doxycycline-Containing Mouse Diet | Envigo | Varies by concentration | https://www.envigo.com/products-services/teklad/laboratory-animal-diets/custom-research/doxycycline-diets/ |
| ENCODE Database | Stanford University | https://www.encodeproject.org/ | |
| iCre mRNA synthesis plasmid (pBBI) | Addgene | 65795 | https://www.addgene.org/65795/ |
| IPTG | GoldBio | I2481C | https://www.goldbio.com/search?isSearch=Y&q=iptg |
| pGL3-Basic | Promega | E1751 | https://www.promega.com/products/reporter-assays-and-transfection/reporter-vectors-and-cell-lines/pgl3-luciferase-reporter-vectors/?catNum=E1751 |
| SVM-BPfinder | Regulatory Genomics, Pompeu Fabra University | http://regulatorygenomics.upf.edu/Software/SVM_BP/ | |
| TiProD: Tissue specific promoter Database | Department of Bioinformatics, UMG, University of Göttingen | http://tiprod.bioinf.med.uni-goettingen.de | |
| UCSC Genome Browser | University of California Santa Cruz | https://genome.ucsc.edu/ |
Referências
- Jackson-Grusby, L., et al. Loss of genomic methylation causes p53-dependent apoptosis and epigenetic deregulation. Nature Genetics. 27 (1), 31-39 (2001).
- David, G., Turner, G. M., Yao, Y., Protopopov, A., DePinho, R. A. mSin3-associated protein, mSds3, is essential for pericentric heterochromatin formation and chromosome segregation in mammalian cells. Genes & Development. 17 (19), 2396-2405 (2003).
- Sumi-Ichinose, C., Ichinose, H., Metzger, D., Chambon, P. SNF2beta-BRG1 is essential for the viability of F9 murine embryonal carcinoma cells. Molecular and Cellular Biology. 17 (10), 5976-5986 (1997).
- Premsrirut, P. K., et al. A rapid and scalable system for studying gene function in mice using conditional RNA interference. Cell. 145 (1), 145-158 (2011).
- Qiu, S., Adema, C. M., Lane, T. A computational study of off-target effects of RNA interference. Nucleic Acids Research. 33 (6), 1834-1847 (2005).
- Gilbert, L. A., et al. Genome-Scale CRISPR-Mediated Control of Gene Repression and Activation. Cell. 159 (3), 647-661 (2014).
- Konermann, S., et al. Genome-scale transcriptional activation by an engineered CRISPR-Cas9 complex. Nature. 517 (7536), 583-588 (2015).
- Peng, H., Ivanov, A. V., Oh, H. J., Lau, Y. F., Rauscher, F. J. Epigenetic gene silencing by the SRY protein is mediated by a KRAB-O protein that recruits the KAP1 co-repressor machinery. The Journal of Biological Chemistry. 284 (51), 35670-35680 (2009).
- Groner, A. C., et al. KRAB-zinc finger proteins and KAP1 can mediate long-range transcriptional repression through heterochromatin spreading. PLOS Genetics. 6 (3), 1000869(2010).
- Lee, K. H., Oghamian, S., Park, J. A., Kang, L., Laird, P. W. The REMOTE-control system: a system for reversible and tunable control of endogenous gene expression in mice. Nucleic Acids Research. 45 (21), 12256-12269 (2017).
- Gossen, M., Bonin, A. L., Bujard, H. Control of gene activity in higher eukaryotic cells by prokaryotic regulatory elements. Trends in Biochemical Sciences. 18 (12), 471-475 (1993).
- Hu, M. C., Davidson, N. The inducible lac operator-repressor system is functional in mammalian cells. Cell. 48 (4), 555-566 (1987).
- Cronin, C. A., Gluba, W., Scrable, H. The lac operator-repressor system is functional in the mouse. Genes & Development. 15 (12), 1506-1517 (2001).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Council, N. R. Guide for the Care and Use of Laboratory Animals: Eighth Edition. , The National Academies Press. (2011).
- Casper, J., et al. The UCSC Genome Browser database: 2018 update. Nucleic Acids Research. 46 (1), 762-769 (2018).
- Church, D. M., et al. Lineage-specific biology revealed by a finished genome assembly of the mouse. PLOS Biology. 7 (5), 1000112(2009).
- Creyghton, M. P., et al. Histone H3K27ac separates active from poised enhancers and predicts developmental state. Proceedings of the National Academy of Sciences of the United States of America. 107 (50), 21931-21936 (2010).
- Heintzman, N. D., et al. Histone modifications at human enhancers reflect global cell-type-specific gene expression. Nature. 459 (7243), 108-112 (2009).
- Heintzman, N. D., et al. Distinct and predictive chromatin signatures of transcriptional promoters and enhancers in the human genome. Nature Genetics. 39 (3), 311-318 (2007).
- Rada-Iglesias, A., et al. A unique chromatin signature uncovers early developmental enhancers in humans. Nature. 470 (7333), 279-283 (2011).
- Handoko, L., et al. CTCF-mediated functional chromatin interactome in pluripotent cells. Nature Genetics. 43 (7), 630-638 (2011).
- Splinter, E., et al. CTCF mediates long-range chromatin looping and local histone modification in the beta-globin locus. Genes & Development. 20 (17), 2349-2354 (2006).
- The ENCODE Project Consortium. An integrated encyclopedia of DNA elements in the human genome. Nature. 489 (7414), 57-74 (2012).
- Rosenbloom, K. R., et al. ENCODE data in the UCSC Genome Browser: year 5 update. Nucleic Acids Research. 41, Database issue 56-63 (2013).
- Murray, J. I., Voelker, R. B., Henscheid, K. L., Warf, M. B., Berglund, J. A. Identification of motifs that function in the splicing of non-canonical introns. Genome Biology. 9 (6), 97(2008).
- Taggart, A. J., et al. Large-scale analysis of branchpoint usage across species and cell lines. Genome Research. 27 (4), 639-649 (2017).
- Corvelo, A., Hallegger, M., Smith, C. W., Eyras, E. Genome-wide association between branch point properties and alternative splicing. PLOS Computational Biology. 6 (11), 1001016(2010).
- Haeussler, M., et al. Evaluation of off-target and on-target scoring algorithms and integration into the guide RNA selection tool CRISPOR. Genome Biology. 17 (1), 148(2016).
- Grainger, S., et al. CRISPR Guide RNA Validation In Vitro. Zebrafish. 14 (4), 383-386 (2017).
- Quadros, R. M., Harms, D. W., Ohtsuka, M., Gurumurthy, C. B. Insertion of sequences at the original provirus integration site of mouse ROSA26 locus using the CRISPR/Cas9 system. FEBS Open Bio. 5, 191-197 (2015).
- Harms, D. W., et al. Mouse Genome Editing Using the CRISPR/Cas System. Current Protocols in Human Genetics. 83, (2014).
- Miura, H., Quadros, R. M., Gurumurthy, C. B., Ohtsuka, M. Easi-CRISPR for creating knock-in and conditional knockout mouse models using long ssDNA donors. Nature Protocols. 13 (1), 195-215 (2018).
- Laird, P. W., et al. Simplified mammalian DNA isolation procedure. Nucleic Acids Research. 19 (15), 4293(1991).
- Kosicki, M., Tomberg, K., Bradley, A. Repair of double-strand breaks induced by CRISPR-Cas9 leads to large deletions and complex rearrangements. Nature Biotechnology. 36 (8), 765-771 (2018).
- Akcakaya, P., et al. In vivo CRISPR editing with no detectable genome-wide off-target mutations. Nature. 561 (7723), 416-419 (2018).
- Lazzarotto, C. R., et al. Defining CRISPR-Cas9 genome-wide nuclease activities with CIRCLE-seq. Nature Protocols. 13 (11), 2615-2642 (2018).
- Ohtsuka, M., et al. Improvement of pronuclear injection-based targeted transgenesis (PITT) by iCre mRNA-mediated site-specific recombination. Transgenic Research. 22 (4), 873-875 (2013).
- Ohtsuka, M., et al. Pronuclear injection-based mouse targeted transgenesis for reproducible and highly efficient transgene expression. Nucleic Acids Research. 38 (22), 198(2010).
- Lee, G., Saito, I. Role of nucleotide sequences of loxP spacer region in Cre-mediated recombination. Gene. 216 (1), 55-65 (1998).
- Thomson, J. G., Rucker, E. B., Piedrahita, J. A. Mutational analysis of loxP sites for efficient Cre-mediated insertion into genomic DNA. Genesis. 36 (3), 162-167 (2003).
- Cho, A., Haruyama, N., Kulkarni, A. B. Generation of Transgenic Mice. Current Protocols in Cell Biology. , Chapter Unit-19.11 (2009).
- Pu, X. A., Young, A. P., Kubisch, H. M. Production of Transgenic Mice by Pronuclear Microinjection. Methods in Molecular Biology. 1874, 17-41 (2019).
- Murgha, Y., et al. Combined in vitro transcription and reverse transcription to amplify and label complex synthetic oligonucleotide probe libraries. Biotechniques. 58 (6), 301-307 (2015).
- Quadros, R. M., et al. Easi-CRISPR: a robust method for one-step generation of mice carrying conditional and insertion alleles using long ssDNA donors and CRISPR ribonucleoproteins. Genome Biology. 18 (1), 92(2017).
- Chen, X., Wu, J. M., Hornischer, K., Kel, A., Wingender, E. TiProD: the Tissue-specific Promoter Database. Nucleic Acids Research. 34, Database issue 104-107 (2006).
- Haruyama, N., Cho, A., Kulkarni, A. B. Overview: Engineering transgenic constructs and mice. Current Protocols in Cell Biology. , Chapter Unit-19.10 (2009).
- Tasic, B., et al. Site-specific integrase-mediated transgenesis in mice via pronuclear injection. Proceedings of the National Academy of Sciences of the United States of America. 108 (19), 7902-7907 (2011).
- JoVE Science Education Database. Lab Animal Research. Fundamentals of Breeding and Weaning. Journal of Visualized Experiments. , (2018).
- Wyborski, D. L., DuCoeur, L. C., Short, J. M. Parameters affecting the use of the lac repressor system in eukaryotic cells and transgenic animals. Environmental and Molecular Mutagenesis. 28 (4), 447-458 (1996).
- Wyborski, D. L., Short, J. M. Analysis of inducers of the E.coli lac repressor system in mammalian cells and whole animals. Nucleic Acids Research. 19 (17), 4647-4653 (1991).
- Traykova-Brauch, M., et al. An efficient and versatile system for acute and chronic modulation of renal tubular function in transgenic mice. Nature Medicine. 14 (9), 979-984 (2008).
- Michel, G., Mosser, J., Fauran, F. Serum kinetics of doxycycline polyphosphate in dogs. European Journal of Drug Metabolism and Pharmacokinetics. 4 (1), 43-48 (1979).
- Bertocchi, I., et al. Regulatory functions of limbic Y1 receptors in body weight and anxiety uncovered by conditional knockout and maternal care. Proceedings of the National Academy of Sciences of the United States of America. 108 (48), 19395-19400 (2011).
- Plageman, T. F., Lang, R. A. Generation of an Rx-tTA: TetOp-Cre knock-in mouse line for doxycycline regulated Cre activity in the Rx expression domain. PLOS One. 7 (11), 50426(2012).
- Mollova, M., et al. Cardiomyocyte proliferation contributes to heart growth in young humans. Proceedings of the National Academy of Sciences of the United States of America. 110 (4), 1446-1451 (2013).
- Ptashne, M. Principles of a switch. Nature Chemical Biology. 7 (8), 484-487 (2011).
- Balazsi, G., van Oudenaarden, A., Collins, J. J. Cellular decision making and biological noise: from microbes to mammals. Cell. 144 (6), 910-925 (2011).
- Nevozhay, D., Zal, T., Balazsi, G. Transferring a synthetic gene circuit from yeast to mammalian cells. Nature Communications. 4, 1451(2013).
- Labow, M. A., Baim, S. B., Shenk, T., Levine, A. J. Conversion of the lac repressor into an allosterically regulated transcriptional activator for mammalian cells. Molecular and Cellular Biology. 10 (7), 3343-3356 (1990).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados