Method Article
O modelo de infecção Waxworm Galleria mellonella para candidíase disseminada
Neste Artigo
Resumo
Galleria mellonella serve como um modelo de invertebrados para candidíase disseminada. Aqui, detalhamos a infecção do protocolo e fornecer dados de apoio para a eficácia do modelo.
Resumo
Espécies de Candida são comensais fungos comuns dos seres humanos colonizando a pele, mucosas e trato gastrointestinal. Sob certas condições, a Candida pode overgrow seus nichos naturais resultando em debilitantes infecções da mucosa como infecções sistêmicas bem como risco de vida, que são um grande foco de investigação devido a seus associados altas taxas de mortalidade. Existem modelos animais de infecção disseminada para estudar a progressão da doença e dissecando as características de patogenicidade da Candida . Destes, o modelo de infecção waxworm Galleria mellonella fornece uma ferramenta de experimental cost-effective para investigações de alta produtividade de virulência sistêmica. Muitos outros agentes infecciosos bacterianos e eukaryotic têm sido efetivamente estudados em mellonella g. para entender a patogenicidade, tornando-se um sistema de modelo amplamente aceito. Ainda, variação no método usado para infectar mellonella g. pode alterar os resultados fenotípicos e complicar a interpretação dos resultados. Aqui, podemos descrever os benefícios e as desvantagens do modelo waxworm para estudar a patogênese de Candida sistêmica e uma abordagem para melhorar a reprodutibilidade de detalhe. Nossos resultados destacam a variedade de cinética de mortalidade em g. mellonella e descrevem as variáveis que podem modular esses cinética. Em última análise, este método permanece como uma abordagem ética, rápida e econômica para estudar a virulência em um modelo de candidíase disseminada.
Introdução
Espécies de Candida são comensais humanas comuns que são capazes de emergir como patógenos oportunistas em severamente imunocomprometidos e pacientes disbióticas. Embora muitas espécies de Candida podem causar doença, c. albicans é a causa mais prevalente de candidíase disseminada1,2. Doença sistêmica resulta da c. albicans acessando na corrente sanguínea através de qualquer penetração directa das barreiras restritivas anteriormente anfitrião ou introdução em sítios cirúrgicos e outras violações do corpo3. Espécies de Candida utilizam uma variedade de processos patogênicos para causar doença sistêmica dentro do host, incluindo filamentação, formação de biofilmes, evasão de células imunes e fuga e ferro4de eliminação. Existem em vitro abordagens para investigar mecanismos patogénicos individuais, mas modelos animais continuam a fornecer a melhor opção para investigar a totalidade do resultado de doença5,6. Pesquisas anteriores detalhou muitas instâncias do promissor em vitro investigações de virulência falhando reproduzir na vivo7,8. Assim, modelos animais ainda são necessários para avaliar a virulência in vivo. A maioria dos modelos da doença dependem de ratos para servir como um substituto para infecções humanas apesar da incapacidade de c. albicans naturalmente colonizar sistemas murino como um comensal9. Modelos de invertebrados de candidíase disseminada incluem o nematódeo Caenorhabditis elegans, a fruta voa melanogaster da drosófilae o waxworm Galleria mellonella, embora as preocupações sobre diferenças fundamentais em fisiologia básica, a temperatura do corpo hospedeiro e rotas de exposição têm dificultado sua ampla aceitação10,11.
Mais recentemente, foi adotado o modelo de infecção de waxworm g. mellonella a patogenicidade de modelo de uma vasta gama de patógenos bacterianos e fúngicos12,13,14. Vantagens deste modelo incluem sua taxa de transferência de custo relativamente baixo, maior facilidade de uso e reduziram as preocupações éticas sobre animal beneficência em relação aos modelos de murino. Para os pesquisadores, isso se traduz em maior capacidade de testar várias variáveis, intervalos de confiança mais fortes, mais rápida experimentação e desvio dos protocolos de animais. G. mellonella tem servido como uma plataforma para avaliar rapidamente a virulência de c. albicans após perturbação de genes necessários para regulamento de gene, filamentação e formação de biofilme em isolados clínicos11,15 ,16. Estudos recentes têm incorporado a investigação da eficácia antifúngica usando mellonella g. para avaliar a farmacocinética da droga atividade e resistência sob configurações na vivo , que são outro modo desafiador e demorado 17,18. Ainda, estudos de virulência de c. albicans em g. mellonella tem sido complicados por alegadamente altos níveis de variação dentro de experiências e protocolos inconsistentes entre grupos de pesquisa que produzem diferentes fenótipos de virulência entre ratos e waxworms11,13,19,20,21. Aqui, nós esboçamos um mellonella g. protocolo para padronizar a reprodutibilidade de aumento de infecções, de c. albicans em experimentos de virulência e demonstrar coerência com o descrito anteriormente estudos de virulência em murino modelos.
Estudos anteriores demonstraram que a c. albicans acasalamento como tipo (MTL) locus no cromossomo 5 regula a identidade da célula e competência semelhante ao Saccharomyces cerevisiae e outros de fungos ascomicetes22de acasalamento. A maioria dos isolados de c. albicans é heterozigota para o locus MTL , codificação um de cada dos MTLum e MTLα alelos (MTLum/α) e é consequentemente estéril15, 23 , 24. a perda de um dos alelos MTL através da perda de heterozigosidade (LOH) ou mutação leva à homozigotos MTLuma MTLα estirpes ou podem sofrer uma mudança fenotípica do estado estéril 'branco' para a acasalamento de Estado competente 'opaco'25. Trabalhos anteriores evidenciou que a perda de heterozigosidade MTL também reduz virulência em modelos murino de infecção sistêmica através de tensão diferentes origens26. Aqui, detalhamos o modelo g. mellonella para candidíase disseminada, usando um conjunto experimental geneticamente semelhante para retratar o contributo da heterozigosidade MTL de virulência em mellonella g.. Mostramos que a configuração de MTL influenciado patogenicidade de c. albicans , onde cepas MTLα foram menos virulentas em relação tantoum/α MTLe MTLuma células, semelhantes às conclusões dentro de modelo murino de infecção26.
Protocolo
Todos os métodos descritos dependem do uso de hospedeiros invertebrados e não requerem aprovação institucional Cuidado Animal e usar Comité (IACUC).
1. larvas de Waxworm galleria mellonella
- Ordem de larvas de atacadistas e fornecedores que não introduza hormonas, antibióticos ou outros tratamentos para as larvas e que são capazes de enviar e entregar espécimes vivos.
- Certifique-se de comprar todas as larvas do mesmo fornecedor durante o curso da experimentação. Tenha cuidado quando encomendar larvas durante os meses de verão, como temperaturas superiores a 30 ° C diminuem a viabilidade de larvas.
- Monitorar temperaturas em toda a rota de transporte esperado e planejar o transporte e a entrega em conformidade ou escolher transporte acelerado para minimizar sua exposição a condições ambientais.
- Quando as larvas chegam, verificar cada recipiente para assegurar-se de larvas viáveis e saudáveis estão presentes. As larvas saudáveis vão ser completamente submersa sob a roupa de cama, movendo-se e possuem uma leve coloração amarelo/tan com poucas larvas que contém marcas pretas ou descolorações ao longo do corpo.
- Armazenar as larvas em seu recipiente em um espaço ventilado, à temperatura ambiente (25 ° C). Dependendo da condição inicial das larvas, eles podem ser usados por até duas semanas.
2. cultura preparação para a Galleria mellonella infecção
Nota: Traje de laboratório apropriado deve ser usado em toda esta parte do protocolo incluindo luvas, jaleco e óculos de segurança.
- Fazer glicose de peptona levedura (YPD) líquido e ágar placas. Prepare 1 x salina tamponada fosfato (PBS) e soluções de etanol 70%.
- Crescem as cepas de C. albicans deve ser injetado durante a noite em 3 mL de YPD fresco em tubos de cultura padrão em um tambor rotativo em velocidade média e 30 ° C.
- Gire as células para baixo a 2.500 x g por 5 min em um centrifugador do tabletop. Decantar o líquido sobrenadante, tomando cuidado para não perturbar o centrifugado.
- Ressuspender as células totalmente em 5 mL de 1X PBS pipetagem repetidas ou num Vortex. Repeti a centrifugação e a ressuspensão das células em PBS mais duas vezes para assegurar a remoção de todos os meios de cultura.
- Após uma lavagem final, Ressuspender as células em 1 mL de PBS e transfira para um tubo de microcentrifugadora.
- Realizar um conjunto de diluições em série em PBS para gerar um 1: 100, 1:1, 000 e a série de diluição de 1: 100.000.
Nota: Diluições alternativas podem ser necessárias para atingir a contagem de células desejado.- Usando um hemocytometer, conte as células da 1: 100 ou a diluição do 1:1,000. Mais frequentemente, a diluição de 1:1,000 fornece que a célula apropriada conta para culturas de c. albicans .
- Calcule a concentração total de células dentro da cultura inicial usando a grade matemática do hemocytometer, apontando para entre 30-300 células a serem contados na grade de 5 x 5 central. Um contador de célula automatizada pode ser usado como uma alternativa; no entanto, a utilização de densidade óptica para determinar a contagem de células é desencorajado como morfologia celular (tamanho, forma, etc.) pode afetar significativamente sua precisão.
- Usando a contagem de células medido, fazer uma nova diluição de 2.5x107 células/mL de 1X PBS em um tubo de microcentrifugadora. Esta diluição servirá como base para cada inoculação do mellonella g. com c. albicans. Cada injecção exigirá 10 µ l de inóculo este para uma dose infecciosa de 250.000 células de c. albicans .
- Confirme a exatidão da dose infecciosa por chapeamento o volume correto de diluição 1: 100.000 para 100 unidades formadora de Colônia (CFUs) no ágar YPD para cada cultura a ser usado na infecção.
- Incubar as placas de contagem celular do passo 2.7 por 48 horas (h) a 30 ° C e contar o número de colônias por placa. Entre 80 e 120 colônias constitui uma faixa aceitável para a exatidão no inóculo.
3. infecção de larvas de Galleria mellonella com culturas de Candida
Nota: Traje de laboratório apropriado deve ser usado em toda esta parte do protocolo incluindo luvas, jaleco e óculos de segurança.
- Adicione 1 mL de etanol 100% e 1 mL de 1X PBS para dois tubos de microcentrifuga separado. O etanol e PBS serão usado para lavar a agulha de injeção entre infecções.
- Espalhe uma pequena quantidade de waxworm de cama em um vazio, 100 x 15mm Petri estéril, que vai abrigar as larvas após inoculação para cada estirpe independente. Adição da cama limita adesão dos mortos mellonella g. larvas para a superfície da placa de Petri.
- Esterilize um 26 G, seringa de 10 µ l por ocupar e Expurgando 10 µ l de etanol a 70% três vezes seguido por três lavagens com 10 µ l de 1X PBS. A diluição de inoculação de c. albicans e toma acima de 10 µ l de cultura de vórtice. Certifique-se de que não há nenhuma bolha de ar dentro da seringa, como injeção de ar promove a morte e vai complicar a análise a jusante.
- Abrir um contêiner segurando as larvas mellonella g. e cuidadosamente virar camas com um dedo para descobrir as larvas. Selecione as larvas que estão de boa saúde, conforme identificado pelo movimento ativo, cor amarelo/tan clara e uma falta de pigmentação preta sobre o corpo de larvas. Essas larvas devem ser de tamanho similar em todo o completo experimental definidas.
- Pegar um único larvas e segure suavemente entre o dedo índice/médio e o polegar semelhante a segurar um lápis. Rode as larvas em sua parte traseira para que as pernas são voltada para cima. Segure o comprimento do corpo entre os dedos e o polegar para que as larvas é incapaz de encaracolar ou afastar a injeção.
Nota: Se desejar, esterilize o local da injeção, usando um cotonete de algodão embebido em álcool etílico 100%. - Gire a seringa para que bisel da agulha virado para e insira lentamente a ponta da agulha incluindo o comprimento do bisel no corpo na junção com a perna esquerda mais recuada. Certifique-se que a agulha penetra no corpo e não simplesmente empurrar o corpo para dentro as larvas. Não utilize força em penetrar o corpo como a agulha pode perfurar completamente as larvas rapidamente. Levantar suavemente com a agulha irá confirmar a penetração adequada. Injetar o inóculo de Candida completa 10 µ l e extrair a agulha.
- Repita a etapa 3.3-3.5 para cada larvas. Para evitar a célula, fixando-se, vórtice a Candida culturas para inoculação após cada terceira injeção. Como um controle, injete um conjunto de g. mellonella com 10 µ l de 1X PBS.
- Casa co 10 larvas injetadas da mesma cultura Candida em cada prato de Petri 100 x 15mm após a inoculação. Incube as larvas a 37 ° C durante oito dias, verificando as larvas cada 24h para monitorar a morte.
- Avaliar a mortalidade inicialmente pela pigmentação escura, a formação de manchas negras ou corpos e a falta de movimento. Para confirmar a mortalidade, use uma pinça para Rode suavemente o moribundas larvas em sua parte traseira e poke levemente inferior das larvas com uma pinça. Não-responsividade como observado por falta de movimento de corpo ou perna visível é marcado como a morte e as larvas são removidas da caixa de Petri.
- Registro de mortalidade de larvas ao longo do tempo. As larvas que começam a empupar em traças podem ser incluídas na análise, mas devem ser removidas se eles começam a muda. Larvas de pupating podem ser censuradas de análise de ponto de extremidade como as diferenças de virulência entre larvas e pupa são claras.
- Avalie a significância estatística usando estatística teste de Mantel-Cox.
Resultados
Aqui, vamos demonstrar um método reprodutível para o uso de waxworms g. mellonella para investigar um modelo de candidíase disseminada de infecção usando c. albicans. O armazenamento adequado, manutenção e seleção de larvas para infecção são um componente crítico do garantindo a reprodutibilidade em mellonella g. mortalidade (Figura 1A). As larvas saudáveis que estão ativas, têm uma luz cor de amarelo/tan, e patches falta preto no corpo devem ser usados para este sistema e são normalmente viável para a infecção até duas semanas após a chegada. Para minimizar quaisquer efeitos potencialmente confundimento de mellonella g. fisiologia, as larvas foram selecionadas de tamanho e peso semelhantes. Um inóculo bem misturado e injeção consistente no mesmo local anatômico do corpo larvas também destacam como variáveis importantes na promoção da reprodutibilidade entre experiências. Imagens de vitrine manutenção de larvas infectadas através da duração de experimentação (Figura 1B).
Para avaliar o impacto da idade de larvas na virulência, infecções de controle separadas PBS foram realizadas com larvas zero ou dez dias depois de chegar. Nenhuma diferença significativa na cinética de morte g. mellonella existia entre estes grupos(Figura 2). Sinais característicos da doença surgiram em larvas de ambos os grupos que sucumbiram à infecção; a coloração originalmente amarelo/tan das larvas tornou-se descoloridos e deu lugar a manchas negras antes de perda total de motilidade e, eventualmente, morte (Figura 2B). Infecção por c. albicans acelera este processo de descoloração e morbidade, mas não altera significativamente a cascata de marcadores fenotípicos, levando à morte em comparação com as larvas não infectadas ou larvas de PBS injetado (Figura 2C).
A dose infecciosa também significativamente impactos cinética de mortalidade das infecções mellonella g. . Para avaliar os efeitos do tamanho do inóculo de c. albicans , estamos infectados mellonella g. com quatro diferentes isolados clínicos (12 C, P60002, P75010 e SC5314: tabela 1) em três doses diferentes. As larvas infectadas com SC5314 exibido mortalidade em todas as doses, consistentes com maior patogenicidade desta isolado em relação à maioria dos outros usado dentro do experimento (Figura 2D). Larvas mais sucumbiram à infecção com 1,0 x 105 SC5314 ou C 12 células comparado a 1,0 x 104 células. A dose mais elevada de 1,0 x 106 células provou excessivamente letal com larvas morrendo após infecção de todas as estirpes, incluindo os menos virulentos isolados, P60002 e 12 C. As larvas injetadas com P75010 e SC5314 sucumbiram à infecção dentro de 24 h, sugerindo que uma dose infecciosa mais moderada é apropriada determinar diferenças na virulência. Consequentemente, uma dose infecciosa de 2.5x105 foi usada para todas as experiências subsequentes.
Para demonstrar a similaridade na virulência entre murino e mellonella g. modelos de doença sistêmica, analisada virulência de estirpes de SC5314-derivado c. albicans codificação também heterozigoto (um/α ou homozigotos (um/ou Α /-) MTL loci. Infecção de g. mellonella com MTL heterozigotos de seu fundo genético prototrophic de derivados BWP17 ou o SC5314 produzido a altas taxas de mortalidade em comparação com animais PBS-injetado. Três quartos das larvas controle sobreviveram ao dia 8, em comparação com a perda de mais que metade de todos os animais de c. albicans injetado dentro de 3 dias pós infecção (dpi) que aumentou ainda mais em 8 dpi (Figura 3A, 3B). Infecção com BWP17 umedecido c. albicans letalidade neste modelo (sobrevivência de 27% em comparação com 4% de sobrevivência em SC5314 MTL heterozigotos em 8 dpi; Figura 3 C, 3D). G. mellonella larvas infectadas com MTLα /-cepas sobrevividas significativamente mais tempo em comparação com as cepas parentais heterozigotas de MTL (log-rank test, SC5314; p = 0,0006, BWP17; p = 0,0002). Curiosamente, virulência de MTLumacélulas/-C. albicans correspondido sua contraparte heterozigoto MTL em fundos de ambos os SC5314 e BWP17. Assim, MTL configuração tem uma influência na virulência de c. albicans com MTLα /-cepas exibindo diminuição da matança em comparação comum/α MTLou MTLum/-células.
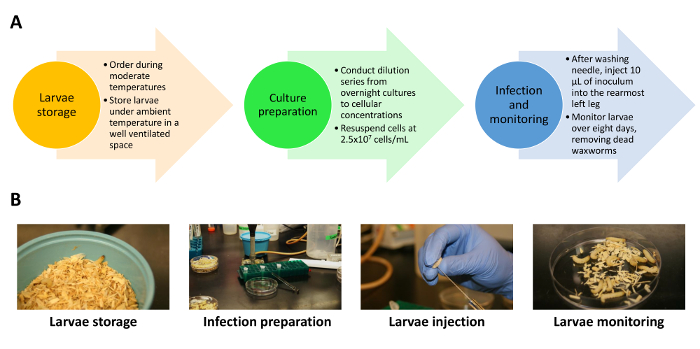
Figura 1 . Visão geral do processo de infecção. (A) um fluxograma destaca os elementos-chave do processo de infecção, incluindo a ordenação e o armazenamento de larvas, preparação de cultura de infecção e injeção. (B) imagens representativas mostram condições de armazenamento saudável, preparação da manutenção de espaço, a injeção e larvas de infecção após a infecção. Clique aqui para ver uma versão maior desta figura.
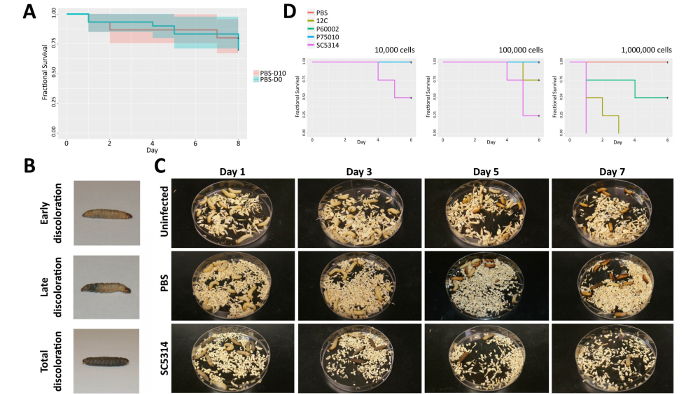
Figura 2 . Os efeitos dos procedimentos de infecção mellonella g. . (A) PBS controles foram infectados ou imediatamente após a chegada (PBS-D0, azul) ou após 10 dias (PBS-D10, vermelho). (B) imagens representativas destacam morte e descoloração de larvas. (C) uma série de imagem de infecção placas detalhar os efeitos da injeção com PBS (médio) ou com SC5314 (inferior) em comparação com larvas não infectadas (top) nos dias 1, 3, 5 e 7, depois da injeção. (D) efeitos de dosagem são mostrados dentro de uma coleção de isolados clínicos. Clique aqui para ver uma versão maior desta figura.
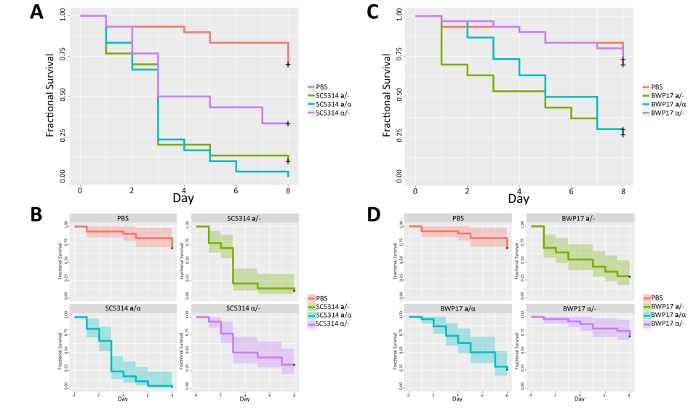
Figura 3 . O MTLum alelo promove matança de c. albicans de g. mellonella. MTL locus heterozigotos (um/α) e homozigotos (um/- e α /-) SC5314 (A) e BWP17 (C) derivados são plotados para mortalidade de larvas ao longo de oito dias. Intervalos de confiança são plotados para cada SC5314 (B) e BWP17 (D) tensão derivado para destacar a consistência na cinética de mortalidade de larvas através de experimentos. A média (linha contínua) é plotada com desvios-padrão (preenchidos no espaço) para três réplicas biológicas de 10 larvas cada. Clique aqui para ver uma versão maior desta figura.
| Estirpe de Candida | Estirpe parental | Genótipo | MTL | Referência |
| MAY1 | SC5314 | Clínico isolado de Candida albicans | a/α | Wu et al 2007 |
| MAY6 | P60002 | Clínico isolado de Candida albicans | um/a | Wu et al 2007 |
| MAY11 | P75010 | Clínico isolado de Candida albicans | a/α | Wu et al 2007 |
| MAY15 | 12C | Clínico isolado de Candida albicans | um/a | Wu et al 2007 |
| MAY61 | SC5314 | MTLa:: SAT1 | Α /- | Este estudo |
| MAY71 | SC5314 | MTLα:: SAT1S tac1::TAC1-GFP-HYGR | um /- | Este estudo |
| MAY313 | BWP17 | ura3Δ::λimm434/ura3Δ::λimm434 his1::hisG/his1::hisG arg4::hisG/arg4::RS-arg4-ura3-BN sir2::his1/sir2::dpl200 | a/α | Este estudo |
| MAY314 | BWP17 | ura3Δ::λimm434/ura3Δ::λimm434 his1::hisG/his1::hisG arg4::hisG/arg4::RS-ARG4-URA3-BN sir2::HIS1/sir2::dpl200 | Α /- | Este estudo |
| MAY315 | BWP17 | ura3Δ::λimm434/ura3Δ::λimm434 his1::hisG/his1::hisG arg4::hisG/arg4::RS-ARG4-URA3-BN sir2::HIS1/sir2::dpl200 | um /- | Este estudo |
Tabela 1. C. albicans strens utilizados neste estudo.
| Componente variável | Controle sugerido | Referência |
| Idade de larvas no momento da injeção | Minimizar o tempo entre a chegada do worm e inoculação | Este estudo |
| Tamanho de larvas no momento da injeção | Assegurar a coerência ao selecionar vermes | Fuchs et al 2010 |
| Saúde de larvas no momento da injeção | Ordem de vermes durante condições de temperatura moderada, usar imediatamente após a chegada | Este estudo |
| Dose infecciosa com c. albicans | Selecione uma concentração infecciosa que apresenta a mais ampla gama de resultados | Este estudo |
| Resposta de larvas para injeção | Realizar controles de injeção PBS ao lado de vermes com nenhuma injeção | Hirakawa et al 2015 |
Tabela 2. Considerações sobre mellonella g. infecção.
Discussão
O modelo de waxworm g. mellonella permanece como uma ferramenta eficaz para a análise rápida e reprodutível de virulência de c. albicans . Este protocolo detalhado baseia-se no momento da entrega consistente de uma dose infecciosa definida para o mesmo site através de um lote de larvas. Dose infecciosa tem um profundo impacto sobre a mortalidade mellonella g. Considerando que a utilização de larvas entre sua chegada inicial e dez dias após a recepção produziu resultados semelhantes. Perda do c. albicansMTLum alelo resulta em diminuição da virulência consistente com experiências anteriores em ratos, embora interrupção do alelo α MTLnão alterou a morte de larvas.
O resultado de infecções mellonella g. pode ser significativamente afetado pelo desenho experimental. Em contraste com os vertebrados modelos de infecção, a pequena variação no local da injeção, inóculo volume e tamanho do inóculo pode impactar interpretações dos dados. Infecções com o aumento do número de células de c. albicans levados a morbidade maior e mais rápida de larvas infectadas. A certa altura, injetáveis muitas c. albicans parece capaz de sobrecarregar as defesas do hospedeiro levando a morte rápida do hospedeiro, potencialmente através de choque tóxico. No entanto, SC5314 foi consistentemente o mais virulento em todas as doses, seguido por 12C e, em seguida, as outras estirpes. Assim, parâmetros de infecção tem um profundo impacto sobre a cinética absoluta das infecções, mas ainda podem fornecer estimativas de virulência relativa. Trabalho prévio dentro dessas experiências mais demonstrou a importância de lavar completamente as células de Candida . YPD residual incluído no bólus de injeção significativamente diminui a sobrevivência de larvas (dados não mostrados).
Saúde do worm é uma variável crítica quando conduzindo experimentos mellonella g. . As larvas transportadas usando padrão frete no meio do verão, muitas vezes chegam prematuramente envelhecido ou estressado, coberto com manchas pretas, com diminuição da viabilidade. Nenhum papel significativo para o tamanho de larvas na morbidade tem sido observado anteriormente embora os experimentos descritos aqui focado na análise do larvas de massa equivalente. Larvas saudáveis e PBS controle larvas devem sempre ser executadas juntamente com grupos de infecção para contabilizar quaisquer alterações na viabilidade de larvas entre réplicas biológicas realizadas em dias separados. G. mellonella infectados 10 dias depois de chegar correspondência a cinética de larvas infectadas imediatamente após o recebimento. Assim, uma única transferência de larvas pode fornecer suficiente material e tempo para realizar experiências completa. Estas experiências confiam 30 animais por tensão para determinar diferenças de virulência, que é significativamente mais animais que geralmente utilizada em modelos murino, resultando em mais forte confiança dos resultados observados11,27 , 28. este modelo também reduziu as preocupações éticas, tempo e custos em relação aos vertebrados modelos de infecção. Assim, o uso de larvas de cera pode facilitar a identificação dos efeitos menores na virulência sistêmica do que é possível em outros sistemas.
Limitações inerentes ao sistema g. mellonella existem que limitam sua utilidade no estudo de interações patógeno-hospedeiro. Primeiro, g. mellonella falta um sistema imune adaptativo e não pode ser usado para investigar a antigenicidade ou memória imunológica como maior eucariontes29. O corpo das larvas é composto de uma única cavidade contínua repleta de hemolinfa, qual função circular nutrientes, sinalização moléculas, células do sistema imunológico e peptídeos antimicrobianos. Estas células do sistema imunológico, hemócitos, se comportam da mesma forma que os neutrófilos e podem, portanto, fagocitam, gerar rajadas oxidativas e secretam enzimas líticas após ativação através de de receptores de reconhecimento de patógeno extracelular30. No entanto, esta função é um subconjunto de processos de célula imune inata dentro sistemas de cavernas que podem não refletir totalmente todas as atividades dos leucócitos. Outra ressalva importante é a falta de um assembly de genoma para mellonella g. embora o genoma foi recentemente sequenciado31. Consequentemente, a extensão da diversidade genotípica dentro da espécie é desconhecida e provavelmente a maioria dos fornecedores navio populações geneticamente heterogêneas que podem afetar a mortalidade através de experimentos. Além disso, técnicas moleculares não existe para o organismo e complicar qualquer tentativa de dissecar as contribuições de anfitrião para a patogênese. Ainda, resultados de virulência consistente após infecção por c. albicans através de experimentos, fornecedores, tempo e laboratórios suporta sua utilidade em questões fundamentais da patogenicidade.
Perda de MTLuma reduzida virulência de c. albicans em relação a MTL heterozigotos e MTLα homozigotia planos de fundo. Esta tendência é consistente com trabalhos anteriores realizados utilizando modelos de rato de virulência sistêmica26. Em contraste com os modelos murino, perda de MTLα não alterou a virulência em relação a MTLuma/α parental estirpe. A discrepância entre estes resultados é obscura, mas pode incluir componentes da imunidade adaptativa que estão faltando em organismos invertebrados. Alternativamente, maior virulência associada com MTL heterozigosidade pode ser atribuível apenas para o alelo MTLα em SC5314, potenciando a necessidade de avaliação através de múltiplas origens de estirpe. Portanto, sugerimos um papel diferencial de virulência entre os dois alelos MTL .
Em geral, o modelo g. mellonella serve como modelo para avaliar a candidíase sistêmica rápido e reprodutível. Outras leituras de virulência podem ser analisadas com este modelo, incluindo prevalência fúngica por chapeamento homogenate de larvas para formadoras de unidades (CFUs)11 ou bioluminescência, que também fornece localização fúngicas32. No futuro, este modelo pode ser expandido para avaliar as características de virulência de outras espécies de Candida , tais como a resistência de droga elevados na recém emergente de espécies de Candida auris 33. Continuação do desenvolvimento de ferramentas para visualizar linfócitos dentro g. mellonella interagindo com infecção por Candida, linhagens puras waxworm para reduzir a variabilidade nos resultados de infecções e visualização do processo infeccioso através repórter Candida linhas34 mais vai aperfeiçoar este modelo de doença e permitir mais profundas investigações in vivo interações patógeno-hospedeiro.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Os autores gostaria de reconhecer a ajuda de Pamela Washington e Leah Anderson na obtenção de Galleria mellonella para uso neste estudo.
Materiais
| Name | Company | Catalog Number | Comments |
| Galleria mellonella | Snackworms.com | Buy twice as many worms as expected to use | |
| 10 uL, Model 1701 N SYR Cemented needle, 26G, type 2 syringe | Hamilton | 80000 | |
| Petri dish, 100X15 mm, 500 pack | Fisher | FB0875712 | |
| Microcentrifuge tube, 1.7 mL, 500 pack | VWR | 87003-294 | |
| Phosphate Buffered Saline (Biotechnology grade), 500 mL | VWR | 97062-818 | |
| Ethanol absolute, ≥99.5% pure, 500 mL | Millipore Sigma | EM-EX0276-1S | |
| autoclaved ddH2O |
Referências
- Kauffman, C. A., et al. Prospective multicenter surveillance study of funguria in hospitalized patients. The National Institute for Allergy and Infectious Diseases (NIAID) Mycoses Study Group. Clinical Infectious Diseases. 30 (1), 14-18 (2000).
- Horn, D. L., et al. Epidemiology and outcomes of candidemia in 2019 patients: data from the prospective antifungal therapy alliance registry. Clinical Infectious Diseases. 48 (12), 1695-1703 (2009).
- Pfaller, M. A., Diekema, D. J. Epidemiology of invasive candidiasis: a persistent public health problem. Clinical Microbiology Reviews. 20 (1), 133-163 (2007).
- Sardi, J. C., Scorzoni, L., Bernardi, T., Fusco-Almeida, A. M., Mendes Giannini, M. J. Candida species: current epidemiology, pathogenicity, biofilm formation, natural antifungal products and new therapeutic options. Journal of Medical Microbiology. 62, 10-24 (2013).
- Segal, E., Frenkel, M. Experimental in Vivo Models of Candidiasis. J Fungi (Basel). 4 (1), (2018).
- Conti, H. R., Huppler, A. R., Whibley, N., Gaffen, S. L. Animal models for candidiasis. Current Protocols in Immunology. 105, 11-17 (2014).
- Heymann, P., et al. The siderophore iron transporter of Candida albicans (Sit1p/Arn1p) mediates uptake of ferrichrome-type siderophores and is required for epithelial invasion. Infection and Immunity. 70 (9), 5246-5255 (2002).
- Priest, S. J., Lorenz, M. C. Characterization of Virulence-Related Phenotypes in Candida Species of the CUG Clade. Eukaryotic Cell. 14 (9), 931-940 (2015).
- Savage, D. C., Dubos, R. J. Localization of indigenous yeast in the murine stomach. J Bacteriol. 94 (6), 1811-1816 (1967).
- Ewbank, J. J., Zugasti, O. C. elegans: model host and tool for antimicrobial drug discovery. Disease Models & Mechanisms. 4 (3), 300-304 (2011).
- Amorim-Vaz, S., Delarze, E., Ischer, F., Sanglard, D., Coste, A. T. Examining the virulence of Candida albicans transcription factor mutants using Galleria mellonella and mouse infection models. Frontiers in Microbiology. 6, 367 (2015).
- Harding, C. R., Schroeder, G. N., Collins, J. W., Frankel, G. Use of Galleria mellonella as a model organism to study Legionella pneumophila infection. Journal of Visualized Experiments. (81), e50964 (2013).
- Jacobsen, I. D. Galleria mellonella as a model host to study virulence of Candida. Virulence. 5 (2), 237-239 (2014).
- Tsai, C. J., Loh, J. M., Proft, T. Galleria mellonella infection models for the study of bacterial diseases and for antimicrobial drug testing. Virulence. 7 (3), 214-229 (2016).
- Hirakawa, M. P., et al. Genetic and phenotypic intra-species variation in Candida albicans. Genome Research. 25 (3), 413-425 (2015).
- Dunn, M. J., Kinney, G. M., Washington, P. M., Berman, J., Anderson, M. Z. Functional diversification accompanies gene family expansion of MED2 homologs in Candida albicans. PLoS Genetics. 14 (4), (2018).
- Astvad, K. M. T., Meletiadis, J., Whalley, S., Arendrup, M. C. Fluconazole Pharmacokinetics in Galleria mellonella Larvae and Performance Evaluation of a Bioassay Compared to Liquid Chromatography-Tandem Mass Spectrometry for Hemolymph Specimens. Antimicrobial Agents and Chemotherapy. 61 (10), (2017).
- Mesa-Arango, A. C., et al. The non-mammalian host Galleria mellonella can be used to study the virulence of the fungal pathogen Candida tropicalis and the efficacy of antifungal drugs during infection by this pathogenic yeast. Med Mycol. 51 (5), 461-472 (2013).
- Brennan, M., Thomas, D. Y., Whiteway, M., Kavanagh, K. Correlation between virulence of Candida albicans mutants in mice and Galleria mellonella larvae. FEMS Immunology and Medical Microbiology. 34 (2), 153-157 (2002).
- Fuchs, B. B., O'Brien, E., Khoury, J. B., Mylonakis, E. Methods for using Galleria mellonella as a model host to study fungal pathogenesis. Virulence. 1 (6), 475-482 (2010).
- Kavanagh, K., Fallon, J. P. Galleria mellonella larvae as models for studying fungal virulence. Fungal Biology Reviews. 24 (1-2), 79-83 (2010).
- Hull, C. M., Johnson, A. D. Identification of a mating type-like locus in the asexual pathogenic yeast Candida albicans. Science. 285 (5431), 1271-1275 (1999).
- Legrand, M., et al. Homozygosity at the MTL locus in clinical strains of Candida albicans: karyotypic rearrangements and tetraploid formation. Molecular Microbiology. 52 (5), 1451-1462 (2004).
- Lockhart, S. R., et al. In Candida albicans, white-opaque switchers are homozygous for mating type. Genetics. 162 (2), 737-745 (2002).
- Miller, M. G., Johnson, A. D. White-opaque switching in Candida albicans is controlled by mating-type locus homeodomain proteins and allows efficient mating. Cell. 110 (3), 293-302 (2002).
- Wu, W., Lockhart, S. R., Pujol, C., Srikantha, T., Soll, D. R. Heterozygosity of genes on the sex chromosome regulates Candida albicans virulence. Molecular Microbiology. 64 (6), 1587-1604 (2007).
- Herrero, A. B., et al. KRE5 gene null mutant strains of Candida albicans are avirulent and have altered cell wall composition and hypha formation properties. Eukaryotic Cell. 3 (6), 1423-1432 (2004).
- Hall, R. A., et al. The Mnn2 mannosyltransferase family modulates mannoprotein fibril length, immune recognition and virulence of Candida albicans. PLoS Pathogens. 9 (4), 1003276 (2013).
- Wojda, I. Immunity of the greater wax moth Galleria mellonella. Journal of Insect Science. 24 (3), 342-357 (2017).
- Bergin, D., Reeves, E. P., Renwick, J., Wientjes, F. B., Kavanagh, K. Superoxide production in Galleria mellonella hemocytes: identification of proteins homologous to the NADPH oxidase complex of human neutrophils. Infection and Immunity. 73 (7), 4161-4170 (2005).
- Lange, A., et al. Genome Sequence of Galleria mellonella (Greater Wax Moth). Genome Announcements. 6 (2), (2018).
- Krappmann, S. Lightning up the worm: How to probe fungal virulence in an alternative mini-host by bioluminescence. Virulence. 6 (8), 727-729 (2015).
- Chowdhary, A., Voss, A., Meis, J. F. Multidrug-resistant Candida auris: 'new kid on the block' in hospital-associated infections. Journal of Hospital Infection. 94 (3), 209-212 (2016).
- Delarze, E., Ischer, F., Sanglard, D., Coste, A. T. Adaptation of a Gaussia princeps Luciferase reporter system in Candida albicans for in vivo detection in the Galleria mellonella infection model. Virulence. 6 (7), 684-693 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados