Method Article
Ensaio de ELISpot otimizado de Interferon-gama às respostas de célula T medida no modelo de porquinho da Índia após a vacinação
Neste Artigo
Resumo
O desenvolvimento do ensaio ELISpot para cobaia PBMCs interferão-gama permite a caracterização das respostas de células T neste modelo altamente relevantes para o estudo de doenças infecciosas. Temos aplicado o ensaio para medir respostas de células T associadas a intradérmica entrega de vacinas de DNA.
Resumo
A cobaia tem desempenhado um papel central como um modelo animal pequeno relevante no desenvolvimento de vacinas para doenças infecciosas como a tuberculose, gripe, difteria e febres hemorrágicas virais. Nós demonstramos que entrega de vacina plasmídeo-DNA (pDNA) na pele provoca respostas humorais robustas o porquinho. No entanto, a utilização deste animal a respostas imunes de modelo era um pouco limitada no passado devido à falta de reagentes disponíveis e protocolos para estudar respostas de células T. As células T desempenham um papel crucial em imunoprofilaticos e mecanismos de imunoterapia. Noções básicas sobre respostas de célula T é crucial para o desenvolvimento de doenças infecciosas e vacinas de Oncologia e acomodando dispositivos de entrega. Aqui descrevemos um ensaio enzima-lig immunospot (ELISpot) de interferon-gama (IFN-γ) para cobaia células mononucleares de sangue periférico (PBMC). O ensaio permite que pesquisadores caracterizar respostas de células T específicas vacina neste importante modelo de roedores. A capacidade de células isoladas do sangue periférico de ensaio fornece a oportunidade de acompanhar a imunogenicidade em animais individuais.
Introdução
O protocolo descrito aqui permite a detecção de interferão-gama células segrega (IFN-γ) após a recordação de antígeno em uma população de células mononucleares (PBMC) de sangue periférico colhida do Hartley cobaias. Temos aplicado o ensaio para caracterizar a cinética e magnitudes das respostas de célula T de antígeno-específicas para um regime de vacinação gripe do porquinho. Acreditamos que este protocolo significativamente irá impulsionar o desenvolvimento pré-clínico de programas de vacinação neste modelo animal altamente relevantes.
Células T eliciadas vacinas desempenham um papel essencial na proteção contra agentes infecciosos e os caminhos de imunoterapia associados com outras doenças. A importância das células T tem sido destacada em vários estudos de vacina. Imunização de furões e ratos com um plasmídeo de DNA (pDNA) codificação para H5 hemaglutinina e proteção de neuraminidase fornecido N1 de morbidade e mortalidade em um desafio de vírus de gripe na ausência de anticorpos, indicando a importância de neutralizantes Imunidade de célula t1. Além de forte neutralizando a resposta humoral, as células T desempenham um papel crucial para liberação viral2 , não só mas também proteção contra infecção por vírus sincicial respiratório (VSR) em ratos3. Nos seres humanos, células CD8 + T pre-existentes foram associadas com severidade da doença diminuiu durante o H1N1 pandemia em 20094. Contagem de células CD4 + T, juntamente com certa citocinas concentração de plasma está correlacionadas com a severidade da doença em crianças infectadas RSV5.
A cobaia ganhou destaque como um modelo de laboratório de pesquisa e desenvolvimento em diversas áreas da medicina, tais como sensibilização da pele, pesquisa nutricional, estudos do sistema auditivo e, mais relevante para este trabalho, as doenças infecciosas. Foi crucial para a descoberta de vacinas contra a tuberculose e a difteria. Mais recentemente, a cobaia é usada como um modelo para Influenza6 e Ebola7. Além disso, possuir semelhanças fisiológicas com pele humana8, a cobaia oferece um modelo animal pequeno acessível para os métodos de entrega de droga dérmica. Em contraste com a sua importância como um modelo de laboratório, a disponibilidade de ensaios específicos de cobaia e sondas para caracterizar respostas imunes permanece limitada9. Ensaios de celulares básicos tais como o IFN-γ enzima-lig immunospot (ELISpot-ensaio) que é usada rotineiramente na investigação pré-clínica e clínica para enumerar as respostas de células T não estão disponíveis.
Os primeira fase sólida enzima-lig immunospot ensaios foram usados para determinar o número de células secretoras de anticorpos específicas em uma célula B-população diversa de10,11. O formato tem avançado para detectar células secretoras de citocinas, incluindo Il-1, Il-2, IL-4, IL-5, IL-6, IL-10, IFN-γ, TNF-alfa, TNF-beta, granzime B e GM-CSF. O ensaio ELISpot possui alta sensibilidade; potencialmente, cada célula de produção de citocinas pode ser detectada. O limite de detecção para ensaios de ELISpot foi relatado para ser inferior a 10 pontos por 100.000 PBMCs12. Recentemente, um par de anticorpo específico de IFN-γ-cobaia foi feito disponível13, e isso abriu a oportunidade de abordar esta deficiência no campo.
IFN-γ é considerada uma molécula efetora importante na resposta imune adaptativa; pode ser produzido e secretado pelas células CD4 e CD8 T tanto após a ativação. IFN-γ tem uma ampla gama de biológico funções no contexto de uma resposta imune a uma infecção de vírus, tais como a ativação de macrófagos e o Regulamento acima do complexo principal de histocompatibilidade (MHC), eu e a expressão de MHCII. Também promove a diferenciação de células B, inibe o crescimento de célula T-auxiliar-2 e ativa as células assassinas naturais. IFN-γ bloqueia a replicação viral em células somáticas infectadas e upregulates expressão de moléculas de MHC. Assim, a produção de IFN-γ é uma indicação muito importante da qualidade da resposta celular T para uma vacina ou agente patogénico.
Um aspecto importante do ELISpot de IFN-γ aqui apresentado é o uso de PBMC, ao invés de splenocytes13. PBMC pode ser obtida pelo processamento de uma amostra de sangue coletada não-terminal, Considerando que a coleção de splenocytes requer a eutanásia de animais antes da colheita do baço. O uso de PBMC permite respostas de IFN-γ T-celular a ser monitorado durante um período de tempo e a avaliação dos efeitos sobre as respostas de células T como regimes prime-boost14.
Para os investigadores que estão usando atualmente a cobaia como um modelo animal, o método de IFN-γ ELISpot ampliará a gama de dados científicos que se pode ganhar. Sua disponibilidade agora pode reduzir a necessidade de realizar estudos com modelos animais menos relevantes para a doença-alvo, que anteriormente foram escolhidos devido à disponibilidade do reagente para o exame das respostas celulares. O uso de PBMC ao invés de baço ou linfonodos permite experimentos não-terminal e monitoramento contínuo de animais individuais.
Abaixo, nós fornecemos uma descrição detalhada das etapas envolvidas na detecção de uma resposta celular de IFN-γ em cobaias para pDNA vacina. Podemos delinear nosso procedimento de entrega específico e descrever o ensaio ELISpot geral, englobando a recolha de amostras de sangue, processamento de sangue, colheita PBMC, procedimento de ensaio e análise de dados. Um esquema do ensaio ELISpot é retratado na Figura 1.

Figura 1 : Visão esquemática do porco Guiné ELISpot protocolo. Clique aqui para ver uma versão maior desta figura.
Protocolo
Todos os métodos descritos aqui foram aprovados pelo Comitê de uso (ACUC) de Acculab e cuidado Animal.
Nota: O protocolo requer o uso de materiais potencialmente perigosos. Por favor refira MSDS do fabricante e usar equipamento pessoal adequado (EPI) durante todo o procedimento.
1. preparação do cobaia imunização local, intradérmica Mantoux-injeção e CELLECTRA-3P-EP-procedimento
-
Preparação do local do tratamento sobre a cobaia.
- Coloque o porco da Guiné em uma câmara de indução e anestesiar a 5% vapor de isoflurano.
- Remover o animal da câmara e colocar o cone de nariz em posição, fornecendo vapor de isoflurano 2% para manter a anestesia durante o procedimento.
- Raspe a região de cerca de 4 cm2 no flanco abdominal.
- Desinfete a área depilada com etanol-cotonete.
-
Injeção de procedimento pDNA-formulação e eletroporação.
- Use uma seringa de insulina para injetar 100 µ l formulação dentro da derme através da técnica de Mantoux. Agulha é inserida em bisel acima em um ângulo de 10 graus com o corpo do animal.
- Retire a agulha e imediatamente inserir a matriz de eletrodo CELLECTRA® - 3P através da injeção-pápula e aplicar o campo elétrico.
- Retire o animal da anestesia e acompanhar sua recuperação.
2. Non-terminal sangrar
-
Coleta de sangue da veia jugular de cobaia anestesiada.
- Coloque o porco da Guiné em uma câmara de indução e anestesiar o animal conforme descrito em 1.1.1
- Utilizando uma seringa de 3 ml com agulha 27 1/2 polegada, pontuam a veia jugular do animal anestesiado e coletar 3 ml de sangue.
- Transferir imediatamente o sangue num tubo de colheita de sangue K2EDTA, inverter o tubo várias vezes para misturar o sangue com anticoagulante e lugar no gelo.
Nota: Evitar a coagulação do sangue é crucial para o sucesso a jusante processamento da amostra de sangue. - Monitore a recuperação do animal.
3. processamento de amostra de sangue
-
Separação de PBMC de sangue total por centrifugação gradiente de densidade
- Dilua 1:1 com Hank está equilibrado sal solução (HBSS) de sangue.
Nota: Para evitar a contaminação de todo o trabalho a partir de agora deve ser executada em um armário de biossegurança, aplicando uma técnica asséptica. - Camada diluído sangue gradualmente mais 4,5 ml Ficoll-Paque Plus em um tubo de 15 ml-cônico. Evite a perturbação da interface. Nota: Para assegurar a separação adequada, Ficoll-Paque deve estar à temperatura ambiente.
- Centrifugar tubos no rcf 800 por 30 min com freio fora.
Nota: como alternativa, SepMate™ tubos (STEMCELL Technologies) pode ser usada para a separação de PBMC. HBSS-diluído sangue é adicionado ao tubo de 15 ml SepMate preenchido com 3,5 ml Ficoll-Paque Plus e então centrifugadas a rcf 1200 por 10 min (travão). Esta técnica de centrifugação gradiente de economia de tempo resulta em viabilidade igual, célula-rendimento e local-formação. - Camada de Buffy-Coat da colheita e diluir em meio de R10 (10% (v/v) calor-desactivado FBS e 1% (v/v) caneta/Strep no meio RPMI1640) para um volume total de 15 ml.
- Pellet de células por centrifugação em 450 rcf por 5 min.
- Lave as células duas vezes com R10 médio.
- Ressuspender as células em 1 ml de R10 e passar celular-suspensão através de 70 µm célula-filtro em para um novo tubo.
- Contar as células e determinar o número de células vivas pela coloração azul Trypan.
- Diluir as células com R10 médio a uma concentração de 1 x 10 ^ 6 células vivas por ml.
- Dilua 1:1 com Hank está equilibrado sal solução (HBSS) de sangue.
4. preparação de placas de ELISpot e célula-estimulação
-
Casaco e bloco poços de uma placa de ELISpot PVDF-membrana de 96 poços antes de semear o PBMC.
- Placas devem ser previamente tratadas por 60 segundos. Pré-tratamento de etanol irá resultar em menos inespecíficos local-formação e manchas com melhor definição.
Nota: Tome cuidado extra para garantir a completa membrana entra em contato com 15 µ l 35% etanol. - Após 60 segundos adicionar 150 µ l 1X PBS por bem e então esvazie poços invertendo-se as placas.
Nota: O pré-tratamento de etanol é muito sensível ao tempo. Não incube a membrana-bem mais do que 60 seg. membranas não deve secar durante as seguintes etapas do procedimento. - Lave pratos três vezes com 250 µ l 1X PBS por bem.
- Casaco com 100 µ l/poço de 5 µ g/ml captura anticobaia anticorpo de IFN-γ V-E4 em PBS.
- Incubar as placas pelo menos 12 horas a 4° C.
- Lave pratos, adicionando 250 µ l/poço PBS três vezes.
- Adicionar 200 µ l/poço reserva bloqueio (10% (p/v) de sacarose e 2% (p/v) BSA em PBS) e incube por 2 horas a temperatura ambiente.
- Lave pratos com 250 µ l/poço PBS três vezes.
- Placas devem ser previamente tratadas por 60 segundos. Pré-tratamento de etanol irá resultar em menos inespecíficos local-formação e manchas com melhor definição.
-
Placa PBMCs com peptídeos do antígeno-específicas, controles positivos e negativos.
- Dilua a piscina de proteína-peptídeo em R10 a concentração de peptídeo final desejado.
- Ensaio as amostra PBMCs em triplica.
Nota: Adicione primeiro o meio com estimulantes para as placas de ELISpot e adicionar a suspensão PBMC segundo. - Adicione 50 µ l de peptídeo-R10 médio indicado aos poços.
- Para controle negativo adicione 50 µ l formulação de peptídeo vazio no R10 em poços indicados.
- Para controle positivo Adicione 5 µ g/ml Concanavalina A (ConA) no meio de R10 em poços indicados.
- Adicionar 100 µ l de suspensão de células PBMC de todos os poços
- Incubar as placas em atmosfera de 5% CO2 umidificado no 37° Celsius para 18 hrs.
Nota: Lugar ELISpot placas sobre um superfície/rack mesmo na incubadora e evitar qualquer perturbação das placas durante o tempo de incubação.
5. detecção dos pontos positivos de interferão-gama
-
Incubação com deteção anticorpo e placa de desenvolvimento.
Nota: Para todas as etapas desta seção não é necessária nenhuma técnica asséptica.- Cuidadosamente, retirar as placas da incubadora e com segurança esvaziar poços. Lave pratos, adicionando 250 µ l/poço PBS por três vezes.
- Adicione 100 µ l/poço de 2 µ g/ml deteção cobaia anti-IFN-γ biotinilado N-G3 diluído em tampão de bloqueio.
Nota: Filtro (22 µm) Anticorpo a solução para reduzir a fundo. - Incube com o anticorpo da deteção para 2 horas à temperatura ambiente.
- Descarte o sobrenadante e lavar pratos, adicionando 250 µ l/poço PBS três vezes.
- Adicionar 100 µ l/poço de fosfatase alcalina (FAL ou ALP)-estreptavidina conjugado diluído em tampão de bloqueio.
Nota: Filtro (22 µm) solução para reduzir a fundo. - Incube com ALP-estreptavidina conjugado por 1 hora em temperatura ambiente.
- Descartar a solução de ALP-Streptavidin e lavar pratos, adicionando 250 µ l/poço PBS duas vezes e remover excesso PBS, inverter a placa e borrá-lo contra uma toalha de papel limpo.
- Lavar pratos, adicionando 250 µ l/poço DI ultrapura água uma vez e remover o excesso de água, invertendo a placa e borrá-lo contra uma toalha de papel limpo.
- Adicione 100 µ l de solução de substrato BCIP/NBT (cuidado) em cada poço. Cuidado: BCIP/NBT é altamente inflamável e tóxico se ingerido, em contacto com a pele, ou inalado. Antes de usar consulte o MSDS.
- Incube durante 20 min em temperatura ambiente protegida da luz.
- Lave a placa 4 vezes com água desionizada. Inverter a placa e para remover o excesso de água.
- Retire o plástica drenagem inferior de placas de ELISpot e permitir que as placas secar.
- Quantificar os pontos manualmente ou usando um leitor de ELISpot automatizado, por exemplo o leitor de placa CTL-Immunospot S6.
Resultados
Os resultados aqui apresentados servem como uma referência para os resultados esperados, o uso do presente protocolo, enfatizando a importância das etapas cruciais e confirmando os benefícios de otimizações descritos a seguir.
Após a centrifugação gradiente de densidade, conforme descrito na etapa 3.1 do protocolo, o líquido viscoso vermelho na parte inferior do tubo irá conter a maioria das células vermelhas do sangue. Como mostrado na Figura 2A, acima os glóbulos vermelhos é uma camada da meio-densidade. Entre uma camada de plasma claro ou amarelo na parte superior e a densidade gradiente médio é a camada de revestimento branco ou claro marrom de buffy, que contém a maioria dos glóbulos brancos e plaquetas. Separação incompleta se manifestaria como a presença de células vermelhas do sangue em cima do meio de gradiente de densidade. A coloração vermelha do plasma na Figura 2 é provavelmente devido à hemólise, como esta amostra de sangue foi armazenada no tubo da coleção 1,5 h antes de serem processadas. Figura 2 B mostra o gradiente antes (esquerda) e após centrifugação (à direita) no dispositivo de isolamento de PBMC. Amostra de sangue em Figura 2B foi processada com atraso mínimo após coleta de sangue e a coloração de plasma é amarelo.
O efeito de pre-molhando as membranas com etanol (ver passo 4.1 do protocolo) no desenvolvimento local é mostrado na Figura 3. Manchas em poços previamente tratadas exibir a melhor definição, e há uma redução no número de pontos em poços de controlo negativo médio/DMSO(Figura 3). Viabilidade típica de cobaia transformada PBMCs varia em torno de 90% e é semelhante tanto para tubos de 15ml regular e dispositivos PBMC-isolamento (Figura 3B). Rendimento de células viáveis de uma amostra de sangue de 3ml geralmente varia entre 3 x 106 e 5 x 106.
Os animais foram imunizados com plasmídeo codificação a cadeia (NP) de estirpe da gripe H1N1 A/PuertoRico8. A Figura 4 mostra a enumeração das respostas a células T IFN-γ apresentado como ponto-formando unidades (SFU) geradas em toda a duração de um regime de vacinação. Ensaio ELISpot com PBMCs colhidas de animais não-imunizadas resultados nas contagens de ponto insignificantes (sem tx). Quatorze dias após a primeira imunização (prime), uma média de 970 pontos de IFN-γ por milhões PBMC foram contados após estimulação imunogênica. Sete dias após a imunização segundo (impulso), respostas de células T contra todas as três piscinas foram expandidas, atingindo uma média de 5020 IFN-γ SFUs/106 PBMCs. quarenta e seis dias após a imunização segundo (memória), uma média total de SFUs de IFN-γ 6310/10 6 PBMC foram contado no sangue periférico.
LEGENDAS DAS FIGURAS:
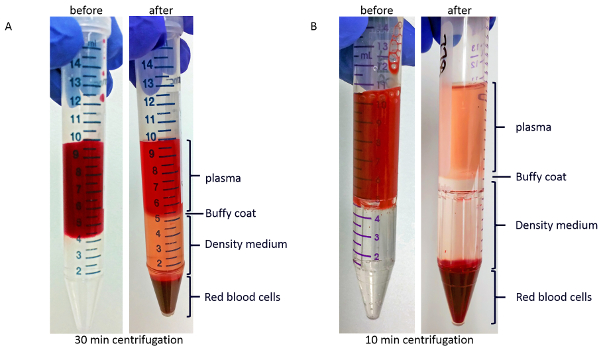
Figura 2 : Imagens representativas das camadas após a centrifugação gradiente de densidade. Amostra de sangue do (A) antes (esquerda) e após centrifugação (à direita) em tubos de regulares. (B) sangue da amostra antes (esquerda) e após centrifugação (à direita) em dispositivos de PBMC-isolamento. Clique aqui para ver uma versão maior desta figura.

Figura 3 : Otimização do protocolo. (A) típica aparência de IFN-γ pontos positivos em uma placa de ensaio ELISpot bem desenvolvido de acordo com o protocolo. Poços de três vias de exemplo são mostrados após pré-tratamento com etanol (à direita) ou sem pré-tratamento (à esquerda). As células foram incubadas durante a noite ou com DMSO (topo) como controle de não-estímulo, peptídeos do antígeno correspondente (médio), ou o mitógeno ConA (parte inferior). PBMC originada-se do mesmo animal individual. Poços foram fotografados usando um scanner de placa automatizado. (B) comparação de diferentes tubos de gradiente de densidade em células transformadas. 3 mL de amostras de sangue de 3 cobaias individuais foram coletados. 1,5 mL de cada amostra foram processados usando tubos regulares (médio gradiente de densidade) ou dispositivos de PBMC-isolamento. Viabilidade (esquerdo, % ± SEM) e o número de células vivas (bem, x 106 ± SEM) foram determinados utilizando uma célula automática contando sistema e ensaio de exclusão trypan azul. Clique aqui para ver uma versão maior desta figura.

Figura 4 : Deteção de robustas celular imune respostas ao longo de um regime de vacinação. Nos dias 1 e 15, 30 µ g de pDNA codificação cadeia de gripe A (NP) foi entregue dermally intra abdominal flanco de cobaias de Hartley, seguido imediatamente pela pele-eletroporação. Resposta de IFN-γ ELISpot foi medida 14 dias após a primeira imunização (prime) e 7 dias (impulso) e 46 dias (memória) após a segunda imunização. Significa SFUs + SEM foram plotado para 5 cobaias tratadas e 2 cobaias não tratadas (sem tx). Clique aqui para ver uma versão maior desta figura.
Discussão
A cobaia é um modelo animal valioso para o desenvolvimento pré-clínico de vacinas e estratégias de entrega intradérmica. O protocolo acima descreve a metodologia para medir respostas de célula T de antígeno-específicas neste modelo altamente relevantes. O ensaio fornece uma enumeração clara de periféricos T-células produtoras de interferão-gama após estimulação com peptídeos do antígeno-específicas. A cinética da resposta imune pode ser monitorada por amostragem de sangue não-terminal.
Temos otimizado o protocolo e identificou aspectos críticos para obter melhores resultados usando este ensaio. Por exemplo, a formação de coágulos de sangue no tubo de coleta resultará na viabilidade e recuperação PBMC suboptimal. Coágulos de sangue de porco da Guiné rapidamente18. É crucial realizar o sorteio de sangue rapidamente. Au-Birck et al fornecer um guia completo para técnicas no modelo cobaia16a sangrar. Desde a coleta de sangue requer anestesia geral, recomenda-se revisar os procedimentos habituais de funcionamento aplicáveis deste aspecto dos procedimento19. Insuficientemente anestesiadas cobaias reagirá movendo suas pernas ou vocalização após uma breve pitada do tecido entre os dedos com as unhas ou vacilar seus ouvidos e movendo que seus bigodes encaminhar após beliscar a sua orelha. A transferência imediata do sangue em um tubo com anticoagulante e misturar cuidadosamente por rolamento ou inversão do tubo várias vezes é um passo essencial no presente protocolo. Para o protocolo descrito aqui, utilizaram-se tubos de EDTA, e não outros anticoagulantes foram testados. Por favor, note que o EDTA é hipertônica, tubos idealmente devem ser preenchidos completo mais da metade e, portanto, o tamanho adequado do tubo para o volume da amostra deve ser usado.
Quando realizada corretamente, centrifugação gradiente de densidade resultados consistentemente em preparação de PBMC limpa. A gradiente de densidade média deve estar à temperatura quando mergulhando o gradiente antes da centrifugação, e freios não devem ser usados para parar o centrifugador quando usar tubos de regulares. Uma melhoria significativa em termos de praticidade do PBMC-processamento foi a combinação de centrifugação gradiente de densidade com dispositivos de isolamento PBMC. Isto permite uma redução no tempo de centrifugação. Centrifugação gradiente de densidade em dispositivos de PBMC-isolamento e tubos regular resulta em viabilidade semelhante, célula viva conta de PBMC transformado e formação local. Independente do tipo de tubo usado para a separação, a colheita de buffy casaco deve seguir imediatamente. Durante um período prolongado de tempo, contato com o meio de gradiente de densidade é citotóxico para os PBMCs.
A contagem exata de PBMC viável é importante semente consistentemente igual número de células em poços de ensaio-placa. Deve ser aplicado um método de discriminação ao vivo/morto. Em nosso laboratório, usamos o ensaio de azul trypan exclusão e um contador de célula automatizado.
Qualidade local, definida como manchas contrastadas afiado e altas, irá resultar em maior precisão e contando ponto consistente, especialmente quando se utiliza um sistema automatizado de contagem. Em consonância com as recomendações do fabricante, observamos pré-tratamentos de etanol das placas de ELISpot para ser um passo crucial para reduzir o número de pontos do plano de fundo e melhorar a definição dos pontos. O uso de um leitor de placa para as ensaio ELISpot-placas no final do protocolo de imagem é altamente recomendado. Imagens originais de cada poço podem ser facilmente e eficientemente obtidas e armazenadas. Usando um software de análise de imagem imagens digitais também permitem uma análise objectiva e contando ponto comparado a contagem manual por operadores individuais.
Uma necessidade absoluta para o desenvolvimento do ensaio descrito aqui foi a geração de uma adequado cobaia antipar de anticorpo de interferão-gama. Antibodies monoclonal de rato V-E4 e N-G3 foram desenvolvidos pela técnica de hibridoma com clones de células B de ratos que foram imunizados com cobaia recombinante interferon gama20. V-E4, que é o isotipo IgG1, e N-G3, que é IgG2a, são relatados para ligar os dois para o antígeno recombinante e nativo. Atribuindo V-E4 como o anticorpo captura e biotinilado N-G3 como o anticorpo da deteção resultou em alta sensibilidade para proteína recombinante e nativa, mantendo o sinal de baixo fundo em um formato de sanduíche-ELISA. Ambos os anticorpos estão disponíveis para a comunidade científica através de um acordo de fabricação conduzido pelo laboratório do Dr. Hubert Schaefer, que é co-autor desta publicação. Solicitações serão recebidas pelo laboratório do Dr. Schaefer e então fabricadas por um parceiro comercial.
Interferão-gama é relatado para ser instável em regular de buffers ou mídia21. Schaefer et al.20 relatou apenas uma diminuição moderada da taxa de recuperação quando usando degradada IFN-y, que tinha perdido a funcionalidade biológica, em um formato de ELISA usando anticorpos V-E4 e N-G3. No entanto, aumentar o tempo de incubação de estímulo de peptídeo de PBMC mais 18 h deve ser cuidadosamente analisado.
As vantagens de usar PBMCs tem sido discutida. No entanto, o ensaio descrito aqui reflete apenas respostas antígeno-específicos circulantes de células T na periferia. Tecido-infiltrando-se células T ou células isoladas de órgãos linfáticos, como o baço e linfonodos, podem apresentar diferentes propriedades22,23,24. Não há diferenças significativas nas respostas celulares foram observadas mediante comparação dos pontos de interferão-gama de PBMC e splenocytes de cobaias que foram imunizadas com a mesma gripe pNP vacina14.
Neste protocolo, descrevemos um procedimento de vacinação intradérmica. Uma justificativa principal para a imunização de ID tem como alvo a alta densidade de células dendríticas presentes na pele25. Nós e os outros têm mostrado que essas células podem ser direcionadas especificamente, adaptando o método de entrega26, formulação27ou drogas-projeto28. Células apresentadoras de antígeno profissionais ativadas podem migrar para um nó de linfa drenando e ativar o sistema imune adaptativo29,30,31,32. Células dendríticas são o antigénio essencial apresentação-tipo de célula para aprontar produtivas respostas imunes de celular.
Para este estudo os animais foram imunizados com plasmídeo codificação a cadeia de gripe H1N1, estirpe A/PuertoRico/8. Entrega de pele desta vacina pDNA (pNP) em combinação com eletroporação tinha sido mostrada para eliciar respostas humorais de antígeno-específicas em cobaias33, furões e primatas não-humanos (NHPs)1,34. Além disso, esta vacina suscitou respostas de células T robustas em ratos após o parto para a epiderme,35, que poderia ser atribuída ao CD4 e CD8 T-células, estimulando com peptídeos representando epítopos específicos para estas populações de células. A vacina pNP foi também imunogênica após a entrega da mucosa, como demonstrado pela geração de respostas humorais em coelhos e porquinhos da Índia, bem como a resposta celular e humoral em ratos36. Mais recentemente, nosso grupo foi capaz de demonstrar a geração de respostas de IFN-γT-célula no coelho após entrega intramuscular (dados não publicados).
Atualmente, as manchas de interferão-gama observadas no guinea pig ELISpot não podem ser alocadas para um subconjunto de CD4 + ou células T CD8 +. Especialmente para a concepção e desenvolvimento de terapias imunes segmentação da pele, que seria muito útil determinar se mancha frequências observadas de interferão-gama são causadas pela expansão de um subconjunto específico ou uma resposta equilibrada de ambos para Avalie a eficácia da vacinação para acionar Cruz-apresentação. Esta limitação pode ser superada por negativo ordenação de célula CD4 ou CD8 antes da semeadura das células na placa ou pela identificação de MHC-classe II (para respostas de CD4) ou MHC-classe I (para respostas de CD8) restrito epitopos.
O ensaio de interferão-gama ELISpot aqui descrito usando cobaia PBMCs aborda a necessidade de avaliar o curso de respostas celulares no modelo cobaia de laboratório. Isso irá refinar o desenvolvimento de vacinas e protocolos de entrega de pele. Acreditamos que permite para o emprego deste modelo animal relevantes para o estudo de doenças com componentes de células T importantes como TB37, Ebola38, HSV39e outros. Que irá reduzir o uso de modelos animais menos relevantes.
Divulgações
Os autores Katherine Schultheis, Holly M. Pugh, Bryan S. Yung, Janet Oh, Holly M. Pugh, Jacklyn Nguyen, Laurent Humeau, Kate E. Broderick e Trevor R.F. Smithare funcionários da Inovio Pharmaceuticals e como tal, receber salário e benefícios, incluindo a propriedade de estoque e opção de ações, da companhia.
Agradecimentos
Gostaríamos de agradecer aos membros da Inovio Pharmaceuticals D departamento de assistência técnica e pessoal do Acculab para fornecer o serviço de criação de excelência. Em especial, gostaríamos de agradecer Alysha Vu e Joe Agnes para revisão do manuscrito. Este trabalho não foi financiado por qualquer subvenção específica de agências de financiamento no setor público, comercial ou não-lucrativa.
Materiais
| Name | Company | Catalog Number | Comments |
| Cellectra-3P | Inovio Pharmaceuticals | ID-Electroporatio device/ non-commercial, R&D-only | |
| K2EDTA blood collection tube | BD | 367844 | |
| Hank’s Balanced Salt Solution | Gibco | 14175-079 | |
| Ficoll-Paque Plus | GE Healthacre | 17144003 | density gradient medium |
| SepMate tube | STEMCELL Technologies | 85415 | PBMC-isolation device |
| RPMI | Thermo Fisher | 11875-135 | |
| heat-deactivated FBS | VWR | 97068-085 | |
| Pen/Strep | Gibco | 15140-122 | |
| β-Mercaptoethanol | Gibco | 21985-023 | |
| 96-well ELISpot PVDF-membrane | Millipore | MSIPS4W10 | ELISpot assay plate |
| Ethanol | Sigma | 459844-1L | |
| UPDI | Invitrogen | 10977-015 | Ultra-Pure DI water |
| Sucrose | Sigma | S7903 | |
| Bovine Serum Albumin | Sigma | A7906 | |
| 10x PBS | HyClone | SH30378.03 | |
| Concanavalin A (ConA) | Sigma | C5275-5MG | |
| alkaline phosphatase (ALP)-conjugated streptavidin | R&D Systems Inc. | SEL002 | |
| BCIP/NBT | R&D Systems Inc. | SEL002 | |
| capture anti-guinea pig IFN-γ antibody V-E4 | GenScript | Order #:U5472CE080-3 | LOT # A217071153 |
| biotinylated detection anti-guinea pig IFN-γ antibody N-G3 | GenScript | Order #:U5472CE080-1 | LOT # A21700598 |
| CTL S6 Micro Analyzer | ImmunoSpot | #S6MIC12 | automated ELISpot plate reader |
| Vi-CELL XR | Beckman-Coulter | 731050 | automated cell counter |
| ImmunoSpot 5.1 | ImmunoSpot | assay analysis software | |
| ESCO Class II Type A2 | ESCO | Biosafety cabinet | |
| Falcon cell strainer | Corning, Inc. | VWR cat# 21008-952 | |
| Exel Comfort Point Insulin syringe | MedLab Supply | 26028 | |
| Rotanta 460R | Hettich | centrifuge | |
| Vi-CELL XR Quad Pak Reagent Kit | Beckman Coulter | 383722 | |
| Incu Safe | Panasonic-Healthcare | incubator | |
| 22 µm Filter | ThermoScientific | VWR act# 597-4520 | 22 µm Filter |
| KimWipes | Kimberly-Clark Professional | VWR cat# 21903-005 | paper towels |
Referências
- Laddy, D. J., et al. Heterosubtypic protection against pathogenic human and avian influenza viruses via in vivo electroporation of synthetic consensus DNA antigens. PloS One. 3 (6), 2517 (2008).
- Lee, J. Y., Chang, J. Recombinant baculovirus-based vaccine expressing M2 protein induces protective CD8+ T-cell immunity against respiratory syncytial virus infection. Journal of Microbiology. 55 (11), 900-908 (2017).
- Kinnear, E., et al. Airway T cells protect against RSV infection in the absence of antibody. Mucosal Immunology. , (2017).
- Sridhar, S., et al. Cellular immune correlates of protection against symptomatic pandemic influenza. Nature Medicine. 19 (10), 1305-1312 (2013).
- Brand, H. K., et al. CD4+ T-cell counts and interleukin-8 and CCL-5 plasma concentrations discriminate disease severity in children with RSV infection. Pediatric Research. 73 (2), 187-193 (2013).
- Bouvier, N. M. Animal models for influenza virus transmission studies: a historical perspective. Current Opinion in Virology. 13, 101-108 (2015).
- St Claire, M. C., Ragland, D. R., Bollinger, L., Jahrling, P. B. Animal Models of Ebolavirus Infection. Comparative Medicine. 67 (3), 253-262 (2017).
- Todo, H. Transdermal Permeation of Drugs in Various Animal Species. Pharmaceutics. 9 (3), 33 (2017).
- Schafer, H., Burger, R. Tools for cellular immunology and vaccine research the in the guinea pig: monoclonal antibodies to cell surface antigens and cell lines. Vaccine. 30 (40), 5804-5811 (2012).
- Czerkinsky, C. C., Nilsson, L. A., Nygren, H., Ouchterlony, O., Tarkowski, A. A solid-phase enzyme-linked immunospot (ELISPOT) assay for enumeration of specific antibody-secreting cells. Journal of Immunological Methods. 65 (1-2), 109-121 (1983).
- Sedgwick, J. D., Holt, P. G. A solid-phase immunoenzymatic technique for the enumeration of specific antibody-secreting cells. Journal of Immunological Methods. 57 (1-3), 301-309 (1983).
- Moodie, Z., et al. Response definition criteria for ELISPOT assays revisited. Cancer Immunology, Immunotherapy. 59 (10), 1489-1501 (2010).
- Gillis, P. A., et al. Development of a novel, guinea pig-specific IFN-gamma ELISPOT assay and characterization of guinea pig cytomegalovirus GP83-specific cellular immune responses following immunization with a modified vaccinia virus Ankara (MVA)-vectored GP83 vaccine. Vaccine. 32 (31), 3963-3970 (2014).
- Schultheis, K., et al. Characterization of guinea pig T cell responses elicited after EP-assisted delivery of DNA vaccines to the skin. Vaccine. 35 (1), 61-70 (2017).
- . Mantoux Tuberculin Skin Test DVD Facilitator Guide - CDC (Part One) Available from: https://www.cdc.gov/tb/education/Mantoux/images/mantoux.pdf (2013)
- Birck, M. M., Tveden-Nyborg, P., Lindblad, M. M., Lykkesfeldt, J. Non-Terminal Blood Sampling Techniques in Guinea Pigs. Journal of Visualized Experiments. (92), e51982 (2014).
- Strober, W. Trypan Blue Exclusion Test of Cell Viability. Current Protocols in Immunology. 111, 1-3 (2014).
- Lewis, J. H. Comparative hematology: studies on guinea-pigs (Cavia porcellus). Comparative Biochemistry and Physiology: Comparative Physiology. 102 (3), 507-512 (1992).
- Flecknell, P., Flecknell, P. . Laboratory Animal Anaesthesia (Fourth Edition). , 77-108 (2016).
- Schaefer, H., Kliem, G., Kropp, B., Burger, R. Monoclonal antibodies to guinea pig interferon-gamma: tools for cytokine detection and neutralization. Journal of Immunological Methods. 328 (1-2), 106-117 (2007).
- Lipiainen, T., et al. Formulation and stability of cytokine therapeutics. Journal of Pharmaceutical Sciences. 104 (2), 307-326 (2015).
- Wang, X. Z., et al. Virus-Specific CD8 T Cells in Peripheral Tissues Are More Resistant to Apoptosis Than Those in Lymphoid Organs. Immunity. 18 (5), 631-642 (2003).
- Veron, P., et al. Deep Sequencing of T Cell Receptor in Peripheral Blood and Muscle from Adeno-Associated Virus Vector-Injected Subjects Reveals Differences in T Cell Clonality Between the Two Compartments. Molecular Therapy. 23, 210 (2015).
- Sckisel, G. D., et al. Differential phenotypes of memory CD4 and CD8 T cells in the spleen and peripheral tissues following immunostimulatory therapy. Journal for ImmunoTherapy of Cancer. 5 (1), 33 (2017).
- Yanofsky, V. R., Mitsui, H., Felsen, D., Carucci, J. A. Understanding Dendritic Cells and Their Role in Cutaneous Carcinoma and Cancer Immunotherapy. Clinical and Developmental Immunology. 2013, 624123 (2013).
- Amante, D. H., et al. Direct Transfection of Dendritic Cells in the Epidermis After Plasmid Delivery Enhanced by Surface Electroporation. Human Gene Therapy Methods. 25 (6), 315-316 (2014).
- Mahe, B., et al. Nanoparticle-based targeting of vaccine compounds to skin antigen-presenting cells by hair follicles and their transport in mice. Journal of Investigative Dermatology. 129 (5), 1156-1164 (2009).
- Vandermeulen, G., et al. Skin-specific promoters for genetic immunisation by DNA electroporation. Vaccine. 27 (32), 4272-4277 (2009).
- Brave, A., Nystrom, S., Roos, A. K., Applequist, S. E. Plasmid DNA vaccination using skin electroporation promotes poly-functional CD4 T-cell responses. Immunology and Cell Biology. 89 (3), 492-496 (2011).
- Romani, N., et al. Targeting skin dendritic cells to improve intradermal vaccination. Current Topics in Microbiology and Immunology. 351, 113-138 (2012).
- Smith, T. R., et al. DNA vaccination strategy targets epidermal dendritic cells, initiating their migration and induction of a host immune response. Molecular Therapy Methods & Clinical Development. 1, 14054 (2014).
- Teunissen, M. B., Haniffa, M., Collin, M. P. Insight into the immunobiology of human skin and functional specialization of skin dendritic cell subsets to innovate intradermal vaccination design. Current Topics in Microbiology and Immunology. 351, 25-76 (2012).
- Lin, F., et al. A novel prototype device for electroporation-enhanced DNA vaccine delivery simultaneously to both skin and muscle. Vaccine. 29 (39), 6771-6780 (2011).
- Laddy, D. J., et al. Electroporation of synthetic DNA antigens offers protection in nonhuman primates challenged with highly pathogenic avian influenza virus. Journal of Virology. 83 (9), 4624-4630 (2009).
- Lin, F., et al. Optimization of Electroporation-Enhanced Intradermal Delivery of DNA Vaccine Using a Minimally Invasive Surface Device. Human Gene Therapy Methods. 23 (3), 157-168 (2012).
- Kichaev, G., et al. Electroporation mediated DNA vaccination directly to a mucosal surface results in improved immune responses. Human Vaccines & Immunotherapeutics. 9 (10), 2041-2048 (2013).
- Klunner, T., Bartels, T., Vordermeier, M., Burger, R., Schafer, H. Immune reactions of CD4- and CD8-positive T cell subpopulations in spleen and lymph nodes of guinea pigs after vaccination with Bacillus Calmette Guerin. Vaccine. 19 (15-16), 1968-1977 (2001).
- Shedlock, D. J., et al. Induction of Broad Cytotoxic T Cells by Protective DNA Vaccination Against Marburg and Ebola. Molecular Therapy. 21 (7), 1432-1444 (2013).
- Hensel, M. T., et al. Prophylactic Herpes Simplex Virus 2 (HSV-2) Vaccines Adjuvanted with Stable Emulsion and Toll-Like Receptor 9 Agonist Induce a Robust HSV-2-Specific Cell-Mediated Immune Response, Protect against Symptomatic Disease, and Reduce the Latent Viral Reservoir. Journal of Virology. 91 (9), 02257 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados