Method Article
Optimizado de interferón-gamma ELISpot análisis a las respuestas de la célula de T de medida en el modelo de conejillo de Indias después de la vacunación
En este artículo
Resumen
El desarrollo de la prueba de interferón-gamma ELISpot para conejillo de Indias PBMCs permite la caracterización de las respuestas de células T en este modelo altamente relevante para el estudio de las enfermedades infecciosas. Hemos aplicado el ensayo para medir las respuestas de células T asociadas con entrega intradérmica de vacunas de ADN.
Resumen
El conejillo de Indias ha jugado un papel fundamental como un modelo animal pequeño relevante en el desarrollo de vacunas contra enfermedades infecciosas como la tuberculosis, difteria, gripe y fiebres hemorrágicas virales. Hemos demostrado que entrega de vacuna de DNA plasmídico (pDNA) en la piel provoca fuerte respuesta humoral en el conejillo de Indias. Sin embargo, el uso de este animal a inmunorespuestas modelo fue algo limitado en el pasado debido a la falta de protocolos para el estudio de las respuestas de células T y reactivos disponibles. Las células T desempeñan un papel fundamental en la immunoprophylactic y mecanismos de la inmunoterapia. Entender las respuestas de células T es crucial para el desarrollo de enfermedades infecciosas y Oncología vacunas y dispositivos con capacidad de entrega. Aquí describimos un análisis enzima-ligado del immunospot (ELISpot) de interferón-gamma (IFN-γ) de conejillo de Indias las células mononucleares de sangre periférica (PBMCs). El ensayo permite a los investigadores caracterizar las respuestas de células T de vacunas específicas en este importante modelo de roedor. La capacidad de análisis de células aisladas de sangre periférica ofrece la oportunidad de seguir inmunogenicidad en animales individuales.
Introducción
El protocolo aquí descrito permite la detección de interferón-gamma células secretoras (IFN-γ) después de memoria del antígeno en una población de células mononucleares (PBMC) de sangre periférica de cobayos Hartley. Hemos aplicado el análisis para caracterizar la cinética y la magnitud de las respuestas de células de T específicas de antígeno a un régimen de vacunación Influenza en el conejillo de Indias. Creemos que este protocolo impulsará significativamente el desarrollo preclínico de los programas de vacunación en este modelo animal altamente relevante.
Las células T inducidas por las vacunas juegan un papel esencial en la protección contra agentes infecciosos y las vías de inmunoterapia asociadas a otras enfermedades. La importancia de las células T ha sido destacada en múltiples estudios de la vacuna. Vacunación de hurones y ratones con ADN plásmido (pDNA) codifican para la hemaglutinina H5 y N1 neuraminidasa proporcionado protección de morbilidad y mortalidad en un reto de virus de influenza en la ausencia de anticuerpos, lo que indica la importancia de neutralizantes Inmunidad de células t1. Además fuerte neutralización de la respuesta humoral, las células T desempeñan un papel crucial no sólo separación viral2 , sino también protección contra la infección con virus sincitial respiratorio (VSR) en ratones3. En los seres humanos, preexistente de las células T CD8 + fueron asociadas a severidad de la enfermedad disminución durante el H1N1 pandémico de 20094. Recuentos de células T CD4 + junto con cierta concentración de plasma del cytokine se correlacionan con la severidad de la enfermedad en niños infectados por RSV5.
El conejillo de Indias ha ganado importancia como modelo de laboratorio para investigación y desarrollo en diversas áreas de la medicina como la sensibilización de la piel, investigación nutricional, estudios del sistema auditivo y, más relevante para este trabajo, las enfermedades infecciosas. Era crucial para el descubrimiento de vacunas contra la tuberculosis y la difteria. Más recientemente el conejillo de Indias se utiliza como un modelo para Influenza6 y7de Ebola. Además, el conejillo de Indias que poseen similitudes fisiológicas con piel humana8, ofrece un modelo animal pequeño acceso de métodos de entrega de drogas cutáneo. En contraste con su importancia como un modelo de laboratorio, la disponibilidad de ensayos específicos de conejillo de Indias y las puntas de prueba para caracterizar la respuesta inmune sigue siendo limitada9. Ensayos celulares básicos tales como el IFN-γ enzima-ligado immunospot (ELISpot-ensayo) que se utiliza rutinariamente en la investigación preclínica y clínica para enumerar las respuestas de células T no han estado disponibles.
Los ensayos de fase sólida enzima-ligado immunospot primeros fueron utilizados para determinar el número de células secretoras de anticuerpos específicos en una población diversa de células B10,11. El formato ha avanzado para la detección de células secretoras de citocinas como IL-1, IL-2, IL-4, IL-5, IL-6, IL-10, GM-CSF, TNF-alfa, TNF-beta, granzima B y IFN-γ. El análisis de ELISpot posee alta sensibilidad; potencialmente cada célula productora de citoquinas puede ser detectado. El límite de detección para los ensayos de ELISpot se ha divulgado para ser inferior a 10 puntos por 100.000 PBMCs12. Recientemente un par de anticuerpos específicos de IFN-γ de conejillo de Indias fue hecho disponible13, y esto ha abierto la oportunidad de abordar esta deficiencia en el campo.
IFN-γ se considera una molécula efectora importante en la respuesta inmune adaptativa; puede ser producida y secretada por las células CD4 y T CD8 en la activación. IFN-γ tiene una amplia gama de biológico funciona en el contexto de una respuesta inmune a una infección de virus, tales como la activación de los macrófagos y la regulación hacia arriba del complejo principal de histocompatibilidad (MHC) expresión de MHCII y yo. También, promueve la diferenciación de células B, inhibe el crecimiento de las células T-helper-2 y activa las células asesinas naturales. IFN-γ bloquea la replicación viral en las células somáticas infectadas y estimula expresión de moléculas de MHC. Así, la producción de IFN-γ es una indicación muy importante de la calidad de la respuesta de la célula de T a una vacuna o patógeno.
Un aspecto importante de la extrapolación de IFN-γ presentado aquí es el uso de PBMCs en lugar de esplenocitos13. PBMCs pueden obtenerse mediante el procesamiento de una muestra de sangre recogida no terminales, mientras que la colección de esplenocitos requiere euthanization animal antes de la cosecha del bazo. El uso de PBMCs permite respuestas de IFN-γ T-cell monitorizada durante un período de tiempo y la evaluación de los efectos sobre las respuestas de células T como los regímenes de prime-boost14.
Para los investigadores que actualmente están usando el conejillo de Indias como modelo animal, el método de extrapolación de IFN-γ ampliará la gama de datos científicos que pueden ganar. Ahora, su disponibilidad puede reducir la necesidad de llevar a cabo estudios con modelos animales menos relevantes para la enfermedad de destino, que previamente fueron elegidos debido a la disponibilidad de reactivos para el examen de respuestas celulares. El uso de PBMCs en lugar de bazo o ganglios linfáticos permite experimentos no terminal y monitoreo continuo de los individuos.
A continuación les proporcionamos una descripción detallada de los pasos involucrados en la detección de una respuesta celular de IFN-γ en conejillos de Indias a pDNA vacunas. Nuestro procedimiento de entrega específica del esquema y describir el análisis de ELISpot general que abarca la muestra de sangre, procesamiento de la sangre, cosecha PBMC, procedimiento de ensayo y análisis de datos. Un esquema del análisis de ELISpot se representa en la figura 1.

Figura 1 : Descripción esquemática del conejillo de Indias protocolo ELISpot. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
Todos los métodos aquí descritos han sido aprobados por el cuidado Animal y uso Comité (ACUC) de especialistas.
Nota: El protocolo requiere el uso de materiales peligrosos potenciales. Por favor, consulte la MSDS del fabricante y usar equipo personal apropiado (PPE) durante el procedimiento.
1. preparación del sitio de vacunación de conejillo de Indias, intradérmico Mantoux inyección y CELLECTRA-3P-EP-procedimiento
-
Preparación del sitio de tratamiento en el conejillo de Indias.
- Conejillo de Indias en una cámara de inducción y anestesiar al 5% vapor de isoflurano.
- Retire el animal de la cámara y cono de nariz en posición, proporcionando 2% isoflurano vapor para mantener la anestesia durante el procedimiento.
- Afeitar el área de aproximadamente 4 cm2 en el flanco abdominal.
- Desinfectar el área de raspado con hisopo de etanol.
-
Inyección del procedimiento formulación de pDNA y electroporación.
- Utilice una jeringa de insulina a inyectar 100 μl formulación en la dermis por la técnica de Mantoux. Se introduce aguja de bisel para arriba en un ángulo de 10 grados con el cuerpo del animal.
- Retire la aguja inmediatamente Inserte la matriz de electrodos CELLECTRA® - 3P en la inyección-wheal y aplicar el campo eléctrico.
- Retirar animales de anestesia y supervisar su recuperación.
2. terminal de no sangrar
-
Colección de sangre de la vena yugular de anestesiados de conejillo de Indias.
- Conejillo de Indias en una cámara de inducción y anestesiar animales como se describe en 1.1.1
- Utilizando una jeringa de 3 ml con una aguja de 27 1/2 pulgada, jalonan la vena yugular de los animales anestesiados y recoger 3 ml de sangre.
- Inmediatamente transferir sangre en tubo de recogida de sangre de K2EDTA, invertir el tubo varias veces para mezclar la sangre con anticoagulante y el lugar en el hielo.
Nota: Evitar la coagulación de la sangre es fundamental para la exitosa transformación aguas abajo de la muestra de sangre. - Supervisar la recuperación del animal.
3. proceso de la muestra de sangre
-
Separación de PBMCs de sangre entera mediante centrifugación del gradiente de densidad
- Diluir la sangre 1:1 con de Hank equilibrada solución de sal (HBSS).
Nota: Para evitar la contaminación de todo el trabajo de aquí en adelante debe realizarse en un gabinete de bioseguridad, aplicando una técnica aséptica. - Capa diluida sangre poco a poco más de 4.5 ml Ficoll-Paque Plus en un tubo de 15 ml-cónico. Evitar la perturbación de la interfaz. Nota: Para garantizar la adecuada separación, Ficoll-Paque debe estar a temperatura ambiente.
- Centrifugar los tubos a rcf 800 por 30 min con freno apagado.
Nota: como alternativa, tubos de SepMate™ (tecnologías de la célula de vástago) puede ser utilizado para la separación de PBMC. Sangre diluida HBSS se añade al tubo de SepMate de 15 ml con 3.5 ml Ficoll-Paque Plus y luego se centrifugó a 1200 rcf durante 10 min (freno). Esta técnica ahorra tiempo de centrifugación gradiente produce igual viabilidad, rendimiento de células y formación de punto. - Capa de Buffy-Coat de la cosecha y diluir en medio R10 (10% (v/v) calor-desactiva el FBS y el 1% (v/v) Pen/Strep en medio RPMI1640) para un volumen total de 15 ml.
- Pellet de células por centrifugación en rcf 450 por 5 min.
- Lavar las células dos veces con medio de R10.
- Resuspenda las células en 1 ml R10 y pasar la suspensión celular a través de la célula-colador de 70 μm en a un tubo nuevo.
- Contar las células y determinar el número de células vivas por la coloración de azul de tripano.
- Diluir las células con medio de R10 a una concentración de 1 x 10 ^ 6 células vivas por ml.
- Diluir la sangre 1:1 con de Hank equilibrada solución de sal (HBSS).
4. preparación de placas ELISpot y estimulación celular
-
Capa y bloque pozos de una placa de 96 pocillos ELISpot PVDF membrana antes de sembrar las PBMCs.
- Las placas deben ser previamente tratadas durante 60 segundos. Tratamiento previo de etanol dará como resultado menos inespecíficos spot-formación y puntos con mejor definición.
Nota: Tenga mucho cuidado para asegurar la membrana completa entra en contacto con 15% de 35 μl etanol. - Después de 60 segundos añadir PBS 1 x de 150 μL por pozo y luego vaciar pozos invirtiendo las placas.
Nota: El tratamiento previo de etanol es muy sensible al tiempo. No incubar la membrana bien más de 60 segundos las membranas no deben secarse durante los pasos siguientes del procedimiento. - Lavar las placas tres veces con PBS de 1 x de 250 μl por pocillo.
- Capa con 100 μL/pocillo de 5 μg/ml captura anti-conejillo de Indias anticuerpo de IFN-γ V-E4 en PBS.
- Incubar las placas durante al menos 12 horas a 4° C.
- Lavar las placas mediante la adición de 250 μL/pocillo de PBS tres veces.
- Agregar 200 μL/pocillo solución amortiguadora de bloqueo (10% (p/v) de sacarosa y 2% (w/v) BSA en PBS) e incubar durante 2 horas a temperatura ambiente.
- Lavar las placas con 250 μL/pocillo de PBS tres veces.
- Las placas deben ser previamente tratadas durante 60 segundos. Tratamiento previo de etanol dará como resultado menos inespecíficos spot-formación y puntos con mejor definición.
-
Placa PBMCs con péptidos específicos de antígeno, controles positivos y negativos.
- Diluir el pool de proteína-péptido en R10 a concentración de péptido final deseada.
- Ensayo las muestra PBMCs en triplicado.
Nota: Medio con estimulantes a las placas ELISpot primero y añadir la suspensión PBMC en segundo lugar. - Añadir 50 μl de medio de péptido-R10 a pozos indicados.
- Para control negativo añadir 50 μl formulación de péptido vacía en R10 en pozos indicados.
- Para el control positivo añadir concanavalina A (ConA) de 5 μg/ml en medio R10 en pozos indicados.
- Añadir 100 μl de suspensión celular PBMC a todos los pocillos
- Incube las placas en atmósfera de 5% de CO2 humidificado a 37° c por 18 horas.
Nota: Ápex lugar placas sobre una superficie/rejilla incluso en la incubadora y evitar cualquier perturbación de las placas durante el tiempo de incubación.
5. detección de interferón-gamma puntos positivos
-
Incubación con la detección de anticuerpos y la placa de desarrollo.
Nota: Para todos los pasos de esta sección no es necesaria técnica aséptica.- Retire con cuidado las placas de la incubadora y vaciar con seguridad pozos. Lavar las placas mediante la adición de 250 μL/pocillo de PBS tres veces.
- Añadir 100 μL/pocillo de 2 μg/ml biotinilado anti-conejillo de Indias IFN-γ anticuerpo de detección N-G3 diluido en solución amortiguadora de bloqueo.
Nota: Filtro (22 μm) anticuerpo solución para reducir fondo. - Incubar con el anticuerpo de detección de 2 horas a temperatura ambiente.
- Deseche el sobrenadante y lave las placas mediante la adición de 250 μL/pocillo de PBS tres veces.
- Añadir 100 μL/pocillo de la fosfatasa alcalina (ALP)-conjugado estreptavidina diluido en solución amortiguadora de bloqueo.
Nota: Filtro (22 μm) la solución para reducir el fondo. - Incubar con conjugado estreptavidina fosfatasa alcalina durante 1 hora a temperatura ambiente.
- Deseche la solución ALP-estreptavidina lavar las placas mediante la adición de 250 μL/pocillo de PBS dos veces y quitar exceso PBS por invertir la placa y borrar contra una toalla de papel limpia.
- Lavar las placas mediante la adición de 250 μL/pocillo DI UltraPure water una vez y eliminar el exceso de agua por invertir la placa y borrar contra una toalla de papel limpia.
- Añada 100 μl de solución de sustrato BCIP/NBT (PRECAUCIÓN) en cada pocillo. PRECAUCIÓN: BCIP/NBT es muy inflamable y tóxico si se ingiere, en contacto con la piel, o inhalado. Consulte la MSDS antes de usar.
- Incubar por 20 min a temperatura ambiente protegido de la luz.
- Lavar la placa 4 veces con agua desionizada. Invertir la placa y golpee para quitar exceso de agua.
- Quitar plástico drenaje de la parte inferior de las placas ELISpot y permitir que las placas se sequen.
- Cuantificar los puntos manualmente o mediante un lector de ELISpot automatizado, por ejemplo el lector de la placa del CTL Immunospot S6.
Resultados
Los resultados aquí presentados sirven como una referencia para los resultados esperados tras el uso de este protocolo, haciendo hincapié en la importancia de los pasos cruciales y confirmando los beneficios de optimización descrito.
Después de la centrifugación en gradiente de densidad, como se describe en el paso 3.1 del Protocolo, el líquido viscoso rojo en la parte inferior del tubo contendrá la mayor parte de los glóbulos rojos. Como se muestra en la figura 2A, por encima de los glóbulos rojos es una capa del medio de la densidad. Entre una capa de plasma claro o amarillo en la parte superior y la densidad del gradiente medio es la capa de la capa anteada marrón blanco, que contiene la mayor parte de los glóbulos blancos y plaquetas. Separación incompleta se manifiesta como la presencia de glóbulos rojos en la parte superior del medio de gradiente de densidad. La coloración roja del plasma en la figura 2A es probablemente debido a la hemólisis, como esta muestra de sangre fue almacenada en el tubo de recogida de 1,5 h antes de ser procesada. Figura 2 B muestra el gradiente antes (izquierda) y después de la centrifugación (derecha) en el dispositivo de aislamiento de PBMC. Muestra de sangre en la figura 2B fue procesado con un mínimo de retraso después de que colección de la sangre y la coloración del plasma es de color amarillo.
El efecto de las membranas con etanol del preremojo (vea el paso 4.1 del Protocolo) en el punto de desarrollo se muestra en la figura 3. Manchas en pozos previamente tratados Mostrar definición mejorada, y hay una reducción en el número de puntos en pozos de control negativo de DMSO/medio (figura 3A). Viabilidad típico de cuy procesada PBMCs oscila alrededor de 90% y es similar para tubos de 15 mL regular y dispositivos de aislamiento de PBMC (figura 3B). Rendimiento de células viables de una muestra de sangre 3 mL por lo general oscila entre 3 x 106 y 5 x 106.
Los animales fueron inmunizados con el plásmido DNA codificación la nucleoproteína (NP) de la cepa de la gripe H1N1 A/PuertoRico8. La figura 4 muestra la enumeración de las respuestas de IFN-γ de células T presentadas como spot-formando unidades (SFU) generadas a través de la duración de un régimen de vacunación. Análisis de ELISpot con PBMCs de resultados de animales no vacunados en cuenta punto insignificante (sin tx). Catorce días después de la primera inmunización (prime), un promedio de 970 puntos de IFN-γ por millón PBMCs fueron contados después del estímulo inmunogénico. Siete días después de la segunda vacunación (refuerzo), se ampliaron las respuestas de células T contra todos tres piscinas, alcanzando un promedio de 5020 IFN-γ SFUs/106 PBMCs. cuarenta y seis días después de la segunda inmunización (memoria), un promedio total de IFN-γ 6310 SFUs/10 6 PBMCs fueron contados en sangre periférica.
LEYENDAS DE LA FIGURA:
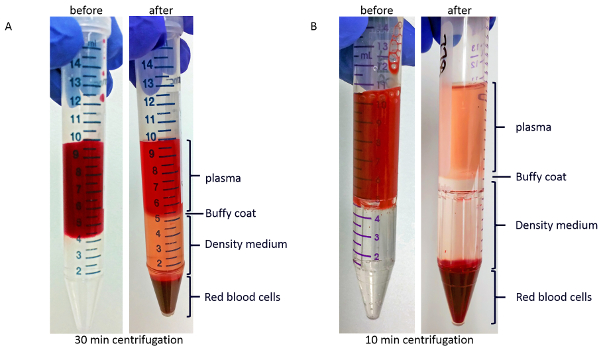
Figura 2 : Imágenes representativas de las capas después de la centrifugación del gradiente de densidad. Muestra de sangre (A) antes (izquierda) y después (derecha) centrifugación en tubos regulares. Muestra de sangre (B) antes (izquierda) y después de la centrifugación (derecha) en los dispositivos de aislamiento de PBMC. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3 : Optimización del Protocolo de. (A) aspecto típico de puntos positivo de IFN-γ en una placa de ensayo ELISpot bien desarrollado de acuerdo con el protocolo. Pozos por triplicado ejemplo aparecen después del tratamiento previo con etanol (derecha) o sin tratamiento previo (izquierda). Las células fueron incubadas con DMSO (arriba) como no-estímulo control, durante la noche péptidos antígeno-emparejado (medio) o mitógenos ConA (abajo). PBMCs originadas de los mismos animales individuales. Pozos fueron fotografiados usando un lector de placa automatizado. (B) comparación de diferentes tubos de gradiente de densidad en las células transformadas. se colectaron 3 mL de muestras de sangre de 3 individuales de conejillos de Indias. 1,5 mL de cada muestra fueron procesados usando tubos regulares (medio de gradiente de densidad) o dispositivos de aislamiento de PBMC. Viabilidad (izquierda, % ± SEM) y número de células vivas (a la derecha, x 106 ± SEM) se determinan usando una célula automática de cuenta de sistema y el análisis de exclusión azul de tripano. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4 : Detección de la respuesta inmune celular robusta en el transcurso de un régimen de vacunación. En los días 1 y 15, 30 μg de pDNA codificación nucleoproteína de la gripe A (NP) entregaron intra cutáneo al flanco abdominal de cobayos Hartley seguido inmediatamente por la piel-electroporación. Respuesta de IFN-γ ELISpot se midió 14 días después de la primera inmunización (prime) y 7 días (boost) y 46 días (memoria) después de la segunda inmunización. Media SFUs + SEM se trazaron 5 cobayas tratadas y 2 cobayas sin tratar (sin tx). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El conejillo de Indias es un modelo valioso para el desarrollo preclínico de vacunas y estrategias de entrega intradérmica. El protocolo anterior describe la metodología para medir las respuestas de células de T específicas de antígeno en este modelo altamente relevante. El ensayo proporciona una enumeración clara de periférica linfocitos T productores de interferón-gamma sobre el estímulo con péptidos específicos de antígeno. La cinética de la respuesta inmune puede ser monitoreada por la muestra de sangre no terminal.
El protocolo e identificado aspectos críticos para obtener resultados óptimos con este ensayo. Por ejemplo, la formación de coágulos de sangre en el tubo de la colección resultará en la viabilidad y la óptima recuperación PBMC. Coágulos de sangre de cuy muy rápidamente18. Es crucial para llevar a cabo el sorteo de la sangre rápidamente. Au-Birck et al. proporcionar una guía completa para la sangría técnicas en el conejillo de Indias modelo16. Puesto que la colección de sangre requiere anestesia general, se recomienda revisar los procedimientos de operación estándar aplicables de este aspecto del procedimiento19. Suficientemente anestesiados de conejillos de Indias reacciona moviendo sus piernas o vocalización después de un breve pellizco del tejido entre sus dedos con sus uñas o vacilar las orejas y moviendo que sus bigotes hacia adelante después de pellizcar la oreja. La transferencia inmediata de la sangre en un tubo con anticoagulante y mezclar completamente por rolling o invirtiendo el tubo varias veces es un paso esencial en el presente Protocolo. Para el protocolo descrito aquí se utilizaron tubos con EDTA, y no otros anticoagulantes fueron probados. Tenga en cuenta que el EDTA es hipertónico, tubos idealmente se deben llenar más de la mitad de lleno y por lo tanto el tamaño de tubo apropiado para el volumen de muestra debe utilizarse.
Cuando se realiza correctamente, centrifugación de gradiente de densidad resultados constantemente en preparación limpia de PBMC. El medio de gradiente de densidad debe estar a temperatura ambiente cuando acodar el gradiente antes de centrifugación y frenos no deben usarse para parar la centrífuga cuando use tubos regulares. Una mejora significativa en cuanto a la practicidad de la PBMC-tratamiento era la combinación de la centrifugación de gradiente de densidad con los dispositivos de aislamiento de PBMC. Esto permite una reducción en el tiempo de centrifugación. La centrifugación de gradiente de densidad en los dispositivos de aislamiento de PBMC y tubos regulares resultados en viabilidad similar, vivo recuento de PBMCs procesados y la formación de punto. Independiente del tipo de tubo utilizado para la separación, la cosecha de la capa anteada debe seguir inmediatamente. Durante un período prolongado de tiempo en contacto con el medio de gradiente de densidad es citotóxico a las PBMCs.
Cuenta exacta de PBMCs viables es importante constantemente igual número de semillas de células en los pocillos de la placa de ensayo. Se debe aplicar algún método de discriminación vivo/muerto. En nuestro laboratorio utilizamos el análisis de exclusión azul de tripano y un contador de células automatizado.
Calidad punto, definido como alta y afilada puntos contrastados, resultará en exactitud mejorada y contar punto constante, especialmente cuando se usa un sistema automatizado de conteo. En consonancia con las recomendaciones del fabricante, observamos los pretratamientos de etanol de las placas ELISpot para ser un paso crucial para reducir el número de puntos de fondo y mejorar la definición de los puntos. Se recomienda el uso de un lector de placas a las láminas de ensayo ELISpot en el final del Protocolo de la imagen. Imágenes originales de cada pozo pueden ser fácil y eficientemente obtenidos y almacenados. Utilizando un software de análisis de imagen imágenes digitales también permiten análisis objetivo y contando puntos en comparación con el conteo manual por los operadores individuales.
Una necesidad absoluta para el desarrollo de la prueba descrita aquí fue la generación de un adecuado el conejillo de Indias par de anticuerpo de interferón-gamma. Técnica de hibridomas con clones de células B de los ratones que fueron vacunados con cuy recombinante interferón gamma20se desarrollaron anticuerpos monoclonales de ratón V-E4 y N-G3. V-E4, que es el isotipo IgG1, y N-G3, que es IgG2a, se divulgan para atar a los antígenos recombinantes y nativos. V-E4 la asignación como el anticuerpo de captura biotinilado N-G3 como el anticuerpo de detección dio lugar a la alta sensibilidad para la proteína recombinante y nativa conservando bajo fondo señal en un formato de ELISA sandwich. Ambos anticuerpos están disponibles para la comunidad científica a través de un acuerdo de fabricación dirigido por el laboratorio del Dr. Hubert Schaefer, quien es coautor de esta publicación. Las solicitudes recibidas por el laboratorio de Dr. Schaefer y luego fabricadas por un socio comercial.
Interferón-gamma se divulga para ser inestable en regular almacenadores intermediarios o medios de comunicación21. Schaefer et al20 registrados sólo una moderada disminución de la tasa de recuperación al utilizar degradados IFN-y, que había perdido funcionalidad biológica, en un formato de ELISA utilizando anticuerpos V-E4 y N-G3. Sin embargo, aumentar el tiempo de incubación de la estimulación de péptido de PBMCs sobre 18 h debe ser cuidadosamente evaluado.
Las ventajas de utilizar PBMCs se ha discutido. Sin embargo, el ensayo descrito aquí sólo refleja respuestas específica de antígeno de células T en la periferia de la circulación. Infiltración de tejido las células T o células aisladas de órganos linfáticos, bazo y ganglios linfáticos, pueden exhibir diversas características22,23,24. No hubo diferencias significativas en las respuestas celulares se observaron sobre la comparación de puntos de la interferón-gamma de PBMCs y esplenocitos de conejillos de Indias que fueron inmunizados con el mismo pNP gripe vacuna14.
En este protocolo, hemos descrito un procedimiento de vacunación intradérmica. Una razón principal para la inmunización de la identificación está dirigida a la alta densidad de células dendríticas presentes en la piel25. Nosotros y otros hemos demostrado que estas células pueden ser específicamente adaptando el método de la entrega26, formulación27o28de drogas de diseño. Activadas las células presentadoras de antígeno profesionales pueden migrar a un nodo de linfa de drenaje y activar el sistema inmune adaptativo29,30,31,32. Las células dendríticas son el antígeno esenciales presentación-tipo de la célula para cebado productiva la respuesta inmune celular.
Para este estudio los animales fueron inmunizados con el plásmido DNA codificación de la nucleoproteína de la gripe H1N1 cepa A/Puerto Rico/8. Entrega de la piel de esta vacuna de pDNA (pNP) en combinación con la electroporación se había demostrado que provocan respuestas humorales antígeno-específica en conejillos de Indias33, hurones y primates no humanos (NHPs)1,34. Además, esta vacuna produce sólidas respuestas de células T en ratones después de la entrega en la epidermis35, que podrían atribuirse a CD4 y CD8 de las células T estimulando con péptidos representando a epítopes específicos para estas poblaciones celulares. La pNP vacuna fue inmunogénica después de la entrega mucosa según lo demostrado por la generación de la respuesta humoral en conejos y conejillos de Indias, así como las respuestas celulares y humorales en ratones36. Recientemente, nuestro grupo fue capaz de demostrar la generación de respuestas de IFN-γT-célula en el conejo después de la entrega intramuscular (datos no publicados).
Actualmente, los puntos observados de interferón-gamma en el conejillo de Indias ELISpot no pueden asignarse a un subconjunto de CD4 + o CD8 + T-cell. Especialmente para el diseño y desarrollo de terapias inmunes contra la piel, sería muy útil para determinar si las frecuencias observadas de la interferón-gamma son causadas por expansión de un subconjunto particular o una respuesta equilibrada de ambos a fin de evaluar la efectividad de la vacunación para desencadenar la presentación cruzada. Esta limitación podría ser superada por negativa clasificación de células CD4 o CD8 antes de la siembra de las células en la placa o por la identificación del MHC de clase II (para respuestas de CD4) o MHC clase restringido (para respuestas CD8) epitopos.
El ensayo de interferón-gamma ELISpot descrito aquí con conejillo de Indias PBMCs aborda la necesidad de evaluar el curso de la respuesta celular en el modelo de laboratorio de conejillo de Indias. Esto refina el desarrollo de vacunas y protocolos de entrega de la piel. Creemos que permite el empleo de este modelo animal relevante para el estudio de enfermedades con componentes importantes del T-cell como TB37, Ebola38,39de HSV y otros. Reducirá el uso de modelos animales menos relevantes.
Divulgaciones
Los autores empleados Katherine Schultheis, Holly M. Pugh, Bryan S. Yung, Janet Oh, Holly M. Pugh, Jacklyn Nguyen, Laurent Humeau, Kate E. Broderick y Trevor R.F. Smithare de Inovio Pharmaceuticals y como tal reciben sueldos y beneficios, incluyendo la propiedad de acciones y opciones sobre acciones, de la compañía.
Agradecimientos
Nos gustaría agradecer a los miembros de la Inovio Pharmaceuticals Departamento R & D para la asistencia técnica y personal de especialistas para prestar servicio de agricultura de excelencia. En particular nos gustaría agradecer a Alysha Vu y Joe Agnes para corregir el manuscrito. Este trabajo no fue financiado por cualquier subvención específica de organismos de financiación en los sectores público, comercial o sin fines de lucro.
Materiales
| Name | Company | Catalog Number | Comments |
| Cellectra-3P | Inovio Pharmaceuticals | ID-Electroporatio device/ non-commercial, R&D-only | |
| K2EDTA blood collection tube | BD | 367844 | |
| Hank’s Balanced Salt Solution | Gibco | 14175-079 | |
| Ficoll-Paque Plus | GE Healthacre | 17144003 | density gradient medium |
| SepMate tube | STEMCELL Technologies | 85415 | PBMC-isolation device |
| RPMI | Thermo Fisher | 11875-135 | |
| heat-deactivated FBS | VWR | 97068-085 | |
| Pen/Strep | Gibco | 15140-122 | |
| β-Mercaptoethanol | Gibco | 21985-023 | |
| 96-well ELISpot PVDF-membrane | Millipore | MSIPS4W10 | ELISpot assay plate |
| Ethanol | Sigma | 459844-1L | |
| UPDI | Invitrogen | 10977-015 | Ultra-Pure DI water |
| Sucrose | Sigma | S7903 | |
| Bovine Serum Albumin | Sigma | A7906 | |
| 10x PBS | HyClone | SH30378.03 | |
| Concanavalin A (ConA) | Sigma | C5275-5MG | |
| alkaline phosphatase (ALP)-conjugated streptavidin | R&D Systems Inc. | SEL002 | |
| BCIP/NBT | R&D Systems Inc. | SEL002 | |
| capture anti-guinea pig IFN-γ antibody V-E4 | GenScript | Order #:U5472CE080-3 | LOT # A217071153 |
| biotinylated detection anti-guinea pig IFN-γ antibody N-G3 | GenScript | Order #:U5472CE080-1 | LOT # A21700598 |
| CTL S6 Micro Analyzer | ImmunoSpot | #S6MIC12 | automated ELISpot plate reader |
| Vi-CELL XR | Beckman-Coulter | 731050 | automated cell counter |
| ImmunoSpot 5.1 | ImmunoSpot | assay analysis software | |
| ESCO Class II Type A2 | ESCO | Biosafety cabinet | |
| Falcon cell strainer | Corning, Inc. | VWR cat# 21008-952 | |
| Exel Comfort Point Insulin syringe | MedLab Supply | 26028 | |
| Rotanta 460R | Hettich | centrifuge | |
| Vi-CELL XR Quad Pak Reagent Kit | Beckman Coulter | 383722 | |
| Incu Safe | Panasonic-Healthcare | incubator | |
| 22µm Filter | ThermoScientific | VWR act# 597-4520 | 22µm Filter |
| KimWipes | Kimberly-Clark Professional | VWR cat# 21903-005 | paper towels |
Referencias
- Laddy, D. J., et al. Heterosubtypic protection against pathogenic human and avian influenza viruses via in vivo electroporation of synthetic consensus DNA antigens. PloS One. 3 (6), 2517 (2008).
- Lee, J. Y., Chang, J. Recombinant baculovirus-based vaccine expressing M2 protein induces protective CD8+ T-cell immunity against respiratory syncytial virus infection. Journal of Microbiology. 55 (11), 900-908 (2017).
- Kinnear, E., et al. Airway T cells protect against RSV infection in the absence of antibody. Mucosal Immunology. , (2017).
- Sridhar, S., et al. Cellular immune correlates of protection against symptomatic pandemic influenza. Nature Medicine. 19 (10), 1305-1312 (2013).
- Brand, H. K., et al. CD4+ T-cell counts and interleukin-8 and CCL-5 plasma concentrations discriminate disease severity in children with RSV infection. Pediatric Research. 73 (2), 187-193 (2013).
- Bouvier, N. M. Animal models for influenza virus transmission studies: a historical perspective. Current Opinion in Virology. 13, 101-108 (2015).
- St Claire, M. C., Ragland, D. R., Bollinger, L., Jahrling, P. B. Animal Models of Ebolavirus Infection. Comparative Medicine. 67 (3), 253-262 (2017).
- Todo, H. Transdermal Permeation of Drugs in Various Animal Species. Pharmaceutics. 9 (3), 33 (2017).
- Schafer, H., Burger, R. Tools for cellular immunology and vaccine research the in the guinea pig: monoclonal antibodies to cell surface antigens and cell lines. Vaccine. 30 (40), 5804-5811 (2012).
- Czerkinsky, C. C., Nilsson, L. A., Nygren, H., Ouchterlony, O., Tarkowski, A. A solid-phase enzyme-linked immunospot (ELISPOT) assay for enumeration of specific antibody-secreting cells. Journal of Immunological Methods. 65 (1-2), 109-121 (1983).
- Sedgwick, J. D., Holt, P. G. A solid-phase immunoenzymatic technique for the enumeration of specific antibody-secreting cells. Journal of Immunological Methods. 57 (1-3), 301-309 (1983).
- Moodie, Z., et al. Response definition criteria for ELISPOT assays revisited. Cancer Immunology, Immunotherapy. 59 (10), 1489-1501 (2010).
- Gillis, P. A., et al. Development of a novel, guinea pig-specific IFN-gamma ELISPOT assay and characterization of guinea pig cytomegalovirus GP83-specific cellular immune responses following immunization with a modified vaccinia virus Ankara (MVA)-vectored GP83 vaccine. Vaccine. 32 (31), 3963-3970 (2014).
- Schultheis, K., et al. Characterization of guinea pig T cell responses elicited after EP-assisted delivery of DNA vaccines to the skin. Vaccine. 35 (1), 61-70 (2017).
- . Mantoux Tuberculin Skin Test DVD Facilitator Guide - CDC (Part One) Available from: https://www.cdc.gov/tb/education/Mantoux/images/mantoux.pdf (2013)
- Birck, M. M., Tveden-Nyborg, P., Lindblad, M. M., Lykkesfeldt, J. Non-Terminal Blood Sampling Techniques in Guinea Pigs. Journal of Visualized Experiments. (92), e51982 (2014).
- Strober, W. Trypan Blue Exclusion Test of Cell Viability. Current Protocols in Immunology. 111, 1-3 (2014).
- Lewis, J. H. Comparative hematology: studies on guinea-pigs (Cavia porcellus). Comparative Biochemistry and Physiology: Comparative Physiology. 102 (3), 507-512 (1992).
- Flecknell, P., Flecknell, P. . Laboratory Animal Anaesthesia (Fourth Edition). , 77-108 (2016).
- Schaefer, H., Kliem, G., Kropp, B., Burger, R. Monoclonal antibodies to guinea pig interferon-gamma: tools for cytokine detection and neutralization. Journal of Immunological Methods. 328 (1-2), 106-117 (2007).
- Lipiainen, T., et al. Formulation and stability of cytokine therapeutics. Journal of Pharmaceutical Sciences. 104 (2), 307-326 (2015).
- Wang, X. Z., et al. Virus-Specific CD8 T Cells in Peripheral Tissues Are More Resistant to Apoptosis Than Those in Lymphoid Organs. Immunity. 18 (5), 631-642 (2003).
- Veron, P., et al. Deep Sequencing of T Cell Receptor in Peripheral Blood and Muscle from Adeno-Associated Virus Vector-Injected Subjects Reveals Differences in T Cell Clonality Between the Two Compartments. Molecular Therapy. 23, 210 (2015).
- Sckisel, G. D., et al. Differential phenotypes of memory CD4 and CD8 T cells in the spleen and peripheral tissues following immunostimulatory therapy. Journal for ImmunoTherapy of Cancer. 5 (1), 33 (2017).
- Yanofsky, V. R., Mitsui, H., Felsen, D., Carucci, J. A. Understanding Dendritic Cells and Their Role in Cutaneous Carcinoma and Cancer Immunotherapy. Clinical and Developmental Immunology. 2013, 624123 (2013).
- Amante, D. H., et al. Direct Transfection of Dendritic Cells in the Epidermis After Plasmid Delivery Enhanced by Surface Electroporation. Human Gene Therapy Methods. 25 (6), 315-316 (2014).
- Mahe, B., et al. Nanoparticle-based targeting of vaccine compounds to skin antigen-presenting cells by hair follicles and their transport in mice. Journal of Investigative Dermatology. 129 (5), 1156-1164 (2009).
- Vandermeulen, G., et al. Skin-specific promoters for genetic immunisation by DNA electroporation. Vaccine. 27 (32), 4272-4277 (2009).
- Brave, A., Nystrom, S., Roos, A. K., Applequist, S. E. Plasmid DNA vaccination using skin electroporation promotes poly-functional CD4 T-cell responses. Immunology and Cell Biology. 89 (3), 492-496 (2011).
- Romani, N., et al. Targeting skin dendritic cells to improve intradermal vaccination. Current Topics in Microbiology and Immunology. 351, 113-138 (2012).
- Smith, T. R., et al. DNA vaccination strategy targets epidermal dendritic cells, initiating their migration and induction of a host immune response. Molecular Therapy Methods & Clinical Development. 1, 14054 (2014).
- Teunissen, M. B., Haniffa, M., Collin, M. P. Insight into the immunobiology of human skin and functional specialization of skin dendritic cell subsets to innovate intradermal vaccination design. Current Topics in Microbiology and Immunology. 351, 25-76 (2012).
- Lin, F., et al. A novel prototype device for electroporation-enhanced DNA vaccine delivery simultaneously to both skin and muscle. Vaccine. 29 (39), 6771-6780 (2011).
- Laddy, D. J., et al. Electroporation of synthetic DNA antigens offers protection in nonhuman primates challenged with highly pathogenic avian influenza virus. Journal of Virology. 83 (9), 4624-4630 (2009).
- Lin, F., et al. Optimization of Electroporation-Enhanced Intradermal Delivery of DNA Vaccine Using a Minimally Invasive Surface Device. Human Gene Therapy Methods. 23 (3), 157-168 (2012).
- Kichaev, G., et al. Electroporation mediated DNA vaccination directly to a mucosal surface results in improved immune responses. Human Vaccines & Immunotherapeutics. 9 (10), 2041-2048 (2013).
- Klunner, T., Bartels, T., Vordermeier, M., Burger, R., Schafer, H. Immune reactions of CD4- and CD8-positive T cell subpopulations in spleen and lymph nodes of guinea pigs after vaccination with Bacillus Calmette Guerin. Vaccine. 19 (15-16), 1968-1977 (2001).
- Shedlock, D. J., et al. Induction of Broad Cytotoxic T Cells by Protective DNA Vaccination Against Marburg and Ebola. Molecular Therapy. 21 (7), 1432-1444 (2013).
- Hensel, M. T., et al. Prophylactic Herpes Simplex Virus 2 (HSV-2) Vaccines Adjuvanted with Stable Emulsion and Toll-Like Receptor 9 Agonist Induce a Robust HSV-2-Specific Cell-Mediated Immune Response, Protect against Symptomatic Disease, and Reduce the Latent Viral Reservoir. Journal of Virology. 91 (9), 02257 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados