Method Article
Em Situ Microscopia para determinação em tempo real da morfologia unicelular em bioprocessos
Neste Artigo
Resumo
Um dispositivo de microscopia in situ foto-óptico foi desenvolvido para monitorar o tamanho de células individuais diretamente na suspensão celular. A medição em tempo real é conduzida aparando a sonda esterilizável foto-óptica a uma análise de imagem automatizada. Mudanças morfológicas aparecem com dependência do estado de crescimento e das condições de cultivo.
Resumo
O monitoramento in situ em bioprocessos microbianos é restrito principalmente a propriedades químicas e físicas do meio(por exemplo,valor do pH e concentração de oxigênio dissolvido). No entanto, a morfologia das células pode ser um indicador adequado para condições ideais, uma vez que muda com a dependência do estado de crescimento, acumulação de produtos e estresse celular. Além disso, a distribuição de tamanho unicelular fornece não apenas informações sobre as condições de cultivo, mas também sobre a heterogeneidade populacional. Para obter tais informações, foi desenvolvido um dispositivo de microscopia in situ foto-óptica1 para permitir o monitoramento da distribuição de tamanho unicelular diretamente na suspensão celular em biorreatores. Uma análise de imagem automatizada é acoplada à microscopia baseada em um modelo neural da rede, que seja treinado com imagens usuário-anotadas. Vários parâmetros, que são obtidos a partir das capturas do microscópio, estão correlacionados ao processo de características relevantes das células, como sua atividade metabólica. Até agora, a série apresentada da ponta de prova da microscopia do in situ foi aplicada para medir o tamanho da pelota em suspensões filamentous dos fungos. Foi usado para distinguir o tamanho unicelular no cultivo de microalgas e relacioná-lo ao acúmulo de lipídios. A forma de partículas celulares foi relacionada ao brotamento em culturas do fermento. A análise da microscopia pode ser geralmente dividida em três etapas: (i) aquisição de imagem, (ii) identificação de partículas e (iii) análise de dados, respectivamente. Todas as etapas devem ser adaptadas ao organismo e, portanto, são necessárias informações anotadas específicas para alcançar resultados confiáveis. A capacidade de monitorar as mudanças na morfologia celular diretamente em linha ou on-line (em um desvio) permite valores em tempo real para monitoramento e controle, no desenvolvimento de processos, bem como na escala de produção. Se os dados off-line se correlacionarem com os dados em tempo real, as medições off-line tediosas atuais com influências desconhecidas no tamanho da célula se tornam desnecessárias.
Introdução
Características morfológicas das células são muitas vezes relacionadas ao estado fisiológico, uma conexão entre forma e função existe para muitas aplicações. A morfologia de uma única célula é influenciada pelo estado de crescimento, idade da célula, estresses ómóticos e outras células potenciais ou acúmulo de produtos. As mudanças morfológicas das células são muitas vezes uma medida da vitalidade do crescimento de uma cultura. Síntese de produtos intracelulares, acúmulo de lipídios em algas e formação corporal de inclusão em bactérias, entre outras, estão relacionados com o tamanho celular também. Aglomeração celular pode ser outro fator que vale a pena investigar como resumido recentemente2.
As heterogeneidades populacionais podem ser quantificadas com base em características morfológicas das células individuais. Estudos mostraram que a heterogeneidade dentro de uma cultura pode ser significativa, por exemplo,condições de produção em larga escala3 o rendimento global pode ser afetado por um baixo desempenho de subpopulações4.
Normalmente, a avaliação das características morfológicas das células é realizada por amostragem manual ou com uma câmara de fluxo de passagem acoplada a um dispositivo foto-óptico. Isso leva a várias restrições: a quantidade limitada de dados adquiridos dificilmente pode fornecer medições estatisticamente confiáveis; o atraso de tempo entre a amostragem e a acessibilidade dos resultados pode ser muito longo em comparação com a dinâmica do processo; e mais importante, o procedimento de amostragem (localização da porta de amostragem, pré-tratamento da amostra antes da medição, condições desfavoráveis no tubo de amostragem ou bypass) pode desencadear um erro tendencioso, pois o procedimento de amostra em si já pode afetar a célula Morfologia. Finalmente, existe sempre um alto risco de contaminação durante a amostragem ou em soluções de passagem suplementar, se eles não são esterilizáveis no lugar.
A aplicação da microscopia in situ (ISM) pode contornar vários desses problemas. Se as células forem detectadas automaticamente, uma identificação correta de suas características morfológicas pode ser pesquisada5. Até agora, as principais limitações deste método eram (i) o tempo de avaliação das imagens, que era muito longa para aplicações in situ, e (ii) a má resolução de imagens, especialmente em altas densidades celulares. Embora as primeiras soluções do ISM incluíssem amostragem mecânica, diluição da sonda, ou foram restritas a um sistema de passagem suplementar6,7,outras abordagens permitem a captura da suspensão celular diretamente8.
Os recentes avanços no ISM permitem o monitoramento em linha ou on-line das células em uma base unicelular, o que fornece a distribuição de parâmetros morfológicos em tempo real diretamente em suspensões celulares em concentrações de células consideravelmente altas. Através de análises off-line dos parâmetros-chave das células, correlações com informações fornecidas pela detecção automatizada de células acoplada e ISM podem ser identificadas. Em seguida, novos projetos de sensores macios são alcançados, nos quais um parâmetro incomensurável é estimado com a morfologia unicelular.
Neste relatório, o ISM é conduzido acoplásse uma sonda foto-óptica a uma análise de imagem automatizada. O ISM consiste em uma sonda de sensor de haste única que permite a captura de imagens dentro de uma faixa de foco conhecida em uma lacuna de medição ajustável com uma câmera CCD de alta resolução [MM-Ho = CCD GT2750 (2750x2200) e MM 2.1 = CMOS G507c (2464x2056)]. A iluminação da luz flash é conduzida pela transmissão. Portanto, a luz se origina do lado oposto da câmera9 e sua intensidade pode ser ajustada. As células passam continuamente por essa lacuna com o fluxo líquido. Assim, uma população representativa da amostra é obtida. A sonda pode ser montada diretamente para o biorreator para que ele atinja a suspensão celular, ou pode ser usado em um desvio estéril. A casca do sensor é conectada ao sistema antes da esterilização, as peças ópticas são montadas mais tarde no escudo.
Até agora, os microorganismos industriais relevantes, por exemplo,fungos filamentosos (diâmetro de até mais de 200 μm), as microalgas heterotróficas Crypthecodinium cohnii (diâmetro médio celular de 20 μm), e o fermento Saccharomyces cerevisiae (diâmetro médio celular de 5 μm), foram investigados com este ou dispositivos similares, o que é mal descrito.
Fungos filamentosos tendem a formar pelotas certas condições de cultivo. Estes são de um tamanho de até várias centenas de μm. A híha das células fúngicas desenvolve diferentes comprimentos na dependência do estresse hidrodinâmico na fase de fluido. Isso tem uma influência sobre a atividade metabólica e de crescimento, captação de substratos e liberação de produtos. O ISM foi aplicado para identificar a distribuição do tamanho da pelota e a largura das zonas de menor densidade de biomassa nas bordas das pelotas (dados não publicados próprios).
O tamanho de C. cohnii altera entre 15 e 26 μm quando as células acumulam o ácido graxo poliinsaturado ácido graxo ácido docosahexaenóico (DHA) limitação de nitrogênio. Este processo de produção de DHA biotecnológico consiste em duas partes, a fase de crescimento, em que as células se dividem e se tornam menores, e a fase de produção, na qual as células acumulam o produto e, assim, tornam-se maiores. Portanto, o tamanho da célula foi usado para determinar o estado do processo, no qual o crescimento ou a produção de DHA foram favoráveis. Finalmente, uma correlação entre o tamanho da célula e o conteúdo dha foi encontrada. Neste caso, o ISM permite monitorar o acúmulo intracelular de DHA em tempo real sem a exigência de amostragem, interrupção celular e a análise de cromatografia a gás comum10.
O fermento de brotamento é geralmente de um tamanho entre 3 e 8 μm. A proporção de células que estão no estado de maturação de cada vez, conforme descrito com o índice de brotamento (BI), fornece informações sobre a vitalidade de crescimento11,12, e até mesmo uma relação com a secreção de proteína recombinante foi comprovada13. Com a ajuda do ISM, as células de levedura em ascensão e não brotamento (células com e sem um broto) foram distinguidas14. As condições de estresse também podem levar a uma variação mais ampla do tamanho da célula dentro de uma população de levedura, como recentemente mostrado em cultivos em escala para baixo, em que as condições de cultivos em lote alimentado em grande escala limitados por nutrientes foram imitadas3.
Portanto, o ISM tem o potencial de monitorar a vitalidade do crescimento e a formação de produtos em um nível unicelular durante todas as etapas de um bioprocesso para a identificação de condições ideais de cultivo, ou para fins de controle de processos. Os métodos descritos aqui estão focados em aplicações microbianas com células únicas, mas também são aplicáveis a partículas maiores, como células humanas e animais, aglomeradas celulares e pelotas de organismos filamentosos.
Protocolo
NOTA: Os seguintes passos são necessários para adaptar os parâmetros às respectivas condições de microrganismos e cultura. O ajuste das configurações da sonda dura cerca de 20 min para um usuário experiente. Uma descrição detalhada das ferramentas e etapas é dada no manual correspondente da ponta de prova de SOPAT GmbH. Em geral, são necessárias as ferramentas que são apresentadas no seguinte protocolo: (i) Controlador de sonda para ajustes de sonda e aquisição de imagem; (ii) Fiji (ImageJ) para anotações em imagens adquiridas; (iii) Suporte SOPAT para treinamento de rede neural artificial (ANN) e criação de fluxo de trabalho; (iv) Batcher para processamento de lotes de dados usando imagens já adquiridas com fluxo de trabalho; (v) Analisador de Resultados para visualização e avaliação de resultados em imagens processadas em lote; e (vi) Monitor para medição automatizada em tempo real e visualização de resultados.
1. Definição de parâmetros de hardware
- Prepare uma cultura com a maior concentração celular que pode ser alcançada durante o experimento ou centrífuga e resuspenda a pelota para alcançar essa concentração. Neste caso, 65 gL-1 de concentração de biomassa seca foi escolhido para cultivos de S. cerevisiae.
- Prepare diferentes diluições, que variam da concentração mais alta à mais baixa para que a faixa esperada seja totalmente coberta. Recomenda-se um mínimo de 4 concentrações diferentes.
- Identifique a faixa de tamanho celular do microorganismo com microscopia convencional. Defina o diâmetro máximo esperado (dmáximo)das respectivas células. Este valor é fixado em 8 μm em caso de S. cerevisiae.
- Escolha duas lacunas de medição de 5x e 10x domáximo d esperado das células.
- Escolha a intensidade máxima do stroboscope. Escolha intensidades de stroboscope para ambas as lacunas com a maior concentração celular para que as células ainda sejam visíveis nas imagens com a menor intensidade de luz (imagens mais escuras).
- Escolha a intensidade mínima do stroboscope e, em seguida, escolha intensidades de estóscópio para ambas as lacunas para que as células ainda sejam visíveis nas imagens com a maior intensidade de luz (imagens mais brilhantes). Use a menor concentração celular, que provavelmente aparece durante o período de medição.
- Escolha uma posição de foco, que produz as imagens mais nítidas para cada lacuna de medição, tanto para intensidades de stroboscope quanto para a faixa de concentração que precisa ser testada (veja o passo 2 para detalhes sobre foco). As células de foco apropriadamente para que os dados de imagem possam ser anotados posteriormente (ver passo 4).
- Medir a série de diluição previamente preparada da concentração celular (ver passo 2) com larguras de abertura e intensidades de estroboscópio.

Figura 1: Ferramenta de calibração de concentração. Esquerda GUI: set diretórios de imagem (mínimo de 3) com concentrações conhecidas; GUI central: escolha os recursos a serem calculados no diretório de imagens; GUI certo: escolha o erro quadrado médio de raiz ponderada (WRMSE) para identificar o mínimo. WRMSE e a melhor correlação entre qualquer recurso de imagem e a concentração celular. Clique aqui para ver uma versão maior deste número.
- Avalie o experimento da série de diluição.
- Use a ferramenta de calibração de concentração (CoCa) (ver Figura 1)para identificar a correlação ideal entre as características de imagem extraídas (brilho ou nitidez) e as concentrações previamente medidas fornecidas pelo usuário, por exemplo,biomassa seca ou contagem de células. Siga as instruções no manual de software para mais detalhes.
- Identifique a correlação ideal entre as informações extraídas das características da imagem em várias concentrações em comparação com quaisquer medições off-line. Veja a lenda da Figura 1.
- Escolha a lacuna de medição mais razoável e as intensidades do estroboscópio em consideração da curva de correlação de concentração com as características que resultam no menor erro quadrado médio de raiz ponderada (WRMSE).
NOTA: A diferença de medição é fixada durante o experimento, enquanto a intensidade do stroboscope pode ser adaptada de acordo com a concentração celular.
2. Medição off-line
- Ajuste a lacuna de medição desejada de acordo com a etapa 1 com a ajuda de um medidor de espessura.
- Abra a interface gráfica do usuário Controle de Sonda no painel SOPAT.
- Conecte a sonda desejada ao amplificador na subseção de software Ações e pressione Connect.
- Pressione o botão Play para começar a transmitir (Live View).
- Limpe a lacuna de medição pulverizando etanol na lacuna e limpe cuidadosamente qualquer poeira ou sujeira com um papel óptico. Verifique se o vidro do sensor está livre de partículas com a visão ao vivo no CamControl.
NOTA: Partículas e poeira perturbam as medições e a identificação automática de células. - Coloque um papel óptico seco na lacuna de medição. Abra o controle da sonda da aba e ajuste a intensidade do stroboscope a fim visualizar o papel. Vire o parafuso de ligação até que as fibras únicas do papel são claramente vistos.
- Encha um tubo com caldo de cultura. Mergulhe o microscópio no caldo de cultura para que a lacuna seja totalmente coberta com suspensão celular. Abra o controle da sonda da aba e ajuste a intensidade desejada do stroboscope de acordo com a seção 1. Concentre-se nas células, ajustando o parafuso de ligação de foco. O foco não deve ser mais alterado durante o experimento
NOTA: 5-6 mL de caldo de cultura são adicionados a um tubo cônico centrífuga de 50 mL para flutuar a lacuna de medição suficientemente. - Defina o número de quadros por ponto de tempo [-] na interface do usuário no menu Desencadeando nos quadros gui por gatilho. Defina o número de quadros para 200 quadros por gatilho.
NOTA: O número de quadros pode ser reduzido ao menor valor, o que é necessário para um resultado estatístico confiável. Isso depende do tamanho da amostra necessário para obter uma distribuição representativa do tamanho das células morfológicas (veja também o passo 5). - Defina a taxa de quadros [Hz] no menu Desencadeando na taxa gui frame. Escolha uma taxa de quadros que garanta que as partículas em movimento de um quadro anterior não aparecerão no quadro a seguir.
NOTA: Isso pode ser provado com um gatilho de teste com 200 quadros. Inspecione as imagens para partículas, que são capturadas repetidamente. Se este for o caso, diminuir a taxa de quadros. Para medições off-line, 1 Hz é recomendado. - Definir o diretório, em que as imagens adquiridas serão salvas, no menu Geral.
- Realize uma aquisição de imagem ativando o botão de aquisição do gatilho de imagem Iniciar. Mova o tubo com suspensão da cultura delicadamente acima e para baixo para induzir um fluxo através da abertura de medição.
- Repita o passo 2.5 após cada medida.
- Verifique as imagens adquiridas. As células têm de ser suficientemente afiadas para a notação. Inspecione as imagens para partículas, que são capturadas repetidamente. Se este for o caso, diminuir a taxa de quadros.
- Salve as configurações selecionando o seguinte caminho: C:\Program Files\SOPAT GmbH\monitoringPrograms\camcontrol, e pressione Save.
3. Identificação de partículas
- Anote partículas para o treinamento da rede neural artificial (ANN) (conjunto de treinamento).
- Carregue as imagens adquiridas na ferramenta de anotação "Fiji, ImageJ" arrastando e soltando o arquivo na janela Principal "ImageJ" (veja GUI "Fiji" ferramenta na Figura 2)
- Abra o Gerente de ROI selecionando: Analise | Ferramentas | Roi Gerente.
- Escolha uma ferramenta de seleção. Ferramenta de varinha (rastreamento), seleções à mão livre, oval ou elípticas são recomendadas.
- Desenhe um círculo em torno da partícula que deve ser anotada com as ferramentas de seleção mencionadas antes e, em seguida, refiná-lo com a ferramenta de pincel.
- Adicione a anotação ao gerente de ROI pressionando Adicionar [t].
- Marque todos os objetos de interesse (células a serem identificadas) em cerca de 15 imagens.
NOTA: Para cobrir todas as informações necessárias, ou seja, diferentes formas, tamanhos, concentração de células, brilho, etc., use cinco imagens desde o início, cinco imagens do meio e cinco imagens do final do experimento. - Decida, se as células precisam ser classificadas em diferentes subclasses devido à sua forma(por exemplo,diferentes fases de um ciclo celular), ou se todas as células são da mesma classe.
- Mude o nome de cada partícula selecionada de acordo. Defina um nome ou abreviação para cada classe e um contador para cada partícula da classe(por exemplo,cell_1, cell_2, etc.). Anote pelo menos 50 partículas por classe.
- Não anote objetos, que não devem ser detectados, porque eles não são relevantes para o processo, como bolhas de gás ou outras partículas como componentes de mídia não dissolvidos.
NOTA: Esses eventos não serão incluídos no procedimento de treinamento para o ANN e ser considerado como pano de fundo. - Não anote as células que estão fora de foco.
- Anote as imagens o mais consistente possível. Se houver dúvidas, o rótulo Ignore pode ser aplicado. É altamente recomendado não abusar de seu uso, uma vez que o ANN só vai reconhecer as estruturas que são rotulados.

Figura 2: Interface do usuário da ferramenta Fiji. Um conjunto de treinamento é criado com as imagens anotadas. Uma anotação manual composta por duas classes é retratada, a lista de partículas anotadas é mostrada no Roi Manager. Diferentes nomes e cores podem ser definidos para diferentes classes. Clique aqui para ver uma versão maior deste número.
- Salve os objetos anotados e a imagem para um formato ZIP e envie o arquivo para a rede de treinamento, seja via upload para a plataforma ou enviando o arquivo ZIP por e-mail.
NOTA: Normalmente, é preciso uma série de rodadas de treinamento iterativo para identificar previsões adequadas dos objetos classificados nas imagens. Cada rodada de treinamento leva a um fluxo de trabalho que é devolvido pelo programa. - Use o fluxo de trabalho (*.wf) com o algoritmo de reconhecimento de objetotreinado para analisar imagens de teste com o lote de dados progredindo no programa Batcher que pode ser iniciado no painel de instrumentos.
- Verifique a detecção de objetos nas imagens de teste através da quantificação de eventos falsos positivos e negativos.
- Quantifique a detecção de eventos falsos positivos: partículas erroneamente detectadas como células, células que não são classificadas corretamente e células das quais o contorno não foi bem identificada.
- Quantificar os falsos eventos negativos (células que não são reconhecidas como tal).
- Visualize os resultados na ferramenta Resultado analisador, iniciando o programa no painel.
- Importar os arquivos de resultados desejados com arquivo | Arquivo de importação ou arquivo | As pastas de importação.
- Visualize os resultados pelo Gráfico | Criar gráfico nos gráficos GUI.
- Selecione uma das seguintes opções: gráfico de distribuição, trama de sensibilidade, característica ao longo do tempo, característica sobre pontos de pesquisa e recurso vs. recurso.
NOTA: Um manual sobre a utilização do Analisador de Resultados vem com o sistema e também está disponível a partir do suporte. - Se os resultados forem aceitáveis, execute o fluxo de trabalho no Batcher em todas as imagens adquiridas do experimento. Ao mesmo tempo, o programa de monitoramento pode ser criado combinando as configurações salvas do Controlador de Sonda (*.pcfg) com o fluxo de trabalho (*.wf), veja também o manual.
NOTA: O fluxo de trabalho também pode ser usado para monitorar futuras experiências para esta mídia cultural. - Se os resultados não forem aceitáveis, verifique a anotação no conjunto de treinamento e/ou continue com outra rodada de treinamento iterativo (ver passo 4.2).
4. Quantificação do tamanho da amostra
- Defina o desvio padrão (σ), que é aceitável entre as partículas detectadas.
NOTA: O desvio padrão muda em paralelo com a homogeneidade do tamanho celular. O desvio padrão máximo indica a amostra com o maior grau de heterogeneidade de tamanho. - Defina a amplitude do intervalo de confiança ou a precisão desejada em relação à variação esperada das medições (e).
- Definir o erro admitido (α) entre 5% (z1-α/2 = 1,96) e 10% (z1-α/2 = 1,64).
- Calcule o número de células a serem identificadas a partir de cada classe a partir da equação 1.
 [Equação 1]
[Equação 1]
NOTA: Com base no número de células, o número de imagens que precisam ser adquiridas pode ser definido para cada ponto de dados. - Realize uma análise de sensibilidade em pontos de tempo aleatórios do experimento para verificar se a análise de partículas n leva a uma variabilidade do diâmetro médio de Feret e do Dv90 de menos de 5%. Ele pode ser calculado automaticamente no Analisador de Resultados.
5. On-line (By-Pass) ou em linha de medição
- Realize o procedimento de medição off-line primeiro (ver passo 2), a fim de definir as configurações de hardware e software em função do organismo e do processo (concentração ou mídia).
- Faça o upload das configurações salvas da seção anterior, selecionando o botão Load e selecione o seguinte caminho: C:\Program Files\SOPAT GmbH\monitoringPrograms\camcontrol.
- Conecte a sonda à célula de fluxo ou ao biorreator.
NOTA: Medições in situ podem ser realizadas com uma pitada flange. - Realizar esterilização.
NOTA: Apenas o material sonda-wetted do instrumento é esterilizável através da esterilização a vapor. O comprimento do tinque da ponta de prova pode ir de 6 a 222 milímetros(figura 3).
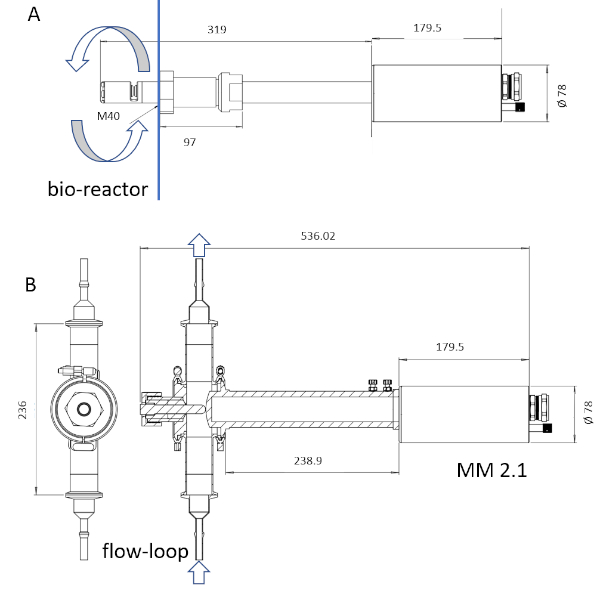
Figura 3: Esboço dos dispositivos ISM. A sonda MM-Ho (A)é instalada diretamente no biorreator, enquanto a sonda MM 2.1(B)pode ser usada como passagem suplementar. A circulação do caldo de cultura é marcada com setas em cada imagem. Os fatores de conversão são 0,166 μm pix-1 para MM-Ho e 0,087 μm pix-1 para MM 2.1. Clique aqui para ver uma versão maior deste número.
- Defina a taxa de aquisição de imagem no gui desencadeando no intervalo de gatilho de campo .
NOTA: Dependendo da dinâmica do processo, a taxa de aquisição de imagem pode ser adaptada. Por exemplo, se for esperada uma fase de atraso de 3 horas, a taxa de aquisição pode ser menor do que se uma mudança de metabolismo ou o acúmulo de um produto for monitorado. Normalmente, isso requer um tempo de aquisição muito mais curto na faixa de minutos. Por exemplo, uma sequência de aquisição de imagem entre 5 e 10 min durante um lote de cultivo de levedura fornece informações suficientes para capturar a dinâmica do processo. - Defina a taxa de quadros, conforme explicado na etapa 2.10.
NOTA: Em medições on-line e em linha, a taxa de quadros pode ser aumentada, uma vez que a agitação mecânica pode aumentar a taxa de fluxo através da lacuna. - Iniciar a aquisição de imagem ativando o botão Iniciar streaming de sonda selecionada.
- Pare de aquisição quando o experimento for concluído com o botão Stop streaming da sonda selecionada.
NOTA: Para a1ª corrida, inicie a aquisição pouco antes da inoculação da cultura e prossiga para o passo 4. Para as seguintes corridas, abra o programa de monitoramento no painel e selecione o fluxo de trabalho criado (ver passo 4). Comece o monitoramento pouco antes da inoculação da cultura pressionando o botão Play.
Resultados
A detecção do tamanho da pilha em culturas do fermento com o ISM e a deteção automatizada da imagem para distinguir entre pilhas de brotamento e non-budding foi conduzida com sucesso. Tanto a intensidade do stroboscope quanto a escolha da lacuna de medição têm uma gama de tolerância, na qual a identificação de partículas não é afetada. Por exemplo, as células de S. cerevisiae foram medidas com várias intensidades de estóscópio dentro de uma faixa de variação de 11% em uma concentração de biomassa seca de 4 g L-1. As imagens correspondentes forneceram limites celulares acentuados, portanto, a identificação de partículas foi viável com uma variação aceitável do tamanho da célula (1%) independentemente da intensidade do stroboscope. Caso a intensidade do stroboscope não seja devidamente ajustada, as imagens sofrem de excesso de iluminação e uma identificação celular adequada não será viável(Figura 4).

Figura 4: Recursos de aquisição de imagem. Exemplos de várias intensidades de stroboscope (SI-%) e as lacunas de medição (MG-μm) para a captura de células Cerevisiae (valores atuais de SI e MG são indicadas entre parênteses): A (25, 50); B (50, 50); C (25, 80); e D (50, 80). Clique aqui para ver uma versão maior deste número.
Até agora, a lacuna de medição não pode ser reajustada durante uma medição in situ. Portanto, o experimento da série de diluição é crucial para garantir dados confiáveis ao longo de um cultivo. A principal preocupação é a ocorrência de eventos sobrepostos não identificáveis devido ao incremento na concentração celular.
Uma trama de sensibilidade (análise de sensibilidade de valores característicos, por exemplo,média de diâmetro celular em relação ao número de partículas n) de todas as células detectadas do arquivo de dados carregados pode ser visualizada(Figura 5). O usuário deve decidir qual estabilidade de um determinado parâmetro de processo é necessária. Neste caso, o número mínimo de células necessárias para um ponto de dados válido. Em conseqüência, mais ou menos imagens podem ser analisadas para um ponto de dados.

Figura 5: Trama de sensibilidade de diâmetro celular médio. Variabilidade do diâmetro celular médio na dependência do número de partículas detectadas. Um valor constante do diâmetro celular médio é alcançado com cerca de 1.000 células. Clique aqui para ver uma versão maior deste número.
A anotação é o ponto-chave para alcançar a precisão desejada da identificação de partículas. A Figura 6 mostra um exemplo de "anotação do usuário" (A), que é usada como conjunto de treinamento para a rede neural, bem como a identificação de partículas em uma imagem do conjunto de testes (dados desconhecidos para a rede neural), que é usado para sua avaliação (B). Ambas as imagens devem ter uma taxa semelhante de eventos identificados.

Figura 6: Comparação da anotação do usuário (conjunto de treinamento) e detecção automática (conjunto de teste). Conjunto de treinamento: imagens anotadas e originais são retratadas em A,e A',respectivamente. As informações desta imagem são usadas para treinar o conjunto de testes ANN. Clique aqui para ver uma versão maior deste número.
Como exemplo do efeito do acúmulo intracelular do produto na distribuição do tamanho da célula, o acúmulo do ácido graxo poliinsaturado ácido docosahexaenóico (DHA) por limitação de nitrogênio foi investigado nas microalgas heterotróficas C. cohnii. Demonstrou-se que o acúmulo do produto pode ser detectado quantitativamente por meio do ISM10. O método é usado atualmente para investigar o impacto das forças de cisalhamento em biorreatores agitados na heterogeneidade morfológica das células.
O estado de maturação da levedura brotação S. cerevisiae foi quantificado. No caso do brotamento, a proporção de células que estão no estado de maturação de cada vez (descrito com o BI), fornece informações sobre a atividade de crescimento e heterogeneidade populacional. O reconhecimento automático da pilha podia identificar e distinguir pilhas de brotamento e non-budding (ou filha) com sucesso na suspensão de pilha15. A distribuição do tamanho celular de três amostras é mostrada na Figura 7. Uma mudança para as células menores indica uma parcela menor de células brotando dentro da população.

Figura 7: Distribuição cumulativa do tamanho de uma célula. Distribuições de tamanho celular medidas durante o curso de tempo de um cultivo em 3 h (linha reta), 7 h (linha pontilhada) e 13 h (linha tracejada). Clique aqui para ver uma versão maior deste número.
Discussão
O ISM apresentado aqui com os mesmos ou dispositivos muito semelhantes foi usado para medir a dinâmica morfológica de fungos, microalgas e células de levedura, o que possibilitou a determinação da atividade de crescimento e, em caso de algas, acúmulo de produtos intracelulares. O sensor não tem peças móveis e é diretamente aplicável em qualquer biorreator de tanque mexido padrão, seja através de uma porta padrão ou em um desvio estéril. Desde que o fermento é muito menor do que algas, a redução no tamanho da pilha exigiu algumas adaptações recentes da ferragem como uma definição e uma iluminação mais elevadas da câmera pela transmissão a fim começ uma definição suficiente do pixel do fermento (para detalhes técnicos, veja15). No entanto, ainda existe uma limitação para medir células ainda menores, como bactérias. A instrumentação foto-óptica in situ atual indica limitações em relação à sobreposição de informações de partículas em alta concentração e efeitos de interferência com estruturas abaixo do espectro UV/VIS. Atualizados, algoritmos de análise de imagem para suspensões bacterianas não foram aplicados, além das correlações de brilho16.
Outras ferramentas de ISM previamente aplicadas foram usadas para determinar a concentração da pilha a fim mostrar sua confiabilidade. Isto, entretanto, tornou-se crucial se as pilhas se sobrepunham em concentrações elevadas. Portanto, o foco deste estudo não foi a quantificação celular, mas a detecção de recursos morfológicos, enquanto características de imagem como intensidade de brilho podem ser correlacionadas com a densidade celular realizada com outros dispositivos, também17. Caso contrário, todos esses dispositivos seriam limitados a baixas concentrações celulares; uma concentração máxima de ca. 20 g L-1 de pilhas do fermento foi avaliada ao usar uma aproximação do reconhecimento de pilha contra ca. 80 g L-1 ao usar um algoritmo do tamanho do conjunto.
A fim de rastrear as características morfológicas de uma célula, suas bordas precisam ser detectadas com precisão. No caso das algas, isso é bastante simples à medida que o tamanho muda, mas a forma permanece constante durante toda a transição das etapas do processo. Em contraste, as células de levedura fornecem um desafio maior devido à sua forma, que não pode ser aproximada a uma esfera ou elipse quando as células estão brotando. No entanto, até agora o tamanho da célula foi calculado a suposição de que uma célula é uma esfera perfeita nas mediçõesism 18. Embora esta aproximação esteja próxima da realidade para alguns casos, formas mais complicadas, como células em ascensão ou células em forma de haste, não podem ser devidamente avaliadas. Neste estudo, no entanto, diferentes formas foram analisadas com sucesso devido à detecção de limite flexível habilitada por meio de algoritmos de aprendizado de máquina. Além disso, os eventos sobrepostos ainda estão investigação19 para alcançar uma nova fase de desenvolvimento.
Atualmente, o padrão ouro para a avaliação da vitalidade e da viabilidade é contar unidades de formação da colônia ou manchar uma amostra com uma tintendência da viabilidade20, por exemplo,methylee violeta ou methyleno21; no entanto, este procedimento pode influenciar os resultados. Sempre que tais características estão relacionadas à morfologia celular22,o potencial de avaliá-las rapidamente deve ser explorado pelo potencial crescente do ISM. Além disso, parâmetros de processo crítico e/ou atributos de qualidade23 podem estar relacionados à formação de forma, aglomeração e pelotas, que podem ser monitorados pelo ISM.
Investigações com outros microorganismos-chave frequentemente utilizados no bioprocesso são realizadas atualmente. O tempo para a adaptação dos algoritmos de reconhecimento de objetos e a extração de recursos para análise de recursos depende principalmente da complexidade das imagens e da precisão esperada dos resultados. No futuro, a captura de imagem colorida será considerada para ampliar ainda mais o leque de informações, que poderiam ser obtidas em um nível unicelular, por exemplo,se os pigmentos forem acumulados ou em organismos geneticamente modificados, nos quais marcadores coloridos foram integrados.
Divulgações
Os autores não têm nada a declarar.
Agradecimentos
Os autores são gratos pelo apoio do Ministério Federal alemão de Economia e Energia no âmbito ZIM-Koop, projeto "Smart Process Inspection", concede não. ZF 4184201CR5.
Materiais
| Name | Company | Catalog Number | Comments |
| Sensor MM 2.1 - MFC | SOPAT GmbH, Germany | n.a. | Inline Monocular Microscopic probe Version 2.1 with a Mirco Flow Cell |
| Sofware version v1R.003.0092 | SOPAT GmbH, Germany | n.a. | |
| Thickness gauge | n.n. | It can be any supplier, DIN 2275:2014-03 | |
| Ethanol 70% | n.n. | It can be any supplier | |
| SOPAT manual Version 2.0.5 | SOPAT GmbH, Germany | ||
| Optical lense paper | VWR | 470150-460 | |
| Fiji, ImageJ | open source | ||
| 50 mL conical centrifuge tubes | It can be any supplier |
Referências
- Maaß, S., Rojahn, J., Hänsch, R., Kraume, M. Automated drop detection using image analysis for online particle size monitoring in multiphase systems. Computers & Chemical Engineering. 45, 27-37 (2012).
- Lemoine, A., Delvigne, F., Bockisch, A., Neubauer, P., Junne, S. Tools for the determination of population heterogeneity caused by inhomogeneous cultivation conditions. Journal of biotechnology. 251, 84-93 (2017).
- Marbà-Ardébol, A. M., Bockisch, A., Neubauer, P., Junne, S. Sterol synthesis and cell size distribution under oscillatory growth conditions in Saccharomyces cerevisiae scale-down cultivations. Yeast. 35 (2), 213-223 (2017).
- Xiao, Y., Bowen, C. H., Liu, D., Zhang, F. Exploiting nongenetic cell-to-cell variation for enhanced biosynthesis. Nature chemical biology. 12 (5), 339-344 (2016).
- Beutel, S., Henkel, S. In situ sensor techniques in modern bioprocess monitoring. Applied microbiology and biotechnology. 91 (6), 1493 (2011).
- Belini, V. L., Wiedemann, P., Suhr, H. In situ microscopy: A perspective for industrial bioethanol production monitoring. Journal of microbiological methods. 93 (3), 224-232 (2013).
- Havlik, I., et al. Monitoring of microalgal cultivations with on-line, flow-through microscopy. Algal Research. 2 (3), 253-257 (2013).
- Suhr, H., Herkommer, A. M. In situ microscopy using adjustment-free optics. Journal of biomedical optics. 20 (11), 116007 (2015).
- Panckow, R. P., Reinecke, L., Cuellar, M. C., Maaß, S. Photo-Optical In-Situ Measurement of Drop Size Distributions: Applications in Research and Industry. Oil Gas Sci. Technol. - Rev. IFP Energies. 72 (3), 14 (2017).
- Marbà-Ardébol, A. -. M., Emmerich, J., Neubauer, P., Junne, S. Single-cell-based monitoring of fatty acid accumulation in Crypthecodinium cohnii with three-dimensional holographic and in situ microscopy. Process Biochemistry. 52, 223-232 (2017).
- Porro, D., Vai, M., Vanoni, M., Alberghina, L., Hatzis, C. Analysis and modeling of growing budding yeast populations at the single cell level. Cytometry. Part A : the journal of the International Society for Analytical Cytology. 75 (2), 114-120 (2009).
- Brauer, M. J., et al. Coordination of growth rate, cell cycle, stress response, and metabolic activity in yeast. Molecular biology of the cell. 19 (1), 352-367 (2008).
- Puxbaum, V., Gasser, B., Mattanovich, D. The bud tip is the cellular hot spot of protein secretion in yeasts. Applied microbiology and biotechnology. 100 (18), 8159-8168 (2016).
- Marbà-Ardébol, A. M., Emmerich, J., Neubauer, P., Junne, S. Vol. P2. Prozessmesstechnik. , 222-225 (2017).
- Marbà-Ardébol, A. -. M., Emmerich, J., Muthig, M., Neubauer, P., Junne, S. Real-time monitoring of the budding index in Saccharomyces cerevisiae batch cultivations with in situ microscopy. Microbial cell factories. 17 (1), 73 (2018).
- Marquard, D., Schneider-Barthold, C., Düsterloh, S., Scheper, T., Lindner, P. Online monitoring of cell concentration in high cell density Escherichia coli cultivations using in situ Microscopy. Journal of biotechnology. 259, 83-85 (2017).
- Marquard, D., et al. In situ microscopy for online monitoring of cell concentration in Pichia pastoris cultivations. Journal of biotechnology. 234, 90-98 (2016).
- Camisard, V., Brienne, J., Baussart, H., Hammann, J., Suhr, H. Inline characterization of cell concentration and cell volume in agitated bioreactors using in situ microscopy: application to volume variation induced by osmotic stress. Biotechnology and bioengineering. 78 (1), 73-80 (2002).
- Böhm, A., Ücker, A., Jäger, T., Ronneberger, O., Falk, T. ISOODL: Instance segmentation of overlapping biological objects using deep learning. , 1225-1229 (2018).
- Davey, H. M. Life, Death, and In-Between: Meanings and Methods in Microbiology. Applied and environmental microbiology. 77 (16), 5571-5576 (2011).
- Lodolo, E. J., Kock, J. L., Axcell, B. C., Brooks, M. The yeast Saccharomyces cerevisiae-the main character in beer brewing. FEMS yeast research. 8 (7), 1018-1036 (2008).
- Albertin, W., et al. Population size drives industrial Saccharomyces cerevisiae. alcoholic fermentation and is under genetic control. Applied and environmental microbiology. 77 (8), 2772-2784 (2011).
- Gomes, J., Chopda, V. R., Rathore, A. S. Integrating systems analysis and control for implementing process analytical technology in bioprocess development. Journal of Chemical Technology and Biotechnology. 90 (4), 583-589 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados