Method Article
In Situ Mikroskopie zur Echtzeitbestimmung der einzelzelligen Morphologie in Bioprozessen
In diesem Artikel
Zusammenfassung
Ein fotooptisches In-situ-Mikroskopiergerät wurde entwickelt, um die Größe einzelner Zellen direkt in der Zellsuspension zu überwachen. Die Echtzeitmessung erfolgt durch Kopplung der photooptischen sterilisierbaren Sonde an eine automatisierte Bildanalyse. Morphologische Veränderungen treten mit Abhängigkeit vom Wachstumszustand und den Anbaubedingungen auf.
Zusammenfassung
Die In-situ-Überwachung in mikrobiellen Bioprozessen beschränkt sich meist auf chemische und physikalische Eigenschaften des Mediums(z.B.pH-Wert und Die Konzentration auf gelöster Sauerstoff). Dennoch kann die Morphologie der Zellen ein geeigneter Indikator für optimale Bedingungen sein, da sie sich mit Abhängigkeit vom Wachstumszustand, der Produktakkumulation und der Zellspannung ändert. Darüber hinaus liefert die Einzelzellgrößenverteilung nicht nur Informationen über die Anbaubedingungen, sondern auch über die Heterogenität der Population. Um solche Informationen zu erhalten, wurde ein fotooptisches In-situ-Mikroskopiongerät 1 entwickelt, um die Überwachung der einzelzelligen Größenverteilung direkt in der Zellsuspension in Bioreaktoren zu ermöglichen. Eine automatisierte Bildanalyse wird an die Mikroskopie gekoppelt, die auf einem neuronalen Netzwerkmodell basiert, das mit benutzerkommentierten Bildern trainiert wird. Mehrere Parameter, die aus den Aufnahmen des Mikroskops gewonnen werden, werden mit prozessrelevanten Merkmalen der Zellen korreliert, wie ihre metabolische Aktivität. Bisher wurde die vorgestellte In-situ-Mikroskopie-Sondenserie zur Messung der Pelletgröße in fadenförmigen Pilzsuspensionen eingesetzt. Es wurde verwendet, um die einzellige Größe in der Mikroalgenkultivatierzukultivierung zu unterscheiden und sie mit der Lipidakkumulation in Beziehung zu setzen. Die Form der zellulären Teilchen war mit dem Aufblühen in Hefekulturen verbunden. Die Mikroskopieanalyse kann im Allgemeinen in drei Schritte unterteilt werden: (i) Bildaufnahme, (ii) Partikelidentifikation bzw. (iii) Datenanalyse. Alle Schritte müssen an den Organismus angepasst werden, und daher sind spezifische, mit Anmerkungen bestellte Informationen erforderlich, um zuverlässige Ergebnisse zu erzielen. Die Möglichkeit, Veränderungen in der Zellmorphologie direkt in der Linie oder im Internet (in einer Umgehungskarte) zu überwachen, ermöglicht Echtzeitwerte für Überwachung und Steuerung, in der Prozessentwicklung sowie im Produktionsmaßstab. Wenn die Off-Line-Daten mit den Echtzeitdaten korrelieren, werden die aktuellen mühsamen Off-Line-Messungen mit unbekannten Einflüssen auf die Zellgröße überflüssig.
Einleitung
Morphologische Merkmale von Zellen hängen oft mit dem physiologischen Zustand zusammen, eine Verbindung zwischen Form und Funktion besteht für viele Anwendungen. Die Morphologie einer einzelnen Zelle wird durch den Wachstumszustand, das Alter der Zelle, osmotische und andere potenzielle Zellspannungen oder Produktakkumulation beeinflusst. Morphologische Veränderungen von Zellen sind oft ein Maß für die Wachstumsvitalität einer Kultur. Intrazelluläre Produktsynthese, Lipidansammlung in Algen und Inklusionkörperbildung in Bakterien, unter anderem, sind auch mit der Zellgröße verbunden. Zellagglomeration kann ein weiterer Faktor sein, der es wert ist, untersucht zu werden, wie kürzlich zusammengefasst2.
Populationsheterogenitäten können anhand morphologischer Merkmale einzelner Zellen quantifiziert werden. Studien zeigten, dass Heterogenität innerhalb einer Kultur signifikant sein kann, z. B.könnte unter großflächigen Produktionsbedingungen3 der Gesamtertrag durch eine geringe Leistung der Subpopulationen beeinflusst werden4.
In der Regel erfolgt die Beurteilung morphologischer Merkmale von Zellen durch manuelle Probenahme oder mit einer Anpass-Durchflusskammer, die an ein fotooptisches Gerät gekoppelt ist. Dies führt zu mehreren Einschränkungen: Die begrenzte Menge der erfassten Daten kann kaum statistisch zuverlässige Messungen liefern; die Zeitverzögerung zwischen der Probenahme und der Zugänglichkeit der Ergebnisse kann im Vergleich zur Dynamik des Prozesses zu lang sein; und am wichtigsten ist, dass das Probenahmeverfahren (Standort des Probenahmeports, Vorbehandlung der Probeprobe vor der Messung, ungünstige Bedingungen in der Probenahme oder im Bypass-Rohr) einen verzerrten Fehler auslösen kann, da das Probenverfahren selbst bereits die Zelle beeinflussen kann. Morphologie. Schließlich besteht immer ein hohes Kontaminationsrisiko bei der Probenahme oder bei Umgehungslösungen, wenn sie nicht sterilisierbar sind.
Die Anwendung der In-situ-Mikroskopie (ISM) kann mehrere dieser Probleme umgehen. Wenn Zellen automatisch erkannt werden, kann eine korrekte Identifizierung ihrer morphologischen Merkmale vermessen werden5. Bisher waren die Haupteinschränkungen dieser Methode (i) die Auswertungszeit von Bildern, die für In-situ-Anwendungen zu lang war, und (ii) die schlechte Auflösung von Bildern, insbesondere bei hoher Zelldichte. Obwohl erste Lösungen von ISM mechanische Probenahme, Verdünnung der Sonde oder waren auf ein Umgehungssystem6,7beschränkt, weitere Ansätze ermöglichen die Erfassung der Zellsuspension direkt8.
Jüngste Fortschritte im ISM ermöglichen die inline- oder online-Überwachung von Zellen auf Einzelzellbasis, die die Verteilung morphologischer Parameter in Echtzeit direkt in Zellsuspensionen bei erheblich hohen Zellkonzentrationen ermöglicht. Durch Off-Line-Analysen der Schlüsselparameter der Zellen können Korrelationen mit Informationen identifiziert werden, die durch die gekoppelte automatisierte Zellerkennung und ISM bereitgestellt werden. Dann werden neue Softsensor-Designs erreicht, bei denen mit der einzelligen Morphologie ein nicht messbarer Parameter geschätzt wird.
In diesem Bericht wird das ISM durch Koppelung einer photooptischen Sonde an eine automatisierte Bildanalyse durchgeführt. Die ISM besteht aus einer einstabigen Sensorsonde, die die Aufnahme von Bildern innerhalb eines bekannten Fokusbereichs in einem einstellbaren Messspalt mit einer hochauflösenden CCD-Kamera [MM-Ho = CCD GT2750 (2750x2200) und MM 2.1 = CMOS G507c (2464x2056)] ermöglicht. Die Blitzlichtbeleuchtung erfolgt über die Übertragung. Daher stammt das Licht von der gegenüberliegenden Seite der Kamera9 und seine Intensität kann eingestellt werden. Zellen passieren diese Lücke kontinuierlich mit dem Flüssigkeitsfluss. Daher wird eine repräsentative Stichprobenpopulation ermittelt. Die Sonde kann direkt am Bioreaktor montiert werden, so dass sie in die Zellsuspension gelangt, oder sie kann in einem sterilisierbaren Bypass verwendet werden. Die Sensorhülle wird vor der Sterilisation mit dem System verbunden, die optischen Teile werden anschließend in die Schale montiert.
Bisher wurden relevante industrielle Mikroorganismen, z.B.fadenförmige Pilze (Durchmesser von bis zu über 200 m), die heterotrophen Mikroalgen Crypthecodinium cohnii (durchschnittlicher Zelldurchmesser von 20 m) und die Hefe Saccharomyces cerevisiae (durchschnittlicher Zelldurchmesser von 5 m) mit diesen oder ähnlichen Vorrichtungen untersucht, was kurz beschrieben wird.
Fadenförmige Pilze neigen dazu, Pellets unter bestimmten Anbaubedingungen zu bilden. Diese haben eine Größe von bis zu mehreren hundert m. Die Hyphen der Pilzzellen entwickeln unterschiedliche Längen in Abhängigkeit von der hydrodynamischen Belastung in der Fluidphase. Dies hat einen Einfluss auf die Stoffwechsel- und Wachstumsaktivität, substrataufnahme und Produktfreisetzung. ISM wurde angewendet, um die Pelletgrößenverteilung und die Breite von Zonen mit geringerer Biomassedichte an den Rändern der Pellets zu identifizieren (eigene unveröffentlichte Daten).
Die Größe von C. cohnii ändert sich zwischen 15 und 26 m, wenn Zellen die mehrfach ungesättigte Fettsäure Docosahexaensäure (DHA) unter Stickstoffbegrenzung ansammeln. Dieser biotechnologische DHA-Produktionsprozess besteht aus zwei Teilen, der Wachstumsphase, in der sich Zellen teilen und kleiner werden, und der Produktionsphase, in der Zellen das Produkt ansammeln und dadurch größer werden. Daher wurde die Zellgröße verwendet, um den Prozesszustand zu bestimmen, in dem entweder Wachstum oder DHA-Produktion günstig war. Schließlich wurde eine Korrelation zwischen der Zellengröße und dem DHA-Inhalt gefunden. In diesem Fall ermöglicht ISM die Überwachung der intrazellulären DHA-Akkumulation in Echtzeit ohne die Notwendigkeit von Probenahme, Zellstörung und der gemeinsamen Gaschromatographie-Analyse10.
Budding Hefe ist in der Regel von einer Größe zwischen 3 und 8 m. Der Anteil der Zellen, die sich gleichzeitig im Reifezustand befinden, wie mit dem angehenden Index (BI) beschrieben, liefert Informationen über die Wachstumsvitalität11,12, und sogar eine Beziehung zur rekombinanten Proteinsekretion wurde13nachgewiesen. Mit Hilfe von ISM wurden angehende und nicht aufkeimende Hefezellen (Zellen mit und ohne Knospe)14unterschieden. Stressbedingungen können auch zu einer breiteren Variation der Zellgröße innerhalb einer Hefepopulation führen, wie kürzlich in scale-down-Kulturen gezeigt wurde, bei denen die Bedingungen für großflächige nährstoffbegrenzte Futter-Batch-Kulturen nachgeahmt wurden3.
Daher hat ISM das Potenzial, die Wachstumsvitalität und Produktbildung auf einzelzelliger Ebene in allen Phasen eines Bioprozesses zur Ermittlung optimaler Anbaubedingungen oder zum Zwecke der Prozesskontrolle zu überwachen. Die hier beschriebenen Methoden konzentrieren sich auf mikrobielle Anwendungen mit Einzelzellen, sind aber auch auf größere Partikel wie menschliche und tierische Zellen, Zellagglomerate und Pellets von fadenförmigen Organismen anwendbar.
Protokoll
HINWEIS: Die folgenden Schritte sind erforderlich, um die Parameter an die jeweiligen Mikroorganismen und Kulturbedingungen anzupassen. Die Einstellung der Sondeneinstellungen dauert für einen erfahrenen Benutzer ca. 20 min. Eine detaillierte Beschreibung der Werkzeuge und Schritte finden Sie im entsprechenden Prüfhandbuch der SOPAT GmbH. Im Allgemeinen werden die Werkzeuge benötigt, die im folgenden Protokoll dargestellt werden: (i) Probe Controller für Sondenanpassungen und Bildaufnahme; (ii) Fidschi (ImageJ) für Anmerkungen zu aufgenommenen Bildern; iii) SOPAT-Unterstützung für die Ausbildung und Erstellung von Workflows für künstliche neuronale Netzwerke (ANN); (iv) Batcher für die Datenverarbeitung mit bereits erfassten Bildern mit einem Workflow; (v) Ergebnisanalyse zur Ergebnisvisualisierung und Auswertung von Batch-verarbeiteten Bildern; und (vi) Monitor für automatisierte Echtzeitmessung und Ergebnisvisualisierung.
1. Einstellen von Hardwareparametern
- Bereiten Sie eine Kultur mit der höchsten Zellkonzentration vor, die während des Experiments oder der Zentrifuge erreicht werden könnte, und setzen Sie das Pellet wieder auf, um diese Konzentration zu erreichen. In diesem Fall wurden 65 gL-1 der Trockenbiomassekonzentration für den Anbau von S. cerevisiae gewählt.
- Bereiten Sie verschiedene Verdünnungen vor, die von der höchsten bis zur niedrigsten Konzentration reichen, so dass der erwartete Bereich vollständig abgedeckt ist. Es werden mindestens 4 verschiedene Konzentrationen empfohlen.
- Identifizieren Sie den Zellgrößenbereich des Mikroorganismus mit konventioneller Mikroskopie. Definieren Sie den erwarteten maximalen Durchmesser (dmax) der jeweiligen Zellen. Bei S. cerevisiaewird dieser Wert auf 8 m festgelegt.
- Wählen Sie zwei Messlücken von 5x und 10x des erwarteten dmax der Zellen.
- Wählen Sie die maximale Stroboskopintensität aus. Wählen Sie Stroboskopintensitäten für beide Lücken mit der höchsten Zellkonzentration, so dass Zellen auf den Bildern mit der niedrigsten Lichtintensität (dunkelste Bilder) noch sichtbar sind.
- Wählen Sie die minimale Stroboskopintensität aus, und wählen Sie dann Stroboskopintensitäten für beide Lücken aus, sodass Zellen auf den Bildern mit der höchsten Lichtintensität (hellste Bilder) noch sichtbar sind. Verwenden Sie die niedrigste Zellkonzentration, die wahrscheinlich während des Messzeitraums auftritt.
- Wählen Sie eine Fokusposition, die die schärfsten Bilder für jede Messlücke liefert, sowohl für die Stroboskopintensitäten als auch für den zu prüfenden Konzentrationsbereich (Details zum Fokussieren siehe Schritt 2). Fokuszellen entsprechend fokussieren, damit die Bilddaten anschließend mit Anmerkungen benotet werden können (siehe Schritt 4).
- Messen Sie die zuvor vorbereitete Verdünnungsreihe der Zellkonzentration (siehe Schritt 2) mit spaltbreiten breiten und Stroboskopintensitäten.

Abbildung 1: Konzentrationskalibrierungswerkzeug. Linke GUI: Bildverzeichnisse (Mindestens 3) mit bekannten Konzentrationen festlegen; zentrale GUI: Wählen Sie Features aus, die im Bildverzeichnis berechnet werden sollen; rechte GUI: Wählen Sie den gewichteten Stammmittelquadratfehler (WRMSE) aus, um das Minimum zu identifizieren. WRMSE und die beste Korrelation zwischen jedem Bild-Feature und der Zellkonzentration. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Bewerten Sie das Verdünnungsserienexperiment.
- Verwenden Sie das Werkzeug Konzentrationskalibrierung (CoCa) (siehe Abbildung 1), um die optimale Korrelation zwischen den extrahierten Bildmerkmalen (Helligkeit oder Schärfe) und den zuvor vom Anwender bereitgestellten Konzentrationen, z. B.Trockenbiomasse oder Zellzahl, zu identifizieren. Folgen Sie den Anweisungen im Software-Handbuch für weitere Details.
- Identifizieren Sie die optimale Korrelation zwischen den extrahierten Informationen aus den Bild-Features in verschiedenen Konzentrationen im Vergleich zu beliebigen Off-Line-Messungen. Siehe die Legende von Abbildung 1.
- Wählen Sie die am besten zumutbaren Messlücken- und Stroboskopintensitäten unter Berücksichtigung der Konzentrationskorrelationskurve mit den Merkmalen, die zu dem kleinsten gewichteten Mittelwert-Quadratfehler (WRMSE) führen.
HINWEIS: Der Messspalt wird während des Experiments fixiert, während die Stroboskopintensität entsprechend der Zellkonzentration angepasst werden kann.
2. Off-Line-Messung
- Stellen Sie den gewünschten Messspalt nach Schritt 1 mit Hilfe eines Dickenmessgeräts ein.
- Öffnen Sie die grafische Benutzeroberfläche Probe Control im SOPAT-Dashboard.
- Schließen Sie die gewünschte Sonde an den Verstärker im Software-Unterabschnitt Aktionen an und drücken Sie Connect.
- Drücken Sie die Play-Taste, um das Streaming zu starten ( LiveView).
- Reinigen Sie den Messspalt, indem Sie Ethanol in den Spalt sprühen und Staub oder Schmutz mit einem optischen Papier sorgfältig abwischen. Prüfen Sie, ob das Glas des Sensors mit der Live-Ansicht im CamControlpartikelfrei ist.
HINWEIS: Partikel und Staub stören Messungen und die automatische Zellidentifikation. - Legen Sie ein trockenes optisches Papier in den Messspalt. Öffnen Sie die Registerkarte Probe-Steuerung und passen Sie die Stroboskopintensität an, um das Papier zu visualisieren. Drehen Sie die Bindungsschraube, bis die einzelnen Fasern des Papiers deutlich sichtbar sind.
- Füllen Sie eine Röhre mit Kulturbrühe. Tauchen Sie das Mikroskop in die Kulturbrühe, so dass der Spalt vollständig mit Zellsuspension bedeckt ist. Öffnen Sie die Tabatonensteuerung und passen Sie die gewünschte Stroboskopintensität gemäß Abschnitt 1 an. Konzentrieren Sie sich auf die Zellen, indem Sie die Fokusbindungsschraube feinabstimmen. Der Fokus darf während des Experiments nicht mehr geändert werden
HINWEIS: 5-6 ml Kulturbrühe werden einem 50 ml konischen Zentrifugalrohr zugesetzt, um den Messspalt ausreichend zu schweben. - Definieren Sie die Anzahl der Frames pro Zeitpunkt [-] in der Benutzeroberfläche im Menü Auslösen in den GUI Frames pro Trigger. Legen Sie die Anzahl der Frames auf 200 Frames pro Trigger fest.
HINWEIS: Die Anzahl der Frames kann auf den niedrigsten Wert reduziert werden, was für ein statistisch zuverlässiges Ergebnis erforderlich ist. Dies hängt von der Stichprobengröße ab, die erforderlich ist, um eine repräsentative morphologische Zellgrößenverteilung zu erhalten (siehe auch Schritt 5). - Definieren Sie die Bildrate [Hz] im Menü Auslösen in der GUI-Framerate. Wählen Sie eine Bildrate aus, die sich einstellt, dass bewegte Partikel aus einem vorherigen Frame nicht im folgenden Frame angezeigt werden.
HINWEIS: Dies kann mit einem Testauslöser mit 200 Frames nachgewiesen werden. Prüfen Sie die Bilder auf Partikel, die wiederholt erfasst werden. Wenn dies der Fall ist, verringern Sie die Bildrate. Für Off-Line-Messungen wird 1 Hz empfohlen. - Legen Sie das Verzeichnis, in dem die erfassten Bilder gespeichert werden, im Menü Allgemeinfest.
- Führen Sie eine Bildaufnahme durch, indem Sie die Schaltfläche "Startbildtrigger"-Aufnahme aktivieren. Bewegen Sie das Rohr mit Kulturfederung sanft nach oben und unten, um einen Fluss durch den Messspalt zu induzieren.
- Wiederholen Sie Schritt 2.5 nach jeder Messung.
- Überprüfen Sie die aufgenommenen Bilder. Zellen müssen scharf genug für Anmerkungen sein. Prüfen Sie die Bilder auf Partikel, die wiederholt erfasst werden. Wenn dies der Fall ist, verringern Sie die Bildrate.
- Speichern Sie die Einstellungen, indem Sie den folgenden Pfad auswählen: C:-Programmdateien, SOPAT GmbH, MonitoringPrograms, camcontrol, und drücken Sie Speichern.
3. Partikelidentifikation
- Kommentieren Sie Partikel für das Training des künstlichen neuronalen Netzwerks (ANN) (Trainingsset).
- Laden Sie die erfassten Bilder in das Anmerkungswerkzeug "Fidschi, ImageJ", indem Sie die Datei in das Hauptfenster "ImageJ" ziehen und ablegen (siehe GUI "Fidschi" Werkzeug in Abbildung 2)
- Öffnen Sie den ROI-Manager, indem Sie Folgendes auswählen: Analysieren | Werkzeuge | ROI Manager.
- Wählen Sie ein Auswahlwerkzeug aus. Wand (Tracing) Werkzeug, Freihand-, Oval- oder elliptische Auswahl werden empfohlen.
- Zeichnen Sie einen Kreis um das Partikel, der mit den zuvor erwähnten Auswahlwerkzeugen mit Anmerkungen benotet werden soll, und verfeinern Sie es dann mit dem Pinselwerkzeug.
- Fügen Sie die Anmerkung zum ROI Manager hinzu, indem Sie auf Hinzufügen [t]drücken.
- Markieren Sie alle Objekte von Interesse (zellen, die identifiziert werden sollen) auf etwa 15 Bildern.
HINWEIS: Um alle notwendigen Informationen, d. h. verschiedene Formen, Größen, Konzentration der Zellen, Helligkeit usw.,abzudecken, verwenden Sie fünf Bilder von Anfang an, fünf Bilder von dazwischen und fünf Bilder vom Ende des Experiments. - Entscheiden Sie, ob Zellen aufgrund ihrer Form(z. B.verschiedene Phasen eines Zellzyklus) in verschiedene Unterklassen klassifiziert werden müssen oder ob alle Zellen derselben Klasse angehören.
- Ändern Sie den Namen der einzelnen ausgewählten Partikel entsprechend. Legen Sie einen Namen oder eine Abkürzung für jede Klasse und einen Zähler für jedes Partikel der Klasse fest(z. B.cell_1, cell_2 usw.). Kommentieren Sie mindestens 50 Partikel pro Klasse.
- Kommentieren Sie keine Objekte, die nicht erkannt werden sollten, da sie für den Prozess nicht relevant sind, wie Gasblasen oder andere Partikel wie ungelöste Medienkomponenten.
HINWEIS: Diese Ereignisse werden nicht in das Schulungsverfahren für die ANN einbezogen und gelten als Hintergrund. - Kommentieren Sie keine Zellen, die nicht im Fokus stehen.
- Kommentieren Sie die Bilder so konsistent wie möglich. Wenn Zweifel bestehen, kann die Bezeichnung Ignorieren angewendet werden. Es wird dringend empfohlen, seine Verwendung nicht zu missbrauchen, da die ANN nur Strukturen erkennt, die gekennzeichnet sind.

Abbildung 2: Benutzeroberfläche des Fidschi-Werkzeugs. Mit den annotierten Bildern wird ein Trainingssatz erstellt. Eine manuelle Anmerkung, die aus zwei Klassen besteht, wird dargestellt, die Liste der annotierten Partikel wird im ROI Manager angezeigt. Für verschiedene Klassen können unterschiedliche Namen und Farben festgelegt werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Speichern Sie die annotierten Objekte und das Bild in einem ZIP-Format und senden Sie die Datei entweder per Upload auf die Plattform oder per E-Mail an das Trainingsnetzwerk.
HINWEIS: In der Regel dauert es eine Reihe von iterativen Trainingsrunden, um angemessene Vorhersagen der klassifizierten Objekte auf den Bildern zu identifizieren. Jede Trainingsrunde führt zu einem Workflow, der vom Programm zurückgegeben wird. - Verwenden Sie den Workflow (*.wf) mit dem trainierten Objekterkennungsalgorithmus, um Testbilder mit dem Datenbatch-Fortschrittsprogramm Batcher zu analysieren, das im Dashboard gestartet werden kann.
- Überprüfen Sie die Objekterkennung auf den Testbildern durch die Quantifizierung falsch positiver und negativer Ereignisse.
- Quantifizieren Sie die Detektion falsch positiver Ereignisse: Partikel, die fälschlicherweise als Zellen erkannt wurden, Zellen, die nicht korrekt klassifiziert sind, und Zellen, deren Kontur nicht gut identifiziert wurde.
- Quantifizieren Sie die falschen negativen Ereignisse (Zellen, die nicht als solche erkannt werden).
- Visualisieren Sie die Ergebnisse im Tool Ergebnisanalysator, indem Sie das Programm im Dashboard starten.
- Importieren der gewünschten Ergebnisdateien mit Datei | Datei oder Datei importieren | Importieren von Ordnern.
- Visualisieren Sie die Ergebnisse nach Diagramm | Erstellen Sie ein Diagramm auf der Charts-GUI.
- Wählen Sie eine der folgenden Optionen aus: Verteilungsdiagramm, Sensitivitätsdiagramm, Merkmal im Zeitverlauf, Merkmal über Vermessungspunkte und Feature vs. Feature.
HINWEIS: Ein Handbuch zur Nutzung des Result Analyzer kommt mit dem System und ist auch im Support erhältlich. - Wenn die Ergebnisse akzeptabel sind, führen Sie den Workflow im Batcher für alle erfassten Bilder des Experiments aus. Gleichzeitig kann dann das Überwachungsprogramm erstellt werden, indem die gespeicherten Einstellungen aus dem Probe Controller (*.pcfg) mit dem Workflow (*.wf) kombiniert werden, siehe auch das Handbuch.
HINWEIS: Der Workflow kann auch zur Überwachung zukünftiger Experimente für diese Kulturmedien verwendet werden. - Wenn die Ergebnisse nicht akzeptabel sind, überprüfen Sie die Anmerkung auf dem Trainingssatz und/oder fahren Sie mit einer anderen iterativen Trainingsrunde fort (siehe Schritt 4.2).
4. Stichprobengrößenquantifizierung
- Legen Sie die Standardabweichung fest, die unter den erfassten Partikeln akzeptabel ist.
HINWEIS: Die Standardabweichung ändert sich parallel zur Homogenität der Zellengröße. Die maximale Standardabweichung gibt die Stichprobe mit der höchsten Größe der Heterogenität an. - Legen Sie die Amplitude des Konfidenzintervalls oder die gewünschte Genauigkeit in Bezug auf die erwartete Varianz der Messungen (e)fest.
- Stellen Sie den zugegebenen Fehler zwischen 5 % (z1-a/2 = 1,96) und 10 % (z1-a/2 = 1,64) ein.
- Berechnen Sie die Anzahl der Zellen, die aus jeder Klasse aus Gleichung 1 identifiziert werden sollen.
 [Gleichung 1]
[Gleichung 1]
HINWEIS: Basierend auf der Anzahl der Zellen kann die Anzahl der Bilder, die erfasst werden müssen, für jeden Datenpunkt definiert werden. - Führen Sie eine Sensitivitätsanalyse zu zufälligen Zeitpunkten des Experiments durch, um zu überprüfen, ob die Analyse von n Partikeln zu einer Variabilität des mittleren Feret-Durchmessers und des Dv90 von weniger als 5 % führt. Sie kann automatisch im Ergebnisanalysatorberechnet werden.
5. On-Line (By-Pass) oder In Line Measurement
- Führen Sie zunächst das Offline-Messverfahren durch (siehe Schritt 2), um die Hardware- und Softwareeinstellungen als Funktion des Organismus und des Prozesses (Konzentration oder Medien) einzustellen.
- Laden Sie die gespeicherten Einstellungen aus dem vorherigen Abschnitt hoch, indem Sie die Schaltfläche Laden auswählen, und wählen Sie den folgenden Pfad aus: C:-Programmdateien, SOPAT GmbH, MonitoringPrograms, camcontrol.
- Verbinden Sie die Sonde mit der Durchflusszelle oder dem Bioreaktor.
HINWEIS: In-situ-Messungen können mit einem Pinch-Flansch durchgeführt werden. - Sterilisation durchführen.
HINWEIS: Nur das sondenbenetzte Material des Instruments ist durch Dampfsterilisation sterilisierbar. Die benetzte Sondenlänge kann von 6 bis 222 mm gehen (Abbildung 3).
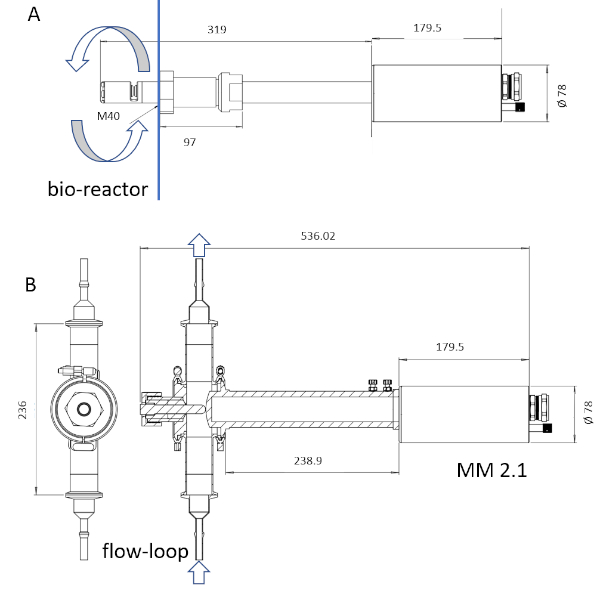
Abbildung 3: Skizze der ISM-Geräte. Die Sonde MM-Ho (A) ist direkt im Bioreaktor einbaubar, während die Sonde MM 2.1 (B) als Umgehungskarte verwendet werden kann. Die Kulturbrühe Zirkulation ist mit Pfeilen in jedem Bild markiert. Die Umrechnungsfaktoren sind 0,166 'm pix-1 für MM-Ho und 0.087 'm pix-1 für MM 2.1. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Definieren Sie die Bildaufnahmerate in der GUI Triggering im Feld Triggerintervall [s].
HINWEIS: Je nach Prozessdynamik kann die Bildaufnahmerate angepasst werden. Wenn z. B. eine Verzögerungsphase von 3 Stunden zu erwarten ist, kann die Erfassungsrate niedriger sein, als wenn eine Stoffwechselverschiebung oder die Akkumulation eines Produkts überwacht werden soll. In der Regel erfordert dies eine viel kürzere Erfassungszeit im Minutenbereich. Beispielsweise liefert eine Bildaufnahmesequenz zwischen 5 und 10 min während einer Chargenhefekultivierung ausreichende Informationen, um die Prozessdynamik zu erfassen. - Definieren Sie die Bildrate, wie in Schritt 2.10 erläutert.
HINWEIS: Bei Online- und Linienmessungen kann die Bildrate erhöht werden, da das mechanische Rühren die Durchflussrate durch den Spalt erhöhen kann. - Starten Sie die Bildaufnahme, indem Sie die Schaltfläche Streaming des ausgewählten Prüfpunktsstarten aktivieren.
- Beenden Sie die Erfassung, wenn das Experiment mit der Schaltfläche Streaming der ausgewählten Sondebeenden abgeschlossen ist.
ANMERKUNG: Starten Sie für den1. Lauf die Erfassung kurz vor der Inokulation der Kultur und fahren Sie mit Schritt 4 fort. Öffnen Sie für die folgenden Ausführungen das Programm Überwachung im Dashboard, und wählen Sie den erstellten Workflow aus (siehe Schritt 4). Starten Sie die Überwachung kurz vor der Inokulation der Kultur, indem Sie die Play-Taste drücken.
Ergebnisse
Die Zellgrößenerkennung in Hefekulturen mit dem ISM und die automatische Bilderkennung zur Unterscheidung zwischen angehenden und nicht aufkeimenden Zellen wurde erfolgreich durchgeführt. Sowohl die Stroboskopintensität als auch die Wahl des Messspalts weisen einen Toleranzbereich auf, bei dem die Partikelidentifikation nicht beeinträchtigt wird. So wurden z.B. S. cerevisiae Zellen mit verschiedenen Stroboskopintensitäten in einem Variationsbereich von 11% bei einer Trockenbiomassekonzentration von 4 gL-1gemessen. Die entsprechenden Bilder lieferten scharfe Zellgrenzen, daher war die Partikelidentifikation mit einer akzeptablen Variation der Zellgröße möglich (1%) unabhängig von der Stroboskopintensität. Falls die Stroboskopintensität nicht richtig eingestellt wird, leiden die Bilder unter Überbeleuchtung und eine ordnungsgemäße Zellidentifikation ist nicht möglich (Abbildung 4).

Abbildung 4: Funktionen zur Bildaufnahme. Beispiele für verschiedene Stroboskopintensitäten (SI-%) und Messlücken (MG-m) zur Erfassung von S. cerevisiae-Zellen (die heutigen Werte von SI und MG sind in Klammern angegeben): A (25, 50); B (50, 50); C (25, 80); und D (50, 80). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Bisher kann der Messspalt bei einer In-situ-Messung nicht nachjustiert werden. Daher ist das Verdünnungsserienexperiment entscheidend, um zuverlässige Daten während eines Anbaus zu gewährleisten. Das Hauptanliegen ist das Auftreten nicht identifizierbarer überlappender Ereignisse aufgrund der Erhöhung der Zellkonzentration.
Ein Sensitivitätsdiagramm (Sensitivitätsanalyse von Merkmalswerten, z.B.mittlerer Zelldurchmesser in Bezug auf Partikelzahl n) aller erfassten Zellen aus der geladenen Datendatei kann visualisiert werden (Abbildung 5). Der Benutzer muss entscheiden, welche Stabilität eines bestimmten Prozessparameters benötigt wird. In diesem Fall die Minimale Anzahl von Zellen, die für einen gültigen Datenpunkt erforderlich sind. In der Folge können mehr oder weniger Bilder für einen Datenpunkt analysiert werden.

Abbildung 5: Mittleres Zelldurchmesser-Empfindlichkeitsdiagramm. Variabilität des mittleren Zelldurchmessers in Abhängigkeit von der Anzahl der erfassten Partikel. Mit etwa 1.000 Zellen wird ein konstanter Wert des mittleren Zelldurchmessers erreicht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die Anmerkung ist der Schlüsselpunkt, um die gewünschte Genauigkeit der Partikelidentifikation zu erreichen. Abbildung 6 zeigt ein Beispiel für eine "Benutzeranmerkung" (A), die als Trainingsset für das neuronale Netzwerk verwendet wird, sowie die Partikelidentifikation auf einem Bild des Testsatzes (unbekannte Daten für das neuronale Netzwerk), das für seine Auswertung (B) verwendet wird. Beide Bilder sollten eine ähnliche Rate von identifizierten Ereignissen aufweisen.

Abbildung 6: Vergleich von Benutzeranmerkungen (Trainingssatz) und automatischer Erkennung (Testsatz). Trainingsset: Annotierte und Originalbilder sind in Abzw. A'dargestellt. Die Informationen dieses Bildes werden verwendet, um die ANN zu trainieren. Testsatz: Der Workflow, der nach dem Training erstellt wurde, wird auf Erfassungen angewendet, die nicht für das Training verwendet wurden: automatisch identifizierte Zellen (siehe B) aus der ursprünglichen Erfassung B'. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Als Beispiel für die Wirkung der intrazellulären Produktakkumulation auf die Zellgrößenverteilung wurde die Akkumulation der mehrfach ungesättigten Fettsäure Docosahexaensäure (DHA) durch Stickstoffbegrenzung in der heterotrophen Mikroalgen C. cohniiuntersucht. Es wurde nachgewiesen, dass die Anhäufung des Produkts mit Hilfe von ISM10quantitativ nachgewiesen werden kann. Die Methode wird derzeit verwendet, um den Einfluss von Scherkräften in gerührten Bioreaktoren auf die morphologische Heterogenität von Zellen zu untersuchen.
Der Reifezustand der angehenden Hefe S. cerevisiae wurde quantifiziert. Im Falle des Aufblühens liefert der Anteil der Zellen, die sich zu einem Zeitpunkt im Reifezustand befinden (beschrieben mit der BI), Informationen über die Wachstumsaktivität und die Heterogenität der Bevölkerung. Die automatische Zellerkennung war in der Lage, angehende und nicht aufkeimende (oder Tochter)-Zellen erfolgreich in der Zellsuspension15zu identifizieren und zu unterscheiden. Die Zellgrößenverteilung von drei Stichproben ist in Abbildung 7dargestellt. Eine Verschiebung zu kleineren Zellen zeigt einen niedrigeren Anteil der aufkeimenden Zellen innerhalb der Grundgesamtheit an.

Abbildung 7: Kumulative Verteilung der Größe einer Zelle. Zellgrößenverteilungen, gemessen während des Zeitverlaufs einer Kultivierung bei 3 h (gerade Linie), 7 h (gepunktete Linie) und 13 h (gestrichelte Linie). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
ISM, wie hier mit den gleichen oder sehr ähnlichen Geräten vorgestellt, wurde verwendet, um die morphologische Dynamik von Pilzen, Mikroalgen und Hefezellen zu messen, die die Bestimmung der Wachstumsaktivität und im Falle von Algen, intrazelluläre Produktakkumulation ermöglicht. Der Sensor hat keine beweglichen Teile und ist direkt in jedem Standard-Rührbehälter-Bioreaktor einsetzbar, entweder über einen Standardport oder in einem sterilisierbaren Bypass. Da Hefe viel kleiner als Algen ist, erforderte die Reduzierung der Zellgröße einige neuere Hardware-Anpassungen wie eine höhere Kameraauflösung und Beleuchtung durch Übertragung, um eine ausreichende Pixelauflösung der Hefe zu erhalten (für technische Details siehe15). Es gibt jedoch immer noch eine Einschränkung für die Messung noch kleinerer Zellen wie Bakterien. Die aktuelle in situ photooptische Instrumentierung weist auf Einschränkungen in Bezug auf überlappende Partikelinformationen in hoher Konzentration und Interferenzeffekte mit Strukturen unterhalb des UV/VIS-Spektrums hin. Bis heute wurden keine Bildanalysealgorithmen für bakterielle Suspensionen angewendet, abgesehen von Helligkeitskorrelationen16.
Andere zuvor eingesetzte ISM-Werkzeuge wurden verwendet, um die Zellkonzentration zu bestimmen, um ihre Zuverlässigkeit zu zeigen. Dies wurde jedoch entscheidend, wenn sich zellenweise in erhöhten Konzentrationen überlappten. Daher lag der Schwerpunkt dieser Studie nicht auf der Zellquantifizierung, sondern auf der morphologischen Merkmalserkennung, während Bildmerkmale wie Helligkeitsintensität mit der Zelldichte korreliert werden können, wie sie mit anderen Geräten durchgeführt wird, auch17. Andernfalls wären alle diese Geräte auf niedrige Zellkonzentrationen beschränkt; eine maximale Konzentration von ca. 20 g L-1 von Hefezellen wurde bei Verwendung eines Zellerkennungsansatzes im Vergleich zu ca. 80 g L-1 bei Verwendung eines Clustergrößenalgorithmus ausgewertet.
Um die morphologischen Merkmale einer Zelle nachzuverfolgen, müssen ihre Kanten genau erkannt werden. Bei Algen ist dies ziemlich einfach, da sich die Größe ändert, aber die Form bleibt während des gesamten Übergangs der Prozessstufen konstant. Im Gegensatz dazu stellen Hefezellen aufgrund ihrer Form eine größere Herausforderung dar, die nicht einer Kugel oder Ellipse angenähert werden kann, wenn Zellen aufblühen. Dennoch wurde bisher die Zellgröße unter der Annahme berechnet, dass eine Zelle eine perfekte Kugel in ISM-Messungen18ist. Obwohl diese Annäherung in einigen Fällen der Realität nahe kommt, können kompliziertere Formen wie angehende Zellen oder stabförmige Zellen nicht richtig beurteilt werden. In dieser Studie wurden jedoch aufgrund der flexiblen Grenzerkennung, die durch Machine Learning-Algorithmen ermöglicht wurde, verschiedene Formen erfolgreich analysiert. Darüber hinaus werden sich überlappende Ereignisse noch untersuchen19, um eine weitere Entwicklungsphase zu erreichen.
Derzeit besteht der Goldstandard für die Vitalitäts- und Lebensfähigkeitsbewertung darin, koloniebildende Einheiten zu zählen oder eine Probe mit einem Lebensfähigkeitsfarbstoff20zu färben, z. B.Methylenblau oder Methylenviolett21; Dieses Verfahren kann jedoch die Ergebnisse beeinflussen. Wann immer solche Merkmale mit der Zellmorphologie22zusammenhängen, sollte das Potenzial einer schnellen Bewertung durch das zunehmende Potenzial von ISM untersucht werden. Darüber hinaus können kritische Prozessparameter und/oder Qualitätsattribute23 mit Form, Agglomeration und Pelletbildung in Verbindung gebracht werden, die alle von ISM überwacht werden können.
Derzeit werden Untersuchungen mit anderen Schlüsselmikroorganismen durchgeführt, die häufig im Bioprozess verwendet werden. Die Zeit für die Anpassung der Objekterkennungsalgorithmen und die Merkmalsextraktion für die Feature-Analyse hängt hauptsächlich von der Komplexität der Bilder und der erwarteten Genauigkeit der Ergebnisse ab. In Zukunft wird die Farbbildaufnahme in Betracht gezogen, um das Informationsspektrum, das z.B.bei ansammelnden Pigmenten oder in gentechnisch veränderten Organismen, in die farbige Marker integriert wurden, auf Einzelzellebene zu erhalten, weiter zu erweitern.
Offenlegungen
Die Autoren haben nichts zu erklären.
Danksagungen
Die Autoren sind dankbar für die Unterstützung des Bundesministeriums für Wirtschaft und Energie im Rahmen von ZIM-Koop, Projekt "Smart Process Inspection", Zuschuss Nr. ZF 4184201CR5.
Materialien
| Name | Company | Catalog Number | Comments |
| Sensor MM 2.1 - MFC | SOPAT GmbH, Germany | n.a. | Inline Monocular Microscopic probe Version 2.1 with a Mirco Flow Cell |
| Sofware version v1R.003.0092 | SOPAT GmbH, Germany | n.a. | |
| Thickness gauge | n.n. | It can be any supplier, DIN 2275:2014-03 | |
| Ethanol 70% | n.n. | It can be any supplier | |
| SOPAT manual Version 2.0.5 | SOPAT GmbH, Germany | ||
| Optical lense paper | VWR | 470150-460 | |
| Fiji, ImageJ | open source | ||
| 50 mL conical centrifuge tubes | It can be any supplier |
Referenzen
- Maaß, S., Rojahn, J., Hänsch, R., Kraume, M. Automated drop detection using image analysis for online particle size monitoring in multiphase systems. Computers & Chemical Engineering. 45, 27-37 (2012).
- Lemoine, A., Delvigne, F., Bockisch, A., Neubauer, P., Junne, S. Tools for the determination of population heterogeneity caused by inhomogeneous cultivation conditions. Journal of biotechnology. 251, 84-93 (2017).
- Marbà-Ardébol, A. M., Bockisch, A., Neubauer, P., Junne, S. Sterol synthesis and cell size distribution under oscillatory growth conditions in Saccharomyces cerevisiae scale-down cultivations. Yeast. 35 (2), 213-223 (2017).
- Xiao, Y., Bowen, C. H., Liu, D., Zhang, F. Exploiting nongenetic cell-to-cell variation for enhanced biosynthesis. Nature chemical biology. 12 (5), 339-344 (2016).
- Beutel, S., Henkel, S. In situ sensor techniques in modern bioprocess monitoring. Applied microbiology and biotechnology. 91 (6), 1493 (2011).
- Belini, V. L., Wiedemann, P., Suhr, H. In situ microscopy: A perspective for industrial bioethanol production monitoring. Journal of microbiological methods. 93 (3), 224-232 (2013).
- Havlik, I., et al. Monitoring of microalgal cultivations with on-line, flow-through microscopy. Algal Research. 2 (3), 253-257 (2013).
- Suhr, H., Herkommer, A. M. In situ microscopy using adjustment-free optics. Journal of biomedical optics. 20 (11), 116007 (2015).
- Panckow, R. P., Reinecke, L., Cuellar, M. C., Maaß, S. Photo-Optical In-Situ Measurement of Drop Size Distributions: Applications in Research and Industry. Oil Gas Sci. Technol. - Rev. IFP Energies. 72 (3), 14 (2017).
- Marbà-Ardébol, A. -. M., Emmerich, J., Neubauer, P., Junne, S. Single-cell-based monitoring of fatty acid accumulation in Crypthecodinium cohnii with three-dimensional holographic and in situ microscopy. Process Biochemistry. 52, 223-232 (2017).
- Porro, D., Vai, M., Vanoni, M., Alberghina, L., Hatzis, C. Analysis and modeling of growing budding yeast populations at the single cell level. Cytometry. Part A : the journal of the International Society for Analytical Cytology. 75 (2), 114-120 (2009).
- Brauer, M. J., et al. Coordination of growth rate, cell cycle, stress response, and metabolic activity in yeast. Molecular biology of the cell. 19 (1), 352-367 (2008).
- Puxbaum, V., Gasser, B., Mattanovich, D. The bud tip is the cellular hot spot of protein secretion in yeasts. Applied microbiology and biotechnology. 100 (18), 8159-8168 (2016).
- Marbà-Ardébol, A. M., Emmerich, J., Neubauer, P., Junne, S. Vol. P2. Prozessmesstechnik. , 222-225 (2017).
- Marbà-Ardébol, A. -. M., Emmerich, J., Muthig, M., Neubauer, P., Junne, S. Real-time monitoring of the budding index in Saccharomyces cerevisiae batch cultivations with in situ microscopy. Microbial cell factories. 17 (1), 73 (2018).
- Marquard, D., Schneider-Barthold, C., Düsterloh, S., Scheper, T., Lindner, P. Online monitoring of cell concentration in high cell density Escherichia coli cultivations using in situ Microscopy. Journal of biotechnology. 259, 83-85 (2017).
- Marquard, D., et al. In situ microscopy for online monitoring of cell concentration in Pichia pastoris cultivations. Journal of biotechnology. 234, 90-98 (2016).
- Camisard, V., Brienne, J., Baussart, H., Hammann, J., Suhr, H. Inline characterization of cell concentration and cell volume in agitated bioreactors using in situ microscopy: application to volume variation induced by osmotic stress. Biotechnology and bioengineering. 78 (1), 73-80 (2002).
- Böhm, A., Ücker, A., Jäger, T., Ronneberger, O., Falk, T. ISOODL: Instance segmentation of overlapping biological objects using deep learning. , 1225-1229 (2018).
- Davey, H. M. Life, Death, and In-Between: Meanings and Methods in Microbiology. Applied and environmental microbiology. 77 (16), 5571-5576 (2011).
- Lodolo, E. J., Kock, J. L., Axcell, B. C., Brooks, M. The yeast Saccharomyces cerevisiae-the main character in beer brewing. FEMS yeast research. 8 (7), 1018-1036 (2008).
- Albertin, W., et al. Population size drives industrial Saccharomyces cerevisiae. alcoholic fermentation and is under genetic control. Applied and environmental microbiology. 77 (8), 2772-2784 (2011).
- Gomes, J., Chopda, V. R., Rathore, A. S. Integrating systems analysis and control for implementing process analytical technology in bioprocess development. Journal of Chemical Technology and Biotechnology. 90 (4), 583-589 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten