Method Article
Na Vivo Medida eletrofisiológica do nervo Ulnar rato com teste de excitabilidade Axonal
Neste Artigo
Resumo
Técnicas de excitabilidade axonal fornecem uma poderosa ferramenta para examinar a fisiopatologia e alterações biofísicas que precedem eventos degenerativas irreversíveis. Este manuscrito demonstra a utilização destas técnicas no nervo ulnar de ratos anestesiados.
Resumo
Eletrofisiologia permite a avaliação objetiva da função de nervo periférico em vivo. Condução nervosa tradicionais medidas como amplitude e latência detectar perda crônica axônio e desmielinização, respectivamente. Técnicas de excitabilidade axonal "pelo limite de rastreamento" expandem-se sobre estas medidas, fornecendo informações sobre a atividade dos canais iônicos, bombas e trocadores que se relacionam com função aguda e podem preceder eventos degenerativas. Como tal, o uso de excitabilidade axonal em modelos animais de doenças neurológicas pode fornecer uma medida útil na vivo para avaliar novas intervenções terapêuticas. Aqui nós descrevemos uma instalação experimental para várias medidas de técnicas de excitabilidade axonal motor no nervo ulnar de rato.
Os animais são anestesiados com isoflurano e cuidadosamente monitorizados para assegurar profundidade constante e adequada de anestesia. Temperatura corporal, taxa de respiração, frequência cardíaca e saturação de oxigênio no sangue são monitorados continuamente. Estudos de excitabilidade axonal são executados usando estimulação percutânea do nervo ulnar e gravação de musculatura hipotenar da pata membro anterior. Com a colocação do eletrodo correto, um potencial de ação muscular composto claro que aumenta em amplitude com o aumento da intensidade do estímulo é gravado. Um programa automatizado é então utilizado para entregar uma série de pulsos elétricos que geram 5 medidas específicas excitabilidade na seguinte sequência: comportamento de resposta de estímulo constante de tempo de duração de força, electrotonus limite, limite de corrente relacionamento e o ciclo de recuperação.
Dados aqui apresentados indicam que estas medidas são repetidas e mostram a semelhança entre esquerda e direita ulnar nervos quando avaliados no mesmo dia. Uma limitação dessas técnicas neste cenário é o efeito da dose e tempo sob anestesia. Cuidadoso monitoramento e gravação dessas variáveis devem ser realizadas a título oneroso no momento da análise.
Introdução
O uso de técnicas eletrofisiológicas é uma ferramenta essencial para a investigação na vivo da função do nervo periférico em doenças neurológicas. Métodos de condução do nervo convencionais utilizam estímulos supramaximal para gravar a latência e amplitude do potencial de ação motor. Essas técnicas, portanto, fornecem informações úteis sobre o número de fibras de condução e a velocidade de condução das fibras mais rápidas. Uma ferramenta complementar valiosa é a do teste de excitabilidade axonal. Esta técnica utiliza padrões de estimulação eletrofisiológica sofisticado indiretamente, avaliar as propriedades biofísicas de nervos periféricos, tais como a atividade de canais iônicos, bombas dependentes de energia, processos de troca iônica e o potencial de membrana 1.
Teste de excitabilidade axonal é comumente utilizado na prática clínica para investigar processos fisiopatológicos e efeitos de intervenções terapêuticas em várias doenças neurológicas. Importante, medidas de excitabilidade axonal são sensíveis a intervenções terapêuticas que afetam a função do nervo periférico como terapia de imunoglobulina intravenosa (IVIg)2,3 e calcineurina inibidor (CNI) quimioterapia 4. embora estes estudos forneceram introspecções importantes, estudos clínicos muitas vezes impedem a investigação dos primeiros traços da doença e novas opções terapêuticas5. Portanto, o uso desses métodos em modelos animais de doenças neurológicas recentemente ganhou tração6,7,8,9. Com efeito, esses métodos fornecem uma oportunidade para compreender as alterações de excitabilidade do nervo específico associadas com esses transtornos, avançando assim pesquisa translacional.
O procedimento descrito aqui é um método simples e confiável para medidas de registro axonal excitabilidade dos nervos ulnar do rato intacta.
Protocolo
Todos os procedimentos experimentais descritos aqui respeitadas o cuidado Animal e o Comitê de ética da UNSW Sydney e foram realizados em conformidade com a saúde nacional e Conselho de pesquisa médica (NHMRC) dos regulamentos de Austrália a experimentação animal.
1. experimental instituído
Nota: ratos de Long-Evans 12 semanas de idade, do sexo femininos foram utilizados neste procedimento.
- Anestesia o rato em uma câmara de indução usando 4% de isoflurano e 1L por min O caudal de2 . Confirmar a anestesia suficiente por meio de testes para o braço endireitante reflexo e certifique-se de sua ausência antes de retirar o animal da câmara de indução. Observe que vários agentes anestésicos têm efeitos diferenciais no nervo excitabilidade10.
- Com segurança, coloque o focinho do animal no nariz cone acessório e entregar uma dose de manutenção de 2,5% de isoflurano e 1 L por taxa de fluxo de2 min O.
- Confirme anestesia adequada, verificando para retirada de pedal e reflexos da córnea beliscar os dedos do pé do animal e tocando suavemente seu olho.
Nota: Aplicação de vet pomada nos olhos, para evitar ressecamento enquanto sob anestesia, é recomendado, mas não essenciais, como o processo normalmente demora 30 min por animal. - Manter a temperatura do corpo do rato a 37 ° C com o uso de um tapete de aquecimento controlado de gabarito e uma sonda termômetro retal. Defina a esteira de aquecimento e sensor de temperatura do corpo integrado a 40 ° C, para evitar qualquer dano da pele que ocorre com temperaturas mais elevadas.
Nota: Recomenda-se monitorar e gravar medidas fisiológicas (frequência cardíaca, saturação de oxigênio, temperatura corporal e frequência respiratória) cada 10s com a utilização de um sistema de monitorização fisiológica animal. Procedimentos de gravação ideal devem incluir medição local da temperatura do membro, como a temperatura periférica pode ser mais fria do que a temperatura de núcleo11 (Figura 1). - Usar luvas de anti-séptico e sempre usar instrumentos que tenham sido limpos com etanol a 70%, para manter um ambiente livre de patógeno durante todo o procedimento.
2. eletrofisiológico configurar
- Use eléctrodos de agulha de platina eletroencefalograma (EEG) de baixa impedância para este procedimento.
- Preparar os eletrodos de agulha de gravação, inserindo o eletrodo de agulha de gravação (Figura 1; indicado em roxo) através do músculo hipotenar e o eletrodo de referência através do aspecto dorsal do dígito 4 (Figura 1; indicado no laranja) para registrar os potenciais de ação muscular composto (CMAPs).
- Coloque o eléctrodo de terra através da pele na face superior do antebraço, entre o estímulo e gravação eletrodos (Figura 1; indicada em verde). Tenha cuidado ao inserir os eletrodos para evitar o tecido muscular.
- Preparar os eletrodos de agulha percutânea estimulante, inserindo o cátodo (Figura 1; rotulado de azul) túnel de aproximadamente 4 mm distal para o cubital no cotovelo. Inserir o ânodo (Figura 1; rotulado de vermelha) aproximadamente 1 cm proximalmente através da pele da região axilar.

Figura 1: um diagrama esquemático das colocações de eletrodo de agulha no membro anterior de rato. O cátodo (azul) é inserido aproximadamente 4 mm distal do túnel cubital no cotovelo e o ânodo (vermelho) é inserido aproximadamente 1 cm proximalmente através da pele da região axilar. O eléctrodo de agulha de terra (verde) é inserido através da pele na face superior do antebraço, entre o estímulo e gravação eletrodos. A gravação (roxa) e eletrodos de agulha de referência (laranja) são inseridos através do músculo hipotenar e a face dorsal do dígito 4th . A sonda de temperatura (cinza) é colocada na face superior da musculatura Tenar. Clique aqui para ver uma versão maior desta figura.
3. axonal excitabilidade procedimentos
- Executar o protocolo TRONDNF usando um semi-automático de nervos motores roedores, programa de computador controlado excitabilidade axonal (consulte a tabela de materiais) ligado a um amplificador e um estimulador de corrente constante. Remova o excesso ruído elétrico 50 Hz usando um eliminador de ruído de 50/60 Hz.
- Gravar o CMAP do músculo hipotenar simultaneamente Visualizar a morfologia do CMAP e aplicando um 1 pulso de onda quadrada de ms para o nervo ulnar com eletrodo de agulha o cátodo.
- Para alcançar o ideais gravações, cuidadosamente, ajuste o ângulo e/ou posição do cátodo até uma curva de resposta bifásica ideal com amplitude constante é alcançado (Figura 2A.). Uma vez que foi determinada a posição ideal, estabilize o cátodo com um eléctrodo repositionable.
Nota: O software usado automaticamente fornece os estímulos do teste, descritos abaixo e aumenta ou diminui a corrente necessária para atingir o limiar.
- Para alcançar o ideais gravações, cuidadosamente, ajuste o ângulo e/ou posição do cátodo até uma curva de resposta bifásica ideal com amplitude constante é alcançado (Figura 2A.). Uma vez que foi determinada a posição ideal, estabilize o cátodo com um eléctrodo repositionable.
- Gravar uma curva de estímulo-resposta aumentando gradualmente a intensidade do estímulo de um 1 ms impulso por 1 mA até que uma resposta máxima é alcançada.
Nota: A linha roxa e verde na figura 2B e 2C representa o aumento incremental da intensidade do estímulo e o sistema automatizado, respectivamente. A amplitude de alvo para rastreamento de limiar é definida automaticamente para 40% da amplitude máxima correspondente à área da encosta mais íngreme da curva de estímulo-resposta. A mudança de 'limite' (ou seja, o estímulo necessário para eliciar 40% CMAP) induzida por vários estímulos do teste é a variável de obtidos no restante do protocolo. - Gravar vários parâmetros de excitabilidade axonal, incluindo electrotonus de limiar (TE), limite de corrente (eu / V) (RC), conforme descrito na referência12ciclo de relacionamento e recuperação.
Nota: O programa de computador controlado excitabilidade axonal avalia o limiar (TE) com um 100 ms abaixo do limite despolarizantes e hiperpolarização correntes que é definido em ± 20% e ± 40% do limiar controle atual. A mudança no limiar após despolarizante e relação de correntes é automaticamente gravada no tempo 14-pontos durante os 12 pontos e 100 ms corrente de polarização após a corrente de polarização. Electrotonus de limiar indiretamente avalia os conductances internodal e é um indicador do potencial de membrana. O que / é determinada relação V com correntes de condicionamento abaixo do limite de 200 ms que se alternam em intensidade de + 50% para -100% do limiar controle em incrementos de 10%. O eu / relação V difere para TE em que as correntes são mais longos em duração, a intensidade de polarização é progressivamente alterada de + 50% para -100% e a mudança do limiar é avaliado em cada intensidade 1 ms após a corrente de polarização ter cessado. I / V relação fornece insights sobre as propriedades de rectificação do axônio1. O RC é avaliado com um paradigma de pulso pareado, onde um estímulo condicionado de supramaximal inicial é aplicado seguido por uma série de estímulos de teste em intervalos específicos de 2,5 ms de 200 ms. este parâmetro testa uma série bem definida de eventos que ocorrem no nodal região do axônio após estimulação supramaximal. Estes eventos incluem, a inativação dos canais de Na+ de voltagem-dependente que torna mais difícil eliciar uma resposta subsequente e é quantificada por refratariedade e o período refratário relativo 1. Isto é seguido por um carregamento do entrenó e um período de elevada excitabilidade mediada pelos canais de potássio rápido, quantificadas pelo superexcitability. Finalmente, lentamente ativando canais de potássio mediam um período tardio da excitabilidade reduzida, quantificada como subexcitability.
- Gravar o CMAP do músculo hipotenar simultaneamente Visualizar a morfologia do CMAP e aplicando um 1 pulso de onda quadrada de ms para o nervo ulnar com eletrodo de agulha o cátodo.
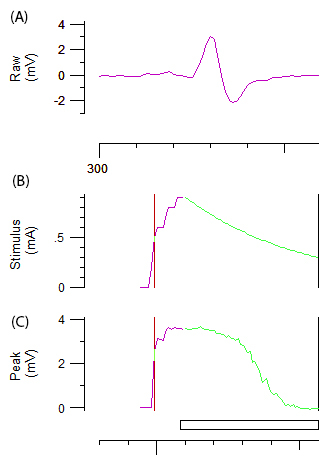
Figura 2: dados brutos de um teste de excitabilidade axonal Painel A demonstra a curva de resposta CMAP abiphasic após aumento incremental da estimulação do nervo ulnar. Os painéis B e C representam a intensidade do estímulo (mA) e a amplitude do CMAP (mV), respectivamente. O componente verde de B e C retrata a diminuição incremental automatizada de intensidade do estímulo e com a diminuição em forma sigmoide associada no CMAP exigido para o limite de controle.
4. publicar procedimentos de eletrofisiologia
- Transferi o rato para uma gaiola separada até que recuperou a consciência suficiente para manter a prostração esternal. Não deixe um animal sozinho e em companhia de outros animais até recuperou totalmente da anestesia. Uma vez que o rato se recuperou totalmente da anestesia, transferi-lo volta para sua gaiola original.
- Após a conclusão do estudo, eutanásia o rato sem dor para a animal, por exemplo, letal injeção intraperitoneal de barbitúricos (por exemplo, lethabarb).
Resultados
Medidas eletrofisiológicas do nervo ulnar rato foram obtidas com o presente protocolo. A Figura 3 demonstra um representante gravação do nervo ulnar esquerdo de 12 semanas de idade feminino longo Evans rato. Potencial de ação muscular composto refere-se ao número de realização de fibras que são ativadas simultaneamente. O pico de resposta supramaximal (mV) (Figura 3A) demonstra a resposta de pico alcançada quando incrementalmente aumentar o estímulo até o existe nenhuma mudança na resposta (Figura 2B).
Figura 3B representa a corrente-tensão (eu / V) relação produzida pelas correntes mais longos em duração (200 ms) e sua intensidade alterada em incrementos de 10% de + 50% para -100% do limiar. O eu / relação V avalia retificação para dentro e para fora, examinando-se as diferenças no limiar atual em resposta a despolarizar e hiperpolarização correntes. O quadrante esquerdo inferior reflete Retificação interna, acomodando a hiperpolarização e ativação de interiormente retificando conductances1. Quadrante superior direito reflete a ativação de canais de K+ rápida e lenta e a acolher a retificação para fora para o corrente despolarizantes.
Conductances internodal podem ser examinados usando a forma de onda do limite electrotonus (Figura 3) em resposta a tempo abaixo do limite despolarizantes e hiperpolarização correntes. Tanto hiperpolarização e despolarizantes TE tem variáveis que podem ser calculadas pela média a mudança do limiar entre pontos específicos de tempo 10-20 ms, ms de 20-40 e 90-100 ms.
Mudanças ao longo do tempo devido a lesão ou a aplicação de intervenções terapêuticas podem causar alterações específicas para parâmetros de excitabilidade do nervo. Isso pode fornecer informações úteis na vivo sobre alterações fisiopatológicas, primeiros traços de doença e efeito terapêutico em modelos animais de doenças neurológicas.

Figura 3: uma parcela representativa de excitabilidade axonal. (A) curva de estímulo-resposta retratando a resposta de pico supermaximal (mV). (B) a corrente-tensão (eu / V) relação produzida por um estímulo polarizador de 200ms, variando de + 50% para -100% do limite da corrente. (C) electrotonus de limiar ilustrando a forma de onda em resposta a prolongada abaixo do limite de polarização atual eliciada um 20% e 40% despolarizantes (acima de 0 no eixo y) e corrente de hiperpolarização (abaixo de 0 no eixo y). Clique aqui para ver uma versão maior desta figura.
Teste de excitabilidade axonal sequencial foi realizado sobre o membro anterior esquerdo e direito, depois de n = 4 ratos (12 semanas). Esquerda e direita gravações foram concluídas dentro de 35 min após a perda do reflexo de retirada de pedal. A análise foi realizada usando o não-paramétricos Wilcoxon assinado classificação teste emparelhado. Essas análises revelaram não há diferenças significativas entre esquerda e direita ulnar nervos para qualquer uma das variáveis excitabilidade axonal. Consistência foi demonstrada em parâmetros de condução do nervo padrão, amplitude CMAP e latência (Figura 4A e B), bem como variáveis de excitabilidade nervosa, incluindo superexcitability e electrotonus de limiar hiperpolarização (TEh) 90-100 (Figura 4 e D). No entanto, anteriores estudos10 indicaram mudanças significativas ao longo do tempo em parâmetros ocorre sob anestesia de isoflurano (ver discussão).
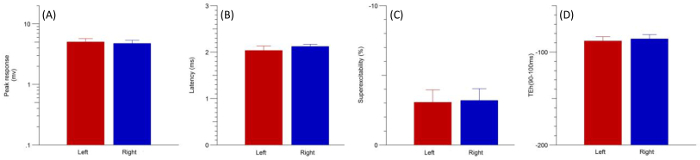
Figura 4: quer dizer as gravações (n = 4) obtidos por (A) pico resposta latência (B) (C) superexcitability e (D) hiperpolarização limiar electrotonus (90-100ms) na esquerda (vermelha) e os nervos ulnar direita (azul). As barras de erro indicam o erro padrão da média (SEM). Clique aqui para ver uma versão maior desta figura.
Discussão
O procedimento descrito demonstra uma maneira simples e confiável, técnica minimamente invasiva que permite a avaliação das propriedades biofísicas e potencial de membrana do axônio em um curto período de tempo. Em comparação com outras técnicas mais invasivas, que exigem a exposição do nervo, o presente método de teste de excitabilidade axonal induz dano mínima dos tecidos, permitindo avaliação na vivo que preserva as condições fisiológicas do nervo de interesse e permite para medidas repetidas.
Para garantir resultados consistentes lá são algumas considerações metodológicas que precisam ser abordadas. Um tal fator é a concentração e o tipo de anestesia. Foi previamente demonstrado que isoflurano tem um efeito sobre o hyperpolarization cíclico do nucleotide-gated canais10. Como alternativa, uma mistura de anestésica injetável de medetomidina, midazolam e butorfanol foi investigada e também demonstrou efeitos sobre a excitabilidade sobre tempo10. Medetomidina/midazolam/fentanil (MMF) parece ter pouco efeito sobre a excitabilidade e tem sido com sucesso usado em muitos nervos excitabilidade estudos7,13,14, embora seus efeitos ao longo do tempo no nervo excitabilidade, não têm sido sistematicamente investigados. De nota, este anestésico é difícil de obter nos EUA e na Austrália como fentanil é uma substância controlada com normas de importação rigorosas. Independentemente de anestesia escolhida, dosagem e tempo sob anestesia devem ser cuidadosamente monitorizados para consideração na análise.
Outro fator a considerar é a qualidade de eletrodo. Devido à forte e prolongada hiperpolarização e despolarizantes correntes aplicadas na excitabilidade axonal eletrodos de alta qualidade de estudos são necessários. Neste estudo, foram utilizados eletrodos de agulha de platina eletroencefalograma (EEG) de baixa impedância. Eletrodos de baixa impedância são normalmente dentro do intervalo de quilo-Ohm e os eletrodos de EEG platina convencionalmente operam dentro de 0.5 - 5 escala de quilo-ohm, que qualifica como eletrodos de baixa impedância. O programa de excitabilidade axonal pode gravar a saída atual e calcular impedância contra o alvo para fora de tensão e anteriormente estabeleceu que a corrente estava estável por 30 min, qual é o comprimento típico deste protocolo15. Além disso, esses eletrodos foram recentemente introduzidos em camundongos16 e não serem sujeitos a efeitos14,15de polarização. Portanto, polarização não seria um problema durante o procedimento experimental.
Em contraste com protocolos que expõem o nervo de interesse, estes estudos utilizam um modelo intacto que torna o posicionamento dos eléctrodos estimulantes aproximados. Assim, a replicação exata de colocação do eletrodo em estudos longitudinais pode ser difícil. Apesar disso, um estudo anterior com anestesia diferente demonstrou boa repetibilidade dos parâmetros de excitabilidade do nervo ulnar 30/34 em 3 estudos separados semelhantes ao observado em nervos tibial e caudal13. Além disso, neste estudo, a comparação entre direita e esquerdas CMAPs mostrou consistência (Figura 4), sugerindo a colocação do eletrodo precisa e adequada é suficiente para compensar esta limitação possível.
Existem várias etapas essenciais no processo de aquisição de respostas CMAP. Adequada e coerente a colocação do eletrodo agulha estimulante é crucial para as medições reproduzíveis da amplitude. Além disso, é essencial para assegurar a colocação adequada dos eletrodos de agulha para minimizar o ruído de fundo de gravação. Portanto, simultaneamente visualizando a curva de resposta, enquanto a colocação do eletrodo de agulha estimulante é crucial para confirmar a colocação consistente.
O uso desta técnica minimamente invasiva em modelos animais de doenças neurológicas pode ser uma ferramenta valiosa para investigar mudanças fisiopatológicas e traços de doença precoce. Estes podem atuar como biomarcadores e facilitar a investigação de novas intervenções terapêuticas em conjunto com medidas comportamentais da função da mão. Além disso, a validação dessas técnicas em roedores pode permitir a investigação das relações farmacocinéticas e farmacodinâmicas de novos compostos. Isto pode permitir a melhor tradução de compostos terapêuticos antes da fase 1 e 2 ensaios clínicos
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
O projeto foi apoiado pela Lundbeck Foundation, Fundação Novo Nordisk, o dinamarquês Medical Research Council, o Ludvig e Sara Elsass Foundation, Fundação para a investigação em neurologia e Bárbara e Kaj Dahlboms Foundation. Ramalho é apoiada por um precoce carreira Doctoral Fellowship do nacional de saúde e medicina Conselho de pesquisa da Austrália (#1091006)
Materiais
| Name | Company | Catalog Number | Comments |
| QTracS Program | Digitimer Ltd. | Axonal excitability program | |
| AM-Systems 2200, Analog Stimulus Isolator, 2200V/50Hz | SDR Scientific | 850005 | Stimulator |
| High Performance AC Amplifier Model LP511 | Grass Technologies | Amplifier | |
| Humbug 50/60Hz Noise eliminator | Quest Scientific Instruments | 726310 | Noise eliminator |
| Low Impedance Platinum Monopolar Subdermal Needle Electrodes | Grass Technologies | F-E2-24 | Recording electrodes, 10 mm length, 30 gauge |
| Low Impedance Platinum Electroencephalography Needle Electrodes | Cephalon | 9013L0702 | Stimulating electrodes, 10 mm length, 30 gauge |
| Multifunction I/O Device Model USB-6341 | National Instruments | Multifunction input/output device | |
| Iron Base Plate IP | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place | |
| Rotating X-block X-4 | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place | |
| Magnetic Stand GJ-8 | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place | |
| Micromanipulator M-3333 | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place |
Referências
- Krishnan, A. V., Lin, C. S. -. Y., Park, S. B., Kiernan, M. C. Axonal ion channels from bench to bedside: a translational neuroscience perspective. Prog neurobiol. 89 (3), 288-313 (2009).
- Lin, C. S. -. Y., Krishnan, A. V., Park, S. B., Kiernan, M. C. Modulatory effects on axonal function after intravenous immunoglobulin therapy in chronic inflammatory demyelinating polyneuropathy. Arch neurol. 68 (7), 862-869 (2011).
- Park, S. B., Goldstein, D., Lin, C. S. -. Y., Krishnan, A. V., Friedlander, M. L., Kiernan, M. C. Acute abnormalities of sensory nerve function associated with oxaliplatin-induced neurotoxicity. J. Clin. Oncol. 27 (8), 1243-1249 (2009).
- Arnold, R., Pussell, B. A., Pianta, T. J., Lin, C. S. -. Y., Kiernan, M. C., Krishnan, A. V. Association between calcineurin inhibitor treatment and peripheral nerve dysfunction in renal transplant recipients. Am. J. Transplant. 13 (9), 2426-2432 (2013).
- Boërio, D., Greensmith, L., Bostock, H. Excitability properties of motor axons in the maturing mouse. J. Peripher. Nerv. Syst. 14 (1), 45-53 (2009).
- Boërio, D., Kalmar, B., Greensmith, L., Bostock, H. Excitability properties of mouse motor axons in the mutant SOD1(G93A) model of amyotrophic lateral sclerosis. Muscle & Nerve. 41 (6), 774-784 (2010).
- Alvarez, S., Calin, A., Graffmo, K. S., Moldovan, M., Krarup, C. Peripheral motor axons of SOD1(G127X) mutant mice are susceptible to activity-dependent degeneration. Neurosci. 241, 239-249 (2013).
- Fledrich, R., et al. Soluble neuregulin-1 modulates disease pathogenesis in rodent models of Charcot-Marie-Tooth disease 1A. Nat. Med. 20 (9), 1055-1061 (2014).
- Vianello, S., et al. Low doses of arginine butyrate derivatives improve dystrophic phenotype and restore membrane integrity in DMD models. FASEB J. 28 (6), 2603-2619 (2014).
- Osaki, Y., et al. Effects of anesthetic agents on in vivo axonal HCN current in normal mice. Clin Neurophysiol. 126 (10), 2033-2039 (2015).
- Biessels, G. J., et al. Phenotyping animal models of diabetic neuropathy: a consensus statement of the diabetic neuropathy study group of the EASD (Neurodiab). J. Peripher. Nerv. Syst. 19 (2), 77-87 (2014).
- Boërio, D., Greensmith, L., Bostock, H. A model of mouse motor nerve excitability and the effects of polarizing currents. J. Peripher. Nerv. Syst. 16 (4), 322-333 (2011).
- Arnold, R., Moldovan, M., Rosberg, M. R., Krishnan, A. V., Morris, R., Krarup, C. Nerve excitability in the rat forelimb: a technique to improve translational utility. J. Neurosci. Methods. 275, 19-24 (2017).
- Moldovan, M., Alvarez, S., Krarup, C. Motor axon excitability during Wallerian degeneration. Brain. 132 (Pt 2), 511-523 (2009).
- Madison, R. D., Robinson, G. A., Krarup, C., Moldovan, M., Li, Q., Wilson, W. A. In vitro electrophoresis and in vivo electrophysiology of peripheral nerve using DC field stimulation. J. Neurosci. Methods. 225, 90-96 (2014).
- Moldovan, M., Krarup, C. Evaluation of Na+/K+ pump function following repetitive activity in mouse peripheral nerve. J. Neurosci. Methods. 155 (2), 161-171 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados