Method Article
In Vivo Misurazione elettrofisiologica del nervo ulnare del ratto con test di eccitabilità assonale
In questo articolo
Riepilogo
Tecniche di eccitabilità assonale forniscono un potente strumento per esaminare la patofisiologia e cambiamenti biofisici che precedono gli eventi degenerativi irreversibili. Questo manoscritto viene illustrato l'utilizzo di queste tecniche sul nervo ulnare di ratti anestetizzati.
Abstract
Elettrofisiologia consente la valutazione obiettiva della funzione di nervo periferico in vivo. La conduzione del nervo tradizionali misure come ampiezza e latenza rilevare perdita cronica dell'assone e demielinizzazione, rispettivamente. Tecniche di eccitabilità assonale "dalla soglia di rilevamento" espandere su queste misure fornendo informazioni riguardanti l'attività di canali ionici, pompe e scambiatori che si riferiscono alla funzione acuta e possono precedere gli eventi degenerativi. Come tale, l'uso di eccitabilità assonale in modelli animali di malattie neurologiche può fornire una misura utile in vivo per valutare nuovi interventi terapeutici. Qui descriviamo un setup sperimentale per misure multiple di tecniche motore eccitabilità assonale nel nervo ulnare del ratto.
Gli animali sono anestetizzati con isoflurano e accuratamente monitorati per garantire la costante e adeguata profondità dell'anestesia. Temperatura corporea, frequenza respiratoria, frequenza cardiaca e saturazione di ossigeno nel sangue sono continuamente monitorate. Studi eccitabilità assonale vengono eseguiti mediante stimolazione percutanea del nervo ulnare e registrazione da muscoli hypothenar della zampa zampa anteriore. Con posizionamento corretto degli elettrodi, viene registrato un potenziale di azione muscolare composto chiaro che aumenta in ampiezza con l'aumento dell'intensità dello stimolo. Un programma automatizzato è quindi utilizzato per fornire una serie di impulsi elettrici che generano 5 misure di eccitabilità specifico nella seguente sequenza: comportamento di stimolo risposta, costante di tempo di resistenza durata, electrotonus soglia, soglia di corrente rapporto e il ciclo di recupero.
I dati presentati qui indicano che queste misure sono ripetibili e mostrano somiglianza tra sinistra e destra ulnare nervi quando valutate nello stesso giorno. Una limitazione di queste tecniche in questa impostazione è l'effetto della dose e tempo sotto anestesia. Attento monitoraggio e registrazione di queste variabili dovrebbero essere intrapresi per considerazione al momento dell'analisi.
Introduzione
L'uso di tecniche elettrofisiologiche è uno strumento essenziale per lo Studio in vivo della funzione di nervo periferico nei disturbi neurologici. Metodi di conduzione del nervo convenzionali utilizzano stimoli supramaximal per registrare la latenza e l'ampiezza del potenziale di azione del motore. Queste tecniche forniscono pertanto informazioni utili sul numero di fibre di conduzione e la velocità di conduzione delle fibre più veloce. Un prezioso strumento complementare è quello di eccitabilità assonale test. Questa tecnica utilizza stimolazioni elettrofisiologiche a sofisticati modelli per valutare indirettamente le proprietà biofisiche dei nervi periferici, come ad esempio l'attività di canali ionici, energia-dipendente pompe, processi di scambio ionico e potenziale di membrana 1.
Test di eccitabilità assonale è comunemente utilizzata in ambito clinico per studiare processi patofisiologici e gli effetti degli interventi terapeutici in vari disturbi neurologici. D'importanza, misure di eccitabilità assonale sono sensibili agli interventi terapeutici che influiscono sulla funzione di nervo periferica quali l'immunoglobulina endovenosa (IVIg) terapia2, trattamento di chemioterapia3 e calcineurina inibitore (CNI) 4. anche se questi studi hanno fornito le comprensioni importanti, studi clinici spesso precludono inchiesta dei primi tratti di malattia e di nuove opzioni terapeutiche5. Pertanto, l'uso di questi metodi in modelli animali di malattie neurologiche recentemente ha guadagnato trazione6,7,8,9. Infatti, questi metodi forniscono un'opportunità per comprendere i cambiamenti di eccitabilità del nervo specifico associati a questi disturbi, avanzando ricerca traslazionale.
La procedura qui descritta è un metodo semplice e affidabile per record eccitabilità assonale misure sui nervi ulnari del ratto intatto.
Protocollo
Tutte le procedure sperimentali descritte qui rispettato con la cura degli animali e il comitato etico di UNSW Sydney e sono state eseguite in conformità con il National Health and Medical Research Consiglio (NHMRC) dei regolamenti di Australia per la sperimentazione animale.
1. sperimentale istituito
Nota: 12 settimane di età, femminile ratti lungo Evans sono stati utilizzati in questa procedura.
- Anestetizzare il ratto in una camera di induzione con 4% isoflurane e 1 L per ogni portata min O2 . Confermare l'anestesia sufficiente di test per il riflesso di raddrizzamento e garantire la sua assenza prima di rimuovere l'animale dalla camera di induzione. Si noti che i vari agenti anestetici avere effetti differenziali sul nervo eccitabilità10.
- In modo sicuro mettere il muso dell'animale nell'allegato del cono di naso e consegnare una dose di mantenimento di 2,5% isoflurane e 1 L al min O2 portata.
- Confermare un'anestesia adeguata controllando per ritiro pedale e riflessi corneali di pizzicare le dita dei piedi dell'animale e sfiorando il suo occhio.
Nota: Applicazione dell'unguento veterinario sugli occhi, per prevenire la secchezza mentre sotto anestesia, è consigliato ma non essenziale come la procedura richiede in genere 30 min per ogni animale. - Mantenere la temperatura corporea del ratto a 37 ° C con l'uso di un tappetino di riscaldamento di feedback controllato e una sonda termometro rettale. Impostare la stuoia di riscaldamento e sensore di temperatura integrato corpo a 40 ° C per evitare eventuali danni alla pelle che si verifica con temperature più elevate.
Nota: Si consiglia di monitorare e registrare misure fisiologiche (frequenza cardiaca, saturazione dell'ossigeno, la temperatura corporea e frequenza respiratoria) ogni 10s con l'uso di un sistema di monitoraggio fisiologico degli animali. Procedure di registrazione ottimale dovrebbero includere locale misurazione della temperatura degli arti come la temperatura periferica può essere più fredda di quello del nucleo temperatura11 (Figura 1). - Indossare guanti di antisettici e utilizzare sempre strumenti che sono stati puliti con etanolo al 70%, per mantenere un ambiente privo di agenti patogeni durante tutta la procedura.
2. elettrofisiologici Set Up
- Per questa procedura, usare elettrodi ad ago di bassa impedenza platino dell'elettroencefalogramma (EEG).
- Preparare gli elettrodi dell'ago di registrazione inserendo l'elettrodo ad ago di registrazione (Figura 1; indicato in viola) attraverso il muscolo ipotenar e l'elettrodo di riferimento attraverso la funzione dorsale della cifra 4 (Figura 1; indicato in arancione) per registrare i potenziali di azione composti del muscolo (CMAPs).
- Posizionare l'elettrodo di terra attraverso la pelle sulla funzione superiore dell'avambraccio tra stimolazione e registrazione elettrodi (Figura 1; indicato in verde). Fare attenzione quando si inseriscono gli elettrodi per evitare il tessuto muscolare.
- Preparare lo stimolante elettrodi ad ago percutaneo inserendo il catodo (Figura 1; etichettati in blu) del tunnel di circa 4 millimetri distale per il cubitale al gomito. Inserire l'anodo (Figura 1; etichettati in rosso) circa 1 cm prossimalmente attraverso la pelle della regione ascellari.

Figura 1: un diagramma schematico dei posizionamenti dell'elettrodo dell'ago nell'arto anteriore ratto. Il catodo (blu) viene inserito circa 4 mm distale del tunnel cubitale al gomito e l'anodo (rosso) viene inserito circa 1 cm prossimalmente attraverso la pelle della regione ascellari. L'elettrodo ad ago di terra (verde) viene inserito attraverso la pelle sulla funzione superiore dell'avambraccio tra stimolando ed elettrodi di registrazione. La registrazione (viola) e gli elettrodi ad ago di riferimento (arancione) vengono inseriti attraverso il muscolo ipotenar e attraverso la funzione dorsale della cifra 4th . La sonda di temperatura (grigio) è posto sulla funzione superiore del muscolo thenar. Clicca qui per visualizzare una versione più grande di questa figura.
3. axonal eccitabilità procedure
- Eseguire il nervo motore roditore protocollo TRONDNF utilizzando un semi-automatico, programma per computer controllato eccitabilità assonale (Vedi la tabella materiali) collegata a uno stimolatore di corrente costante e di un amplificatore. Rimuovere il rumore elettrico in eccesso di 50 Hz utilizzando un eliminatore di rumore 50/60 Hz.
- Registrare il CMAP dal muscolo ipotenar contemporaneamente visualizzare la morfologia CMAP e applicando un 1 impulso di onda quadra di ms al nervo ulnare con l'elettrodo ad ago del catodo.
- Per ottenere registrazioni ottimale, regolare con cura l'angolo e/o la posizione del catodo fino a una curva di risposta ottimale bifase con ampiezza costante è raggiunto (Figura 2A.). Una volta stabilita la posizione ottimale, stabilizzare il catodo con una pinza porta elettrodo riposizionabile.
Nota: Il software utilizzato automaticamente trasporta gli stimoli test, descritti di seguito e aumenta o diminuisce la corrente necessaria per raggiungere la soglia.
- Per ottenere registrazioni ottimale, regolare con cura l'angolo e/o la posizione del catodo fino a una curva di risposta ottimale bifase con ampiezza costante è raggiunto (Figura 2A.). Una volta stabilita la posizione ottimale, stabilizzare il catodo con una pinza porta elettrodo riposizionabile.
- Registrare una curva stimolo-risposta aumentando gradualmente l'intensità dello stimolo di 1 ms impulso da 1 mA fino a quando una risposta massima è raggiunta.
Nota: La linea viola e verde in figura 2B e 2C rappresenta rispettivamente l'aumento incrementale dell'intensità dello stimolo e il sistema automatizzato. L'ampiezza di destinazione per la soglia di rilevamento viene impostata automaticamente al 40% della massima ampiezza corrispondente alla zona del versante più ripida della curva di risposta agli stimoli. Il cambiamento di 'soglia' (cioè stimolo necessario suscitare 40% CMAP) indotto da vari stimoli di prova è la variabile di ottenuti in tutto il resto del protocollo. - Registrare i parametri di eccitabilità assonale multipli, compreso electrotonus soglia (TE), corrente-soglia (io / V) rapporto e recupero ciclo (RC) come descritto nella Guida di riferimento12.
Nota: Il programma del computer controllato eccitabilità assonale valuta la soglia (TE) con un 100 ms sottosoglia depolarizzante e hyperpolarizing correnti che è fissata a ± 20% e ± 40% del limite di controllo corrente. Il cambiamento nella soglia dopo sia depolarizzazione e hyperpolarizing correnti viene automaticamente registrato a 14 punti di tempo durante i 100 ms corrente di polarizzazione e 12 punti dopo la corrente di polarizzazione. Electrotonus soglia indirettamente valuta le conduttanze internodale ed è un indicatore del potenziale di membrana. I / V relazione è valutata con correnti di sottosoglia condizionata 200 ms che si alternano in intensità da + 50% a -100% del limite di controllo in incrementi del 10%. I / V relazione è diversa per TE in quanto le correnti sono più lunghe della durata, l'intensità di polarizzazione è progressivamente alterato da + 50% a -100% e il cambiamento di soglia è valutata a ogni intensità 1 ms dopo la corrente di polarizzazione ha cessato. I / rapporto V fornisce la comprensione nelle proprietà rettifica del assone1. La RC è valutata con un paradigma di impulsi appaiati, dove viene applicato uno stimolo condizionata sopramassimale iniziale seguito da una serie di stimoli prova intervalli specifici da 2,5 ms a 200 ms. questo parametro test una serie ben definita di eventi che si verificano nella nodale regione dell'assone dopo stimolazione sopramassimale. Tali eventi includono, l'inattivazione delle scanalature tensione-gated di Na+ che rende più difficile suscitare una risposta successiva ed è quantificata dalla refrattarietà e il periodo refrattario relativo 1. Questa è seguita da una ricarica l'internodo e un periodo di maggiore eccitabilità mediata dai canali del potassio veloce, quantificati da superexcitability. Infine, lentamente d'attivazione canali del potassio mediano un tardo periodo di ridotta eccitabilità, quantificata come subexcitability.
- Registrare il CMAP dal muscolo ipotenar contemporaneamente visualizzare la morfologia CMAP e applicando un 1 impulso di onda quadra di ms al nervo ulnare con l'elettrodo ad ago del catodo.
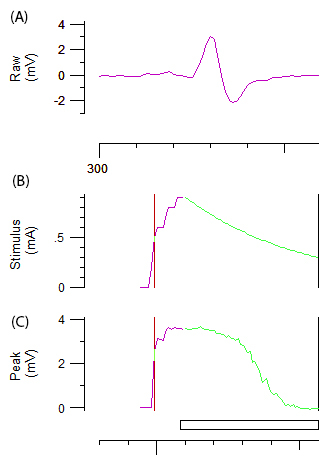
Figura 2: dati non elaborati da un test di eccitabilità assonale. Pannello A dimostra abiphasic curva di risposta CMAP dopo aumento incrementale di stimolazione del nervo ulnare. Pannelli B e C rappresentano l'intensità dello stimolo (mA) e l'ampiezza di CMAP (mV), rispettivamente. Il componente verde di B e C vengono illustrate la diminuzione incrementale automatizzata in intensità dello stimolo e la diminuzione a forma sigmoidea associata in CMAP necessarie per soglia di rilevamento.
4. procedure di elettrofisiologia di post
- Trasferire il ratto in una gabbia separata fino a quando ha riacquistato coscienza sufficiente per mantenere decubito sternale. Non lasciare un animale incustodito e in compagnia di altri animali fino a quando non ha pienamente recuperato dall'anestesia. Una volta che il ratto ha recuperato pienamente dall'anestesia, trasferirlo indietro nella sua gabbia originale.
- Al termine dello studio, eutanasia il ratto senza dolore per l'animale, per esempio letale iniezione intraperitoneale di un barbiturico (ad es. lethabarb).
Risultati
Misure elettrofisiologiche del nervo ulnare del ratto sono stati ottenuti con il presente protocollo. Nella figura 3 viene illustrato un rappresentante registrazione dal nervo ulnare sinistro di un ratto di Evans lungo femminile week-old 12. Potenziale di azione muscolare composto correlato al numero di fibre che vengono attivati contemporaneamente di condurre. La risposta di punta sopramassimale (mV) (Figura 3A) dimostra la risposta di picco raggiunta quando aumenta in maniera incrementale lo stimolo fino a quando non c'è alcun cambiamento nella risposta (Figura 2B).
Figura 3B rappresenta la corrente-tensione (I / V) rapporto prodotto da correnti più lunghe nella loro intensità e durata (200 ms) cambiato in incrementi del 10% da + 50% a -100% della soglia. I / rapporto V valuta la rettificazione interiore ed esteriore esaminando le differenze di corrente in risposta a depolarizzante e hyperpolarizing correnti di soglia. Il quadrante sinistro inferiore riflette verso l'interno rettifica accomodante a hyperpolarization e attivazione della interiormente che rettifica conduttanze1. Quadrante superiore destro riflette lenta e una veloce attivazione del canale K+ e il premuroso rettifica verso l'esterno per la corrente di depolarizzazione.
Gli internodi conduttanze possono essere esaminati utilizzando soglia electrotonus forma d'onda (Figura 3) in risposta a lungo sottosoglia depolarizzante e hyperpolarizing correnti. Hyperpolarizing sia depolarizzante TE hanno variabili che possono essere calcolate con la media il cambiamento di soglia tra punti specifici di tempo 10-20 ms, ms 20-40 e 90-100 ms.
Cambiamenti nel tempo a causa di lesioni o l'applicazione di interventi terapeutici potrebbero causare modifiche specifiche parametri di eccitabilità del nervo. Ciò può fornire informazioni utili in vivo per quanto riguarda cambiamenti patofisiologici, primi tratti di malattia ed efficacia terapeutica in modelli animali di malattie neurologiche.

Figura 3: un complotto di eccitabilità assonale rappresentante. (A) curva stimolo-risposta raffigurante la risposta di punta supermaximal (mV). (B) la corrente-tensione (I / V) il rapporto prodotto da uno stimolo polarizzante 200ms che vanno da + 50% a -100% del limite di corrente. (C) electrotonus soglia che illustrano le forme d'onda in risposta alla prolungata sottosoglia polarizzazione corrente suscitati da un 20% e 40% depolarizzanti (superiore a 0 sull'asse y) e corrente di hyperpolarizing (inferiori a 0 sull'asse y). Clicca qui per visualizzare una versione più grande di questa figura.
Test sequenziale eccitabilità assonale è stata intrapresa sulla zampa anteriore sinistra poi a destra di n = 4 ratti (12 settimana-vecchio). Registrazioni di destra e sinistra sono state completate in 35 min dopo la perdita del riflesso del pedale ritiro. L'analisi è stata effettuata usando l'accoppiati non parametrica firmato rango di Wilcoxon. Queste analisi hanno rivelato nessuna differenza significativa fra i nervi ulnare di destra e sinistra per ognuna delle variabili di eccitabilità assonale. Coerenza è stata dimostrata in parametri di conduzione del nervo standard, ampiezza CMAP e latenza (Figura 4A e B), nonché le variabili di eccitabilità del nervo tra cui superexcitability ed electrotonus soglia hyperpolarizing (TEh) 90-100 (Figura 4 e D). Tuttavia, precedenti studi10 hanno indicato cambiamento significativo nel corso del tempo nei parametri si verificano nell'ambito dell'anestesia isoflurano (vedi discussione).
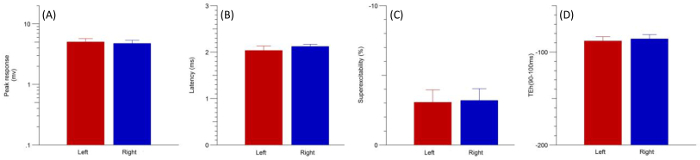
Figura 4: dire le registrazioni (n = 4) ottenuti per (A) picco risposta latenza (B) (C) superexcitability e (D) hyperpolarizing electrotonus soglia (90-100 ms) a sinistra (rosso) e a nervi ulnare di destra (blu). Le barre di errore indicano l'errore standard della media (SEM). Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
La procedura descritta di seguito viene illustrato un semplice e affidabile, tecnica mini-invasiva che permette la valutazione delle proprietà biofisiche e potenziale di membrana dell'assone in un breve periodo di tempo. Rispetto ad altre tecniche più invasive, che richiedono l'esposizione del nervo, l'attuale metodo di eccitabilità assonale test induce danno di tessuto minimo consentendo in tal modo in vivo valutazione che preserva le condizioni fisiologiche della nervo di interesse e consente misurazioni ripetute.
Per garantire risultati coerenti ci sono alcune considerazioni metodologiche che devono essere affrontate. Uno di questi fattori è la concentrazione e il tipo di anestetico. È stato precedentemente dimostrato che isoflurano ha un effetto su hyperpolarization-attivato ciclico del nucleotide-gated canali10. In alternativa, una miscela di anestetica iniettabile di medetomidina, midazolam e butorfanolo è stata studiata e dimostrato effetti sull'eccitabilità del nervo oltre tempo10. Medetomidina/midazolam/fentanil (MMF) sembra avere scarso effetto sull'eccitabilità del nervo ed è stato correttamente utilizzato in molti nervose eccitabilità studi7,13,14, però suoi effetti nel tempo sul nervo eccitabilità non sono stati studiati sistematicamente. Di nota, questo anestetico è difficile da ottenere negli Stati Uniti e Australia, come il fentanyl è una sostanza controllata con importazione rigorose normative. Indipendentemente dall'anestesia selezionata, dosaggio e tempo sotto anestesia devono essere attentamente monitorati per considerazione alle analisi.
Un altro fattore da considerare è la qualità dell'elettrodo. A causa della forte e prolungata hyperpolarizing e depolarizzazione correnti applicate nell'eccitabilità assonale elettrodi di alta qualità di studi sono necessari. In questo studio, sono stati utilizzati gli elettrodi ad ago di platino dell'elettroencefalogramma (EEG) bassa impedenza. Elettrodi a bassa impedenza sono in genere all'interno della gamma di kilo-ohm e gli elettrodi EEG platino convenzionalmente operano entro 0,5 - 5 gamma kilo-ohm che si qualifica come elettrodi a bassa impedenza. Il programma di eccitabilità assonale in grado di registrare l'uscita in corrente e calcolare l'impedenza rispetto al target fuori tensione e in precedenza è stato stabilito che la corrente era stabile per 30 min, che è la lunghezza tipica di questo protocollo15. Inoltre, questi elettrodi sono state recentemente introdotte in topi16 e sono stati trovati per non subire effetti14,15di polarizzazione. Di conseguenza, polarizzazione non sarebbe stato un problema durante la procedura sperimentale.
Contrariamente ai protocolli che espongono il nervo di interesse, questi studi utilizzano un modello intatto che rende il posizionamento degli elettrodi stimolanti approssimativi. Così, la replica esatta di posizionamento degli elettrodi in studi longitudinali può essere difficile. Nonostante ciò, uno studio precedente con diverso anestesia ha dimostrato buona ripetibilità dei parametri di eccitabilità del nervo ulnare 30/34 attraverso 3 studi separati simili a quello veduto in nervi tibial e caudale13. Inoltre, in questo studio, confronto tra destra e sinistra CMAPs ha mostrato coerenza (Figura 4), suggerendo il posizionamento preciso e corretto degli elettrodi è sufficiente a compensare questa limitazione possibile.
Ci sono diversi passaggi critici nel processo di acquisizione di risposte CMAP. Posizione corretta e coerente dell'elettrodo stimolante dell'ago è cruciale per le misurazioni riproducibili di ampiezza. Inoltre, è essenziale per garantire il corretto posizionamento del registrazione elettrodi ad ago per ridurre al minimo il rumore di fondo. Di conseguenza, visualizzando contemporaneamente la curva di risposta anche ponendo l'elettrodo ad ago stimolante è fondamentale per confermare il posizionamento coerenza.
L'uso di questa tecnica mini-invasiva su modelli animali di malattie neurologiche può essere un valido strumento per indagare i cambiamenti patofisiologici e i primi tratti di malattia. Questi possono agire come biomarcatori e facilitare la ricerca di nuovi interventi terapeutici in combinazione con misure del comportamento della funzione della mano. Inoltre, convalida di queste tecniche in roditori può attivare l'indagine delle relazioni farmacocinetiche e farmacodinamiche di nuovi composti. Questo può consentire la migliore traduzione di composti terapeutici prima della fase 1 e 2 studi clinici
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Il progetto è stato sostenuto da Lundbeck Foundation, la Fondazione di Novo Nordisk, il Danish Medical Research Council, il Ludvig e Sara Elsass Foundation, Fondazione per la ricerca in neurologia e Jytte e Kaj Dahlboms Foundation. R. a è supportato da una precoce carriera induttrici Fellowship del National Health and Medical Research Council of Australia (#1091006)
Materiali
| Name | Company | Catalog Number | Comments |
| QTracS Program | Digitimer Ltd. | Axonal excitability program | |
| AM-Systems 2200, Analog Stimulus Isolator, 2200V/50Hz | SDR Scientific | 850005 | Stimulator |
| High Performance AC Amplifier Model LP511 | Grass Technologies | Amplifier | |
| Humbug 50/60Hz Noise eliminator | Quest Scientific Instruments | 726310 | Noise eliminator |
| Low Impedance Platinum Monopolar Subdermal Needle Electrodes | Grass Technologies | F-E2-24 | Recording electrodes, 10 mm length, 30 gauge |
| Low Impedance Platinum Electroencephalography Needle Electrodes | Cephalon | 9013L0702 | Stimulating electrodes, 10 mm length, 30 gauge |
| Multifunction I/O Device Model USB-6341 | National Instruments | Multifunction input/output device | |
| Iron Base Plate IP | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place | |
| Rotating X-block X-4 | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place | |
| Magnetic Stand GJ-8 | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place | |
| Micromanipulator M-3333 | Narishige Scientific Instrument Laboratory | Used for holding stimulating needle electrode in place |
Riferimenti
- Krishnan, A. V., Lin, C. S. -. Y., Park, S. B., Kiernan, M. C. Axonal ion channels from bench to bedside: a translational neuroscience perspective. Prog neurobiol. 89 (3), 288-313 (2009).
- Lin, C. S. -. Y., Krishnan, A. V., Park, S. B., Kiernan, M. C. Modulatory effects on axonal function after intravenous immunoglobulin therapy in chronic inflammatory demyelinating polyneuropathy. Arch neurol. 68 (7), 862-869 (2011).
- Park, S. B., Goldstein, D., Lin, C. S. -. Y., Krishnan, A. V., Friedlander, M. L., Kiernan, M. C. Acute abnormalities of sensory nerve function associated with oxaliplatin-induced neurotoxicity. J. Clin. Oncol. 27 (8), 1243-1249 (2009).
- Arnold, R., Pussell, B. A., Pianta, T. J., Lin, C. S. -. Y., Kiernan, M. C., Krishnan, A. V. Association between calcineurin inhibitor treatment and peripheral nerve dysfunction in renal transplant recipients. Am. J. Transplant. 13 (9), 2426-2432 (2013).
- Boërio, D., Greensmith, L., Bostock, H. Excitability properties of motor axons in the maturing mouse. J. Peripher. Nerv. Syst. 14 (1), 45-53 (2009).
- Boërio, D., Kalmar, B., Greensmith, L., Bostock, H. Excitability properties of mouse motor axons in the mutant SOD1(G93A) model of amyotrophic lateral sclerosis. Muscle & Nerve. 41 (6), 774-784 (2010).
- Alvarez, S., Calin, A., Graffmo, K. S., Moldovan, M., Krarup, C. Peripheral motor axons of SOD1(G127X) mutant mice are susceptible to activity-dependent degeneration. Neurosci. 241, 239-249 (2013).
- Fledrich, R., et al. Soluble neuregulin-1 modulates disease pathogenesis in rodent models of Charcot-Marie-Tooth disease 1A. Nat. Med. 20 (9), 1055-1061 (2014).
- Vianello, S., et al. Low doses of arginine butyrate derivatives improve dystrophic phenotype and restore membrane integrity in DMD models. FASEB J. 28 (6), 2603-2619 (2014).
- Osaki, Y., et al. Effects of anesthetic agents on in vivo axonal HCN current in normal mice. Clin Neurophysiol. 126 (10), 2033-2039 (2015).
- Biessels, G. J., et al. Phenotyping animal models of diabetic neuropathy: a consensus statement of the diabetic neuropathy study group of the EASD (Neurodiab). J. Peripher. Nerv. Syst. 19 (2), 77-87 (2014).
- Boërio, D., Greensmith, L., Bostock, H. A model of mouse motor nerve excitability and the effects of polarizing currents. J. Peripher. Nerv. Syst. 16 (4), 322-333 (2011).
- Arnold, R., Moldovan, M., Rosberg, M. R., Krishnan, A. V., Morris, R., Krarup, C. Nerve excitability in the rat forelimb: a technique to improve translational utility. J. Neurosci. Methods. 275, 19-24 (2017).
- Moldovan, M., Alvarez, S., Krarup, C. Motor axon excitability during Wallerian degeneration. Brain. 132 (Pt 2), 511-523 (2009).
- Madison, R. D., Robinson, G. A., Krarup, C., Moldovan, M., Li, Q., Wilson, W. A. In vitro electrophoresis and in vivo electrophysiology of peripheral nerve using DC field stimulation. J. Neurosci. Methods. 225, 90-96 (2014).
- Moldovan, M., Krarup, C. Evaluation of Na+/K+ pump function following repetitive activity in mouse peripheral nerve. J. Neurosci. Methods. 155 (2), 161-171 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon