Method Article
Combinado optogenética e Freeze-fratura Replica imunomarcação para examinar Arranjo específicos de entrada de glutamato receptores no mouse Amygdala
Neste Artigo
Resumo
This article illustrates how the expression of neurotransmitter receptors can be quantified and the pattern analyzed at synapses with identified pre and postsynaptic elements using a combination of viral transduction of optogenetic tools and the freeze-fracture replica immunolabeling technique.
Resumo
microscopia eletrônica de fractura por congelação tem sido uma técnica importante na investigação ultra-estrutural há mais de 40 anos. No entanto, a falta de meios eficazes para estudar a composição molecular de membranas produzido um declínio significativo na sua utilização. Recentemente, tem havido um grande avivamento em freeze-fratura de microscopia electrónica graças ao desenvolvimento de formas eficazes para revelar proteínas de membrana integrais através de uma rotulagem immunogold. Um destes métodos é conhecido como detergente solubilizado de fractura por congelação de réplica de imunomarcação (FRIL).
A combinação da técnica FRIL com Optogenetics permite uma análise correlacionada dos propriedades estruturais e funcionais de sinapses centrais. Usando esta abordagem, é possível identificar e caracterizar os neurónios tanto pré e pós-sinápticos, por sua respectiva expressão de um channelrodopsina marcados e marcadores moleculares específicos. A aparência distinta da especialização membrana pós-sináptica da Glutamatérgicos sinapses ainda permite que, mediante a rotulagem dos receptores de glutamato ionotrópicos, quantificar e analisar a distribuição intrasynaptic desses receptores. Aqui, damos uma descrição passo-a-passo dos procedimentos necessários para preparar réplicas emparelhados e como immunolabel eles. Também vamos discutir as advertências e limitações da técnica FRIL, em particular aqueles associados com potenciais vieses de amostragem. A elevada reprodutibilidade e versatilidade da técnica FRIL, quando combinado com Optogenetics, oferece uma abordagem poderosa para a caracterização de diferentes aspectos da transmissão sináptica no microcircuitos identificados neuronais no cérebro.
Aqui, nós fornecemos um exemplo de como esta abordagem foi utilizada para obter insights sobre relações estrutura-função de sinapses excitatórias em neurônios das massas de células intercaladas do amygdala mouse. Em particular, foi investigada a expressão de receptores de glutamato ionotrópicos nas entradas ou identificadosiginated do intralaminar posterior do tálamo e núcleos geniculados mediais. Essas sinapses foram mostrados para retransmitir a informação sensorial relevante para a aprendizagem medo e se submeter a mudanças plásticas no medo condicionado.
Introdução
A definição da arquitectura funcional das biomembranas à escala nanométrica foi contestada nos últimos anos com o desenvolvimento de um número de técnicas de imunomarcação adequados para microscopia electrónica de transmissão. No entanto, estas técnicas, por exemplo, pré e imuno-incorporação de pós, têm um certo número de limitações importantes, que incluem pobre detecção de antigénios e / ou avaliação quantitativa limitado de proteínas ligadas à membrana. Estas limitações tornam-se particularmente crítico na investigação da estrutura fina do sistema nervoso, que é caracterizada por um elevado grau de diversidade e heterogeneidade celular sinapse. Esta heterogeneidade resultados de diversidade estrutural e funcional ditada pelos elementos pré- e pós-sinápticos e pela expressão diferencial, enriquecimento, ou a interacção de proteínas de sinalização, tais como receptores, transportadores, e moléculas efectoras.
Uma nova abordagem para immunolabe diretaling de proteínas de membrana integrais ou reticuladas em réplicas de fractura por congelação de detergente solubilizado (FRIL) foi originalmente introduzido pela Fujimoto há duas décadas 1. Este método original tinha, no entanto, várias limitações, ou seja, a fragmentação grave de réplicas, o que dificultava correlações significativas de moléculas marcadas com células mapeadas individualmente em tecidos complexos como o cérebro. Cerca de 10 anos atrás, Shigemoto e Fukazawa melhorou progressivamente a técnica 2. Esta foi acompanhada por esforços de outro grupo de cientistas dos laboratórios de Boulder da Universidade Estadual do Colorado, que também melhorou significativamente a técnica, em particular para o estudo das junções comunicantes 3.
A melhoria em protocolos de congelação-fractura e máquinas, bem como a introdução de congelação rápida (sob alta pressão), permite agora que os investigadores para produzir réplicas ininterrupta de espécimes de tamanho relativamente grande e oiimagens de qualidade gh da maioria dos componentes celulares sem as limitações e artefatos produzidos por fortes fixações químicas.
A técnica FRIL oferece a grande vantagem de uma altamente quantitativa na identificação in situ de um ou mais proteínas (simultaneamente) em histologicamente mapeadas e identificadas células citologicamente dentro dos tecidos complexos, tais como o cérebro, com a vantagem adicional de uma vista plana de pré- e pós-sináptico elementos em uma única réplica. Portanto, a técnica FRIL, apesar das suas muitas dificuldades técnicas, mantém a promessa de uma série de avanços científicos muito significativos, particularmente para a correlação de propriedades estruturais e funcionais de sinapses individuais. Durante as últimas décadas, uma grande quantidade de informações foi obtida sobre a estrutura, fazer molecular, e função fisiológica das sinapses; ainda sinapses são morfologicamente e molecularmente muito diverso, dependendo do pa pré e pós-sinápticaaluguer neurônios 4. Apenas por um punhado de tipos de sinapses eram estudos de estrutura-função feito até agora 5-7. Este foi principalmente devido a condicionalismos técnicos que impediram uma identificação precisa da natureza dos elementos pré e pós-sinápticos.
A análise ultra forneceu insights críticos sobre a variabilidade das especializações membrana pós-sináptica através de contatos sinápticos distintas, tanto em termos de tamanho sináptica e conteúdo em receptores de neurotransmissores 6, que tem um grande impacto sobre a força e a plasticidade da transmissão sináptica. Além disso, um grande corpo de pesquisa indica que o número de receptores de glutamato ionotrópicos expressos em diferentes tipos de sinapse é regulado de forma afferent- e meta-dependentes 7-10.
Aqui, um método é descrito que permite a análise da composição e estrutura do receptor da membrana pós-sináptica com especializações definirelementos pré-sinápticos d e função. Esta abordagem toma vantagem da expressão de pré-sináptica de proteínas sensíveis à luz recentemente desenvolvidos de algas, tais como Channelrhodopsin2 (ChR2), e da técnica FRIL para analisar o padrão de expressão pós-sináptico de α-amino-3-hidroxi-5-metil-4-isoxazolpropiónico ácido (AMPA-R) e N-metil-D-aspartato (NMDA-R) de receptores de glutamato. Isto é demonstrado nas sinapses formadas por axônios provenientes dos posteriores núcleos geniculados tálamo-mediais (PIN / MGN) em neurônios das massas de células intercaladas do amígdala (ITC). Neurónios ITC são células GABAérgicos espinhosas pequenas organizadas em aglomerados em torno do complexo amigdalóide basolateral (BLA) 11, 12. Neurónios ITC são conhecidos para receber entradas excitatórios de BLA principais neurónios e para atingir o núcleo central (CEA), funcionando, assim, como um portão inibidora para o fluxo de informações entre o BLA e CeA 12-15.
Recentemente, foi demonstrado que TINeurônios C localizados no cluster medio-dorsal entre BLA e CeA também recebem inputs excitatórios diretos e convergente de regiões corticais do tálamo e temporais sensoriais, que são modificados no medo aprendizado durante pavloviano auditivo medo condicionado 16. O condicionamento do medo é uma das formas mais bem compreendidos de aprendizagem associativa em termos de mecanismos cerebrais. Com medo condicionado, um estímulo condicionado inicialmente neutro (CS, por exemplo, um tom) está emparelhado com um estímulo aversivo incondicionado (US, por exemplo, um choque pé leve), resultando em uma associação CS-US e resposta de medo 17, 18 condicionado. Excitatórios entradas a partir de ambas as áreas do tálamo e neocorticais, que transportam informação que representa o CS e dos Estados Unidos, respectivamente, eram conhecidos por convergem para neurónios piramidais do núcleo lateral da amígdala (LA) e se submeter a plasticidade 19. Nosso trabalho anterior revelou que a informação entrada sensorial é também em paralelo retransmitida para os neurônios ITC 16.
Como um primeiro passo para uma análise molecular mecanicista da entrada sensorial indivíduo sinapses em neurônios ITC, foi utilizado um vírus adeno-associado (AAV) para expressar ChR2 marcada com a proteína fluorescente amarela (YFP). O AAV foi injectado no PIN / MGN e os terminais de axónios foram identificados pela sua expressão de ChR2-YFP. Usamos ambas as faces geradas pela técnica FRIL para avaliar a densidade de pós-sinápticos AMPA-Rs e NMDA-R nas sinapses formados com ITC neurônios por terminais do axônio PIN / MGN.
Protocolo
Procedimentos envolvendo indivíduos animais foram aprovados pela Regierungspraesidium Tübingen, Estado de Baden-Württemberg, Alemanha, e pelo Conselho de Ética em Experimentação animal austríaca, e estavam em conformidade com a directiva da UE sobre a utilização de animais em pesquisa.
1. estereotáxica injeções de AAV-Channelrhodopsin2-YFP
NOTA: As injecções estereotáxicas foram realizadas de acordo com um protocolo previamente publicado a 20.
- Preparar as ferramentas estéreis aquecendo-os a 180 ° C durante 1,5 h.
- Puxe afiadas pipetas de vidro (~ 50 mm de diâmetro) para injectáveis usando um extrator de microeletrodos horizontal definido com os seguintes parâmetros: Calor = valor Ramp - 20, Pull = 0, Velocity = 100, Tempo = 200, Pressão = 200.
NOTA: O valor de rampa tem de ser determinado para cada lote de pipetas de vidro comprados de acordo com as instruções fornecidas pelo fabricante micropipeta extrator. - Pré-mistura 1 ml de solução de vírus e 0,2 ul de solução verde rápido 0,1% (para uma melhor visibilidade da solução na pipeta de vidro) em fosfato tampão estéril salino (PBS; 25 mM, NaCl a 0,9%, pH 7,4). Encha a pipeta de vidro usando uma pipeta 10 ml e gel-fil dicas. Para a construção virai, usar rAAV-hSyn-ChR2 (H134R) -eYFP (serotipo 2/9).
- Anestesiar rato usando um pequeno aparelho de anestesia para animais (3% de isoflurano em oxigênio para a indução). Usar. Para este estudo, usar 3 ratinhos de tipo selvagem com idades compreendidas entre ~ 6 semanas.
- Raspar a cabeça entre as orelhas e os olhos e desinfectar com uma solução à base de iodo-povidona.
- Aplique uma pomada para evitar a secagem dos olhos durante a anestesia. Injectar subcutaneamente rato com analgésico (à base de meloxicam, 0,1 ml de uma solução a 5 mg / ml).
- Coloque o mouse no quadro estereotáxico e manter a anestesia através de um aparelho de anestesia de gás (2% de isoflurano em oxigênio para manutenção). Verifique a profundidade da anestesia por falta de uma retirada do membroreflexo antes de continuar.
- Manter condições estéreis da melhor forma possível durante todo o procedimento cirúrgico. Usar um face-máscara descartável, um vestido cirúrgico e luvas.
- Faça uma incisão na pele de aproximadamente 1 cm na parte superior da cabeça com uma tesoura 20. Com cuidado, puxe a pele para o lado usando uma pinça sem corte, fixe com grampos para expor a superfície do crânio e do crânio limpo com H 2 O 2.
- locais de injecção marca no crânio usando um marcador permanente ponta fina. Perfurar um furo pequeno (aproximadamente 1 mm de diâmetro) no crânio no local marcado. Para unilateral injecção PIN / MGN neste parafuso prisioneiro, use as seguintes coordenadas: a partir de bregma (mm): posteriores 3.0, lateral ± 1,8, ventrais 3.8.
- Montagem preenchido pipeta de vidro sobre a armação estereotáxica ligado a um dispositivo de injecção de pressão e trazer a pipeta em relação ao bregma posição.
- Quebre a ponta da pipeta de vidro usando pinça fina ponta reta. Certifique-se de ponta da pipeta é aberta por que apga pulsos alguns pressão e observando extrusão de gotas de solução de vírus.
- Ir para as coordenadas de injeção desejados e injetar metade do conteúdo da pipeta (~ 0,5 mL) utilizando as seguintes definições no dispositivo de injeção de pressão: pressão de 20 psi, duração média de pulso de 30 ms, o número médio de pulsos 50.
- Deixar no lugar pipeta para ~ 1 min antes de se lentamente (1 mm / min) retirá-los.
- crânio limpa com PBS (pH 7,4) e remover as braçadeiras. Com cuidado, puxe a pele juntos, e suturar a incisão (3 - 4 nós). Aplicar desinfectante (povidona-iodo com base) em torno da ferida.
- Pare a anestesia e não deixar o mouse sem vigilância até que esteja totalmente acordado. Manter os ratos alojados individualmente. No pós-operatório, continuar a monitorizar o estado de saúde; se necessário analgésico administrar.
- Manter os animais durante 4 semanas antes da fixação do cérebro para garantir níveis adequados de expressão viral.
2. Preparação de Amostras
- Fixação cerebral </ Strong>
- Preparação do fixador
- Para 1 litro de fixador, pesar 10 g de paraformaldeído e adicioná-lo para 300 ml de H 2 O. desionizada Aquece-se a 55-60 ° C durante ~ 10 min, com agitação contínua.
- Desligue o fogo e adicione 7 - 8 gotas de NaOH 4 N. A solução deve ficar claro em ~ 10 min.
- Deixe esfriar à temperatura ambiente, adicionar 150 ml de uma solução saturada de ácido pícrico e trazê-lo para 500 ml com H 2 O. deionizada
- Adicionar 500 ml de tampão 0,2 M de fosfato (PB). Filtrar com papel de filtro. Ajustar o pH para 7,4 com NaOH.
- Resfriar o fixador para 6 ºC, armazená-lo em garrafas de vidro escuro por não mais de um dia de 6 ºC.
- intracardíaca perfusão
- Anestesiar ratos com uma injecção intraperitoneal de tiopental (120 mg / kg de peso corporal). Certifique-se de que o animal está profundamente anestesiados, verificando a refl retirada pedalex, que deve estar ausente. Colocar o animal em sua parte traseira em uma mesa de perfusão com as quatro extremidades amarradas para baixo.
- Abra a parede abdominal longitudinalmente com uma tesoura sem corte-end e fazer dois cortes adicionais lateralmente ao longo da borda caudal da caixa torácica, para expor o diafragma. Cortar o diafragma e cortar a parede torácica na fronteira osteocartilageneous em ambos os lados. Levantar a extremidade caudal da laje central da parede torácica contendo o esterno para expor o coração.
- Remover o pericárdio, fazer um pequeno corte preciso na ponta do ventrículo esquerdo para receber a cânula do aparelho de perfusão. Usar uma cânula romba com um diâmetro interno de 0,6 mm. Passar a cânula suavemente através do ventrículo até a ponta aparece na aorta ascendente e fixar a cânula com uma braçadeira. Para permitir que o sangue e perfusatos para sair da corrente sanguínea, fazer um corte no átrio direito.
- ratinhos perfundir transcardialmente utilizando uma bomba peristáltica a um caudalde 5 ml / min, a primeira com PBS (25 mM, NaCl a 0,9%, pH 7,4) durante cerca de 1 min, seguido de fixador de gelo-refrigeradas durante 7 min.
- Após a fixação, cortar a cabeça de rato com um par de tesouras e depois cortar a pele através da linha média do pescoço ao nariz. Remover o músculo para expor completamente o crânio.
- Usando uma tesoura afiada, faça um corte longitudinal através do occipital e ossos interparietais a partir do forame magno. Usando uma pinça fina remover esses ossos para expor todo o cerebelo. Em seguida, faça outro corte longitudinal através do parietal e ossos frontais até o osso nasal e removê-los com uma pinça para expor todo o cérebro.
- Usando uma espátula remover o cérebro sem o danificar, e colocá-lo em gelada M PB 0,1.
- Preparação do fixador
- Corte e recorte dos espécimes
- Corte um bloco coronal de aproximadamente de 5 - 6 mm, com lâminas de barbear contendo a área de interesse. Cole-o para o titular doo vibroslicer com uma cola de cianoacrilato. Orientar o bloco de tecido para que o neocórtex enfrenta a lâmina vibrante. Secções coronais contendo fatia, a amígdala, a 140 uM com o vibroslicer (Figura 1A) em arrefecido em gelo M PB 0,1, e à sua reunião num prato de 6 poços no mesmo tampão.
- Sob um microscópio estereoscópico, remates para fora da região de interesse (aqui, o cluster paracapsular medio-dorsal da ITC, ver Figura 1B) da fatia. Fazei isto em uma placa de Petri revestida com elastômero de silicone e preenchido com 0,1 M PB, utilizando um bisturi oftálmico. Certifique-se de que os blocos aparadas encaixar-se no furo do espaçador (aproximadamente 1,5 mm) (Figura 1B).
- Mova os blocos aparadas em solução crioproteção (30% de glicerol em M PB 0,1) O / N a 6 ºC.
3. Congelamento Alta Pressão
NOTA: O FRIL é composto por 6 passos essenciais (Figura 2): 1) o congelamento rápido com alta pressão (em 2300 - 2600 bar) do espécime. 2) Fractura do espécime. O avião fratura geralmente segue o núcleo hidrofóbico central da membranas congelados, dividindo-os em dois folhetos meia-membrana: um meio que se encontra ao lado do protoplasma (P-face) e meio que se encontra adjacente ao espaço extracelular ou exoplasmic (E- cara). 3) a replicação do espécime por vácuo-deposição de platina e carbono. 4) Detergente-digestão do tecido. 5) imunomarcação. 6) Análise da réplica usando um microscópio eletrônico de transmissão.
- Preparação de suportes de cobre
NOTA: Para ser manipulados através das sucessivas fases do procedimento FRIL, as amostras devem ser montados em suportes de metal (ouro ou cobre). Estas transportadoras variam em tamanho e design de acordo com o modo de fratura e o tipo de máquinas usadas. Aqui usamos suportes de cobre (Figura 1B, E) e uma articulada "table replica double"; (ver Figura 3B), que, quando aberta produz uma fractura de tracção através da amostra congelada (Figura 2). Isto permite reter e replicar ambos os lados da amostra fracturada.- suportes de cobre poloneses com um removedor de manchas usando uma folha de camurça.
- portadores lugar em um pote de vidro e limpo duas vezes com um detergente não-iônico (pH ~ 1,5) em um banho de água ultra-sons, em seguida, extensivamente lavar em água corrente e depois com água deionizada e depois lave duas vezes com etanol.
- Sonicar os suportes de cobre em acetona durante 15 min.
- Coloque as transportadoras em papel de filtro para secar.
- Anexar um anel de fita dupla face a um transportador de cobre (Figura 1C), que servirá como segurando bem para o (transportadora holding) bloco aparada.
- Congelamento do espécime
NOTA: Punho de nitrogênio líquido com cuidado e usando óculos apropriados.- Ligue a alta pressão livrezing unidade (Figura 1F), pelo menos, 1,5 horas antes de começar com o congelamento da amostra.
- Iniciar o aquecimento premindo o botão "aquecedor de ar", e leve ao forno para fora para 50 min. temperatura do ar ajustado para 80 ° C.
- Conecte o tanque de nitrogênio para a unidade de congelamento de alta pressão e pressione o botão "de azoto" para preencher o interior Dewar com nitrogênio líquido. Os "NITROGEN LEVEL" acende-se. Comece arrefecimento, pressionando o botão "resfriamento".
- Pressione o "drive in" botão quando o "nível de nitrogênio" apaga-se. Verifique se o sistema hidráulico move o pistão e para trás 3 vezes.
- Pressione o botão "AUTO" e o botão "de azoto". Assim que "READY" acende-se, a unidade de congelamento de alta pressão está pronto para o congelamento de alta pressão.
- Coloque um bloco aparado no buraco da fita dupla face (Figura 1B) usando um loop fio de platina que foi derretido em agpipeta moça.
- Remover o excesso da solução de agente crioprotector utilizando papel de filtro ou uma escova.
NOTA: Este procedimento também é importante para remover bolhas de ar que podem formar em torno do tecido e o que poderia causar a distorção da forma de tecidos e / ou ultra-estrutura. - Sob um microscópio estereoscópico, cobrir a transportadora exploração com outra transportadora, de modo que o bloco de tecido é imprensada entre as duas transportadoras.
- Insira o carrier-sanduíche para o suporte de amostras da unidade de alta pressão congelamento (Figura 1D). Insira o suporte de amostras para a unidade de alta pressão congelamento (ponta para baixo) e fixá-lo por aparafusar o suporte da amostra.
- Iniciar o ciclo de congelação, premindo o botão de "Jet-auto". Trabalhando tão rapidamente quanto possível, remova o suporte da amostra e submergir a ponta com nitrogênio líquido em uma caixa isolada. Mergulhar as pontas dos dois pares de pinças em azoto líquido para arrefecer-los.
- Remova cuidadosamente the carrier-sanduíche do suporte da amostra e colocá-lo em um cryovial pré-refrigerados. Certifique-se de que as operadoras só são manipulados com pinças arrefecido a azoto líquido. Criotubos deve ser perfurada para permitir que o nitrogénio a fluir para fora do frasco (Figura 1G).
- Repita os passos 3.2.6 a 3.2.11 até que todas as amostras desejadas foram congelados. Várias transportadoras-sanduíches contendo o mesmo tipo de amostra pode ser armazenado no mesmo frasco.
- Armazenar os criotubos contendo os portadores em um cryotank até que a replicação (Figura 1H).

Figura 1. Preparação de tecidos e congelamento de alta pressão. (A) Vibroslicer usado para a secção do tecido. (B) uma secção coronal do cérebro de rato resultante que contém o lado amígdala mostrado a lado com ACtransportadora Opper equipado com um anel de fita dupla face. A caixa tracejada indica a área de interesse que contém o cluster paracapsular medial do ITC. O diâmetro do furo na fita de dupla face é aproximadamente 1,5 mm. (C) Ferramentas para preparação de suportes de cobre. Do canto superior esquerdo no sentido horário: fita dupla face, pinças, perfurador, transportadoras de cobre, e tesoura. (D) Inserção da portadora de sanduíche para titular a amostra por congelamento de alta pressão. A portadora de sanduíche é colocado no furo de suporte da amostra. (E) As transportadoras de cobre sem e com um anel de fita dupla face e "carrier-sanduíche". (F) da unidade de congelação de alta pressão com o tanque de alimentação de azoto líquido pressurizado a ele. (G) A cryovial para estocar os tecidos congelados. Nota os orifícios na posição média superior do frasco permitindo que o gás nitrogénio a fluir para fora do frasco (ponta de seta). (H) Cryotank para armazenar o tecido congelado. Por favor clique aqui para ver uma versão maior desta figura.
4. Freeze-fratura e Replication
- Preparação das armas de feixe de elétrons
- Antes de inserir as armas de feixes electrónicos, remova o escudo com o "prato deflector". Coloque o "medidor de configuração" para centrar o filamento para a pinça através da tampa do cátodo inferior.
NOTA: A extremidade de maior diâmetro do indicador de ajuste é usado para a arma de carbono enquanto que a extremidade de menor diâmetro é a arma de platina. - Deslize o novo filamento através do medidor até "a pressão lâminas" pode prender as extremidades do filamento, assegurando que a bobina de filamento não se encontra em um ângulo.
- Remover o indicador de configuração e inserir a vara de carbono. Corrigi-lo apertando o collet mandril de suporte da haste do evaporador, garantindo que a altura da extremidade da haste está no meio da segunda bobina a partir do fundo. Para a arma de platina, a altura da extremidade da haste de platina deve estar no meio da segunda bobina de filamento a partir do topo.
- Substitua a placa de deflector e introduzir armas na unidade de congelamento fratura. Limpe as armas com uma areia-Blaster após o uso.
- Antes de inserir as armas de feixes electrónicos, remova o escudo com o "prato deflector". Coloque o "medidor de configuração" para centrar o filamento para a pinça através da tampa do cátodo inferior.

Figura 2. Ilustração das etapas fundamentais da Técnica FRIL.
Esboço dos diferentes passos necessários para a preparação e análise de réplica. (1) o congelamento alta pressão do tecido. (2) A fratura. Durante a fracturação de tecido congelado, a bicamada lipídica das membranas plasmáticas é dividida em duas metades na interface hidrofóbica. As proteínas presentes na membrana plasmática são alocados para tanto o exoplasmic (E-cara) ou protomembranas plasmáticas (P-face). (3) Replication. A evaporação do carbono (C) intercepta lípidos e proteínas na superfície do tecido fracturado. O material é revestido com 2 nm de platina / carbono para sombreamento a um ângulo de 60 °, e, em seguida, com outra camada de carbono de 15 nm, o que reforça a estrutura da réplica (C-camada, Pt-sombreamento). (4) A solubilização. O tecido não preso pela membrana de réplica é, em seguida, solubilizado com SDS-solução. (5) Etiquetagem. As proteínas de interesse podem ser visualizados em réplica usando um complexo formado de anticorpos específicos primários (primário Ab) e anticorpos secundários (Ab secundário) conjugado com uma partícula de ouro (Au). A utilização de diferentes tamanhos de partículas de ouro permite a detecção de mais do que uma proteína sobre a mesma réplica. (6) Depois de imunomarcação, as réplicas são coletados em redes de malha de cobre e analisadas com um microscópio eletrônico de transmissão a 80 -. 100 kV Por favor click aqui para ver uma versão maior desta figura.
- Criação de unidade de fractura de congelação
- Ligue a unidade de congelamento fratura (Figura 3A), rodando REDE para 1. Para uma descrição detalhada dos procedimentos de fractura por congelação e de replicação, consulte instruções fornecidas pelo fabricante.
- Antes de arrefecimento do dispositivo de congelação-fractura, cozer a todo o sistema de refrigeração da unidade com ar quente. Pressione o botão "descongelamento", no 010 dispositivo MTC (unidade de controle de temperatura) (Figura 3A) e permitir que o processo de execução de bolos para fora para 45 min.
- Ative a estação de vácuo. A unidade de fractura de congelação geralmente funciona numa gama de vácuo de 10 ~ -6 - 10 -7 mbar.
- Encha o tanque de nitrogênio e conecte-o à unidade de congelamento fratura. Verificar que o suporte da válvula é seco e também limpar a entrada do tanque antes da inserção do suporte de válvula (humidade pode interferir com vacuum e indicação de N 2 de enchimento do reservatório).
- Inicie o arrefecimento ajustando a temperatura de -115 ° C. Resfriamento leva cerca de 45 min.
- Coloque as armas de feixe de elétrons e ajuste de corrente e tensão para alcançar os seguintes parâmetros para a evaporação:
arma de carbono: rotação sobre, posição de 90 °, a taxa de acúmulo de carbono 0,1-0,2 nm / seg
gun carbono-platina: rotação de fora, a posição 60 °, a taxa de acumulação de 0,06-0,1 nm / seg
NOTA: Se uma arma é usado pela primeira vez após troca da haste de carbono ou de platina, desgaseificar durante 3 min antes da utilização.
- Fraturamento e replicação
- Insira transportadora-sanduíches congelados na tabela réplica dupla certificando-se de todas as manipulações são feitas em nitrogênio líquido.
- Transferir tabela réplica dupla a um vaso Dewar e corrigi-lo para o receptor estágio da amostra em um ângulo de 45 °. O nível de nitrogênio líquido deve estar sempre acima da tabela réplica dupla.
- Pegar a tabela réplica duplo com o manipulador de mesa e inseri-lo na unidade de congelamento fratura no palco frio. Espera aproximadamente 20 min para permitir que a temperatura da mesa de réplica dupla para ajustar a -115 ° C.
- Verificar que o vácuo é inferior a 10 -6 mbar e a temperatura é de -115 ° C.
- Fraturar o tecido pela rotação anti-horária manual da roda ligado à mortalha colocados acima da tabela réplica dupla. Quando a mortalha gira, ele força a tabela réplica dupla para abrir, fraturando o tecido.
- Pressione o botão "Alta Tensão" no (unidade eletrônica de controle do feixe de evaporação) 030 dispositivo EVM da unidade de congelamento fratura (Figura 3A).
- Replicar as superfícies expostas do tecido fracturado (Figura 3C) por evaporação de carbono (de rotação) por meio de um canhão de feixe de electrões posicionada num ângulo de 90 ° até uma espessura de 5 nm, seguido de um shado unidireccionalasa com platina-carbono num ângulo de 60 ° até uma espessura de 2 nm. Finalmente, aplique uma camada espessa de 15 nm de carbono a partir de um ângulo de 90 ° (rotação).
- Utilize os seguintes parâmetros para a evaporação:
1º de carbono: rotação sobre, posição de 90 °; velocidade de 0,1-0,2 nm / seg; 5 nm
2º carbono-platina: posição de 60 °; velocidade 0,06-0,1 nm / seg; 2 nm
3ª carbono: rotação sobre, posição de 90 °; velocidade ,3-,5 nm / seg; 15 nm - Retirar as amostras replicadas a partir da unidade de fractura de congelação e transferi-los para uma placa de 12 poços de cerâmica (Figura 4A) encheu-se com TBS (solução salina tamponada com Tris, pH 7,4).
- Usando uma vareta de fio de ansa de platina, remover o tecido reproduzido a partir do suporte de amostra (Figura 4A).
- Repita os passos 4.3.1 a 4.3.10 até que todas as amostras foram replicadas.
 r /> Figura 3. Freeze-fraturamento e replicação.
r /> Figura 3. Freeze-fraturamento e replicação.
(A) A unidade de fractura de congelação. A máquina contém várias unidades de controlo e um monitor. As amostras são introduzidos na câmara através de uma porta do lado esquerdo da câmara. Um contentor de azoto líquido sob pressão é ligado à unidade de fractura de congelação-se arrefecer a fase. Imagens abaixo mostram vistas ampliadas de duas das unidades de UPC (010 e 010) de MDC e o monitor que exibe parâmetros durante a evaporação da segunda camada de carbono. (B) aberto (à esquerda) e fechados (direita) vistas da tabela réplica dupla. Os "transportadores"-sanduíches são inseridos nas ranhuras da mesa (indicado pelas setas). Os armas pequenas prevenir "carrier-sanduíches" de cair durante a manipulação. (C) Uma amostra fracturada e replicada. Réplicas aparecem filmes em preto finas na parte superior do tecido fraturada.53 / 53853fig3large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
- SDS-digestão da réplica
- Transferência de réplicas para um frasco de vidro de 4 ml cheia com 1 ml de tampão de SDS-digestão (2,5% Lauril sulfato de sódio, 20% de sacarose em Tris 15 mM, pH 8,3). Digest durante 18 h a 80 ° C com agitação (45 curso / min).
- Transferência de réplicas para um novo tubo cheio com tampão de SDS-digestão e armazenar a RT.
5. imunomarcação
NOTA: Todas as incubações são realizadas à temperatura ambiente com agitação suave, excepto para as incubações com anticorpos.
- Lava-se a réplica durante 10 min em tampão de SDS-digestão fresco.
- Lava-se a réplica de uma vez com 2,5% de BSA (albumina de soro de bovino) em TBS durante 5 minutos, e em seguida 3 x 10 min, com 0,1% de BSA em TBS.
- Bloquear os locais de ligação não específicos em TBS com 5% de BSA durante 1 hora.
- Aplicar anti primáriacorpos diluído em 2% de BSA-TBS. Realizar as incubações em uma gota 30 mL (Figura 4B) numa câmara húmida a 15 ° C durante 72 horas (Figura 4C).
- Para este estudo, ambas as réplicas processo a partir do tecido fracturado. Incubar uma réplica com um anticorpo policlonal de porquinho da índia criados contra os aminoácidos 717 - 754 do rato GluR1 comum para todas as subunidades de AMPA-R (diluição: 1: 200) ou um anticorpo monoclonal de murganho produzidos contra uma proteína de fusão recombinante que abrangem os aminoácidos 660 - 811 da subunidade NR1 do NMDA-R (diluição: 1: 500), e um anticorpo policlonal de coelho criado contra a proteína fluorescente verde (diluição: 1: 300).
- Incubar a outra réplica com um anticorpo policlonal de coelho criado contra um péptido sintético correspondente aos aminoácidos 384 - 398 do receptor μ-opióide de rato (diluição: 1: 500).
- Lavar com TBS com 0,05% de BSA (3 x 5 min.).
- Aplicar anticorpos secundários. Para este estudo use o ouro (5 nm para ionotrópicos receptores de glutamato, os receptores 10 para μ-opióides e / ou 15 nm para ChR2-YFP) anticorpos conjugados diluídos em TBS com 2% de BSA. Diluir 1:30 anticorpos secundários e incubar numa queda de 30 uL a 15 ° CO / N.
- Lavar 3 x 5 min em 0,05% de BSA-TBS à temperatura ambiente.
- Lave 2 x 5 min em água ultrapura.
- Réplica Mount em 100 linhas da grelha barra paralela formvar-revestido (Figura 4D).
6. Análise Replica
- réplicas de imagens com um microscópio eletrônico de transmissão (TEM) a 80 ou 100 kV. Aquisição de imagens digitais através de um (cobrado coupled device) câmera CCD.
- Off-line, encontrar regiões correspondentes em imagens de ambas as réplicas usando marcos (Figura 4E). Analisar imagens digitais usando a imagem J. Determine área de pós-sináptico eo número de partículas marcado com imunomarcação dirigidos contra o receptor analisados.

Figura 4. imunomarcação de réplica.
Ferramentas de (A) para a manipulação e lavando as réplicas. Uma placa de 12 poços de cerâmica (parte superior direita) e 2 tipos de pipetas de vidro (parte superior esquerda). A pipeta de vidro com ponta redonda (canto inferior esquerdo) é usado para transferir réplica, e a pipeta com haste de platina (centro inferior) é usado para desdobrar réplicas. Uma réplica em tampão de lavagem (canto inferior direito). (B) de imunomarcação de réplicas é levada a cabo em gotas (30 ul) colocados sobre um pequeno pedaço de parafilme em um poço de uma cultura de tecido de placa de 6 poços. Note-se que uma réplica é coberto por uma gota de tampão contendo anticorpos. Para evitar a evaporação, um pedaço húmido de papel de seda é colocado em volta da borda interna do poço. (C) Incubadora para a etapa de imunomarcação. As incubações são realizadas a 15 ° C. (D) Uma réplica montado sobre um 100- revestido-Formvarlinha de grade barra paralela. (E) micrografias baixa ampliação a partir de um par de réplicas. As praças pontilhadas indicam três marcos típicos para identificar um local nas réplicas correspondentes. Barra de escala: 10 ^ m. Todos os dados são apresentados como ± médios sem Por favor clique aqui para ver uma versão maior desta figura.
Resultados
A técnica FRIL, quando combinado com a expressão de actuadores optogenetic de origem microbiana 21, isto é, canais integrados na membrana do plasma e eficazmente transportadas anterogradamente ao longo dos axónios, permite analisar quantitativamente a expressão pós-sináptico de AMPA-R e NMDA-R em um subgrupo definido de sinapses. Isso é mostrado aqui para axônios provenientes de núcleos do tálamo distintas (por exemplo, PIN / MGN) em neurônios ITC na amígdala. Esta abordagem permite uma análise molecular das sinapses de entrada sensoriais individuais em neurônios ITC, um grupo de células que tenham sido refratários a uma caracterização anatômica e molecular detalhada até agora.
Quatro semanas após a injeção estereotáxica do rAAV-ChR2-YFP para o PIN / MGN, os axônios ChR2-YFP positivas densamente inervados do LA, área de transição amygdalostriatal (Astria) eo paracapsular medial I Aglomerado TC na amígdala, um padrão totalmente coerente com o rastreamento de estudos anteriores 16, 22. Nós também detectou ouro intensa imunomarcação para o ChR2-YFP na P-face de axônios e terminais em réplica de fractura por congelação de rAAV-ChR2-YFP- ratinhos injectados (Figura 5A), mas não em réplicas a partir de ratinhos não injectados. A especialização da membrana pós-sináptica das sinapses glutamatérgicas na uma réplica pode ser observado como um aglomerado de partículas intramembranar (PIM) na E-face da membrana de plasma 2, 23, e é muitas vezes acompanhada pela P-face da sua membrana plasmática pré-sináptica 7 (Figura 5B-C). Esses recursos permitiram identificar a especialização pós-sináptico das sinapses glutamatérgicas formadas por terminais do axônio PIN / MGN (Figura 5 e 6). Nós marcado AMPA-R com um anticorpo que reconhece todas as quatro subunidades (GluA1-4), enquanto NMDA-R foram detectadas utilizando um anticorpo contra a subunidade NR1 essencial.
ntent "fo: manter-together.within-page =" 1 "> Por causa da falta de ferramentas para detectar na mesma réplica se essas sinapses foram feitas com espinhas dendríticas ou veios de neurônios ITC, que classificou o rosto réplica correspondente para μ -opiáceos, como os neurónios pós-sinapticamente ITC expressam altos níveis desses receptores 24. Isto exigiu a identificação dos mesmos perfis de pós-sinápticos nas duas réplicas (Figura 5C-F e Figura 6A-D), usando uma estratégia que utiliza pontos de referência (Figura 4E) .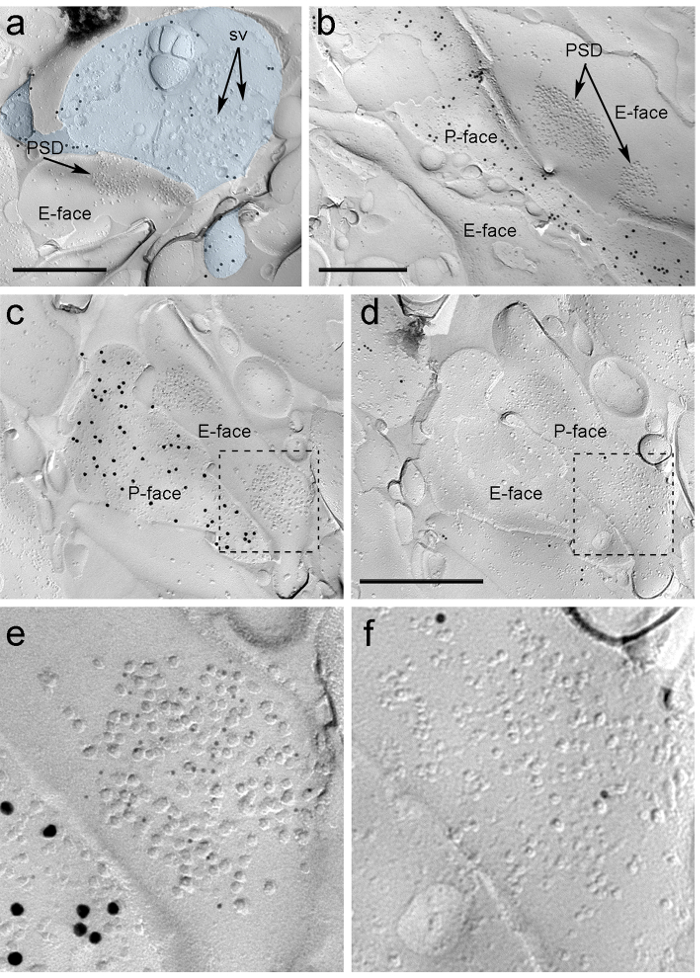
Figura 5. Detecção de ChR2-YFP e glutamato ionotrópicos receptores na réplica por imuno partículas. (A) Um terminal axonal transversal fracturado (azul-claro) e pequenas porções de P sua face marcado com partículas de ouro de 15 nm de detecção ChR2-YFP. Dentro do terminal, a membrana óf numerosas vesículas sinápticas pode ser observado (SV). Note-se a especificidade da imunomarcação em grande parte restrita para a membrana plasmática. Rotulagem para ChR2 identifica o terminal como originários do PIN / MGN. O terminal forma uma sinapse assimétrica com uma espinha. A especialização membrana pós-sináptica (PSD) no E-face mostra um conjunto característico de partículas intramembranar e é marcado com partículas de 5 nm de ouro revelando AMPA-Rs. (B) O P-face de um axónio ChR2-expressando (marcado com partículas de ouro de 15 nm) é mostrado na fronteira com dois dendritos, uma delas possuindo duas PSDs marcados com partículas de 5 nm de ouro revelando NMDA-R. (CD) faces opostas das membranas pré e pós-sinápticos de uma sinapse PIN / MGN-ITC. (C) O P-face do terminal expressa ChR2 (marcado com partículas de ouro de 15 nm) e estende-se sobre o E-face de dois veios dendríticas, um deles contendo dois PSDs rotulados para AMPA-R (5 partículas nm de ouro). ( D) O correspondente P-face das duas dendrites é rotulada para receptores μ de opiáceos (10 nm de partículas de ouro). (EF) vistas ampliadas das áreas delineadas pelas linhas tracejadas. Barras de escala:. 500 nm Por favor clique aqui para ver uma versão maior desta figura.
Imunopartulas para AMPA-Rs nas sinapses PIN / MGN-ITC foram encontrados em todo o cluster IMP, sugerindo uma distribuição homogênea dentro da especialização pós-sináptica (Figura 5E). Um significativamente maior (teste t não emparelhado p <0,018), foi observado densidade de marcação AMPA-R em PIN / MGN sinapses sobre as espinhas ITC (715 ± 38 partículas de ouro / uM 2, n = 32) comparado com sinapses Onto dendritos ITC (590 ± 44 partículas de ouro / uM 2, n = 32). Em geral, a densidade de AMPA-R no pino sinapses / MGN-ITC demonstrou uma relativamente baixavariância (coeficiente de variação, CV = 0,37) de acordo com uma distribuição homogénea.
Imunopartulas para NMDA-R nas sinapses PIN / MGN-ITC foram frequentemente observados desigualmente distribuídos nos pólos de IMP pós-sinápticos (Figura 5B). A densidade de rotulagem NMDA-R foi semelhante (teste t não pareado p = 0,39) entre PIN / MGN sinapses em espinhas ITC (1070 ± 153 partículas de ouro / ^ m 2, n = 8) e dendritos ITC (812 ± 183 partículas de ouro / 2 uM, n = 9). Ao contrário do que foi observado para AMPA-Rs, a densidade de NMDA-R no pino sinapses / MGN-ITC foi altamente variável (CV = 0,54).
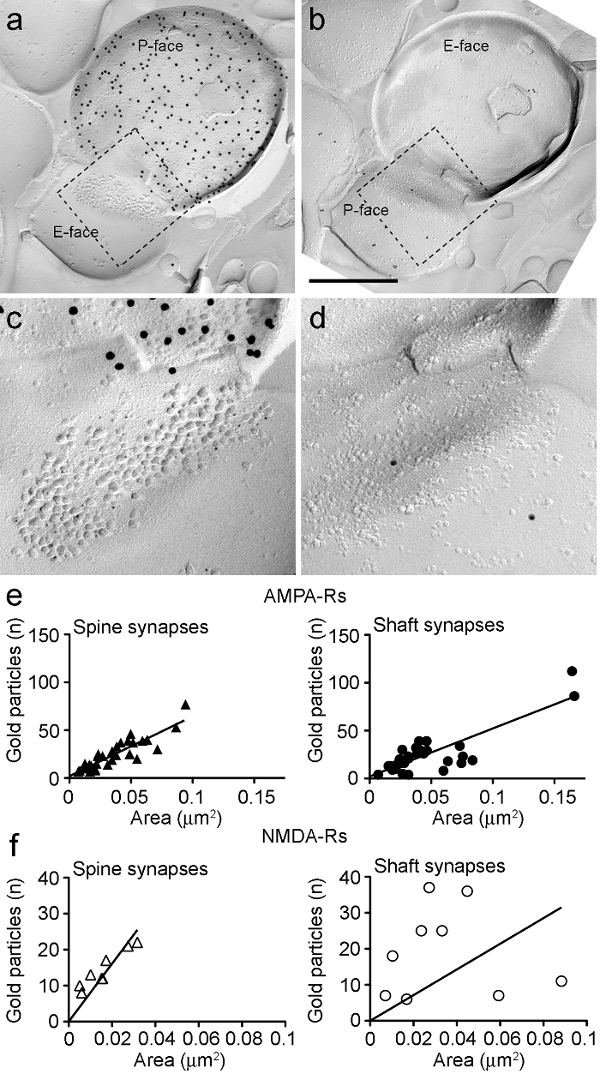
Figura 6. AMPA-Rs e NMDA-Rs imunomarcação em Identificados sinapses PIN / MGN-ITC.
(AB) faces opostas das membranas pré e pós-sinápticos de um pino / MGN-ITCsinapse feita em uma espinha dendrítica em que o P-face do terminal expressa ChR2 (rotulado com 15 partículas de ouro nm) e do PSD para uma espinha dendrítica é rotulado de AMPA-Rs (5 partículas nm de ouro). (CD) vistas ampliadas das áreas descritas pela linha tracejada. Estas áreas foram rodados cerca de 45 ° esquerda para permitir uma melhor visualização do PSD. (E) Scatterplots do número de partículas de AMPA-R em comparação com a área de sináptica nas espinhas e dendritos ITC. Em ambas as estruturas, uma correlação positiva foi observada. (F) Scatterplots do número de partículas de NMDA-R contra a área sináptica nas espinhas e dendritos ITC. Uma correlação positiva significativa foi detectada apenas em espinhas dendríticas. Barras de escala:. 500 nm Por favor clique aqui para ver uma versão maior desta figura.
Porqueo P-face da membrana plasmática pré-sináptica muitas vezes sobrepostos em parte do cluster IMP pós-sináptica, que se poderia calcular a área sináptica de apenas 30% das sinapses (espinhas: área média de 0,032 ^ M 2, gama: 0,007-0,063? M 2, n = 8; dendritos: 0,047? M 2, gama: 0,024 a 0,166 uM 2, n = 11). Estes foram em uma escala similar como anteriormente analisados glutamatérgica telencefálico sinapses 25.
Em ambas as espinhas e dendritos, o número de imunopartulas de ouro para AMPA-R em sinapses individuais foi positivamente correlacionada com a área sináptica (Spearman, espinhas: r = 0,88, dendritos: r = 0,60, p <0,0001) (Figura 6E). Por outro lado, o número de imunopartulas ouro para NMDA-R foi encontrada uma correlação com a área sináptica nas espinhas (Spearman, espinhas: r = 0,90, p <0,002), mas não em dendritos (r = 0,21, p = 0,29) (Figura 6F ).
Discussão
microscopia eletrônica de fractura por congelação tem sido uma técnica importante na investigação ultra-estrutural há mais de 40 anos. No entanto, a falta de meios eficazes para estudar a composição molecular de membranas produzido um declínio significativo na sua utilização. Recentemente, tem havido um grande avivamento em microscopia electrónica de congelação-fractura, devido ao desenvolvimento de meios eficazes para revelar proteínas de membrana integrais por imunomarcação 1, 2, ou seja, a técnica de FRIL.
A técnica FRIL possui várias vantagens sobre outros métodos de ultra-estruturais imunomarcação. Em primeiro lugar, as proteínas são facilmente acessíveis aos anticorpos que aumentam a sensibilidade. Em segundo lugar, a exposição de grande porção de especializações da membrana plasmática, tal como a membrana pós-sináptica, sobre a superfície bidimensional da réplica permite a inspecção da distribuição espacial e de contiguidade física de moléculas de interesse sem reconstrução laborioso e demorado de seriseções al ultrafinos. Em terceiro lugar, a disponibilidade de ambas as metades da membrana plasmática aumenta o número de proteínas que podem ser marcados para cada estrutura individual, anticorpos adequados fornecidos estão disponíveis. Após a fractura, a face hidrofóbica da membrana de separação é revestida com carbono-platina que entrenches domínios de proteína restantes na superfície fracturada. Isso impede o acesso dos anticorpos aos antigénios nestes domínios. Por exemplo no P-face de uma réplica apenas epitopos de frente para o espaço protoplásmica pode ser detectada por anticorpos, ao passo que na E-cara somente epítopos de frente para o espaço exoplasmic pode ser ligado por anticorpos (ver Figura 2).
Por outro lado, a técnica FRIL também sofre de algumas limitações 2. Como as fraturas ocorrem aleatoriamente, pode ser difícil de atingir as células ou estruturas específicas. Isto pode também conduzir a um desequilíbrio da amostragem, por exemplo, na recolha de sinapse, tendo em conta a probabilidade de diferentes fracturing ao longo da membrana de estruturas com curvatura diferente (por exemplo, espinhas contra eixos). Além disso, a atribuição de proteínas de membrana a uma das duas faces é imprevisível. Por conseguinte, a distribuição de uma proteína com a P-face ou E-face, em particular para estudos quantitativos, devem ser cuidadosamente examinadas utilizando anticorpos reactivos com os domínios intracelulares e extracelulares. Finalmente, a identificação na réplica de certas estruturas, tais como terminais de axónios pré-sinápticos, pode ser difícil quando baseado apenas nas características morfológicas. No entanto, a utilização de anticorpos específicos para proteínas marcadoras ou a transdução de proteínas de membrana integrais etiquetadas ou canais que utilizam vectores virais oferece ferramentas adicionais para facilitar a identificação das membranas fracturados. Por exemplo, este estudo aproveitou a transdução de ChR2-YFP nos neurônios do tálamo para identificar seus eferentes axonal na amígdala ou a rotulagem para os receptores μ-opióides para revelar me pós-sinápticambranes de neurônios ITC.
A fim de executar a técnica FRIL com sucesso, um cuidado especial deve ser tomado a respeito fixação do tecido. fixação do tecido forte (> 2% paraformaldeído) pode resultar numa elevada taxa de fracturas transversais e uma diminuição na sensibilidade rotulagem. Por outro lado, as fixações fracos tornar o manuseamento e preparação do tecido (por exemplo, o corte de secções) difícil. Também é importante para controlar a espessura dos blocos aparadas corresponde à espessura da fita de dupla face. Se a espessura da amostra é menor do que a da fita, as superfícies do tecido não pode anexar à superfície dos dois transportadores de metal, consequentemente, a amostra congelada não se fracturou. Se o tecido é mais espesso, ele vai ser comprimido com distorções estruturais inevitáveis quando a sanduíche dos dois suportes de cobre é feito. A temperatura à qual a amostra é fraturado (neste protocolo, -115 ° C) desempenha também um papel importantena estrutura da réplica. Temperaturas mais elevadas podem produzir um aumento da taxa de artefactos, tais como a condensação de vapor de água na superfície do tecido antes ou durante a evaporação. Temperaturas mais baixas (<-125 ° C), podem aumentar o risco de cisão de material durante a fracturação. Este material pode cair sobre a superfície do espécime ou ficar ligado a ela. Estes flocos de material também são revestidos e contrastados produzindo manchas escuras na imagem. Fraturando a temperaturas mais baixas também pode afetar a frequência de cruzamento de fraturas especialmente para as pequenas estruturas finas como espinhas dendríticas. Um outro passo crucial na preparação das réplicas é a detergente-digestão. Se a digestão é incompleta, o tecido não digerido aparece como manchas escuras na réplica, confundindo a análise da estrutura ao MET. Além disso, o tecido não digerido pode anticorpos armadilha ou ligar não especificamente, aumentando a rotulagem de fundo. Por outro lado, o uso de detergentes para a digestão de tecido pode desnaturar as moléculas associadas à réplica de alterar as suas estruturas secundária e terciária. Portanto, para certos antigénios, pode ser necessário diluir gradualmente a concentração de SDS com passos de lavagem adicionais.
Para imunomarcação, a disponibilidade de diferentes tamanhos de partículas de ouro conjugadas com anticorpos secundários permite detectar, ao mesmo tempo, mas apenas qualitativamente, proteínas múltiplas, mesmo em microdomínios específicos da membrana do plasma, tais como a especialização pós-sináptica. No entanto, devido a impedimento estereoquímico, estudos quantitativos são geralmente limitados para a detecção de apenas uma molécula. O tamanho da partícula de ouro, também pode afectar a eficácia de rotulagem.
Para a interpretação da rotulagem em FRIL, deve-se ter em mente que a partícula imuno pode ser localizado em qualquer lugar dentro de um hemisfério com um raio de 20-25 nm do antigénio devido à forma complexa flexíveled pelo anticorpo primário e secundário 26. Para mais informações sobre a teoria e prática da FRIL e técnicas relacionadas, nós nos referimos o leitor também a outros artigos metodológicos 27, 28.
A técnica FRIL foi recentemente usada para a alta resolução de análises quantitativas de localização do receptor de glutamato em diversas populações sinapse 29, 30. Além disso, a sensibilidade de detecção da técnica FRIL para AMPA-R foi estimada tão elevada como uma partícula imuno por uma AMPA funcional canal -R 29. Assim, esta abordagem é em geral muito útil para quantificar e analisar o padrão de expressão pós-sináptico de AMPA e NMDA-Rs-Rs em sinapses centrais. Aqui, nós demonstramos a sua aplicabilidade nas sinapses PIN / MGN-ITC, um local mais provável importante para veicular a US informações durante o condicionamento do medo. Usando um anticorpo produzido contra os resíduos de aminoácidos extracelulares altamente conservadas das subunidades do receptor de AMPA GluA1-GluA4, encontramos uma distribuição uniforme de partículas de ouro nos pólos de IMP correspondentes a especializações membrana pós-sináptica. A densidade de AMPA-Rs em espinhas ITC foi significativamente maior em comparação com sinapses eixo alvo de PIN / MGN aferentes tálamo. Em ambas as coluna e eixo sinapses, foi detectada uma correlação positiva entre a rotulagem de AMPA-Rs e área de pós-sináptico, uma característica comum a outras sinapses glutamatérgicas 25. A baixa variação na densidade de AMPA-Rs no sinapses PIN / MGN-ITC indica uma distribuição homogênea semelhante a outras sinapses formadas por eferentes tálamo 7, mas diferente de sinapses corticais 25. Por outro lado, a densidade de NMDA-R foi mais variável e não diferiu entre coluna e eixo sinapses sugerindo uma regulação diferente do que AMPA-Rs. No futuro, a elevada reprodutibilidade da técnica FRIL não só irá permitir a avaliação da composição molecular basal de sinapses centrais, mas pode facilitar a detecção de cHanges em número de receptores ionotrópicos de glutamato e distribuição subsináptica Depois de aprender o medo, complementando ex-vivo gravações de propriedades de pré e pós-sinápticos desses insumos.
Em conclusão, esta abordagem poderia ser utilizado por outros investigadores para obter insights sobre relações estrutura-função de sinapses excitatórias específicos de entrada em muitos outros circuitos neurais em que desembaraçar a origem das entradas e da natureza e composição de elementos pós-sinápticos é fundamental, mas problemático .
Divulgações
The authors declare that they have no competing financial interests.
Agradecimentos
Funding was provided by the Austrian Science Fund FWF grant No. P-22969-B11 to F. Ferraguti, and by the Charitable Hertie Foundation and the Werner Reichardt Centre for Integrative Neuroscience and by the DFG (CIN-Exc. 307) to I. Ehrlich.
Materiais
| Name | Company | Catalog Number | Comments |
| Surgery | |||
| Stereotactic frame | Stoelting, USA | 51670 | can be replaced by other stereotactic frame for mice |
| Stereotactic frame mouse adaptor | Stoelting, USA | 51625 | |
| Gas anesthesia mask for mice | Stoelting, USA | 50264 | no longer available, replaced by item no. 51609M |
| Pressure injection device, Toohey Spritzer | Toohey Company, USA | T25-2-900 | other pressure injection devices (e.g. Picospritzer) can be used |
| Kwik Fill glass capillaries | World Precision Instruments, Germany | 1B150F-4 | |
| Anesthesia machine, IsoFlo | Eickemeyer, Germany | 213261 | |
| DC Temperature Controler and heating pad | FHC, USA | 40-90-8D | |
| Horizontal Micropipette Puller Model P-1000 | Sutter Instruments, USA | P-1000 | |
| Surgical tool sterilizer, Sterilizator 75 | Melag, Germany | 08754200 | |
| rAAV-hSyn-ChR2(H134R)-eYFP (serotype 2/9) | Penn Vector Core, USA | AV-9-26973P | |
| fast green | Roth, Germany | 0301.1 | |
| Isoflurane Anesthetic, Isofuran CP (1 ml/ml) | CP Pharma, Germany | ||
| Antiseptic, Betadine (providone-iodine) | Purdure Products, USA | BSOL32 | can be replaced by other disinfectants |
| Analgesic, Metacam Solution (5 mg/ml meloxicam) | Boehringer Ingelheim, Germany | can be replaced by other analgesics | |
| Bepanthen eye ointment | Bayer, Germany | 0191 | can be replaced by other eye ointments |
| Drill NM3000 (SNKG1341 and SNIH1681) | Nouvag, Switzerland | ||
| Sutranox Suture Needle | Fine Science Tools, Germany | 12050-01 | |
| Braided Silk Suture | Fine Science Tools, Germany | 18020-60 | |
| Name | Company | Catalog Number | Comments |
| Tissue preparation | |||
| Paraformaldehyde EM grade | Agar Scientific Ltd., United Kingdom | AGR1018 | |
| Saturated picric acid solution | Sigma-Aldrich, USA | P6744-1GA | |
| Na2HPO4-2H20 | Merck Millipore, Germany | 1065860500 | |
| NaH2PO4-2H2O | Merck Millipore, Germany | 1063451000 | |
| NaCl | Merck Millipore, Germany | 1064041000 | |
| 4N NaOH | Carl Roth, Germany | T198.1 | |
| Thiopental | Sandoz, Austria | 5,133 | |
| Glycerol | Sigma-Aldrich, USA | G5516-500ML | |
| GenPure ultrapure water system | Thermo Fisher Scientific, USA | 50131235 | |
| Peristaltic pump | ISMATEC, Germany | ISM 930C | |
| Filter Paper | MACHEREY-NAGEL, Germany | MN 615 1/4 | |
| Vibroslicer, VT1000S | Leica Microsystems, Austria | ||
| Ophthalmic scalpel | Alcon Laboratories, USA | can be replaced by other ophthalmic scalpels | |
| Perfusion cannula | Vieweg, Germany | F560088-1 | can be replaced by similar items from other companies |
| Name | Company | Catalog Number | Comments |
| High-pressure Freezing | |||
| Copper carriers | Engineering Office M. Wohlwend, CH | 528 | |
| Sidol Polish | Henkel, Germany | can be replaced by same item from other companies | |
| Chamois skin | Household supply store | ||
| Hole punch, 1,5mm | Stubai, Austria | can be replaced by same item from other companies | |
| Denatured ethanol | Donauchem, Austria | can be replaced by same item from other companies | |
| Acetone | Roth, Germany | 9372.5 | CAUTION! |
| High Pressure Freezing Machine HPM 010 | BalTec, CH; now Leica Microsystems | HPM010 | not produced any more, substituted by LeicaEM HPM100 |
| Stereo-microscope | Olympus, Japan | SZX10 | |
| Liquid nitrogen | CAUTION! | ||
| Cryo-vials | Roth, Germany | E309.1 | can be replaced by same item from other companies |
| CryoCane | Nalge Nunc International,USA | 5015-0001 | can be replaced by same item from other companies |
| CryoSleeve | Nalge Nunc International,USA | 5016-0001 | can be replaced by same item from other companies |
| Liquid nitrogen storage vessel | Cryopal, France | GT38 | can be replaced by same item from other companies |
| Non-ionic detergent (Lavocid) | Werner & Mertz Professional, Germany | ||
| Name | Company | Catalog Number | Comments |
| Freeze-fracture and Replication | |||
| Sandblaster, Mikromat 200-1 | JOKE Joisten & Kettenbaum, Germany | SANDURET 2-K | can be replaced by same item from other companies |
| Siliciumcarbid SIC 360, grain size 25 - 21µ | JOKE Joisten & Kettenbaum, Germany | 955932 | |
| Freeze Fracture System BAF 060 | BalTec, CH; now Leica Microsystems | BAF060 | |
| Ceramic 12 well plate | Gröpel, Austria | 14511 | can be replaced by same item from other companies |
| Trizma base | SIGMA, USA | T1503 | can be replaced by same item from other companies |
| Trizma hydrochloride | SIGMA, USA | T3253 | can be replaced by same item from other companies |
| Sodium chloride | Merck, Germany | 1,064,041,000 | can be replaced by same item from other companies |
| SDS, Sodium lauryl sulfate | Roth, Germany | 5136.1 | CAUTION! ; can be replaced by same item from other companies |
| Sucrose | Merck, Germany | 1,076,871,000 | can be replaced by same item from other companies |
| TRIS | Roth, Germany | 5429.3 | can be replaced by same item from other companies |
| Universal Hybridization Oven | Binder, Germany | 7001-0050 | can be replaced by same item from other companies |
| Name | Company | Catalog Number | Comments |
| Immunolabelling | |||
| BSA | SIGMA, USA | A9647 | can be replaced by same item from other companies |
| Anti-GFP Antibody | Molecular Probes, USA | A11122 | |
| Anti-pan-AMPAR Antibody | Frontier Institute, Japan | pan AMPAR-GP-Af580-1 | |
| Anti-NMDAR1 Antibody, clone 54.1 | Merck Millipore, Germany | MAB363 | |
| Opioid Receptor-Mu (MOR) Antibody | ImmunoStar, USA | 24216 | |
| EM goat anti-guinea pig, 5 nm; secondary antibody | BBInternational, UK | EM.GAG5 | |
| EM goat anti-rabbit, 15 nm; secondary antibody | BBInternational, UK | EM.GAR15 | |
| Donkey anti-rabbit, 10nm, secondary antibody | AURION, Netherlands | DAR 10nm | |
| Copper grids, 100 Parallel Bar | Agar scientific, UK | G2012C | |
| Incubator | Major Science, USA | MO-RC | can be replaced by same item from other companies |
| Pioloform Powder | Agar scientific, UK | R1275 | |
| Chloroform | Roth, Germany | 3313.1 | CAUTION! ; can be replaced by same item from other companies |
| Name | Company | Catalog Number | Comments |
| EM analysis | |||
| Philips CM120 TEM | Philips/FEI | ||
| Morada CCD camera | Soft Imaging Systems, Germany | ||
| iTEM Ver. 5.2, imaging software | Soft Imaging Systems, Germany |
Referências
- Fujimoto, K. SDS-digested freeze-fracture replica labeling electron microscopy to study the two-dimensional distribution of integral membrane proteins and phospholipids in biomembranes: practical procedure, interpretation and application. Histochem Cell Biol. 107 (2), 87-96 (1997).
- Masugi-Tokita, M., Shigemoto, R. High-resolution quantitative visualization of glutamate and GABA receptors at central synapses. Curr Opin Neurobiol. 17 (3), 387-393 (2007).
- Rash, J. E., Yasumura, T. Direct immunogold labeling of connexins and aquaporin-4 in freeze-fracture replicas of liver, brain, and spinal cord: factors limiting quantitative analysis. Cell Tissue Res. 296 (2), 307-321 (1999).
- Emes, R. D., Grant, S. G. Evolution of synapse complexity and diversity. Annu Rev Neurosci. 35, 111-131 (2012).
- Matsuzaki, M., et al. Dendritic spine geometry is critical for AMPA receptor expression in hippocampal CA1 pyramidal neurons. Nat Neurosci. 4 (11), 1086-1092 (2001).
- Rollenhagen, A., Lübke, J. H. The morphology of excitatory central synapses: from structure to function. Cell Tissue Res. 326 (2), 221-237 (2006).
- Tarusawa, E., et al. Input-specific intrasynaptic arrangements of ionotropic glutamate receptors and their impact on postsynaptic responses. J Neurosci. 29 (41), 12896-12908 (2009).
- Nusser, Z., et al. Cell type and pathway dependence of synaptic AMPA receptor number and variability in the hippocampus. Neuron. 21 (3), 545-559 (1998).
- Nyìri, G., Stephenson, F. A., Freund, T. F., Somogyi, P. Large variability in synaptic N-methyl-D-aspartate receptor density on interneurons and a comparison with pyramidal-cell spines in the rat hippocampus. Neuroscience. 119 (2), 347-363 (2003).
- Nicholson, D. A., Geinisman, Y. Axospinous synaptic subtype-specific differences in structure, size, ionotropic receptor expression, and connectivity in apical dendritic regions of rat hippocampal CA1 pyramidal neurons. J Comp Neurol. 512 (3), 399-418 (2009).
- Millhouse, O. E. The intercalated cells of the amygdala. J Comp Neurol. 247 (2), 246-271 (1986).
- Busti, D., et al. Different fear states engage distinct networks within the intercalated cell clusters of the amygdala. J Neurosci. 31 (13), 5131-5144 (2011).
- Amano, T., Unal, C. T., Paré, D. Synaptic correlates of fear extinction in the amygdala. Nat Neurosci. 13 (4), 489-494 (2010).
- Duvarci, S., Pare, D. Amygdala microcircuits controlling learned fear. Neuron. 82 (5), 966-980 (2014).
- Jüngling, K., et al. Neuropeptide S-mediated control of fear expression and extinction: role of intercalated GABAergic neurons in the amygdala. Neuron. 59 (2), 298-310 (2008).
- Asede, D., Bosch, D., Lüthi, A., Ferraguti, F., Ehrlich, I. Sensory inputs to intercalated cells provide fear-learning modulated inhibition to the basolateral amygdala. Neuron. 86 (2), 541-554 (2015).
- Maren, S. Neurobiology of Pavlovian fear conditioning. Annu Rev Neurosci. 24, 897-931 (2001).
- Pape, H. C., Pare, D. Plastic synaptic networks of the amygdala for the acquisition, expression, and extinction of conditioned fear. Physiol Rev. 90 (2), 419-463 (2010).
- Sigurdsson, T., et al. Long-term potentiation in the amygdala: a cellular mechanism of fear learning and memory. Neuropharmacology. 52 (1), 215-227 (2007).
- Bosch, D., Asede, D., Ehrlich, I. Ex-vivo optogenetic dissection of fear circuits in brain slices. J. Vis. Exp. (110), e53628 (2016).
- Fenno, L., Yizhar, O., Deisseroth, K. The development and application of optogenetics. Annu Rev Neurosci. 34, 389-412 (2011).
- Bienvenu, T. C. M., et al. Large intercalated neurons of amygdala relay noxious sensory information. J. Neurosci. 35 (5), 2044-2057 (2015).
- Sandri, C., Akert, K., Livingston, R. B., Moor, H. Particle aggregations at specialized sites in freeze-etched postsynaptic membranes. Brain Res. 41 (1), 1-16 (1972).
- Likhtik, E., Popa, D., Apergis-Schoute, J., Fidacaro, G. A., Paré, D. Amygdala intercalated neurons are required for expression of fear extinction. Nature. 454 (7204), 642-645 (2008).
- Fukazawa, Y., Shigemoto, R. Intra-synapse-type and inter-synapse-type relationships between synaptic size and AMPAR expression. Curr Opin Neurobiol. 22 (3), 446-452 (2012).
- Amiry-Moghaddam, M., Ottersen, O. P. Immunogold cytochemistry in neuroscience. Nat Neurosci. 16 (7), 798-804 (2013).
- Fukazawa, Y., Masugi-Tokita, M., Tarusawa, E., Hagiwara, A., Shigemoto, R., Cavalier, A., et al. SDS-digested Freeze-fracture replica labelling (SDS-FRL). Handbook of Cryo-Preparation Methods for Electron Microscopy. , 567-586 (2007).
- Severs, N. J. Freeze-fracture electron microscopy. Nat Protoc. 2 (3), 547-576 (2007).
- Tanaka, J., et al. Number and density of AMPA receptors in single synapses in immature cerebellum. J Neurosci. 25 (4), 799-807 (2005).
- Mansouri, M., et al. Distinct subsynaptic localization of type 1 metabotropic glutamate receptors at glutamatergic and GABAergic synapses in the rodent cerebellar cortex. Eur J Neurosci. 41 (2), 157-167 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados