Method Article
Optogenetic 및 동결 골절 복제 Immunolabeling는 마우스 편도체에서 글루타메이트 수용체의 입력 특정 배열을 검사하기 위해 결합
요약
This article illustrates how the expression of neurotransmitter receptors can be quantified and the pattern analyzed at synapses with identified pre and postsynaptic elements using a combination of viral transduction of optogenetic tools and the freeze-fracture replica immunolabeling technique.
초록
동결 골절 전자 현미경은 40 년 이상 미세 구조 연구의 주요 기술하고있다. 그러나, 막의 고분자 조성물을 연구하는 유효한 수단의 결여는 그 사용에 상당한 감소를 일으켰다. 최근 immunogold 라벨링함으로써 세포막 단백질을 표시하기위한 효과적인 방법의 개발이 동결 골절 전자 현미경 덕분에 큰 부활되고있다. 이러한 방법 중 하나는 세제 용해 동결 골절 복제 Immunolabeling (FRIL)로 알려져있다.
optogenetics와 FRIL 기술의 조합은 중앙 시냅스의 구조 및 기능적 특성의 상관 분석을 할 수 있습니다. 이 방법을 사용하여 식별 및 태깅 channelrhodopsin 각각 식 특정 분자 표지로 사전 및 시냅스 후 뉴런 모두를 특성화 할 수있다. glutamat의 시냅스 막 전문의 독특한 외관ergic 정량화 이들 수용체의 intrasynaptic 분포를 분석하기 위해, 상기 시냅스 이온 성 글루타메이트 수용체의 라벨링시에 허용한다. 여기서 우리는 페어 복제 방법을 immunolabel하는 방법을 준비하는 데 필요한 절차를 단계별 설명을 제공합니다. 우리는 또한 잠재적 인 샘플링 편견과 관련된 특히 사람들을 FRIL 기술의주의 사항 및 제한 사항에 대해 설명합니다. optogenetics와 결합 할 때 FRIL 기술의 높은 재현성과 다양성은 뇌에서 확인 된 신경 세포의 미세 회로의 시냅스 전달의 다양한 측면의 특성에 대한 매우 강력한 접근 방식을 제공합니다.
여기서는 이러한 접근은 마우스 편도의 인터 세포 질량의 뉴런에서 흥분성 시냅스의 구조 - 기능 관계에 대한 통찰력을 얻기 위해 사용 된 방법의 예를 제공한다. 특히,이 확인 입력에서 이온 성 글루타메이트 수용체의 발현을 조사 하였다하거나시상 후방 intralaminar와 중간 geniculate 핵에서 iginated. 이 시냅스는 두려움 학습을위한 관련 감각 정보를 중계하고 공포 조건화에 플라스틱 변화를 겪는 것으로 나타났다.
서문
나노 미터 크기의 생체막의 기능적 구조의 정의는 투과 전자 현미경에 적합한 immunolabeling 기술 다수의 발달로 최근에는 도전되었다. 그러나, 이러한 기술은, 예를 들면 전후의 매립 immunogold을, 항원 및 / 또는 막 결합 단백질의 양적 제한 평가 불량한 검출 포함 중요한 제한들을 갖는다. 이러한 제한은 셀 다양성과 시냅스 이질성 높은 것을 특징으로하는 신경 조직의 미세 구조의 연구에 특히 중요해진다. 사전 및 시냅스 소자 차동 식 농축, 또는 수용체 전송기 및 이펙터 분자로서 시그널링 단백질의 상호 작용에 의해 결정 구조적 및 기능적 다양성이 이질성 결과.
직접 immunolabe에 대한 새로운 접근 방식세제 용해 동결 골절 복제 (FRIL)의 통합 또는 가교 막 단백질의 링은 원래 20 년전 1 후지모토에 의해 소개되었다. 이 원래의 방법이 있었다, 그러나 몇 가지 제한 사항, 즉, 같은 두뇌와 같은 복잡한 조직에서 개별적으로 매핑 된 셀 라벨 분자의 의미있는 상관 관계를 방해 복제의 심각한 분열. 약 10 년 전, Shigemoto와 카자는 점진적으로 기술이 향상되었습니다. 이것은 또한 크게 갭 접합 (3)의 연구, 특히 기술을 향상 콜로라도 주립 대학의 볼더 연구소, 과학자의 또 다른 그룹의 노력이 병행되었다.
동결 파쇄 프로토콜 및 시스템의 개선뿐만 아니라, (고압) 빠른 냉동의 도입은 지금 하이 연구자들은 상대적으로 큰 크기의 시험편의 단절 복제본을 생성 할 수 있도록한계와 강한 화학 고착에 의해 생성 된 유물없이 대부분의 세포 성분의 GH 품질의 이미지.
FRIL 기술은 사전 및 시냅스의 평면도의 또 다른 장점으로, 이러한 뇌 복잡한 조직 내의 하나 이상의 매핑 학적에서 (동시에) 단백질 및 미세 침 흡인 세포 검사 식별 세포 동일계 식별에 고 정량의 큰 장점을 제공한다 하나의 복제 요소. 따라서, FRIL 기술은 많은 기술적 장애에도 불구하고, 특히 각각의 시냅스의 구조적 및 기능적 특성의 관계에 대해 매우 중대한 과학적 돌파구로 사용하는 가능성을 보유하고있다. 지난 몇 년 동안, 많은 정보는 분자 구성, 구조에 획득하고 있으며, 시냅스의 생리 기능; 아직 시냅스는 형태 학적 및 분자 매우 다양한 사전 및 시냅스 파에 따라 있습니다임대 뉴런 4. 시냅스 만 종류의 소수에 대한 구조 - 기능 연구가 지금까지 5-7 수행 하였다. 이는 사전 및 시냅스 요소의 특성에 대한 정확한 식별을 방지 기술적 제약에 대부분이었다.
미세 분석은 시냅스 전달의 강도와 소성에 큰 영향을 미치는 신경 전달 물질 수용체 6 별개의 시냅스 접촉에 걸쳐 모두 시냅스 크기와 내용면에서 시냅스 막 전문의 변동성에 중요한 통찰력을 제공하고 있습니다. 또한, 많은 연구 기관은 시냅스의 종류 발현 이온 성 글루타메이트 수용체의 수는 afferent- 및 목표 의존적 7-10으로 조절되는 것을 나타낸다.
여기에서, 방법은 정의와 시냅스 막 전문의 구조와 수용체의 조성 분석을 허용하는 개략되어D 시냅스 요소 및 기능. 이 방법은 channelrhodopsin2 (ChR2)와 같은 최근 개발 된 감광성 조류 단백질의 연접 식을 활용하고 FRIL 기술의 α 아미노 -3- 히드 록시 -5- 메틸 -4- isoxazolepropionic의 시냅스 발현의 패턴을 분석 산 (AMPA-RS) 및 N- 메틸 -D- 아스 파르 테이트 (NMDA-RS) 글루타메이트 수용체. 이는 편도 (ITC)의 인터 셀 대중의 신경 세포에 후방 시상 - 중간 geniculate 핵 (PIN / MGN)에서 발생하는 축색 돌기에 의해 형성된 시냅스에서 시연된다. ITC 뉴런은 기저 amygdaloid 복합 (BLA) (11), (12)을 둘러싼 클러스터 구성 작은 가시 GABA 성 세포이다. ITC 신경 세포가 BLA 주요 신경 세포에서 흥분성 입력을 수신하고 (CEA)를 중심 핵을 대상으로하는 것으로 알려져있다, 따라서 억제 게이트 역할을 정보에 대한 BLA와 CEA 12 ~ 15 사이에 흐른다.
최근에, 우리는 IT 시연BLA와 CEA의 메디 - 지느러미 클러스터에있는 C 뉴런은 두려움 파블로프 청각 공포 조건화 16시 학습에 수정 감각 시상 및 시간 대뇌 피질의 영역에서 직접 수렴 흥분성 입력을받을 수 있습니다. 공포의 조절은 뇌 메커니즘의 관점에서 연관 학습의 가장 좋은 이해 형태 중 하나입니다. 공포 에어컨, 초기 중립 조건 자극 (CS, 예를 들면, 톤)에서 CS-US 협회 초래하는 혐오 무조건 자극 (US, 예를 들면, 가벼운 발 충격)와 짝과 공포 응답 (17), (18)를 조절한다. 흥분성을 연사 및 미국을 대표하는 정보를 전달 시상 및 신피질 영역 모두에서 입력은 각각 편도 (LA)의 측면 핵의 피라미드 뉴런에 수렴 및 소성 (19)를 받아야하는 것으로 알려져 있었다. 우리의 이전 작품은 감각 입력 정보가 ITC의 신경 세포에 전달 병렬도 밝혀 16입니다.
각각의 감각 입력의 기계적인 분자 분석을 향한 첫 번째 단계는 ITC의 신경 세포에 시냅스, 우리는 ChR2는 노란색 형광 단백질 (YFP) 태그로 표현하는 아데노 관련 바이러스 (AAV)을 사용했다. AAV는 PIN / MGN에 주입하고, 축삭 단자는 ChR2 - YFP의 발현에 의해 확인되었다. 우리는 PIN / MGN 엑손 단말기들에 의해 ITC 뉴런 형성 시냅스 시냅스 AMPA-RS와 NMDA-RS의 밀도를 평가하기 FRIL 기술에 의해 생성 된 양면을 사용했다.
프로토콜
동물 주제와 관련된 절차는 Regierungspraesidium 튀빙겐, 바덴 뷔 르템 베르크, 독일의 국가에 의해 오스트리아의 동물 실험 윤리위원회의 승인을, 연구에서 동물의 사용에 대한 유럽 연합 (EU) 지침에 따라했다되었습니다.
AAV-Channelrhodopsin2-YFP 1. 정위 주사
참고 : 정위 주사는 이전에 게시 된 프로토콜 (20)에 따라 수행 하였다.
- 1.5 시간 동안 180 ºC에서 그들을 가열하여 멸균 도구를 준비합니다.
- 다음 매개 변수를 설정 수평 미세 전극 풀러를 사용하여 주사에 대한 날카로운 (~ 50 μm의 직경) 유리 피펫을 당기 : 열 = 램프 값을 - 20 = 200 = 0, 속도 = 100 시간 = 200, 압력을 당깁니다.
참고 : 램프 값은 마이크로 피펫 풀러 제조업체에서 제공 한 지침에 따라 구입 한 유리 피펫의 각 로트에 대해 결정해야합니다. - 프리믹스 바이러스 솔루션의 1 μL 멸균 인산 완충 식염수 (유리 피펫에서 솔루션의 더 나은 가시성) 0.1 % 빠른 그린 솔루션의 0.2 μL (PBS; 25 밀리미터, 0.9 %의 NaCl, pH를 7.4). 10 μL 피펫 및 젤-FIL 팁을 사용하여 유리 피펫을 입력합니다. 바이러스 구조의 경우, rAAV-hSyn-ChR2 (H134R) -eYFP (혈청 형 2/9)를 사용합니다.
- 작은 동물 마취 장치 (유도 산소 3 % 이소 플루 란)를 사용하여 마우스를 마취. 용도. 이 연구를 위해 ~ 육주 세 (3) 야생형 마우스를 사용합니다.
- 귀와 눈 사이의 머리를 면도하고 포비돈 - 요오드 기반 솔루션으로 소독.
- 마취 동안 눈의 건조를 방지하기 위해 눈 연고를 적용합니다. 피하 진통과 마우스를 주입 (멜 록시 캄 계, 5 ㎎ / ㎖ 용액 0.1 mL)을 첨가 하였다.
- 정위 프레임에 마우스를 놓고 가스 마취 장치 (유지 보수를 위해 산소의 2 % 이소 플루 란)를 통해 마취를 유지한다. 사지 철수의 부족으로 마취 깊이를 확인계속하기 전에 리플렉스.
- 전체 수술 중 가능한 한 가장으로 무균 상태를 유지한다. 일회용 얼굴 마스크, 수술 가운과 장갑을 착용 할 것.
- 가위 (20)를 사용하여 머리의 상단에 약 1cm의 피부 절개를합니다. 부드럽게 H 2 O 2와 두개골 표면 청소 두개골을 노출 클램프로 고정, 무딘 집게를 사용하여 옆으로 피부를 당기십시오.
- 좋은 팁 영구 마커를 사용하여 두개골에 마크 주사 부위. 표시된 부위에서 두개골에 작은 구멍 (직경 약 1mm)을 뚫는다. 브레 그마에서 (mm) : 3.0 후방, 1.8 ± 측면, 3.8 복부이 스터드의 일방적 인 PIN / MGN 분사를 들어, 다음 좌표를 사용합니다.
- 마운트 압력 주입 장치에 접속 정위 프레임에 유리 피펫을 작성하고 위치를 정수리 피펫을 가져온다.
- 고급 스트레이트 팁 집게를 사용하여 유리 피펫의 팁을 끊다. 확인 피펫 팁을 만드 applyin에 의해 열려조지아 약간의 압력 펄스 및 바이러스 솔루션 방울의 관찰 압출.
- 원하는 주입 좌표로 이동하여 압력 분사 장치에서 다음 설정을 사용하여 피펫 콘텐츠 (~ 0.5 μL)의 절반 주입 : 압력 20 psi의 평균 펄스 길이 30 밀리 초, 펄스 (50)의 평균 수를.
- 를 후퇴 천천히 (1mm / 분) 전 ~ 1 분 동안 장소에서 피펫을 둡니다.
- PBS (산도 7.4)와 클램프를 제거 청소 두개골. 부드럽게 함께 피부를 당겨와 절개를 봉합 (3-4 노트). 상처 주위에 살균제 (기반 포비돈 - 요오드)를 적용합니다.
- 마취를 중지하고 완전히 깨어 때까지 무인 마우스를 두지 마십시오. 단일 보관 마우스를 유지합니다. 수술 후는 건강 상태를 지속적으로 모니터링; 필요한 관리]의 진통 경우.
- 바이러스 성 표현의 적절한 수준을 보장하기 위해 뇌 고정하기 전에 4 주간 동물을 유지합니다.
2. 표본 준비
- 뇌 고정 <> / 강해
- 정착액의 준비
- 정착액 1 L를 들어, 파라 포름 알데히드의 10g의 무게를 탈 H 2 O의 300 ml의에 추가 연속 교반하면서 10 분 ~ 60 ºC - 55 열.
- 열을 끄고 7 추가 - 4 N NaOH를 8 방울을. 이 솔루션은 ~ 10 분에 명확하게해야한다.
- 산 피크르산 포화 용액 150 mL를 넣고,이 RT로 식히 탈 H 2 O로 500 ml의 가져
- 0.2 M 인산 완충액 (PB)의 500 ML을 추가합니다. 필터 종이 필터. NaOH로 7.4으로 산도를 조정합니다.
- 6 ºC에 정착 쿨 6 ºC에서하게보다 하루 어두운 유리 병에 보관하십시오.
- Transcardiac 관류
- 티 오펜 탈 (120 ㎎ / ㎏ 체중)의 복강 내 주사하여 마우스를 마취. 동물 깊이 페달 탈퇴 REFL를 확인하여 확인 마취되어 있는지 확인결석해야합니다 예. 묶여 네 사지와 관류 테이블의 뒷면에있는 동물을 놓습니다.
- 무딘 엔드 가위로 길이 방향으로 복벽을 열고 다이어프램을 노출, 측면 흉곽의 꼬리 국경을 따라 두 개의 추가 인하합니다. 다이어프램을 멀리 잘라 양쪽에 osteocartilageneous 국경에서 흉부 벽을 잘라. 마음을 노출하는 흉골을 포함한 가슴 벽의 중앙 슬래브의 꼬리 끝을 들어 올립니다.
- 관류 장치의 정맥을 인정 좌심실의 끝에서 작은 정확한 절단을하기 위해선, 심낭을 제거합니다. 0.6 mm의 내부 직경이 무딘 캐뉼라를 사용합니다. 끝이 상행 대동맥에 나타납니다까지 심실을 통해 조심스럽게 캐 뉼러에 전달하고 클램프와 함께 정맥을 고정합니다. 혈류를 종료 혈액 및 관류을 허용하려면, 우심방에 상처를합니다.
- 관류 생쥐로 transcardially 유속으로 연동 펌프를 사용하여7 분 동안 얼음 냉각 정착 한 다음 약 1 분 동안 PBS로 처음에 5 ml / 분 (25 밀리미터, 0.9 %의 NaCl, pH를 7.4),의.
- 고정 후, 가위와 마우스 머리를 절단하고 목에서 코 정중선을 통해 피부를 잘라. 완전히 두개골을 노출하는 근육을 제거합니다.
- 날카로운 가위를 사용하여 후두와 난원 매그넘에서 시작 interparietal 뼈를 통해 길이 절단을합니다. 미세 핀셋이 뼈를 제거 사용하면 전체 소뇌를 노출합니다. 그 후 코 뼈까지 정수리와 이마 뼈를 통해 다른 길이 컷을 전체 뇌를 노출 핀셋으로 제거합니다.
- 주걱을 사용하면 손상을주지 않고 뇌를 제거하고 얼음처럼 차가운 0.1 M PB에 넣습니다.
- 정착액의 준비
- 단면 및 시료의 트리밍
- 관심 영역을 포함하는 면도날와 6mm - 약 5의 관상 블록을 잘라. 의 홀더에 그것을 접착제시아 노 아크릴 레이트 접착제로 vibroslicer. 신피질의 진동 블레이드를 향하도록 상기 조직 블록의 방향. 빙냉 0.1 M PB의 vibroslicer (도 1a)에서 140 μm의 편도선을 포함하고, 동일한 완충액에서 6- 웰 접시 조각들을 수집 관상 섹션.
- 실체 현미경 아래에서 관심 영역을 잘라 슬라이스에서 (여기에서, ITC의 메디 - 지느러미 paracapsular 클러스터는 그림 1B 참조). 안과 용 메스를 사용하여 0.1 M PB로 실리콘 탄성 중합체로 코팅하고 가득 페트리 접시에서이 작업을 수행합니다. 트리밍 블록 스페이서 (약 1.5 mm) (그림 1B)의 구멍에 맞게 있는지 확인합니다.
- 6 ºC에서 O / N (0.1 M PB 30 % 글리세롤) cryoprotection 솔루션에 트리밍 블록을 이동합니다.
3. 고압 냉동
참고 : FRIL 6 필수 단계로 구성됩니다 (그림 2) : 고압 (2,300에서 1) 급속 동결 - 시편의 2,600 바). 시편의 2) 골절. 원형질 (P-면)에 인접 해있다 반 및 세포 외 또는 exoplasmic 공간에 인접 해있다 반 (E-: 파괴면은 일반적으로 두 반 막 전단지로 분할, 냉동 멤브레인의 중심 소수성 코어를 다음과 얼굴). 백금 및 탄소를 진공 증착하여 시료 3) 복제. 조직의 4) 세제 소화. 5) Immunogold 라벨링. 투과형 전자 현미경을 사용하여 복제 6) 분석.
- 구리 캐리어의 준비
주 : FRIL 절차의 연속적인 단계를 통해 처리하기 위해, 표본 금속 (금 또는 구리) 캐리어에 장착해야합니다. 선택된 항공사는 파쇄 및 중고 기계의 종류의 모드에 따라 크기와 디자인에 따라 다릅니다. 여기에서 우리는 구리 캐리어 (그림 1B, E)과 힌지 "더블 복제 테이블을"사용; 열 때이 고정 된 표본을 통해 인장 파괴 (그림 2)을 생성하는 (그림 3B 참조). 이것은 유지하고 골절 시편의 양면을 복제 할 수 있습니다.- 세무 피부의 시트를 사용하여 변색 제거 폴란드어 구리 통신사.
- 두 번 초음파 처리 수조에서 비이 온성 세제 (산도 ~ 1.5)와 유리 냄비 청소에 넣어 운반 후 광범위하게 탈 이온수 다음 수돗물에 세척하고 에탄올로 두 번 씻어.
- 15 분 동안 아세톤 구리 캐리어를 초음파 처리.
- 건조 여과지에 캐리어를 놓습니다.
- 상기 트리밍 블록 (유지 캐리어) 잘 유지 될 것입니다 구리 캐리어 (그림 1C)에 양면 테이프의 고리를 연결합니다.
- 시료의 동결
주 : 관리 및 적절한 고글을 착용하여 액체 질소를 처리합니다.- 무료 고압 켭니다활기 장치 (그림 1 층) 시편 동결과 함께 시작하기 전에 적어도 1.5 시간.
- 은 "AIR의 HEATER"버튼을 눌러 가열을 시작하고 50 분 동안 밖으로 굽는다. 80 ℃로 설정 공기 온도.
- 고압 냉동 장치에 질소 탱크를 연결하고 액체 질소로 내부 듀어를 채우기 위해 "NITROGEN"버튼을 누릅니다. 은 "질소 LEVEL"램프가 켜집니다. 은 "냉방"버튼을 누름으로써 냉각 시작.
- 은 "질소 LEVEL은"외출 할 때 버튼 "IN DRIVE"를 누르십시오. 유압 시스템 앞뒤로 3 회 피스톤을 이동하는 것을 확인합니다.
- 은 "AUTO"버튼을 누르면 "NITROGEN"버튼을 누릅니다. 즉시 "READY"가 점등으로, 고압 냉동 장치는 고압 동결에 대한 준비가되어 있습니다.
- AG에 용융 된 양면 테이프 (도 1b), 백금 와이어 루프를 사용하는 구멍에 트리밍 블록을 배치아가씨 피펫.
- 필터 종이 또는 브러시를 사용하여 동결 방지제 용액의 초과를 제거합니다.
주 :이 절차는 조직의 주위에 형성 할 수 있고, 조직 형태 및 / 또는 미세 구조의 왜곡을 야기 할 수있는 기포를 제거하는 것이 중요하다. - 조직 블록은 두 개의 캐리어 사이에 개재되도록 실체 현미경, 다른 캐리어 유지 캐리어 커버.
- 고압 냉동 장치 (그림 1D)의 시편 홀더에 캐리어 샌드위치를 삽입합니다. 고압 냉동 장치에 시편 홀더를 삽입합니다 (아래 팁)과 시편 홀더에 나사에 의해 고정합니다.
- 은 "제트 오토 '버튼을 눌러 냉동 사이클을 시작합니다. 가능한 한 빨리 작업, 시편 홀더를 제거하고 절연 상자에 액체 질소와 팁을 잠수함. 를 냉각 액체 질소에 포셉 두 쌍의 팁을 담가.
- 조심스럽게 일을 제거전자 시편 홀더 캐리어 샌드위치와 사전 냉장 cryovial에 넣습니다. 캐리어는 액체 질소 냉각 집게로 처리되어 있는지 확인합니다. 크리오 바이알 (cryovial)은 질소 바이알 (도 1G)으로부터 유출 할 수 있도록 관통한다.
- 원하는 모든 샘플이 동결 될 때까지 반복 3.2.11에 3.2.6 단계를 반복합니다. 샘플의 동일한 유형을 포함하는 다중 캐리어 샌드위치 같은 바이알에 저장 될 수있다.
- 복제 (그림 1H)까지 cryotank에서 캐리어를 포함하는 크리오 바이알 (cryovial)를 저장합니다.

그림 1. 조직 준비 고압 동결. (A) Vibroslicer 부에 조직을 사용 하였다. (B) 교류와 옆에 편도 표시면을 포함하는 결과 관상 마우스 뇌 섹션opper 캐리어는 양면 테이프의 고리를 장착. 점선 박스는 ITC의 중간 paracapsular 클러스터가 포함 된 관심 영역을 나타냅니다. 양면 테이프의 구멍의 직경은 약 1.5 mm이다. 구리 사업자의 준비를위한 (C) 도구. 양면 테이프, 핀셋, 구멍을 뚫는, 구리 캐리어, 가위 : 왼쪽 상단 시계 방향 방식에서. 고압 동결에 대한 시편 홀더에 캐리어 샌드위치 (D) 삽입. 반송파 샌드위치 시편 홀더의 홀에 배치된다. 없이 양면 테이프의 링과 "캐리어 샌드위치"와 (E) 구리 통신사. (F) 가압 탱크는 액체 질소를 공급 높은 압력 냉동 장치. cryovial (G) A는 냉동 조직을 재고합니다. 질소 가스는 바이알 (화살촉) 밖으로 흐르게 바이알의 상부 중간 위치에 구멍을 참고. (H) Cryotank은 냉동 조직을 저장. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 동결 골절 및 복제
- 전자빔 총 제조
- 전자빔 총을 삽입하기 전에 "향기 플레이트"로 실드를 제거합니다. 낮은 음극 커버를 통해 콜릿 척에 필라멘트를 중심으로에 대한 "설정 게이지"를 놓습니다.
주 : 소 직경 단부는 백금에 대한 총 반면 설정 게이지의 큰 직경의 단부 카본 총 사용된다. - "압력 라미"때까지 게이지를 통해 새로운 필라멘트를 밀어 필라멘트 코일 각도로 거짓말을하지 않는다는 것을 보장 필라멘트의 끝을 고정 할 수 있습니다.
- 설정 게이지를 제거하고 탄소 막대를 삽입합니다. 공동을 체결하여 수정로드의 단부의 높이가 바닥으로부터 제 2 코일의 중간에있는 것을 보장하는 증발기로드 홀더 llet 척. 백금 총 들어 백금로드의 단부의 높이가 상부로부터 상기 제 필라멘트 코일의 중앙이어야한다.
- 디플렉터 판을 교체하고 동결 골절 부에 총을 삽입합니다. 사용 후 모래 블래스터와 함께 총을 청소합니다.
- 전자빔 총을 삽입하기 전에 "향기 플레이트"로 실드를 제거합니다. 낮은 음극 커버를 통해 콜릿 척에 필라멘트를 중심으로에 대한 "설정 게이지"를 놓습니다.

그림 FRIL 기술의 주요 단계 2. 그림입니다.
제조 및 복제의 분석에 필요한 여러 단계의 개요. 조직 (1) 고압 동결. (2) 골절. 냉동 조직의 파쇄 동안, 세포막의 지질 이중층은 소수성 계면에서 두 부분으로 분할된다. 세포막 단백질은 어느 exoplasmic (E-면) 또는 프로토에 할당plasmic 막 (P-면). (3) 복제. 탄소 (C)의 증발은 골절 조직의 표면에 지질 단백질 트랩. 재료는 복제 구조 (C 층, PT-그림자)를 강화하는 또 다른 15 나노 탄소 층을 다음 60 °의 각도로 그림자가 2 nm 인 백금 / 탄소로 피복하고있다. (4) 가용화. 복제 막에 의해 트랩되지 조직은 다음 SDS-용액으로 용해된다. (5) 레이블. 관심있는 단백질은 특정 일차 항체 (주 AB) 및 금 입자 (금)와 접합 이차 항체 (보조 AB)로 이루어진 복합체를 사용하여 레플리카에 가시화 될 수있다. 금 입자의 다양한 크기의 사용은 동일한 복제에서 하나 이상의 단백질을 검출 할 수있다. (6) immunolabeling 후 복제본 구리 메쉬 그리드 상에 수집하고, 80에, 투과형 전자 현미경으로 분석하여 -. 100 kV의 CLIC주세요이 그림의 더 큰 버전을 보려면 여기를 케이.
- 동결 골절 유닛의 설정
- , 동결 골절 및 복제 절차에 대한 자세한 설명은 1. 주전원을 돌려 동결 골절 부 (그림 3A)에 스위치 제조업체가 제공하는 사용 설명서를 참조하십시오.
- 상기 동결 파쇄 장치를 냉각하기 전에 따뜻한 공기를 장치의 전체 냉각 시스템을 굽는다. 선교사 훈련원 010 장치의 "해동"버튼 (온도 제어 장치) (그림 3A)를 누르고 45 분 동안 베이크 아웃 절차 실행을 할 수 있습니다.
- 진공 스테이션을 활성화합니다. 10-7 밀리바 - 동결 골절 부 보통 ~ 10-6의 진공 범위에서 동작한다.
- 질소 탱크에 채우고 동결 골절 부에 연결한다. 밸브 홀더가 건조되었는지 확인하고 또한 밸브 홀더의 삽입 전에 탱크의 항목을 청소 (습도는 vacuu을 방해 할 수 있습니다m 및 N의 표시 탱크의 2 충전).
- -115 ℃까지 온도를 설정하여 냉각 시작한다. 냉각은 약 45 분 소요됩니다.
- 전자빔 총을 넣고 증발 다음 매개 변수에 도달 할 전류 및 전압 조절 :
탄소 총 :에 회전, 위치 90도, 탄소 축적의 속도 0.1-0.2 나노 미터 / 초
탄소 백금 총 : 오프 회전, 위치 60 °, 축적 0.06의 속도 - 0.1 나노 미터 / 초
주 : 총 탄소 또는 백금 봉, 사용하기 전에 3 분간 탈기 교환 후 처음으로 사용하는 경우.
- 골절 및 복제
- 모든 조작은 액체 질소에 완료 확인하는 더블 복제 테이블에 고정 된 캐리어 샌드위치를 삽입합니다.
- 듀어 용기에 두 번 복제 테이블을 전송하고 45 °의 각도로 시험편 단계 수신기에 고정합니다. 액체 질소 수준은 항상 이중 replica 테이블 위에 있어야합니다.
- 테이블 조작으로 이중 복제 테이블을 들고 추위 스테이지로 동결 골절 부에 삽입합니다. 이중 복제 테이블의 온도가 -115 ° C에 적응 할 수 있도록 약 20 분을 기다립니다.
- 진공 10-6 밀리바 이하이고 온도가 -115 ℃로 있는지 확인합니다.
- 이중 replica 테이블 위에 배치 덮개에 연결된 바퀴를 수동으로 반 시계 방향의 회전에 의해 조직을 파괴. 덮개가 회전 할 때, 조직을 파쇄, 열려면 더블 복제 테이블을 강제로.
- 냉동 파쇄 장치 (도 3a)의 EVM 030 장치 (전자빔 증착법 제어부)에서 "하이 텐션"버튼을 누른다.
- 단방향를 Shado이어서, 5 nm의 두께로 90 ° 각도로 위치하는 전자총에 의해 탄소 (회전)의 증발에 의해 골절 조직 (도 3c)의 노출 된 표면을 복제2 nm의 두께로 60 ° 각도로 백금 - 탄소와 날개. 마지막으로, 90 ° 각도 (회전)에서 탄소의 15 nm 두께의 층을 적용합니다.
- 증발에 대해 다음 매개 변수를 사용하여
1 탄소 :에 회전, 위치 90 °; 속도 0.1-0.2 나노 미터 / 초; 5 nm의
2 탄소 - 백금 : 위치 60 °; 속도 0.06-0.1 나노 미터 / 초; 2 nm의
3 탄소 :에 회전, 위치 90 °; 속도 0.3-0.5 나노 미터 / 초; 15 nm의 - (트리스는, pH가 7.4 완충 식염수) 동결 골절 부로부터 복제 된 표본을 제거하고 세라믹 12 웰 플레이트 TBS 가득 (그림 4A)로 전송.
- 백금 루프 선재를 사용하여, 시료 담체 (도 4a)에서 복제 된 조직을 제거한다.
- 모든 샘플이 복제 될 때까지 반복 4.3.10에 4.3.1 단계를 반복합니다.
 R /> 그림 3. 냉동 파쇄 및 복제.
R /> 그림 3. 냉동 파쇄 및 복제.
(A) 동결 골절 부. 기계는 여러 제어 장치와 모니터가 포함되어 있습니다. 시료 챔버의 좌측면에 포트를 통해 챔버로 도입된다. 가압 액체 질소 용기는 상기 스테이지를 냉각하는 냉동 파쇄 부에 접속된다. 쇼 확대 단위의 두 가지 전망 (UPC 010 및 MDC 010) 및 제 탄소 층의 증착 동안 매개 변수를 표시하는 모니터 아래 이미지. (B) (왼쪽) 개설 및 이중 복제 테이블의 폐쇄 (오른쪽) 전망을 제공합니다. 은 "캐리어 - 샌드위치"테이블의 슬롯에 삽입된다 (화살표로 표시). 작은 팔 조작 중에 떨어지는 "캐리어 샌드위치"를 방지합니다. (C) 골절 및 복제 샘플. 복제본은 골절 조직의 상단에 얇은 검은 필름 나타납니다.53 / 53853fig3large.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 복제의 SDS-소화
- SDS-소화 버퍼 (2.5 % 라 우릴 황산나트륨, 15 mM 트리스의 20 % 자당, 산도 8.3) 1 ㎖ 가득 4 ㎖의 유리 병에 전송 복제. (45 스트로크 / 분)을 흔들어 80 ° C에서 18 시간 동안 다이제스트.
- RT에서 SDS-소화 버퍼와 상점으로 가득 새로운 튜브로 전송 복제본.
5. Immunolabeling
주 : 모든 배양은 항체 배양을 제외하고, 부드러운 흔들림으로 실온에서 수행된다.
- 신선한 SDS-소화 버퍼에 10 분 동안 복제본을 씻으십시오.
- TBS 2.5 5 분 동안 TBS는 % BSA (소 혈청 알부민), 다음 3 × 10 분, 0.1 %의 BSA로 한번 복제 씻는다.
- 1 시간 동안 5 %의 BSA와 TBS의 블록 비특이적 결합 부위.
- 차 항을 적용몸은 2 % BSA-TBS에 희석. 72 시간 동안 15 ° C (도 4C)에서 습기 챔버에서 30 ㎕를 드롭 (그림 4B)에서의 배양을 수행합니다.
- 골절 조직에서이 연구 과정을 모두 복제하십시오. 아미노산 660을 커버하는 재조합 융합 단백질에 대해 제기 또는 마우스 단일 클론 항체 (200 : 1 희석) 모두 AMPA-R 소단위 공통 마우스하는 GluR1 754 - 아미노산 (717)에 대해 발생 기니 피그 폴리 클로 날 항체와 하나의 복제본을 부화 - NMDA-R의 NR1 서브 유닛의 811 (희석 1 : 500) 및 녹색 형광 단백질에 대해 발생 토끼 폴리 클로 날 항체 (희석 1 : 300).
- (1 : 500 희석) 래트 μ 오피오이드 수용체 - 398 - 384 산 아미노기에 해당하는 합성 펩티드에 대해 발생 토끼 폴리 클로 날 항체와 다른 복제본 부화.
- 0.05 % BSA로 씻어 TBS (3 × 5 분.).
- 이차 항체를 적용합니다. 이 연구의 U에 대한자체 골드 (이온 성 글루타민산 염 수용체 5 나노 미터, 10 μ-오피오이드 수용체 및 / 또는 ChR2-YFP 15 ㎚) 2 % BSA와 TBS에 희석 복합 항체. 이차 항체를 1:30 희석하고 15 ° CO / N에서 30 μl의 드롭에 품어.
- RT에서 0.05 % BSA-TBS에서 3 × 5 분을 씻으십시오.
- 초순수에서 2 × 5 분을 씻으십시오.
- formvar 코팅 (100) 온라인 평행봉 그리드 (그림 4D)에 장착 복제.
6. 복제 분석
- 80 또는 100 kV의 투과형 전자 현미경 (TEM)으로 이미지 복제. 는 CCD (전하 결합 소자) 카메라를 통해 디지털 이미지를 획득.
- 오프라인, 랜드 마크를 사용하여 두 복제본 (그림 4E)의 이미지에 영역을 해당 찾을 수 있습니다. 이미지 J.는 시냅스 영역 분석 수용체에 대항 immunogold 표지 입자의 수를 결정하여 디지털 이미지를 분석합니다.

그림 4. 복제의 Immunolabeling.
조작 및 복제본을 세척하기위한 (A) 도구. 세라믹 12 웰 플레이트 (오른쪽 위) 및 유리 피펫의 2 종류 (왼쪽 위). 라운드 팁 (왼쪽 아래)와 유리 피펫 복제본을 전송하기 위해 사용되며, 백금로드 (하단 중앙)와 피펫 복제본을 전개하는데 사용된다. 세척 버퍼의 복제본 (오른쪽 아래). 복제본 (B) Immunolabeling는 조직 배양 6- 웰 플레이트의 웰에 파라 필름의 작은 부분에 배치 방울 (30 μL)에서 수행된다. 복제가 버퍼를 포함하는 항체의 드롭에 포함되어 있습니다. 증발을 방지하기 위해, 티슈의 습 부분은 웰의 내주 주위에 장착되어있다. immunolabeling의 단계 (C) 보육. 배양은 15 ℃에서 수행된다. (D)에 장착 된 레플리카 formvar 코팅 100-라인 평행봉 격자입니다. (E) 복제 한 쌍의에서 낮은 배율의 현미경 사진. 점선 사각형 해당 복제에서의 위치를 식별하는 일반적인 세 최적를 나타낸다. 스케일 바 : 10 μm의. 모든 데이터가 표시되는 등 평균 ± SEM 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
FRIL 기술은 미생물 기원 (21) 즉, 세포막 통합 효과적으로 축삭을 따라 anterogradely 전송 채널 optogenetic 액추에이터 식으로 결합 될 때, 정의 된 서브 그룹에서 정량 AMPA-RS와 NMDA-RS의 시냅스 발현을 조사 할 수 있도록 시냅스의. 이 편도에 ITC 뉴런에 (예를 들어, PIN / MGN) 별개의 시상 핵에서 발생하는 축삭을 위해 여기에 표시됩니다. 이 접근법은 ITC 뉴런, 지금까지 상세한 해부학 분자 특성화 난치성이었다 셀 그룹 상 개별 감각 입력 시냅스의 분자 분석을 가능하게한다.
4 주 PIN / MGN에 rAAV-ChR2 - YFP의 정위 주사 후, ChR2 - YFP 양성 축색 돌기 밀도가 LA의 amygdalostriatal 전이 지역 (Astria) 및 내측 paracapsular의 I를 신경 지배 편도선에 TC 클러스터는, 이전의 추적과 완벽하게 일치하는 패턴은 22, 16 연구. 우리는 또한 rAAV-ChR2-YFP-에서 동결 골절 복제의 축삭과 단자의 P-얼굴에 ChR2 - YFP에 대한 immunolabeling 강한 금을 감지 주입 된 마우스 (도 5a), 그러나 비 - 주입 된 쥐에서 복제된다. 복제에서 글루타메이트 시냅스의 시냅스 막 특성화 원형질막 2 (23)의 E-얼굴 intramembrane 입자 (하는 IMP)의 클러스터로서 관찰 될 수 있고, 종종 시냅스 전 혈장 막 (7)의 P-얼굴 수반 (그림 5B-C). PIN / MGN의 축삭 단자에 의해 형성 글루타메이트 성 시냅스의 시냅스 전문화를 식별 할 수 이러한 기능 (그림 5, 6). 우리는 NMDA-RS는 필수 NR1 서브 유닛에 대한 항체를 사용하여 검출 된 반면, 네 개의 서브 유닛 (GluA1-4)를 인식하는 항체와 AMPA-R을 표시.
"FO : 유지-together.within 페이지를 ="ntent 1 "은>이 시냅스가 돌기 쪽 또는 ITC 뉴런의 축으로 만들어진 여부를 동일한 복제본에 감지 할 수있는 도구의 부족 때문에, 우리는 μ에 대한 대응 복제의 얼굴을 표지 ITC 뉴런이 수용체 (24)의 postsynaptically 높은 수준의 발현으로 -opioid 수용체. 이것은 최적의 고용 전략을 사용하여 두 개의 복제본 (도 5C-F 및도 6A-D)에서 동일한 시냅스 정보의 확인 요구 (도 4E) .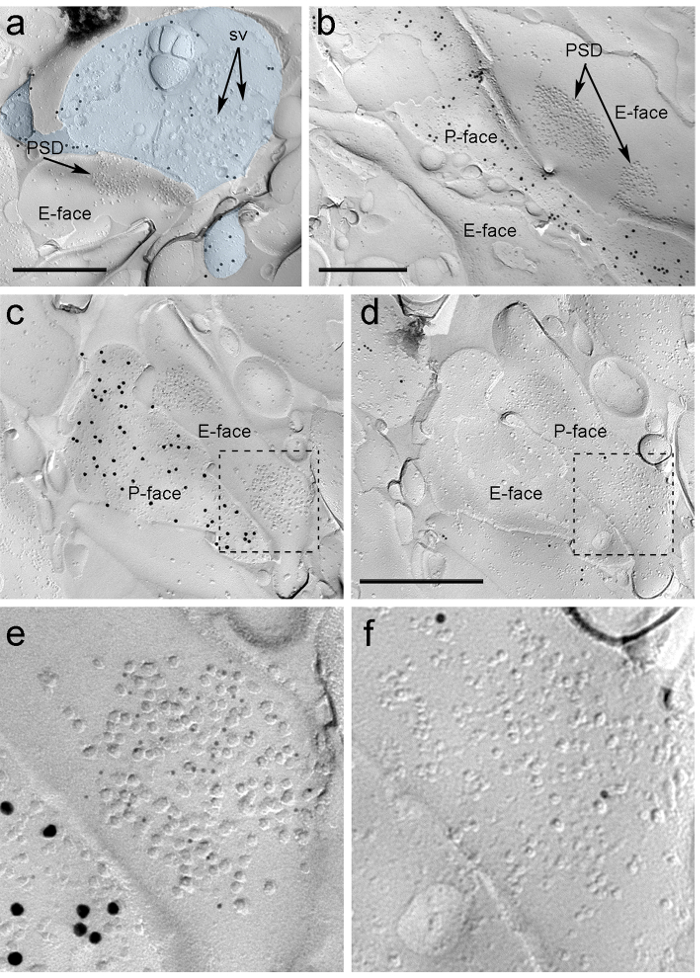
그림 5. Immunogold 입자에 의한 복제에 ChR2 - YFP 및 이온 성 글루타메이트 수용체의 검출. (A) 크로스 골절 축삭 터미널 (하늘색)과 ChR2 - YFP을 검출하는 15 나노 금 입자로 표지의 P-얼굴의 작은 부분. the 터미널 내에있는 경우의 O-F 수많은 시냅스 소포가 관찰 될 수있다 (SV). 원형질막에 한정되는 대부분의 immunolabeling의 특이성 주. ChR2에 대한 라벨링은 PIN / MGN에서 발생 등의 단말기를 식별합니다. 단말은 척추 비대칭 시냅스를 형성한다. 전자의 얼굴에 시냅스 막 전문화 (PSD)는 intramembrane 입자의 특성 클러스터를 보여줍니다 AMPA-R을 공개 5 나노 금 입자로 표지한다. (B) (15 나노 금 입자로 표지)를 ChR2 발현 축삭의 P-얼굴이 수상 돌기, 그들이 NMDA-R을 공개 5 나노 금 입자로 표지 두의 PSD를 보유 중 하나를 경계 표시됩니다. (CD)는 PIN / MGN-ITC 시냅스의 사전 및 시냅스 막의 반대면. (C) 상기 단말기의 P-얼굴 (15 nm의 금 입자로 표지) ChR2 표현 두 돌기 축, 그들 AMPA-RS (5 nm의 금 입자) 표지 두 개의 PSD를 포함하는 하나의 E-면 위에 연장된다. ( D) 두 개의 수상 돌기의 대응 P-얼굴 μ-아편 유사 수용체 (10 나노 금 입자) 표지 할 것. (EF) 점선으로 설명하는 부분 확대도. 스케일 바 :. 500 nm의 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
PIN을 / MGN-ITC 시냅스에서 AMPA-RS에 대한 Immunoparticles은 시냅스 전문 (그림 5E) 내에서 균일 한 분포를 제안, 모든 IMP 클러스터를 통해 발견되었다. 유의하게 높은 (짝 t 테스트 페이지가 <0.018) AMPA-R 라벨의 밀도는 PIN / MGN에서 관찰되었다 ITC의 등뼈에 시냅스 (715 ± 38 금 입자 / μm의 2, N = 32) ITC의 수상 돌기 위에 시냅스에 비해 (590 ± 44 금 입자 / ㎛의 2, N = 32). 전반적으로, PIN / MGN-ITC 시냅스에서 AMPA-RS의 밀도가 비교적 낮은 나타났다분산 (분산 계수, CV = 0.37) 균일 한 분포와 일치.
PIN을 / MGN-ITC 시냅스에서 NMDA-RS에 대한 Immunoparticles은 종종 불균일 시냅스 IMP 클러스터 (그림 5B) 내에 분포 관찰되었다. NMDA-R 라벨의 밀도는 (짝 t 테스트 P = 0.39) PIN / MGN은 ITC의 등뼈에 시냅스 사이에 유사했다 (1070 ± 153 금 입자 / μm의 2, N = 8)과 ITC의 수상 돌기 (812 ± 183 금 입자 / μm의 2, N = 9). AMPA-RS에 대한 관찰 내용과는 달리, PIN / MGN-ITC 시냅스에서 NMDA-RS의 밀도 (CV는 = 0.54)이 높은 변수였다.
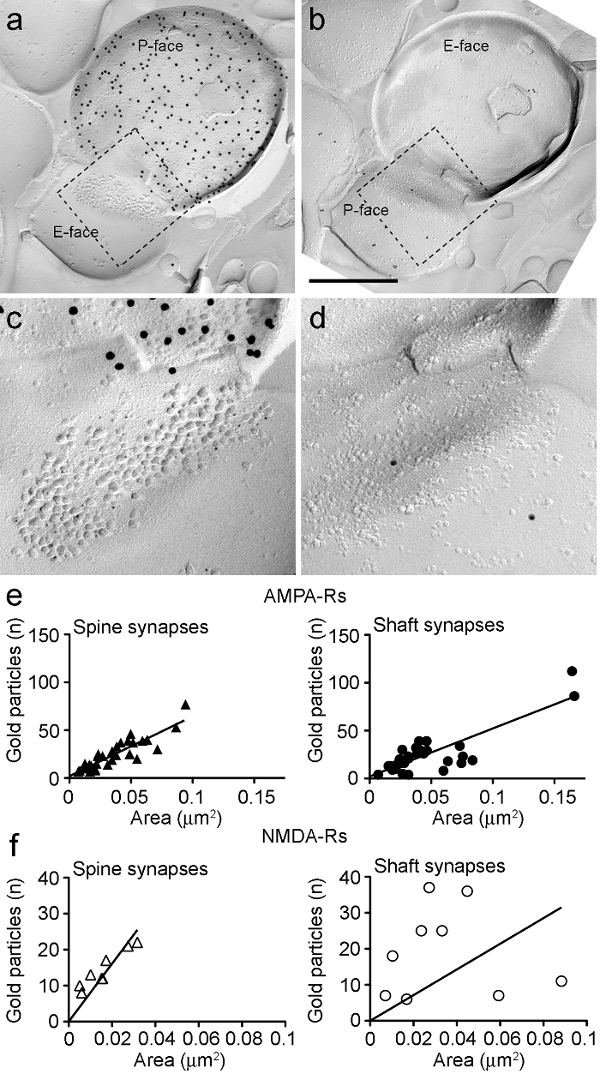
확인 된 PIN / MGN-ITC 시냅스에서 그림 6. AMPA-RS 및 NMDA-R과 Immunolabeling.
(AB)는 PIN / MGN-ITC의 사전 및 시냅스 막의 반대면단말기의 P-얼굴 ChR2을 표현하는 수지상 척추에 만들어진 시냅스는 (15 나노 금 입자로 표지) 및 수지상 척추 상에 PSD는 AMPA-RS (5 나노 금 입자) 표지 할 것. (CD)에 점선으로 설명하는 부분 확대도. 이 지역은 PSD의 더 잘 볼 수 있도록 약 45 ° 시계 반대 방향으로 회전하고있다. (E) ITC 등뼈와 돌기 시냅스 영역 대 AMPA-R 입자 수의 산점도. 두 구조에서 양의 상관 관계가 관찰되었다. (F) ITC 등뼈와 돌기 시냅스 NMDA 영역에 대해 R-입자 수의 산점도. 유의 한 양의 상관 관계 만 돌기 쪽이 검출되었다. 스케일 바 :. 500 nm의 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
때문에종종 부분적으로 시냅스 IMP 클러스터에 겹쳐 시냅스 세포막의 P-면, 우리는 시냅스의 30 %의 시냅스 영역을 추정 수 (등뼈는 : 영역을 0.032 ㎛의 제 2 범위의 의미 : 0.007 ㎛의 2 0.063로를 N = 8; 수상 돌기 : 0.047 μm의 2 범위 : 0.024 11 μm의 2 0.166로, N =). 이전 분석 telencephalic 글루타메이트 25 시냅스 이러한 유사한 범위에 있었다.
두 쪽과 수상 돌기에서, 각각의 시냅스에서 AMPA-R과 골드 immunoparticles의 수는 긍정적 인 시냅스 영역과의 상관 관계를 보였다 (스피어, 쪽 : R = 0.88, 수상 돌기 : R = 0.60, p <0.0001) (그림 6E). 하지만 수상 돌기 (R = 0.21, P = 0.29) (그림 6 층에서 : 반대로, NMDA-R과 골드 immunoparticles의 수는 쪽 (R = 0.90, P <0.002 스피어, 등뼈)의 시냅스 영역과 상관 관계가 밝혀졌다 ).
토론
동결 골절 전자 현미경은 40 년 이상 미세 구조 연구의 주요 기술하고있다. 그러나, 막의 고분자 조성물을 연구하는 유효한 수단의 결여는 그 사용에 상당한 감소를 일으켰다. 최근 인해 immunogold 라벨 (1, 2), 즉 FRIL 기술에 의해 세포막 단백질을 표시하기위한 효과적인 방법의 개발이 동결 골절 전자 현미경의 주요 부활되고있다.
FRIL 기술은 다른 immunogold 미세 방법에 비해 몇 가지 장점을 가지고있다. 첫째, 단백질은 감도를 증가 항체에 쉽게 액세스 할 수 있습니다. 둘째, 복제의 2 차원 표면 등 시냅스 막으로서 세포막 전문, 큰 부분의 노출 세리의 힘들고 시간 소모적 재구성없이 관심 분자의 공간적 분포 및 물리적 연속성의 검사를 허용알 얇은 섹션. 셋째, 세포막의 양쪽 절반의 이용은 각각의 구성에 대해 표시 할 수 단백질의 수가 제공 적합한 항체를 사용할 수를 증가시킨다. 파쇄시 분할 멤브레인의 소수성 표면은 골절 표면에 잔류 된 단백질 도메인을 구축하고 그리고 탄소, 백금으로 코팅된다. 이것은 이러한 도메인의 항원에 대한 항체의 접근을 방지 할 수 있습니다. 복제의 P-얼굴 인스턴스의 원형질 공간 대향 만 에피토프 반면 단지 항체에 의해 결합 될 수있는 공간 exoplasmic 대향 에피토프 전자 표면에 항체가 검출 될 수있다 (도 2 참조).
한편, FRIL 기법은 특정 제한이 앓고. 골절이 무작위로 발생, 특정 세포 또는 구조를 대상으로 어려울 수 있습니다. 이것은 또한 FRA의 다른 확률이 주어진, 시냅스 컬렉션, 예를 들어 샘플링 바이어스로 이어질 수 있습니다다른 곡률 (샤프트 대 예를 들어, 등뼈)와 구조의 멤브레인을 따라 cturing. 또한, 상기 두면 중 한 막 단백질의 배치를 예측할 수있다. 따라서, P-E-얼굴이나 얼굴 단백질의 분포는 특별히 정량적 연구에 신중 될 세포와 세포 외 도메인에 대한 반응성 항체를 사용하여 검사한다. 유일한 형태 적 특징에 기초 할 때 마지막으로, 시냅스 축삭 단자로서 특정 구조의 복제본의 식별이 어려울 수있다. 그러나, 마커 단백질에 대한 특이적인 항체를 사용하거나 태그 세포막 단백질 또는 추가 도구 바이러스 벡터를 제공하여 채널의 전달은 골절 막의 식별을 용이하게한다. 예를 들어,이 연구는 시냅스 날 공개 μ-오피오이드 수용체의 편도 또는 라벨에 자신의 축삭의 efferents를 식별하기 위해 시상 신경 세포에 ChR2 - YFP의 전달을 이용했다ITC 뉴런의 mbranes.
성공적 FRIL 기술을 수행하기 위해 특별한주의가 조직 정착 관한주의해야한다. 강 조직을 고정 (> 2 % 파라 포름 알데히드)를 교차 골절 고속 라벨링 감도의 감소를 초래할 수있다. 한편, 약한 고착 티슈 운반 제제 (예 : 부분 절단)을 어렵게 만든다. 이 트리밍 된 블록의 두께는 양면 테이프의 두께와 일치하는지 제어하는 것도 중요하다. 시편의 두께는 테이프보다 낮은 경우, 조직의 표면은 두 개의 금속 담체의 표면에 부착 할 수있는, 따라서 고정 된 시편을 파단되지 않는다. 조직이 두꺼운 경우 두 구리 캐리어 샌드위치이 이루어질 때, 그것은 불가피 구조적 왜곡으로 압축 될 것이다. 시험편이 파단되는 온도 (이 프로토콜에서, -115 ° C)도 중요한 역할을복제의 구조. 높은 온도는 이전 또는 증발 동안 조직의 표면에 수증기 축합 생성물로의 더 높은 레이트를 생성 할 수있다. 낮은 온도 (<-125 ° C) 골절 중 물질의 오프 분할의 위험을 증가시킬 수있다. 이 물질은 시료의 표면에 떨어지거나 연결된 숙박 할 수 있습니다. 재료의이 조각은 코팅 된 이미지에 어두운 반점을 생산 대조된다. 낮은 온도에서 파쇄도 특히 돌기 쪽이 작은 미세 구조물 간 골절의 주파수에 영향을 미칠 수있다. 복제의 제조에서 또 다른 중요한 단계는 세제 소화이다. 소화가 완료되지 않으면, 소화 조직은 TEM의 구조 분석을 교란 복제본에 어두운 패치 나타난다. 또한, 소화 조직 배경 라벨링 증가 비특이적으로 결합하는 항체 또는 트랩을 할 수있다. 세제 한편, 사용조직 소화의 자신의 2 차 및 3 차 구조를 변경 복제에 관련된 분자를 변성 수 있습니다. 따라서, 특정 항원 서서히 추가 세척 단계 SDS 농도를 희석 할 필요가있을 수도있다.
immunolabeling 들어, 이차 항체에 접합 된 금 입자의 크기가 서로 다른 가능성이 동시에 검출 할 수 있지만, 단지 성적, 심지어 시냅스 특성화와 세포막의 특정 마이크로 도메인에 여러 단백질. 그러나, 입체 장해로 정량 연구는 일반적으로 단지 하나의 분자의 검출에 한정된다. 금 입자의 크기는 또한 라벨 효능에 영향을 미칠 수있다.
FRIL에서 라벨의 해석 들어, 인해가요 복잡한 형태로 immunogold 입자는 항원 20-25 nm의 반경을 갖는 반구 내의 어딘가에 위치 할 수 있음을 명심해야한다일차 및 이차 항체 (26)에 의해 에드. 이론과 FRIL 및 관련 기술의 연습에 대한 자세한 내용은, 우리는 다른 방법 론적 기사 (27), (28)에 또한 독자를 참조하십시오.
FRIL 기술은 최근 30. 또한, AMPA-RS에 대한 FRIL 기술의 검출 감도는 하나의 기능 AMPA 하나씩 immunogold 입자 높이로 추정 다양한 시냅스 인구 29에서 글루타메이트 수용체 지역화 고해상도 정량 분석에 사용 된 -R 채널 29. 따라서,이 방법은 정량화 및 중앙 시냅스에서 AMPA-RS 및 NMDA-R과의 시냅스 표현의 패턴을 분석하기 위해 전반적으로 매우 유용합니다. 여기, 우리는 PIN / MGN-ITC 시냅스에서의 적용 가능성, 공포 조건화 동안 미국의 정보를 중계 가능성이 중요한 사이트를 보여 주었다. AMPA 수용체 아 단위의 Glu의 고도로 보존 된 세포 외 아미노산 잔기에 대해 발생하는 항체를 사용하여A1-GluA4, 우리는 시냅스 막 전문 분야에 해당하는 IMP 클러스터 내에서 금 입자의 고른 분포를 발견했다. ITC의 등뼈에서 AMPA-RS의 밀도는 PIN / MGN 시상 구 심성의 대상이 축 시냅스에 비해 유의하게 높았다. 모두 척추와 샤프트 시냅스에서 AMPA-RS에 대한 표시와 시냅스 영역 사이에 양의 상관 관계는 다른 글루타메이트 성 시냅스 (25)에 공통 기능을 검출 하였다. PIN / MGN-ITC 시냅스에서 AMPA-RS의 밀도가 낮은 분산은 대뇌 피질의 시냅스 (25)에서 시상 efferents (7)에 의해 형성된 다른 시냅스와 유사하지만 서로 다른 균일 한 분포를 나타냅니다. 반대로, NMDA-RS의 밀도보다 변수이고 AMPA-RS는 상이한 규제 건의 척추 축 시냅스 차이가 없었다. 미래에, FRIL 기법의 재현성는 중심 시냅스 기저 고분자 조성물을 평가하는 것을 허용하지 않지만 (C)의 검출을 용이하게 할 수있다공포 학습 후 이온 성 글루타메이트 수용체의 숫자와 subsynaptic 분포 hanges, 이러한 입력의 사전 및 시냅스 속성의 전 생체 내 녹음을 보완.
입력의 기원과 시냅스 후 소자의 특성 및 조성 disentangling 것은 중요하지만, 문제가되는 결론적으로,이 방법은 많은 다른 신경 회로에 입력 특정 흥분성 시냅스의 구조 - 기능 관계에 대한 통찰력을 얻기 위해 다른 연구자들에 의해 사용될 수있는 .
공개
The authors declare that they have no competing financial interests.
감사의 말
Funding was provided by the Austrian Science Fund FWF grant No. P-22969-B11 to F. Ferraguti, and by the Charitable Hertie Foundation and the Werner Reichardt Centre for Integrative Neuroscience and by the DFG (CIN-Exc. 307) to I. Ehrlich.
자료
| Name | Company | Catalog Number | Comments |
| Surgery | |||
| Stereotactic frame | Stoelting, USA | 51670 | can be replaced by other stereotactic frame for mice |
| Stereotactic frame mouse adaptor | Stoelting, USA | 51625 | |
| Gas anesthesia mask for mice | Stoelting, USA | 50264 | no longer available, replaced by item no. 51609M |
| Pressure injection device, Toohey Spritzer | Toohey Company, USA | T25-2-900 | other pressure injection devices (e.g. Picospritzer) can be used |
| Kwik Fill glass capillaries | World Precision Instruments, Germany | 1B150F-4 | |
| Anesthesia machine, IsoFlo | Eickemeyer, Germany | 213261 | |
| DC Temperature Controler and heating pad | FHC, USA | 40-90-8D | |
| Horizontal Micropipette Puller Model P-1000 | Sutter Instruments, USA | P-1000 | |
| Surgical tool sterilizer, Sterilizator 75 | Melag, Germany | 08754200 | |
| rAAV-hSyn-ChR2(H134R)-eYFP (serotype 2/9) | Penn Vector Core, USA | AV-9-26973P | |
| fast green | Roth, Germany | 0301.1 | |
| Isoflurane Anesthetic, Isofuran CP (1 ml/ml) | CP Pharma, Germany | ||
| Antiseptic, Betadine (providone-iodine) | Purdure Products, USA | BSOL32 | can be replaced by other disinfectants |
| Analgesic, Metacam Solution (5 mg/ml meloxicam) | Boehringer Ingelheim, Germany | can be replaced by other analgesics | |
| Bepanthen eye ointment | Bayer, Germany | 0191 | can be replaced by other eye ointments |
| Drill NM3000 (SNKG1341 and SNIH1681) | Nouvag, Switzerland | ||
| Sutranox Suture Needle | Fine Science Tools, Germany | 12050-01 | |
| Braided Silk Suture | Fine Science Tools, Germany | 18020-60 | |
| Name | Company | Catalog Number | Comments |
| Tissue preparation | |||
| Paraformaldehyde EM grade | Agar Scientific Ltd., United Kingdom | AGR1018 | |
| Saturated picric acid solution | Sigma-Aldrich, USA | P6744-1GA | |
| Na2HPO4-2H20 | Merck Millipore, Germany | 1065860500 | |
| NaH2PO4-2H2O | Merck Millipore, Germany | 1063451000 | |
| NaCl | Merck Millipore, Germany | 1064041000 | |
| 4N NaOH | Carl Roth, Germany | T198.1 | |
| Thiopental | Sandoz, Austria | 5,133 | |
| Glycerol | Sigma-Aldrich, USA | G5516-500ML | |
| GenPure ultrapure water system | Thermo Fisher Scientific, USA | 50131235 | |
| Peristaltic pump | ISMATEC, Germany | ISM 930C | |
| Filter Paper | MACHEREY-NAGEL, Germany | MN 615 1/4 | |
| Vibroslicer, VT1000S | Leica Microsystems, Austria | ||
| Ophthalmic scalpel | Alcon Laboratories, USA | can be replaced by other ophthalmic scalpels | |
| Perfusion cannula | Vieweg, Germany | F560088-1 | can be replaced by similar items from other companies |
| Name | Company | Catalog Number | Comments |
| High-pressure Freezing | |||
| Copper carriers | Engineering Office M. Wohlwend, CH | 528 | |
| Sidol Polish | Henkel, Germany | can be replaced by same item from other companies | |
| Chamois skin | Household supply store | ||
| Hole punch, 1,5mm | Stubai, Austria | can be replaced by same item from other companies | |
| Denatured ethanol | Donauchem, Austria | can be replaced by same item from other companies | |
| Acetone | Roth, Germany | 9372.5 | CAUTION! |
| High Pressure Freezing Machine HPM 010 | BalTec, CH; now Leica Microsystems | HPM010 | not produced any more, substituted by LeicaEM HPM100 |
| Stereo-microscope | Olympus, Japan | SZX10 | |
| Liquid nitrogen | CAUTION! | ||
| Cryo-vials | Roth, Germany | E309.1 | can be replaced by same item from other companies |
| CryoCane | Nalge Nunc International,USA | 5015-0001 | can be replaced by same item from other companies |
| CryoSleeve | Nalge Nunc International,USA | 5016-0001 | can be replaced by same item from other companies |
| Liquid nitrogen storage vessel | Cryopal, France | GT38 | can be replaced by same item from other companies |
| Non-ionic detergent (Lavocid) | Werner & Mertz Professional, Germany | ||
| Name | Company | Catalog Number | Comments |
| Freeze-fracture and Replication | |||
| Sandblaster, Mikromat 200-1 | JOKE Joisten & Kettenbaum, Germany | SANDURET 2-K | can be replaced by same item from other companies |
| Siliciumcarbid SIC 360, grain size 25 - 21µ | JOKE Joisten & Kettenbaum, Germany | 955932 | |
| Freeze Fracture System BAF 060 | BalTec, CH; now Leica Microsystems | BAF060 | |
| Ceramic 12 well plate | Gröpel, Austria | 14511 | can be replaced by same item from other companies |
| Trizma base | SIGMA, USA | T1503 | can be replaced by same item from other companies |
| Trizma hydrochloride | SIGMA, USA | T3253 | can be replaced by same item from other companies |
| Sodium chloride | Merck, Germany | 1,064,041,000 | can be replaced by same item from other companies |
| SDS, Sodium lauryl sulfate | Roth, Germany | 5136.1 | CAUTION! ; can be replaced by same item from other companies |
| Sucrose | Merck, Germany | 1,076,871,000 | can be replaced by same item from other companies |
| TRIS | Roth, Germany | 5429.3 | can be replaced by same item from other companies |
| Universal Hybridization Oven | Binder, Germany | 7001-0050 | can be replaced by same item from other companies |
| Name | Company | Catalog Number | Comments |
| Immunolabelling | |||
| BSA | SIGMA, USA | A9647 | can be replaced by same item from other companies |
| Anti-GFP Antibody | Molecular Probes, USA | A11122 | |
| Anti-pan-AMPAR Antibody | Frontier Institute, Japan | pan AMPAR-GP-Af580-1 | |
| Anti-NMDAR1 Antibody, clone 54.1 | Merck Millipore, Germany | MAB363 | |
| Opioid Receptor-Mu (MOR) Antibody | ImmunoStar, USA | 24216 | |
| EM goat anti-guinea pig, 5 nm; secondary antibody | BBInternational, UK | EM.GAG5 | |
| EM goat anti-rabbit, 15 nm; secondary antibody | BBInternational, UK | EM.GAR15 | |
| Donkey anti-rabbit, 10nm, secondary antibody | AURION, Netherlands | DAR 10nm | |
| Copper grids, 100 Parallel Bar | Agar scientific, UK | G2012C | |
| Incubator | Major Science, USA | MO-RC | can be replaced by same item from other companies |
| Pioloform Powder | Agar scientific, UK | R1275 | |
| Chloroform | Roth, Germany | 3313.1 | CAUTION! ; can be replaced by same item from other companies |
| Name | Company | Catalog Number | Comments |
| EM analysis | |||
| Philips CM120 TEM | Philips/FEI | ||
| Morada CCD camera | Soft Imaging Systems, Germany | ||
| iTEM Ver. 5.2, imaging software | Soft Imaging Systems, Germany |
참고문헌
- Fujimoto, K. SDS-digested freeze-fracture replica labeling electron microscopy to study the two-dimensional distribution of integral membrane proteins and phospholipids in biomembranes: practical procedure, interpretation and application. Histochem Cell Biol. 107 (2), 87-96 (1997).
- Masugi-Tokita, M., Shigemoto, R. High-resolution quantitative visualization of glutamate and GABA receptors at central synapses. Curr Opin Neurobiol. 17 (3), 387-393 (2007).
- Rash, J. E., Yasumura, T. Direct immunogold labeling of connexins and aquaporin-4 in freeze-fracture replicas of liver, brain, and spinal cord: factors limiting quantitative analysis. Cell Tissue Res. 296 (2), 307-321 (1999).
- Emes, R. D., Grant, S. G. Evolution of synapse complexity and diversity. Annu Rev Neurosci. 35, 111-131 (2012).
- Matsuzaki, M., et al. Dendritic spine geometry is critical for AMPA receptor expression in hippocampal CA1 pyramidal neurons. Nat Neurosci. 4 (11), 1086-1092 (2001).
- Rollenhagen, A., Lübke, J. H. The morphology of excitatory central synapses: from structure to function. Cell Tissue Res. 326 (2), 221-237 (2006).
- Tarusawa, E., et al. Input-specific intrasynaptic arrangements of ionotropic glutamate receptors and their impact on postsynaptic responses. J Neurosci. 29 (41), 12896-12908 (2009).
- Nusser, Z., et al. Cell type and pathway dependence of synaptic AMPA receptor number and variability in the hippocampus. Neuron. 21 (3), 545-559 (1998).
- Nyìri, G., Stephenson, F. A., Freund, T. F., Somogyi, P. Large variability in synaptic N-methyl-D-aspartate receptor density on interneurons and a comparison with pyramidal-cell spines in the rat hippocampus. Neuroscience. 119 (2), 347-363 (2003).
- Nicholson, D. A., Geinisman, Y. Axospinous synaptic subtype-specific differences in structure, size, ionotropic receptor expression, and connectivity in apical dendritic regions of rat hippocampal CA1 pyramidal neurons. J Comp Neurol. 512 (3), 399-418 (2009).
- Millhouse, O. E. The intercalated cells of the amygdala. J Comp Neurol. 247 (2), 246-271 (1986).
- Busti, D., et al. Different fear states engage distinct networks within the intercalated cell clusters of the amygdala. J Neurosci. 31 (13), 5131-5144 (2011).
- Amano, T., Unal, C. T., Paré, D. Synaptic correlates of fear extinction in the amygdala. Nat Neurosci. 13 (4), 489-494 (2010).
- Duvarci, S., Pare, D. Amygdala microcircuits controlling learned fear. Neuron. 82 (5), 966-980 (2014).
- Jüngling, K., et al. Neuropeptide S-mediated control of fear expression and extinction: role of intercalated GABAergic neurons in the amygdala. Neuron. 59 (2), 298-310 (2008).
- Asede, D., Bosch, D., Lüthi, A., Ferraguti, F., Ehrlich, I. Sensory inputs to intercalated cells provide fear-learning modulated inhibition to the basolateral amygdala. Neuron. 86 (2), 541-554 (2015).
- Maren, S. Neurobiology of Pavlovian fear conditioning. Annu Rev Neurosci. 24, 897-931 (2001).
- Pape, H. C., Pare, D. Plastic synaptic networks of the amygdala for the acquisition, expression, and extinction of conditioned fear. Physiol Rev. 90 (2), 419-463 (2010).
- Sigurdsson, T., et al. Long-term potentiation in the amygdala: a cellular mechanism of fear learning and memory. Neuropharmacology. 52 (1), 215-227 (2007).
- Bosch, D., Asede, D., Ehrlich, I. Ex-vivo optogenetic dissection of fear circuits in brain slices. J. Vis. Exp. (110), e53628 (2016).
- Fenno, L., Yizhar, O., Deisseroth, K. The development and application of optogenetics. Annu Rev Neurosci. 34, 389-412 (2011).
- Bienvenu, T. C. M., et al. Large intercalated neurons of amygdala relay noxious sensory information. J. Neurosci. 35 (5), 2044-2057 (2015).
- Sandri, C., Akert, K., Livingston, R. B., Moor, H. Particle aggregations at specialized sites in freeze-etched postsynaptic membranes. Brain Res. 41 (1), 1-16 (1972).
- Likhtik, E., Popa, D., Apergis-Schoute, J., Fidacaro, G. A., Paré, D. Amygdala intercalated neurons are required for expression of fear extinction. Nature. 454 (7204), 642-645 (2008).
- Fukazawa, Y., Shigemoto, R. Intra-synapse-type and inter-synapse-type relationships between synaptic size and AMPAR expression. Curr Opin Neurobiol. 22 (3), 446-452 (2012).
- Amiry-Moghaddam, M., Ottersen, O. P. Immunogold cytochemistry in neuroscience. Nat Neurosci. 16 (7), 798-804 (2013).
- Fukazawa, Y., Masugi-Tokita, M., Tarusawa, E., Hagiwara, A., Shigemoto, R., Cavalier, A., et al. SDS-digested Freeze-fracture replica labelling (SDS-FRL). Handbook of Cryo-Preparation Methods for Electron Microscopy. , 567-586 (2007).
- Severs, N. J. Freeze-fracture electron microscopy. Nat Protoc. 2 (3), 547-576 (2007).
- Tanaka, J., et al. Number and density of AMPA receptors in single synapses in immature cerebellum. J Neurosci. 25 (4), 799-807 (2005).
- Mansouri, M., et al. Distinct subsynaptic localization of type 1 metabotropic glutamate receptors at glutamatergic and GABAergic synapses in the rodent cerebellar cortex. Eur J Neurosci. 41 (2), 157-167 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유