Method Article
Isolamento de CD 90+ fibroblastos / miofibroblastos de humanos congelados gastrointestinais Amostras
Neste Artigo
Resumo
Here, a protocol to isolate and establish primary fibroblast/myofibroblast (MF) cultures from frozen gastric, small intestinal, and colonic tissue-yielding cells with a MF phenotype-is presented. These cells express CD90, α-SMA and vimentin. MFs can be used for a variety of functional assays including enzymatic activity and cytokine production.
Resumo
Fibroblastos / miofibroblastos (MFS) têm vindo a ganhar cada vez mais atenção para o seu papel na patogênese e suas contribuições para ambos cicatrização de feridas e promoção do microambiente do tumor. Embora não existam actualmente muitas técnicas para o isolamento de CM (GI) de tecidos gastrointestinais, este protocolo introduz um novo elemento de isolamento destas células estromais de tecido congelado. Congelamento amostras de tecido GI não só permite que o pesquisador para adquirir amostras de colaboradores em todo o mundo, biobancos, e vendedores comerciais, ele também permite o tratamento tardio de amostras frescas. O protocolo descrito consistentemente produzir células fusiformes característicos com o fenótipo MF que expressam os marcadores CD90, α-SMA e vimentina. À medida que estas células são derivadas a partir de amostras de doentes, a utilização de células primárias também confere a vantagem de que imitam de perto MFs de estados de doença, ou seja o cancro e doenças inflamatórias do intestino. Esta técnica tem a abelhan validado em gástrica, intestino delgado e do cólon MF geração cultura primária. MF culturas primárias podem ser utilizados em uma vasta gama de ensaios ao longo de um número de passagem e a sua pureza avaliada por ambos imunocitoquímica e análise de citometria de fluxo.
Introdução
Miofibroblastos / fibroblastos (MFS) representam uma população abundante de células em gastrointestinal (GI) mucosa. Estas células estromais estão localizados logo abaixo do epitélio e formar uma rede interligada dentro da lâmina própria da mucosa no intestino. MFs não são apenas responsáveis pela deposição da matriz extracelular, mas através da regulação parácrina podem influenciar o transporte de electrólito, restituição e a função de barreira do epitélio adjacente 1, 2. Além disso, CM ter sido mostrado desempenhar um papel chave na inflamação e tecidos remodelação 3, 4. Miofibroblastos são uma parte crítica do microambiente do tumor, onde também são conhecidas como fibroblastos associados ao câncer, e contribuir para o crescimento de células tumorais e servir como um nicho de células-tronco do câncer 3. Dados emergentes sugerem que os CM também pode servir como células apresentadoras de antígenos locais. Além disso, a função MFs como reguladores importantes de respostas imune inata e adaptativa, producing uma variedade de citocinas e factores de crescimento 5.
Em indivíduos saudáveis, as células MFS são acreditados para diferenciar a partir de células-tronco mesenquimais e expressam na sua superfície celular, o marcador mesenquimal, CD90 3, 5. Estas células também são positivas para vimentina, mas negativo para epitelial e marcador de células hematopoiéticas, EpCAM e CD45 , respectivamente. Os miofibroblastos são sugeridos como sendo uma forma activada de fibroblastos e podem ser distinguidas a partir de fibroblastos não-activado pela expressão de α-SMA 5.
Ao longo da última década, várias abordagens para o isolamento de miofibroblastos da mucosa do cólon humano foram publicadas-principalmente com base no método originalmente descrito por Mahida et al. 5-8. Enquanto os estudos individuais relatar os procedimentos de isolamento a partir de vários mucosa intestinal, nenhum protocolo universal para o isolamento de CM a partir de várias áreas do tracto GI (por exemplo, úlcera gástrica, pequena e Lmucosa intestinal arge) foi publicada. O protocolo aqui apresentado foi testado e utilizado com êxito para todos os três tipos de tecido acima mencionados. . Além disso, não foram relatados os procedimentos para isolar MFs de mucosa GI congelados.
Aqui, apresenta-se um método aperfeiçoado, que se baseia na digestão enzimática, e ao mesmo tempo permite o isolamento da mucosa do intestino humano MFs para cultura e análise de citometria de fluxo em recém-digeridos, unicelulares, preparações mucosas. Esta técnica produz culturas primárias de forma fiável com um fenótipo MF. Além disso, os mesmos métodos podem ser utilizados para isolar MFs de amostras congeladas de tecidos intestinais gástricas e pequenas bem. Isolamento de miofibroblastos de tecido GI fresco foi previamente descrito; No entanto, a utilização de amostras congeladas apresenta muitas vantagens. Ou seja, os pesquisadores seriam capazes de coletar e armazenar tecidos de qualquer número de colaboradores em todo o mundo que têm a capabilidade para enviar amostras de tecidos congelados. Além disso, os pesquisadores podem encontrar a coleção de tecido descartado da sala de cirurgia e / ou do conjunto de endoscopia e imediato processamento do tecido para o isolamento de conflito com a sua programação experimentação atual. Além disso, devido à natureza imprevisível da cirurgia, recolha de tecidos pode ocorrer muito tarde no dia, o que irá limitar o tempo que resta para o tecido processamento. Congelamento de tecido para posterior processamento irá melhorar esses desafios.
Por fim, estes métodos têm sido utilizados com sucesso no isolamento de miofibroblastos intestinais do cólon, gástrico e pequenas em estados de doença tais como carcinoma colorrectal e doenças inflamatórias do intestino.
Protocolo
O protocolo para a obtenção de tecidos humanos descartados de pacientes cirúrgicos e o estabelecimento de culturas primárias foi aprovado pela University of Texas Medical Branch e University of New Mexico Institutional Review Boards. Os requisitos gerais para a aquisição de amostras de tecidos humanos é descrito abaixo. Note-se que desde MFs pode ser isolado a partir de tecido congelado, biobanks e vendedores comerciais são também opções.
1. Obtenha Human Tissue
- Enviar um protocolo para obtenção de tecido do cólon humano para o conselho de revisão institucional para aprovação.
- Estabelecer colaborações com cirurgiões gerais e / ou cirurgiões colorretais, a fim de obter tecidos humanos para pesquisa. A colaboração com o departamento de patologia também é obrigatória, já que serão determinação do tecido que não é necessária para o diagnóstico e pode ser designado para a investigação.
- Aconselhar o patologista para fornecer tecido do tumor e, em seguida, Grosslmucosa normal Y, pelo menos, 5 cm do tumor. Coloque imediatamente as amostras em meios de lavagem gelada e colocar no gelo. O patologista irá determinar a quantidade de tecido que pode ser dada de forma segura para a investigação. O tecido mínima necessária para isolamento MF é de 1,5 mm 2.
- Utilizar o tecido obtido quer imediatamente, para estabelecer as culturas primárias ou congelar e entre -80 ° C para futuro isolamento.
- Se congelação para o isolamento posterior, cortar o tecido em cerca de 1 - 2 mm 2 peças, colocar num tubo criogénico com 1 ml de meio de congelamento (ver abaixo), e armazenar a -80 ° C. Nota: Utilizando este protocolo, foi observado o isolamento bem sucedido de CM a partir de tecido congelado por mais de 4 anos.
2. Prepare Reagentes
- Para a solução de colagenase: a preparação de 100 U / ml de colagenase I, II e IV em solução salina equilibrada de Hank (HBSS) com Ca2 + / Mg2 + (ver Tabela Materiais ). CUIDADO: colagenase concentração unidade activa e pureza pode varia de fabricante para fabricante, o que pode impedir a eficiência da digestão do tecido e / ou preservação do epítopo na superfície da célula da mucosa. Para evitar que esses potenciais armadilhas, use colagenase com alto grau de pureza (≥95%) e preparar a solução estoque com base na concentração unidades ativa.
- Preparar a solução estoque DNase à base de água em 10 mg / ml (3,55 UA / mg).
- Prepare media Wash: (MEM: 89 ml, antibiótico-antimicótico, 100x: 1 ml; FCS inativado pelo calor: 10 ml)
- Prepare crescimento de fibroblastos mídia: MEM: 500 ml garrafa; L-glutamina (200 mM): 5 ml; MEM não essenciais aminoácidos, 100x solução: 5 ml; Ciprofloxacina HCl (10 mg / ml): 570 l; O antibiótico-antimicótico, 100x solução: 10 ml; piruvato de sódio (100 mM): 5 ml; FCS inactivado pelo calor: 50 ml
- Prepare meio de congelamento: meios de crescimento de fibroblastos (Reagente de 2,4) com a adição de 10% de dimetilsulfóxido (DMSO), em seguida, filtrar-sterilize com um filtro de 0,22 um.
Tissue 3. Enzimaticamente Digest Humano
- Se o tecido foi congelado no meio de congelamento, em lugar cryovial (~ 37 ° C) água morna até que o tecido é descongelado e meios de comunicação.
- Para 4 - 5 de 2 mm, 2 peças de tecido, tecido lavar duas vezes com 10 ml de HBSS sem Ca2 + / Mg2 +.
- Uma vez que o tecido tenha resolvido pela gravidade, descartar cuidadosamente o sobrenadante sem fiação amostra.
- Adicionar 10 ml da solução de colagenase para a amostra e transferir a mistura tecido-solução para um tubo de DNase / RNase estéril com built-in rotores para amostra dissociação. Use colagenase a dissociar-se da matriz extracelular que rodeia o aspecto basal das células epiteliais e constitui a fracção não-celular da própria lâmina da mucosa.
- Feche bem tubo e anexá-lo de cabeça para baixo na luva do Dissociator (por exemplo, gentleMACS). Se o laboratório não tem o acesso a tele equipamento acima mencionado, aumentar o tempo de cada passo de digestão para se obter resultados comparáveis.
- Execute o Programa h_tumor_01, um perfil pré-definido fornecido com a máquina (duração total de 36 seg, com pulsos intermitentes que variam de 1.000 - 4.000 rpm, com 268 voltas por corrida).
- Após o término do programa, retire tubo do Dissociator.
- Incubar amostra durante 45 min a 37 ° C sob rotação contínua num agitador a 140 rpm. Nota: Para quantidades variadas de amostras de tecido, o tempo de digestão pode ser proporcionalmente reduzida ou aumentada (isto é, maiores quantidades de tecido pode necessitar de mais tempo).
- Aplica o tubo de cabeça para baixo na luva do Dissociator.
- Escolha e executar o Programa h_tumor_02 (duração total de 37 seg, com pulsos intermitentes que variam de 1.000 - 4.000 rpm, com 235 voltas por corrida).
- Após o término do programa, retire tubo do Dissociator.
- Adicionar 50 ul de solução de ADNase Estoque. Use DNAse dissociar / remover as células mortas e fração de DNA de restos celulares que leva a célula a aglutinação.
- Incubar amostra durante 30 min a 37 ° C sob rotação contínua num agitador a 60 rpm.
- Aplica o tubo de cabeça para baixo na luva do Dissociator novamente.
- Escolha e executar o Programa h_tumor_03 (duração total de 37 seg, com pulsos intermitentes que variam de 1.000 - 4.000 rpm, com 168 voltas por corrida).
Nota: Se o tecido não é completamente digerido, centrifugar a 250 x g durante 10 min a 20 ° C, descartar o sobrenadante, ressuspender em 2 ml de solução de dissociação de células e incubar a temperatura ambiente durante 10 min. - Passe a suspensão de células através de estéril 70 um filtro de células.
- Centrifuga-se a suspensão de células a 250 x g durante 10 min a 20 ° C. Aspirar o sobrenadante completamente.
- Lavar sedimento celular duas vezes com 25 ml de HBSS sem Ca2 + / Mg2 + e desprezar o sobrenadante.
- Antes da última erah, a contagem do número de células usando um sistema de contagem de células automatizado disponível no laboratório ou manualmente usando hemocitômetro. Para MF geração cultura primária prosseguir para a etapa 3.19.1, para a análise ou classificação da MFS por citometria de fluxo prosseguir para a etapa 3.19.2.
- Para o isolamento e o crescimento da cultura MF puro (Figura 1), descartar o sobrenadante da última centrifugação, sedimento de células ressuspender em a quantidade apropriada de meios de isolamento de fibroblastos necessária para semear até 4 x 10 6 células em 3 ml do meio por poço em 6 pratos bem, tratados com cultura de células. Prossiga para a etapa 3.20.
- Para a análise ou classificação da MFS por citometria de fluxo, coloque até 2 x 10 6 em 2 ml de meios de isolamento de fibroblastos em 24 poços, placa baixa de ligação e incubar O / N a 37 ° C com 5% de CO 2. Isto é para restaurar os epítopos de superfície celular que podem ser afectadas pelo processo enzimático. Em seguida, recolher suspensão de células e contagem de células recuperado e prossigapara a imunocoloração e citometria de fluxo análise 8.
- Crescer as células a 37 ° C com 5% de CO 2. Mudar meios cada 2 - 3 dias até formação de ~ 80% confluentes MF monocamada (Figura 1D-E).
- Células passagem em frascos T25 com placa de 6 poços, com a relação 1: 1 e crescer durante ~ 10 - 14 dias em meio de crescimento de fibroblasto para atingir 80 - 100% de confluência.
- Expandir cultura por passagem de células de T25 a T75 com células proporção de 1: 2. Uma vez que as células atingem a confluência, utilizar um frasco para análise de pureza MF isolado utilizando por citometria de fluxo como descrito anteriormente 5. Congelar ou passagem outro frasco T75 da cultura MF na proporção de 1: 3.
Nota: Quando analisados por citometria de fluxo, espera-se que GI mucosa estromal MF de origem mesenquimal, quando crescendo em cultura terão seguinte fenótipo: EpCAM-, CD31-, CD45-, vimentina +, α-SMA +, CD90 +.
Resultados
Usando este protocolo digestão enzimática, que têm sido consistentemente capaz de isolar e cultivar células CD90 + do estroma da mucosa intestinal de MF população GI espécimes cirúrgicos e de biópsias (Figura 1). Visível MF proliferação de colónias pode ser observado no dia 2 - 5 após a sementeira de células mononucleares em suspensões placas de 6 cavidades (Figura 1A-B). As culturas primárias MF chegar ~ 50-70% de confluência por dia 7-11 (Figura 1C-D).
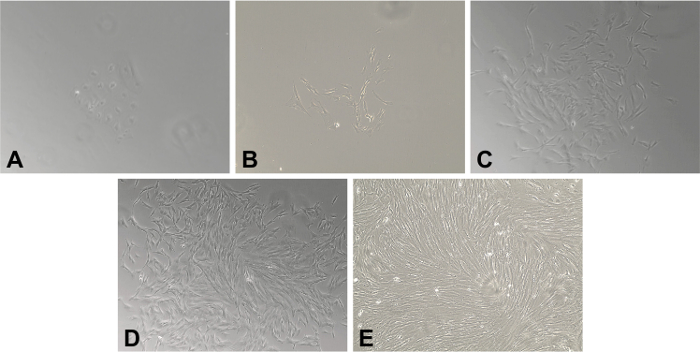
Figura 1. Principais Miofibroblastos (MFS) isoladas de tecido congelado Gastrointestinal. A ampliação 20X de MFs humano isolado em amostras congeladas de mucosa do cólon humana. (A) Dia 2. agrupamentos aderentes de células estromais estão presentes. (B) Dias 4. O spindle- característica ou stellate-a morfologia das células foi desenvolvido e é facilmente aparente. A densidade de fibroblastos continuam a aumentar em (C) Dia 7 e (D) Dia 10. (E) ao dia 14, há uma monocamada confluente de MFs completamente. Por favor clique aqui para ver uma versão maior desta figura.
Há um ligeiro decréscimo na viabilidade da preparação de células da mucosa único sobre o congelamento de espécimes cirúrgicos (~ 10%, Tabela 1). No entanto, com congelação, também há um decréscimo na contaminação bacteriana / fúngica do tecido observada e, consequentemente, um aumento na eficiência da geração de cultura MF.
| Fonte de GI mucosas Miofibroblastos | * Viabilidade da mucosa preparação única suspensão de células (n = 11) | MF Isolamento Eficiência (n = 11) |
| Fresco | 88,32 ± 2,369 | 8 dos 11 (82%) |
| Congeladas | 78,64 ± 4,174 | 11 de 11 (100%) |
| * Viabilidade como determinado por contador de células automatizado seguinte tripano a 0,4% solução de coloração azul. | ||
Tabela 1. Viabilidade e Eficiência de recuperação de miofibroblastos. Fresca vs congeladas tecidos.
A pureza da cultura MF gerado foi analisado após as células foram propagadas em, pelo menos, duas passagens, a fim de assegurar a ausência de contaminação por outras células de mucosas. Usando a microscopia confocal, demonstrou-se que os CM eram positivas para o marcador da linhagem de células mesenquimatosas CD90 e vimentina, e ALSO α-SMA, um marcador das células mesenquimais diferenciadas (Figura 2).
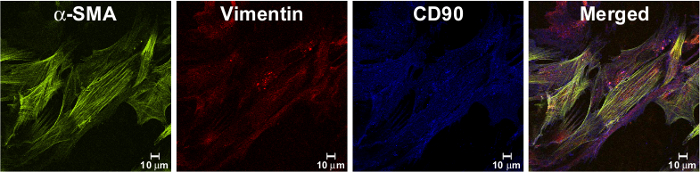
Figura 2. Isolado células têm Fibroblast Forma e expressar MF marcadores. Immunostaining de isolado MF monocamada, passadas pelo menos duas vezes em cultura foram fixadas com paraformaldeído 1%, imunocorados e analisados por microscopia confocal, como descrito anteriormente 9. As células isoladas expressaram o marcador de miofibroblastos, a-SMA (no verde, tal como detectado pelo mAb murino clone 1A4), e marcadores mesenquimais: vimentina (de vermelho, tal como detectado pelo mAb, clone RV202) e CD90 (em azul, tal como detectado pela mAb murino, clone 5E10). Na imagem resultante da fusão, laranja / células amarelas representam co-localização da a-SMA e vimentina; roxo representa co-localização de vimentina e CD90. Fundamentos e clique aqui para ver uma versão maior desta figura.
Este dado foi confirmado por análise de citometria de fluxo (Figura 3). Como relatado anteriormente, os CM normais isolados a partir de mucosa GI, também foram negativos para os fabricantes de hematopoiéticas CD45 e CD31, assim como marcador epitelial, EpCAM 3, 5, 9.

Figura 3. Caracterização fenotípica dos miofibroblastos primária (MF) Culturas. Os estudos foram realizados em MFs primárias isoladas a partir de mucosa do cólon e passadas, pelo menos, duas vezes em cultura. Immunostaining, seguido por análise de citometria de fluxo, confirmaram que as células isoladas têm MF fenótipo são uniformemente positivos para vimentina, α-SMA, e CD90. Controlos isotípicos apropriadas foram incluídos no estudo."target =" _ blank arge.jpg "> Clique aqui para ver uma versão maior desta figura.
Discussão
Embora este protocolo foi desenvolvido para a aplicação de investigação única, à luz da cada vez maior importância crítica de células estromais como um cancro de biomarcadores potenciais prognósticos e alvo terapêutico, a capacidade de congelar biospecimens "funcionais" para uso posterior oferece uma vantagem significativa. Isto representa uma vantagem única para a criação de biorrepositório clínico, que pode servir como ferramentas adicionais servindo para fazer avançar o desenvolvimento da medicina personalizada 10, 11. Semelhante aos resultados reportados anteriormente para as células-tronco mesenquimais derivadas de tecido adiposo isoladas de fração vascular estromal congelado, fizemos não observaram quaisquer alterações significativas nos marcadores e respostas proliferativas / imunes / inflamatórios e atividade metabólica da MFS isolado a partir de amostras de mucosa congelados. 12 No entanto, não se exclui que algumas das respostas não-testados, tais como marcador depósito extracelular, etc. podem variar . Assim, nos casos de se trabalhar com desconhecido / unreeventos portados, os investigadores podem definir-se uma experiência de comparação na qual a função particular será testado lado a lado em MFs isolado a partir de tecido do mesmo indivíduo e congelado fresco.
A maioria das técnicas de métodos de isolamento de miofibroblastos são baseados tanto no uso de picagem mecânica do tecido combinado com o tratamento quer com agentes quelantes [ácido etilenodiaminotetracético (EDTA), DL-ditiotreitol (DTT)] ou enzimas proteoliticas e colagenolíticas 13-14 . Foi relatado anteriormente que a geração de MF de estômago, intestino delgado e cólon era eficiente usando o método excrescência inicialmente descrito por Mahida et ai, que se baseia na picagem mecânico e de aplicação dos agentes quelantes 5, 6. Aqui, um enzimática adicional método que permite a geração de culturas primárias de MFS de amostras de tecido congelado é relatado. Embora ambas as técnicas de crescimento e digestão enzimática são-igualmente eficazes no isolamento de myofibroblasts primárias de gástrica, intestino delgado, e tecido do cólon, ainda há debate dentro da comunidade científica sobre se as células cultivadas in vivo preservar o seu fenótipo. A técnica relatada neste manuscrito permite não só a geração de cultura MF primário, mas também permite que ex vivo análise de populações de células diferentes, apresentados em GI mucosa 15-17. Isto inclui determinar a sua abundância relativa com o tecido e os marcadores que expressam, mas também para uso em ensaios funcionais (por exemplo, actividade enzimática ou produção de citocina). Abundância relativa de CM no interior do tecido pode ser avaliada usando FACS, classificando as células com base em marcadores únicos aos CM (ou seja, EpCAM-, CD31-, CD45-, vimentina +, α-SMA +, CD90 +) e quantificar a sua presença, quando comparada com um total de todas as células isoladas de fresco ou, se necessário, fazendo relação comparativa com tipos de células distintas. Apesar da eficáciade isolamento de células viáveis, uma limitação notável deste e outros protocolos baseada na digestão enzimática é que a actividade proteolítica da enzima empregue pode alterar epítopos de superfície celular. Para ultrapassar esta situação, que permitem que as células para recuperar S / N, a fim de epítopos a serem re-expresso de forma semelhante ao seu estado pré-digeridas.
Temos sido capazes de gerar consistentemente cultura MF de tecido congelado com mínima perda de viabilidade celular. A capacidade de recuperar essas culturas a partir de amostra congelada permite que os pesquisadores para manipular e melhor preservar amostras de tecidos cirúrgicos e / ou endoscópicos obtidos durante a noite ou fora de horas de trabalho regulares. Além disso, a redução na perda de adquiridos, tecido utilizável devido aos contaminantes bacterianos e / ou de fungos durante o processo de congelação serve como uma vantagem adicional. Na sequência do isolamento, o uso de antibióticos deve limitar-se apenas os primeiros 2 - 3 passagens, após o que a cultura deve continuar usando asepti padrãoc técnica e anti-micótica meio sem agente / anti-micoplasma. O uso rotineiro destes agentes em cultura celular tem sido demonstrado exercer efeitos citotóxicos, ou seja, crescimento de células, degeneração celular e, ocasionalmente, em morte 18.
A digestão enzimática irá produzir múltiplas populações de células presentes no GI própria lâmina, incluindo: as células imunes, células epiteliais, e MFs. Após a primeira passagem, única MFs permanecerá e podem ser identificados pelo seu fenótipo original (Figura 1), bem como através do painel específico de célula de análise do marcador (CD90, a-SMA, e vimentina positiva, mas negativa para células epiteliais e hematopoiéticas marcadores) 3, 5, 9. Embora seja amplamente aceito que myofibroblasts surgem a partir de células-tronco mesenquimais no hospedeiro normal, em estados de doença, tais como a inflamação crônica e câncer, uma subpopulação de CM foi mostrado epitelial expressa ou marcadores hematopoiéticas 3. Estes resultados têm sido sugeridos para ser possivelmenteum resultado da transição epitelial-mesenquimal (EMT) ou recrutamento de fibrócitos derivadas da linhagem hematopoiética 3, 19. Além disso, o cuidado adicional deve ser usado se as células forem imunocoradas e analisadas por citometria de fluxo para os marcadores discutidos acima. Embora nós não encontramos a perda epitopo a ser um problema depois de permitir que as células para recuperar O / N a partir de tecido fresco digerido incubadas em placas não-aderentes, a perda de epitopos pode ocorrer quando utilizando tripsina ou qualquer outra enzima proteolítica durante o desprendimento de as células a partir da placa. Assim, para evitar este problema, é recomendável a utilização de uma solução de dissociação de células com agentes quelantes, tais como EDTA MF quando as culturas aderentes são destinados para a imunocoloração, seguido por análise de citometria de fluxo. Depois de uma cultura primária de miofibroblastos é estabelecido, as células podem ser então congeladas em meio de congelamento e armazenadas em azoto líquido. Estas células podem ser utilizadas em uma variedade de experiências in vitro até cerca de 14 - 15passagens, tempo após o qual as células senesce e deve ser descartado.
Divulgações
The authors have nothing to disclose.
Agradecimentos
This work was supported by National Institute of Health (1R01DK103150-01A1, T32 DK007639, R01CA175803, K08CA125209) and the Institute for Translational Sciences at the University of Texas Medical Branch, and a Clinical and Translational Science Award (8UL1TR000071).
Materiais
| Name | Company | Catalog Number | Comments |
| MEM, 1x | Corning | MT-10-010-CV | |
| Hanks' Balanced Salt Solution | Sigma-Aldrich | H6648 | |
| Sodium pyruvate | Sigma-Aldrich | S8636 | |
| Antibiotic-Antimycotic, 100x | Gibco | 15240-062 | |
| Ciprofloxacin HCl | Corning | 61-277-RF | |
| L-Glutamine, 100x | Corning | 25-005-CI | |
| MEM Nonessential Amino Acids | Corning | 25-025-CI | |
| Dimethyl Sulfoxide (DMSO) Hybri-Max | Sigma-Aldrich | D2650 | |
| DL-Dithiothreitol solution (DTT) | Sigma-Aldrich | 646563 | |
| 0.5 M EDTA, pH 8.0 | Cellgro | 46-034-CI | |
| DNAse | Worthington | LS002139 | |
| Collagenase from Clostridium histolyticum, Type I | Sigma-Aldrich | C1639 | |
| Collagenase from Clostridium histolyticum, Type II | Sigma-Aldrich | C1764 | |
| Collagenase from Clostridium histolyticum, Type IV | Sigma-Aldrich | C5138 | |
| Accumax cell dissociation solution | Sigma-Aldrich | A7089 | |
| gentleMACS C Tubes | Miltenyi Biotec | 130-093-237 | |
| gentleMACS Dissociator | Miltenyi Biotec | 130-093-235 | |
| Countess Automated Cell Counter | Invitrogen | C10227 | |
| Cell Strainer (70 µm) | Corning | 352350 | |
| PE Mouse Anti-Human Vimentin | BD Biosciences | 562337 | Clone RV202 |
| FITC Monoclonal Anti-Actin, α-Smooth Muscle | Sigma-Aldrich | F3777 | Clone 1A4 |
| APC Mouse Anti-Human CD90 | BD Biosciences | 559869 | Clone 5E10 |
Referências
- Yamaguchi, H., et al. Stromal Fibroblasts Mediate Extracellular Matrix Remodeling and Invasion of Scirrhous Gastric Carcinoma Cells. PLoS ONE. 9, e85485 (2014).
- Mullan, N., Hughes, K. R., Mahida, Y. R. Primary Human Colonic Myofibroblasts Are Resistant to Clostridium difficile Toxin A-Induced, but Not Toxin B-Induced, Cell Death. Infect Immun. 79, 1623-1630 (2011).
- Powell, D. W., Pinchuk, I. V., Saada, J. I., Chen, X., Mifflin, R. C. Mesenchymal Cells of the Intestinal Lamina Propria. Annu Rev Physiol. Annu Rev Physiol . 73, 213-237 (2011).
- Latella, G., Sferra, R., Speca, S., Vetuschi, A., Gaudio, E. Can we prevent, reduce or reverse intestinal fibrosis in IBD?. Eur Rev Med Pharmacol Sci. 17, 1283-1304 (2013).
- Saada, J. I., et al. Subepithelial myofibroblasts are novel nonprofessional APCs in the human colonic mucosa. J. Immunol. 177, 5968-5979 (2006).
- Mahida, Y. R., et al. Adult human colonic subepithelial myofibroblasts express extracellular matrix proteins and cyclooxygenase-1 and -2. Am J Physiol. 273, G1341-G1348 (1997).
- Roncoroni, L., et al. Isolation and culture of fibroblasts from endoscopic duodenal biopsies of celiac patients. J Transl Med. 7 (40), (2009).
- Pinchuk, I. V., et al. Stromal Cells Induce Th17 during Helicobacter pylori Infection and in the Gastric Tumor Microenvironment. PLoS ONE. 8, e53798 (2013).
- Pinchuk, I. V., et al. Monocyte chemoattractant protein-1 production by intestinal myofibroblasts in response to staphylococcal enterotoxin a: relevance to staphylococcal enterotoxigenic disease. J. Immunol. 178, 8097-8106 (2007).
- Paulsson, J., Micke, P. Prognostic relevance of cancer-associated fibroblasts in human cancer. Sem Cancer Biol. 25, 61-68 (2014).
- Valcz, G., Sipos, F., Tulassay, Z., Molnar, B., Yagi, Y. Importance of carcinoma-associated fibroblast-derived proteins in clinical oncology. J. Clin. Pathol. 67, 1026-1031 (2014).
- Minonzio, G., et al. Frozen adipose-derived mesenchymal stem cells maintain high capability to grow and differentiate. Cryobiology. 69, 211-216 (2014).
- Gargus, M., Niu, C., Shaker, A. Isolation of Myofibroblasts from Mouse and Human Esophagus. J. Vis. Exp. (95), e52215 (2015).
- Khalil, H., Nie, W., Edwards, R. A., Yoo, J. Isolation of primary myofibroblasts from mouse and human colon tissue. J. Vis. Exp. (80), e50611 (2013).
- Schiller, J. H., Bittner, G. Loss of the Tumorigenic Phenotype with in Vitro, but not in Vivo, Passaging of a Novel Series of Human Bronchial Epithelial Cell Lines: Possible Role of an α5/β1-Integrin-Fibronectin Interaction. Cancer Res. 55, 6215-6221 (1995).
- Augello, A., Kurth, T. B., De Bari, C. Mesenchymal stem cells: a perspective from in vitro cultures to in vivo migration and niches. Eur Cell Mater. 20, 121-133 (2010).
- Meller, D., Pires, R. T. F., Tseng, S. C. G. Ex vivo preservation and expansion of human limbal epithelial stem cells on amniotic membrane cultures. Br J Ophthalmol. 86, 463-471 (2002).
- Kuhlmann, I. The prophylactic use of antibiotics in cell culture. Cytotechnology. 19, 95-105 (1995).
- Morris, K. T., Nofchissey, R. A., Pinchuk, I. V., Beswick, E. J. Chronic Macrophage Migration Inhibitory Factor Exposure Induces Mesenchymal Epithelial Transition and Promotes Gastric and Colon Cancers. PLoS ONE. 9, e98656 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados