Method Article
人間の冷凍消化管標本からCD 90 +線維芽細胞/筋線維芽細胞の単離
要約
Here, a protocol to isolate and establish primary fibroblast/myofibroblast (MF) cultures from frozen gastric, small intestinal, and colonic tissue-yielding cells with a MF phenotype-is presented. These cells express CD90, α-SMA and vimentin. MFs can be used for a variety of functional assays including enzymatic activity and cytokine production.
要約
線維芽細胞/筋線維芽細胞(mfsが)病因におけるそれらの役割と腫瘍微小環境の両方の創傷治癒やプロモーションへの貢献のためにますます注目を集めています。現在、胃腸(GI)組織からのMFsを単離するための多くの技術がありますが、このプロトコルは、凍結組織からこれらの間質細胞の単離の新規要素を紹介します。 GI組織標本を凍結するだけでなく、世界中の共同研究者、バイオバンク、および商業ベンダーからサンプルを取得するために研究者が、それはまた、新鮮なサンプルの遅延処理を可能にすることができます。記載されているプロトコルは、一貫して、マーカーCD90、α-SMAおよびビメンチンを表現MF表現型と特徴紡錘状細胞が得られます。これらの細胞は患者のサンプルから誘導されるように、一次細胞の使用は、疾患状態、すなわち癌および炎症性腸疾患に密接に模倣するのMFsの利点を与えます。この技術は蜂を持っていますnは、胃、小腸、および結腸MF初代培養世代で検証。初代MF培養は、通路の数を超える実験の広大な配列で使用することができ、それらの純度は、両方の免疫細胞化学によって評価し、フローサイトメトリー分析。
概要
筋線維芽細胞/線維芽細胞(mfsが)胃腸(GI)粘膜内の細胞の豊富な集団です。これらの間質細胞だけ上皮の下に位置し、腸内の粘膜固有層内の相互接続ネットワークを形成しています。 mfsがばかりでなく、細胞外マトリックスの沈着の原因であるが、パラクリン調節を介して電解質輸送、回復、および隣接する上皮1,2のバリア機能に影響を与えることができる。さらに、mfsが炎症および組織において重要な役割を果たすことが示されています3、4改造。筋線維芽細胞は、それらがまた、癌関連線維芽細胞として知られている腫瘍の微小環境の重要な一部であり、腫瘍細胞増殖に寄与し、癌幹細胞ニッチ3として機能します。新興データがmfsも、地元の抗原提示細胞として機能し得ることを示唆しています。さらに、のMFS機能自然免疫と適応免疫応答の重要な調節因子として、のproduサイトカインおよび増殖因子5の様々なcing。
健康な個体では、のMFS細胞は、これらの細胞は、ビメンチンに対して陽性である。間葉系幹細胞から分化し、それらの細胞表面、間葉系マーカー、CD90 3,5に発現すると考えられているが、上皮細胞および造血細胞マーカー、のEpCAMおよびCD45について陰性、それぞれ。筋線維芽細胞は、線維芽細胞の活性化形態であることが示唆されており、α-SMA 5の発現により活性化されていない線維芽細胞から区別することができます。
過去10年間、人間の結腸粘膜から筋線維芽細胞を単離するための複数のアプローチが発表され、大部分はもともとMahida ら 5-8に記載された方法に基づいています。個々の研究は、様々な腸粘膜から単離手順を報告しているが、GI管の複数の領域からのMFsを単離するための普遍的なプロトコル( すなわち 、胃、小およびlARGE腸粘膜)が公開されています。本明細書に提示プロトコルがテストされ、正常に上記の組織のすべての3つのタイプに使用されています。 。また、冷凍GI粘膜からのMFsを単離するための手順が報告されていません。
ここでは、酵素消化に基づいて最適化された方法を提示し、同時に培養のための人間の腸粘膜のMFsの分離を可能にし、新たに消化し、単一の細胞、粘膜製剤中のフローサイトメトリー分析。この技術は確実にMF表現型と初代培養物を生成します。また、同様の方法は、同様に胃および小腸組織の凍結標本からのMFsを単離することができます。新鮮GI組織から筋線維芽細胞の単離は、以前に記載されています。しかし、冷凍標本の利用は、多くの利点を提供します。すなわち、研究者はcapabiを持っている世界中の協力者の任意の数から収集して保存組織することができるだろう凍結組織サンプルを出荷するリティ。また、研究者は、現在の実験スケジュールと競合への単離のための組織を処理し、手術室から廃棄された組織の収集および/または内視鏡検査スイートと即座に見つけることができます。また、手術の予測不可能な性質のために、組織の調達が処理組織のために残された時間が制限されている、非常に遅めの時間に発生することがあります。後の処理のために組織を凍結することは、これらの課題を改善します。
最後に、これらの方法は、正常結腸、胃および結腸直腸癌および炎症性腸疾患のような疾患状態における小腸筋線維芽細胞の単離に利用されています。
プロトコル
手術患者からのヒト組織を破棄し、初代培養物の確立はテキサス大学医学部、ニューメキシコ制度審査委員会の大学によって承認された取得するためのプロトコル。ヒト組織標本の調達のための一般的な要件について説明します。 MFsは凍結組織から単離することができるので、バイオバンクや商業ベンダーはまた、実行可能な選択肢であることに注意してください。
1.ヒト組織を入手
- 承認のための制度審査委員会へのヒト結腸組織を得るためのプロトコルを提出してください。
- 研究のためのヒト組織を得るために、一般的な外科医および/または結腸直腸の外科医との連携を確立します。彼らは診断のために必要とされず、研究のために指定することができる組織を決定するように、病理部門との連携も必須です。
- その後、新生物の組織を提供するために、病理学者に助言し、grosslY正常粘膜腫瘍から5cm以上。直ちに氷冷洗浄培地中のサンプルを配置し、氷上に置きます。病理学者は、研究のために安全に与えることができる組織の量を決定します。 MFの単離のために必要な最小限の組織は、1.5ミリメートル2です。
- 将来の単離のために-80℃で一次培養または凍結と場所を確立するために、直ちに得られた組織を使用してください。
- -80℃で凍結培地(下記参照)、および店舗1mlの極低温管に置き、2 mmの2個-後単離するために、凍結した場合、約1内に組織を切断します。注:このプロトコルを利用して、4年以上の凍結組織からのMFsの成功の分離が観察されています。
2.試薬を準備
- コラゲナーゼ溶液の場合: の Ca 2+をハンクス平衡塩溶液(HBSS)で100 U / mlのコラゲナーゼI、IIおよびIVを準備/ Mgが2+(材料表を参照してください )。注意:コラゲナーゼアクティブユニット濃度および純度は、組織消化および/または粘膜の細胞表面上のエピトープの保全の効率化を妨げる可能性がある、ベンダーからベンダーに変動することがあります。これらの潜在的な落とし穴を防ぐ純度の最も高い(≥95%)とコラゲナーゼを使用して、アクティブユニット濃度に基づいて、ストック溶液を調製しました。
- 10 mg / mlの(3.55 UA / mg)でで水ベースのDNaseストック溶液を準備します。
- ウォッシュメディアを準備します(MEM:89ミリリットルを、抗生物質 - 抗真菌、100X:1ミリリットル;熱不活性化FCS:10ミリリットル)
- MEM:線維芽細胞増殖培地を準備する500ミリリットルのボトルを。 L-グルタミン(200 mM)の5 mlでMEM非必須アミノ酸、100×溶液5 mlでシプロフロキサシン塩酸(10 mg / mlで):570μL;抗生物質 - 抗真菌、100倍液:10ミリリットル。ピルビン酸ナトリウム(100 mM)の5 mlで熱不活性化FCS:50ミリリットル
- フィルタ-STERをその後、10%ジメチルスルホキシド(DMSO)を添加した線維芽細胞増殖培地(試薬2.4):凍結培地を調製します0.22μmのフィルターでilize。
3.酵素的にダイジェストヒト組織
- 組織とメディアが解凍されるまで組織を温かい(〜37℃)の水の凍結メディア、場所クライオバイアル中で凍結された場合。
- 4の場合-組織の2ミリメートル2枚の5、のCa 2+ / Mg 2+をすることなく、HBSSで2回10mlの組織を洗います。
- 組織は、重力によって解決したら、慎重にサンプルを回転させずに、上清を捨てます。
- サンプルへのコラゲナーゼ溶液10mlを加え、サンプル解離のための組み込みのローターを滅菌、DNアーゼ/ RNaseフリーのチューブに組織液の混合物を移します。上皮細胞の基底面を囲み、粘膜固有層の非細胞画分を形成する細胞外マトリックスを解離するためにコラゲナーゼを使用してください。
- しっかり近いチューブ(例えば、GentleMACs)解離のスリーブ上に逆さまに取り付けます。ラボは、トンへのアクセス権を持っていない場合彼は、同等の結果を得るために、各消化工程の時間を増加させる、装置を前述しました。
- プログラムh_tumor_01を実行し、予め設定されたプロファイルは、マシン( - ランあたり268回と4,000 rpmの範囲の断続的なパルスで36秒の合計時間、1000〜)に含まれています。
- プログラムの終了後、解離からチューブを外します。
- 140 rpmで振とう機上で連続回転下37℃で45分間サンプルをインキュベートします。注:組織サンプルの量を変化させるため、消化の時間は比例的に減少または増加させることができる( すなわち 、組織のより大きな量をさらなる時間を必要とするかもしれません)。
- 解離のスリーブ上に逆さにチューブを取り付けます。
- ( - 1回あたり235回で、4,000 rpmで千に至るまで断続的なパルスで、37秒の合計時間)を選択して、プログラムのh_tumor_02を実行します。
- プログラムの終了後、解離からチューブを外します。
- DNアーゼストック溶液50μlを追加。 /解離死細胞および凝集をセルにつながる細胞破片のDNA画分を除去するためのDNAseを使用してください。
- 60 rpmで振とう機上で連続回転下、37℃で30分間サンプルをインキュベートします。
- 再び解離のスリーブ上に逆さにチューブを取り付けます。
- ( - 1回あたり168回で、4,000 rpmで千に至るまで断続的なパルスで、37秒の合計時間)を選択して、プログラムのh_tumor_03を実行します。
組織が完全に消化されていない場合は、20℃で10分間、250×gで遠心分離後、上清を捨て、細胞解離溶液2ml中に再懸濁し、10分間室温でインキュベート。注意してください。 - 滅菌70μmのセルストレーナーを通して細胞懸濁液を渡します。
- 20℃で10分間、250×gで遠心細胞懸濁液。完全に上清を吸引。
- 洗浄細胞のCa 2+ / Mg 2+をなしHBSSで2回25mlでペレット、上清を捨てます。
- 最後に先立ちましたhは、実験室で利用可能な自動細胞計数システムを使用して、または手動で血球計数器を用いて細胞数を数えます。 MF初代培養生成するステップ3.19.2進行フローサイトメトリーを用いてのMFsの解析やソートに、ステップ3.19.1進行。
- 分離及び純粋なMF培養物の増殖( 図1)のために、培地3mlに4×10 6個の細胞にまで播種するために必要な繊維芽細胞の分離媒体の適切な量で、最後の遠心分離、再懸濁細胞ペレットから上清を捨て、ウェルあたりで6ウェル、細胞培養処理プレート。 3.20に進みます。
- 分析のために、または、フローサイトメトリー24で線維芽細胞の分離培地の2 ml中に2×10 6までの配置だけでなく、低結合プレートおよび5%CO 2、37℃でO / Nインキュベート使用してのMFsのソート。これは、酵素的手順によって影響され得る細胞表面エピトープを回復することです。その後、細胞懸濁液を回収し、回収した細胞をカウントし、続行免疫染色のための分析8フローサイトメトリー。
- 5%CO 2、37℃で細胞を増殖させます。 〜80%コンフルエントのMF単層( 図1D-E)が形成されるまで3日-ごとに2メディアを変更します。
- 比1で6ウェルプレートからでT25フラスコ内の通路細胞:1と〜のための10の成長 - 100%の密集度 - 80を達成するために、線維芽細胞増殖培地で14日。
- 2:1の比率でT75細胞にT25から細胞を継代することにより文化を展開します。細胞がコンフルエントに達すると、先に説明したように5フローサイトメトリーで使用して孤立したMF純度の分析のための1フラスコを使用しています。 3:1の割合で、MF文化の別のT75フラスコを凍結または通過。
注意:EpCAM-、CD31-、CD45 - 、ビメンチン+、α-SMA +、CD90 +:フローサイトメトリーで分析すると、それは間葉起源のGI粘膜の間質MFは文化の中で成長すると、次の表現型を持つことになりますときにことが期待されます。
結果
この酵素消化プロトコルを使用して、我々は一貫して分離し、GI外科標本や生検( 図1)からMF人口腸CD90 +粘膜の間質細胞を成長させることができました。 6ウェルプレート( 図1A-B)中の単核細胞懸濁液を播種した後、5 -可視MFコロニー増殖は2日目に観察されました。 11( 図1C-D) - 7日目までに70%コンフルエンス- MF初代培養物は〜50に達します。
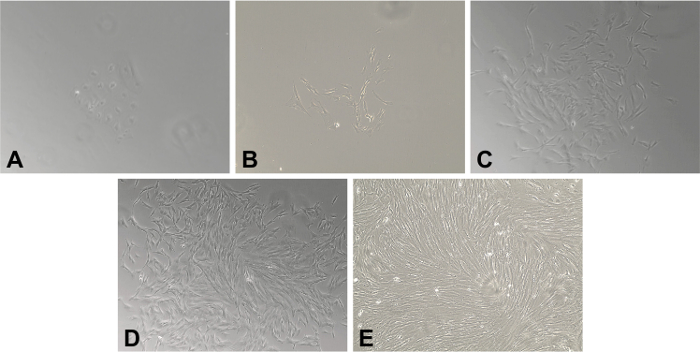
冷凍胃腸組織から単離され、図1一次筋線維芽細胞MFS()。人間のMFsの20X倍率は、人間の結腸粘膜の凍結試料から単離しました。 (A)日間質細胞の2付着クラスターが存在しています。 (B)デイズ4.特性紡錘またはstellate-細胞形態が開発され、容易に明らかです。線維芽細胞の密度が14日目では(C)7日目及び(D)10日目(E)に増加し続け、のMFsの完全コンフルエント単層が存在する。 この図の拡大版をご覧になるにはこちらをクリックしてください。
手術標本の凍結時に粘膜単一細胞調製物(〜10%、 表1)の生存率のわずかな減少があります。しかし、凍結して、観察される組織の細菌/真菌汚染の減少とMF培養生成効率で、その結果、増加もあります。
| GI粘膜筋線維芽細胞のソース | 粘膜単一細胞懸濁液の調製(N = 11)の生存率* | MFの単離効率(N = 11) |
| 新鮮な | 88.32±2.369 | 11(82%)のうち8 |
| 凍結 | 78.64±4.174 | 11(100%)のうち11 |
| * 0.4%トリパンブルー溶液染色後自動細胞カウンターによって決定される生存率。 | ||
表1. 生存率および筋線維芽細胞回収効率 。凍結組織対新鮮。
細胞は他の粘膜細胞によるコンタミネーションを確実にしないために、2つの通路のための少なくとも増殖させた後に生成されたMF培養物の純度を分析しました。共焦点顕微鏡を使用して、それがのMFsは間葉細胞系譜CD90及びビメンチン、およびALSのマーカーに陽性であったことが示されましたOα-SMA、分化した間葉系細胞のマーカー( 図2)。
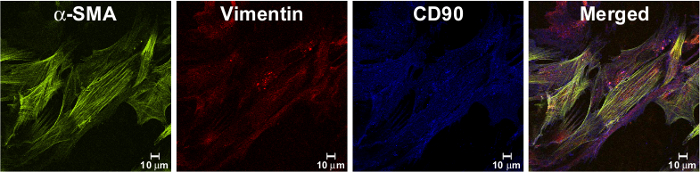
図2.単離された細胞は 、以前に9説明したように線維芽細胞の形状と分離されたMF単層のエクスプレスMFマーカー。免疫染色は、1%パラホルムアルデヒドで固定して免疫染色し、共焦点顕微鏡で分析した文化の中で少なくとも2回継代してもらいます。によって検出されたビメンチン(赤で、モノクローナル抗体、クローンRV202によって検出される)およびCD90(青で、:単離された細胞は、(マウスmAbクローン1A4によって検出されるように、緑色で)筋線維芽細胞のマーカー、-SMAを発現し、間葉系マーカーマウスmAb、クローン5E10)。マージされた画像では、オレンジ色/黄色のセルは、SMAおよびビメンチンの共局在を示します。紫は、ビメンチンおよびCD90の共局在を表します。 プリーズ Eこの図の拡大版をご覧になるにはこちらをクリックしてください。
このデータは、フローサイトメトリー分析( 図3)により確認しました。既報の通り、GI粘膜から分離された通常のMFSが造血メーカーCD45とCD31と同様に、上皮マーカー、EpCAMの3、5、9のために陰性でした。

図3.一次筋線維芽細胞(MF)文化の表現型の特徴。研究は、結腸粘膜から単離された初代のMFs上で実行し、培養中に少なくとも2時間を継代しました。免疫染色、フローサイトメトリー分析に続いて、単離された細胞は、MFの表現型を有する、α-SMA、ビメンチンおよびCD90のために一様に陽性であることを確認しました。適切なアイソタイプ対照を試験に含めました。arge.jpg「ターゲット= "_空白">この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
このプロトコルは、唯一の研究用途のために開発されたが、潜在的な癌予後バイオマーカーおよび治療標的としての間質細胞の成長の重要な重要性に照らして、後で使用するために「機能的」生物試料を凍結する能力は重要な利点を提供しています。これは、個別化医療10、11の開発を進めるのに役立つなどの追加のツールとして機能し得る臨床バイオレポジトリーを作成するためのユニークな利点を表している。以前に凍結された間質血管画分から単離された脂肪由来間葉系幹細胞について報告調査結果と同様に、私たちがやりましたマーカーの有意な変化を観察し、増殖性/免疫/炎症反応とのMFsの代謝活性が凍結粘膜検 体から分離されていない。12しかし、我々はそのような細胞外マーカー蒸着などのような非テスト応答の一部を変更できることを排除するものではありません。したがって、未知の/ unreでの作業のような場合で移植されたイベントは、研究者がmfsが同じ個体の凍結、新鮮な組織から単離された特定の機能がサイド・バイ・サイドをテストされるで比較実験を設定することもできます。
筋線維芽細胞の単離方法は、いずれかのいずれかでキレート剤を用いた治療と組み合わせた組織の機械的ミンチの使用に基づいているための技術の大半[エチレンジアミン四酢酸(EDTA)、DL-ジチオスレイトール(DTT)]またはコラーゲンとタンパク質分解酵素13-14 。これは、以前に胃からMFの発生が報告され、小腸および大腸の最初に機械的ミンチ及びキレート剤5,6の応用に基づいているMahida らによって記載伸長法を用いて効率的であった。ここでは、追加の酵素凍結組織標本からのMFsの初代培養物の生成を可能にする方法が報告されています。技術-伸長および酵素の両方の消化は、ですが胃、小腸、および結腸組織からの一次筋線維芽細胞の単離にも同様に有効、培養細胞がそれらのインビボ表現型を維持するかどうかに科学界で議論が依然として存在します。この原稿で報告された技術は、主MF文化だけでなく生成を可能にするだけでなく、胃腸粘膜15-17に提示異なる細胞集団の ex vivo分析が可能になります。これは、組織およびそれらが発現するマーカーとの相対量を決定することを含むだけでなく、機能的アッセイ (例えば、酵素活性またはサイトカイン産生)で使用するため。組織内のMFsの相対存在量がmfs(すなわち、EpCAM-、CD31-、CD45 - 、ビメンチン+、α-SMA +、CD90 +)に特有のマーカーに基づいて細胞を選別し、と比較した場合に、それらの存在を定量することにより、FACSを用いて評価することができます全て新たに単離した細胞の合計や、個別の細胞型と比較比の操作を実行して、必要であれば。有効性にもかかわらず、生細胞の単離、酵素消化に基づいて、これと他のプロトコルの注目すべき制限が用いられる酵素のタンパク質分解活性は、細胞表面エピトープを変化させることができるということです。これを克服するために、我々は、細胞がその予め消化状態と同様に再発現されるエピトープのためにO / Nを回収することを可能にします。
我々は一貫して、細胞生存率の損失を最小限に抑えて凍結組織からMF培養を生成することができました。凍結した試料から、これらの培養物を回収する能力は、研究者が操作し、より良い夜間や通常の作業時間外得外科的および/または内視鏡組織標本を保持することができます。また、凍結プロセス中の細菌および/または真菌の汚染物質による調達、使用可能な組織の損失の減少は、付加的な利点となります。培養は、標準aseptiを継続して使用するまでの、3通路 - 単離した後、抗生物質の使用は、最初の2に限定されるべきですC技術と抗真菌/抗マイコプラズマ剤を含まない培地。細胞培養中のこれらの薬剤の日常的な使用には細胞毒性効果、すなわち細胞増殖、細胞変性、及び機会に、18死を発揮することが示されています。
免疫細胞、上皮細胞、およびのMFs:酵素消化を含む消化管粘膜固有層内に存在する複数の細胞集団が得られます。最初の継代の後、唯一のMFSが残ると、同様にマーカー分析(CD90、-SMAおよびビメンチン正の細胞特異的なパネルを独自の表現型( 図1)によって識別することができますが、上皮および造血のための負マーカー)3、5、9。それは広く筋線維芽細胞は、正常な宿主において間葉系幹細胞から生じることが認められているが、このような慢性炎症や癌などの疾患状態においてのMFsの亜集団が明示上皮または造血マーカー3に示されています。これらの知見は、おそらくあることが示唆されています細胞は免疫染色し、上述のマーカーのためのフローサイトメトリーによって分析された場合に上皮間葉移行(EMT)または造血系統3、19由来線維細胞の募集の結果は、また、追加の注意が必要です。我々は、細胞が非接着性のプレート中でインキュベートした新たに消化された組織からのO / Nを回収することを可能にした後に問題になるために、エピトープの損失を発見していない一方での剥離の際にトリプシンまたは他のタンパク質分解酵素を使用した場合、エピトープの損失が発生することができプレートからの細胞。したがって、この問題を回避するために、我々は、接着MF培養物をフローサイトメトリー分析、続いて免疫染色のために意図されているときにEDTAなどのキレート化剤との細胞解離溶液を使用することをお勧めします。筋線維芽細胞の初代培養を確立した後、次いで、細胞を凍結培地中で凍結し、液体窒素中で保存することができます。 15 -これらの細胞は、約14まで、in vitro実験のアレイで使用することができ通路は、その時間の後、細胞は老化して廃棄する必要があります。
開示事項
The authors have nothing to disclose.
謝辞
This work was supported by National Institute of Health (1R01DK103150-01A1, T32 DK007639, R01CA175803, K08CA125209) and the Institute for Translational Sciences at the University of Texas Medical Branch, and a Clinical and Translational Science Award (8UL1TR000071).
資料
| Name | Company | Catalog Number | Comments |
| MEM, 1x | Corning | MT-10-010-CV | |
| Hanks' Balanced Salt Solution | Sigma-Aldrich | H6648 | |
| Sodium pyruvate | Sigma-Aldrich | S8636 | |
| Antibiotic-Antimycotic, 100x | Gibco | 15240-062 | |
| Ciprofloxacin HCl | Corning | 61-277-RF | |
| L-Glutamine, 100x | Corning | 25-005-CI | |
| MEM Nonessential Amino Acids | Corning | 25-025-CI | |
| Dimethyl Sulfoxide (DMSO) Hybri-Max | Sigma-Aldrich | D2650 | |
| DL-Dithiothreitol solution (DTT) | Sigma-Aldrich | 646563 | |
| 0.5 M EDTA, pH 8.0 | Cellgro | 46-034-CI | |
| DNAse | Worthington | LS002139 | |
| Collagenase from Clostridium histolyticum, Type I | Sigma-Aldrich | C1639 | |
| Collagenase from Clostridium histolyticum, Type II | Sigma-Aldrich | C1764 | |
| Collagenase from Clostridium histolyticum, Type IV | Sigma-Aldrich | C5138 | |
| Accumax cell dissociation solution | Sigma-Aldrich | A7089 | |
| gentleMACS C Tubes | Miltenyi Biotec | 130-093-237 | |
| gentleMACS Dissociator | Miltenyi Biotec | 130-093-235 | |
| Countess Automated Cell Counter | Invitrogen | C10227 | |
| Cell Strainer (70 µm) | Corning | 352350 | |
| PE Mouse Anti-Human Vimentin | BD Biosciences | 562337 | Clone RV202 |
| FITC Monoclonal Anti-Actin, α-Smooth Muscle | Sigma-Aldrich | F3777 | Clone 1A4 |
| APC Mouse Anti-Human CD90 | BD Biosciences | 559869 | Clone 5E10 |
参考文献
- Yamaguchi, H., et al. Stromal Fibroblasts Mediate Extracellular Matrix Remodeling and Invasion of Scirrhous Gastric Carcinoma Cells. PLoS ONE. 9, e85485 (2014).
- Mullan, N., Hughes, K. R., Mahida, Y. R. Primary Human Colonic Myofibroblasts Are Resistant to Clostridium difficile Toxin A-Induced, but Not Toxin B-Induced, Cell Death. Infect Immun. 79, 1623-1630 (2011).
- Powell, D. W., Pinchuk, I. V., Saada, J. I., Chen, X., Mifflin, R. C. Mesenchymal Cells of the Intestinal Lamina Propria. Annu Rev Physiol. Annu Rev Physiol . 73, 213-237 (2011).
- Latella, G., Sferra, R., Speca, S., Vetuschi, A., Gaudio, E. Can we prevent, reduce or reverse intestinal fibrosis in IBD?. Eur Rev Med Pharmacol Sci. 17, 1283-1304 (2013).
- Saada, J. I., et al. Subepithelial myofibroblasts are novel nonprofessional APCs in the human colonic mucosa. J. Immunol. 177, 5968-5979 (2006).
- Mahida, Y. R., et al. Adult human colonic subepithelial myofibroblasts express extracellular matrix proteins and cyclooxygenase-1 and -2. Am J Physiol. 273, G1341-G1348 (1997).
- Roncoroni, L., et al. Isolation and culture of fibroblasts from endoscopic duodenal biopsies of celiac patients. J Transl Med. 7 (40), (2009).
- Pinchuk, I. V., et al. Stromal Cells Induce Th17 during Helicobacter pylori Infection and in the Gastric Tumor Microenvironment. PLoS ONE. 8, e53798 (2013).
- Pinchuk, I. V., et al. Monocyte chemoattractant protein-1 production by intestinal myofibroblasts in response to staphylococcal enterotoxin a: relevance to staphylococcal enterotoxigenic disease. J. Immunol. 178, 8097-8106 (2007).
- Paulsson, J., Micke, P. Prognostic relevance of cancer-associated fibroblasts in human cancer. Sem Cancer Biol. 25, 61-68 (2014).
- Valcz, G., Sipos, F., Tulassay, Z., Molnar, B., Yagi, Y. Importance of carcinoma-associated fibroblast-derived proteins in clinical oncology. J. Clin. Pathol. 67, 1026-1031 (2014).
- Minonzio, G., et al. Frozen adipose-derived mesenchymal stem cells maintain high capability to grow and differentiate. Cryobiology. 69, 211-216 (2014).
- Gargus, M., Niu, C., Shaker, A. Isolation of Myofibroblasts from Mouse and Human Esophagus. J. Vis. Exp. (95), e52215 (2015).
- Khalil, H., Nie, W., Edwards, R. A., Yoo, J. Isolation of primary myofibroblasts from mouse and human colon tissue. J. Vis. Exp. (80), e50611 (2013).
- Schiller, J. H., Bittner, G. Loss of the Tumorigenic Phenotype with in Vitro, but not in Vivo, Passaging of a Novel Series of Human Bronchial Epithelial Cell Lines: Possible Role of an α5/β1-Integrin-Fibronectin Interaction. Cancer Res. 55, 6215-6221 (1995).
- Augello, A., Kurth, T. B., De Bari, C. Mesenchymal stem cells: a perspective from in vitro cultures to in vivo migration and niches. Eur Cell Mater. 20, 121-133 (2010).
- Meller, D., Pires, R. T. F., Tseng, S. C. G. Ex vivo preservation and expansion of human limbal epithelial stem cells on amniotic membrane cultures. Br J Ophthalmol. 86, 463-471 (2002).
- Kuhlmann, I. The prophylactic use of antibiotics in cell culture. Cytotechnology. 19, 95-105 (1995).
- Morris, K. T., Nofchissey, R. A., Pinchuk, I. V., Beswick, E. J. Chronic Macrophage Migration Inhibitory Factor Exposure Induces Mesenchymal Epithelial Transition and Promotes Gastric and Colon Cancers. PLoS ONE. 9, e98656 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved